BioMnOx對非甾體藥物氧化協同Fe(III)吸附的研究
秦松巖,呂務娟,黃 馨,胡 杰,羅 義,趙立新
(1.天津理工大學 環境科學與安全工程學院,天津 300384;2.南京大學 環境學院,污染控制與資源化研究國家重點實驗室,南京 210093)
乙酰氨基酚(acetaminophen,APAP)具有解熱鎮痛的作用,是全世界使用量最高的非甾體抗炎藥物[1],通過生物代謝物及過期或未用完廢棄物進入環境,導致其在污水處理廠、自然水環境、土壤中頻頻檢出,APAP在污水處理廠的出水中質量濃度可達到8 025 ng/L[2].APAP是中國近45個污水處理廠活性污泥的主要污染物之一[3].含有微量的APAP水體經過加氯消毒后會產生毒性更大的苯醌類物質[4];APAP在水環境藥物風險評價中風險值大于1,質量濃度超出了無生態風險濃度值[5-6],其殘留已對水生生態系統和人體構成潛在危害[7-9],對其去除成為環境研究中的一個熱點問題[10].目前,國內外研究用于降解APAP的方法主要有高級氧化法、TiO2光催化、生物降解[11-16]等.其中,生物降解法由于不存在二次污染以及成本低等備受關注.
生物錳氧化物是由錳氧化細菌如惡臭假單胞球菌(PseudomonasPutida)、纖發菌屬(Leptothrix)、錳土微菌(Pedomicrobiummanganicum)等以O2為電子受體,通過多銅氧化酶(MCOs) 將Mn(II)氧化為Mn(IV)而形成高價態錳生物氧化物(BioMnOx).BioMnOx作為錳氧化細菌形成的初級產物,基本單元是 Mn(Ⅳ)O6的正八面體結構,存在包括Mn(Ⅳ)空缺位點和晶體的邊緣及內層位點,Mn(IV)/Mn(II)間的氧化還原電位及強氧化劑Mn(III)為中間體的單電子轉移,使其具有較強的氧化能力[17].因此,BioMnOx同時展現了較強的氧化和吸附能力.Pseudomonassp.作為錳氧化的模式菌株,其形成的錳氧化物已應用到多種重金屬和有機物氧化去除的研究中.Owen[18]研究了PseudomonasputidaGB-1產生的BioMnOx對草銨鐵的吸附,發現Fe(III)在多個位點特異性地吸附到礦物結構上.菅之輿等[19]在以錳氧化細菌Pseudomonassp.QJX-1構建的生物體系中,通過Pseudomonassp.QJX-1生成的BioMnOx有效去除2-羥基-4-甲氧基二苯甲酮-5-磺酸(BP-4).Zhang等[7]通過在錳砂/石英砂好氧生物濾池啟動時引入Pseudomonassp.形成BioMnOx生物膜,對卡馬西平、雙氯芬酸等通過開苯環降解.以往研究基于對實際工藝的模擬,對Pseudomonas的不同菌株BioMnOx在水處理反應體系中,或對有機物氧化、或對重金屬吸附進行了宏觀評價.然而,實際水體中存在著多種金屬離子,在被吸附占據吸附位點同時對BioMnOx氧化有機物的影響鮮有研究.另外,BioMnOx具有較高的吸附及氧化活性,其微觀結構和活性會隨時間快速變化,Pseudomonas的菌株活性、BioMnOx的形成過程及結構變化等對吸附和有機物的降解影響相關性研究,對于生物鐵錳反應器的參數設計及啟動運行具有重要意義.
本研究以具有強錳氧化能力的Pseudomonasputida作為模式菌種, 以水體中常見的Fe(III)為共存離子,通過研究P.putida形成錳氧化物的過程對Fe(III)的吸附及對APAP降解效率,確定BioMnOx吸附過程對氧化能力的影響;提出BioMnOx生物量對APAP降解的動力學并推斷APAP的降解途徑,為BioMnOx應用于水體殘留非甾體藥物類的去除提供新思路及理論支撐.
1 實 驗
1.1 實驗試劑
實驗中所用藥品有乙酰氨基酚(acetaminophen,APAP)(純度>99.0%,上海潤捷化學試劑有限公司)、四氫呋喃(99.9%,J&K Chemical)、N-O雙(三甲基硅烷基)三氟乙酰胺(BSTFA,99%,TCI),其他無機試劑均為分析純或優級純,甲醇、乙腈等有機試劑均為色譜純.
1.2 生物錳氧化物的形成
實驗所用菌株為惡臭假單胞菌(PseudomonasputidaQYS-1,CGMCCNO:14390),從某除鐵錳的生物濾池中篩選分離出來.
培養基成分(g/L):蛋白胨 0.8,酵母浸粉 0.2,K2HPO40.1,MgSO4·7H2O 0.2,NaNO30.2,CaCl20.1,NH4Cl 0.1,MnSO4·H2O 0.2.配置一定量的培養基, 然后用飽和 NaOH 調節 pH(7.1~7.2),分裝后放于滅菌器中 121 ℃滅菌 30 min. 然后將其轉入生物安全柜中, 冷卻至室溫.取100 mL裝入錐形瓶中,將PseudomonasputidaQYS-1母液以1%的接種量接入,然后將其置于恒溫振蕩器中培養(溫度25 ℃,轉速125 r/min),培養40 h,每隔2 h取樣.測其OD600監測生物錳氧化物的形成過程.取上層清液測鐵錳離子質量濃度,考察BioMnOx形成過程對Fe(III)吸附的影響.
1.3 BioMnOx的制備
配置一批培養基,以相同的條件滅菌冷卻,將母液以1%的接種量接入新配置的培養基中,將其置于恒溫振蕩器中培養(溫度25 ℃,轉速125 r/min)40 h左右生成黑色顆粒沉淀,即培養完全.將培養完全的培養基轉入滅菌的離心管中,置于高速離心機中離心20 min(溫度25 ℃,轉速5 000 r/min),棄掉上清液用無菌水反復水洗3次,反復離心,得到BioMnOx.
1.4 BioMnOx的形成過程中Fe(III)吸附及APAP氧化相互影響
配置一定量的培養基,加入不同質量濃度的APAP溶液(10,100 mg/L)、Fe(III)以檸檬酸鐵銨形式加入(1 g/L)以及1%的惡臭假單胞菌母液,同時設置3組平行樣.將Pseudomonasputida接入的時間記為零時刻,每隔一定時間取樣.通過HPLC和ICP-OES測定溶液中不同時刻APAP的剩余質量濃度和Fe(III)質量濃度,考察BioMnOx形成過程中Fe(III)吸附及APAP氧化相互影響.
另外,配置不同Mn2+質量濃度(8.13,16.25,24.38,32.50 mg/L)的培養基,接種1%的Pseudomonasputida母液,每組設置3個平行樣.不同量的BioMnOx生成后離心收集,加入APAP溶液中,將BioMnOx接入的時間記為零時刻,每隔一定時間取樣,檢測剩余APAP質量濃度,以此探討BioMnOx的量對APAP氧化的影響.
1.5 Pseudomonas putida對APAP的氧化活性
制備6組相同條件下生成的BioMnOx,振蕩離心后棄掉上清液,將BioMnOx與10 mg/L APAP的無菌溶液混合,同時向其中3瓶加入50 mg/L的疊氮化鈉,作為抑制組1,其余3瓶不加作為對照組1[9].將其置于恒溫振蕩器中振蕩(溫度 25 ℃;轉速 125 r/min).將加入BioMnOx的時間記為零時刻,在振蕩2 h及24 h時各取一次樣,測定溶液中APAP質量濃度.通過兩組APAP去除情況的比較,探討Pseudomonasputida的氧化活性對Fe(III)吸附及APAP氧化的影響.
振蕩24 h后,將兩組溶液分別超聲1 h,取其上清液檢測溶液中鐵錳質量濃度,探討其在APAP降解過程中的作用.
1.6 降解產物分析
配置一定質量濃度的APAP溶液,加入生成的BioMnOx,將BioMnOx接入的時間記為零時刻,每隔一定時間取樣,通過GC-MS系統分析降解產物.
1.7 分析方法
1.7.1 樣品分析
實驗中不同時刻所取的樣品于20 ℃、4 000 r/min條件下離心20 min,上清液經0.22 μm濾膜過濾后于4 ℃下保存,用于后續實驗分析.
APAP質量濃度通過HPLC-UV系統分析,配置反向C18高效液相色譜柱(150×4.6 mm,5 μm).柱溫設為30 ℃,進樣量20 μL.流動相,V(甲醇)∶V(超純水)(含0.05%冰乙酸)=20∶80,流速0.5 mL/min,檢測波長240 nm[9].
溶液中鐵錳離子質量濃度通過電感耦合等離子體發射光譜儀(ICP-OES)測定.
1.7.2 動力學實驗
對APAP的降解、Mn2+的氧化過程進行一級反應動力學擬合,反應速率方程如下
(1)
積分形式為
(2)
式中:t為時間,h;ρ為t時刻APAP或Mn2+的質量濃度,mg/L;ρ0為0時刻APAP或Mn2+的質量濃度,mg/L;K為反應速率常數.
1.7.3 降解產物分析
采用GC-MS分析主要降解產物,GC-MS條件[20]:進樣口溫度280 ℃,采用程序升溫,初始60 ℃,保持3 min,然后以10 ℃/min升至280 ℃,保持3 min;He為載氣,流量1 mL/min,分流20 mL/min,進樣量1 μL;EI源為電離源,70 eV.樣品前處理:取水樣150 μL,加入氣相色譜瓶中,以輕柔的氮氣吹干,然后加入150 μL無水四氫呋喃和60 μL BSTFA,加蓋密封后置于40 ℃烘箱中衍生30 min,用于GC-MS分析.
1.7.4 BioMnOx表征方法
分別收集培養24,44 h時的BioMnOx,將其置于冷凍干燥機中冷凍干燥,分別取少許置于電鏡樣品臺上作噴金處理,然后采用掃描電鏡(SEM,Quanta FEG 250,美國)、透射電鏡(TEM,Talos F200 X,美國)對BioMnOx的微觀結構進行觀察.
2 結果與討論
2.1 BioMnOx的形成過程
從P.putidaQSY-1接種至6 h,培養基保持澄清透明,顏色為橙黃色,從6 h起培養基溶液顏色加深,為紅棕色,觀測到10 h無明顯沉淀,但溶液逐漸渾濁;從10 h起開始逐漸出現棕黑色錳沉淀物,到20 h之間培養基呈黑褐色膠體狀溶液,靜置不分層;20 h后大量絮狀棕黑色沉淀逐漸積累,靜置后固液邊界清晰,上清液澄清透明;由圖2可知,OD600也與觀測現象吻合,在6~18 h呈線性遞增,20 h后OD600幾乎不再增加,但誤差棒增大,是因為錳氧化物顆粒變化較大,培養基由乳濁液變化至可分離懸濁態,說明BioMnOx在形成過程中自身結構發生變化.
BioMnOx生成過程中的微觀結構變化見圖1.可以看出,在BioMnOx形成初期,BioMnOx表面較為平整,但內部嵌布顆粒,粒徑較小,直徑約為49.9 nm,可見此時生物氧化形成的錳氧化物結晶較弱[21],由TEM圖可以看出,BioMnOx為無定型的納米顆粒.在24~44 h,BioMnOx結構發生了變化,由平整演變為密集、突出的顆粒狀,顆粒邊界更為清晰,粒徑約70 nm.Tebo等研究發現生物錳氧化物初級產物的晶體結構會隨時間發生變化,在初級產物中共存著正六邊形和假直角型兩種晶體結構.12 h時正六邊形結構占主導,之后假直角結構逐漸變成主導[22].
由圖2可知,溶解性錳離子在0~10 h質量濃度變化較小,10~20 h迅速降低,從44.44 mg/L降至0.86 mg/L,尤其是在14~16 h,2 h內減少了40.8 mg/L.Mn離子的急劇減少并非是Mn離子的完全氧化,因為OD600在2 h內沒有急劇增加,仍處于線性遞增,Mn離子的急劇減少應源于BioMnOx對Mn離子的吸附.Forrez等[23]觀察到錳氧化物形成過程中表面可吸附大量的Mn離子,培養20 h時Mn2+/Mn4+的比率為0.57 mg/mg.20 h后,Mn離子質量濃度再次處于緩慢降低的過程,最終Mn離子質量濃度穩定在0.15 mg/L左右.
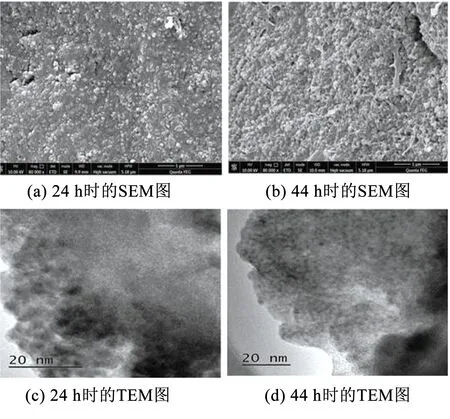
圖1 不同時刻BioMnOx的TEM結構
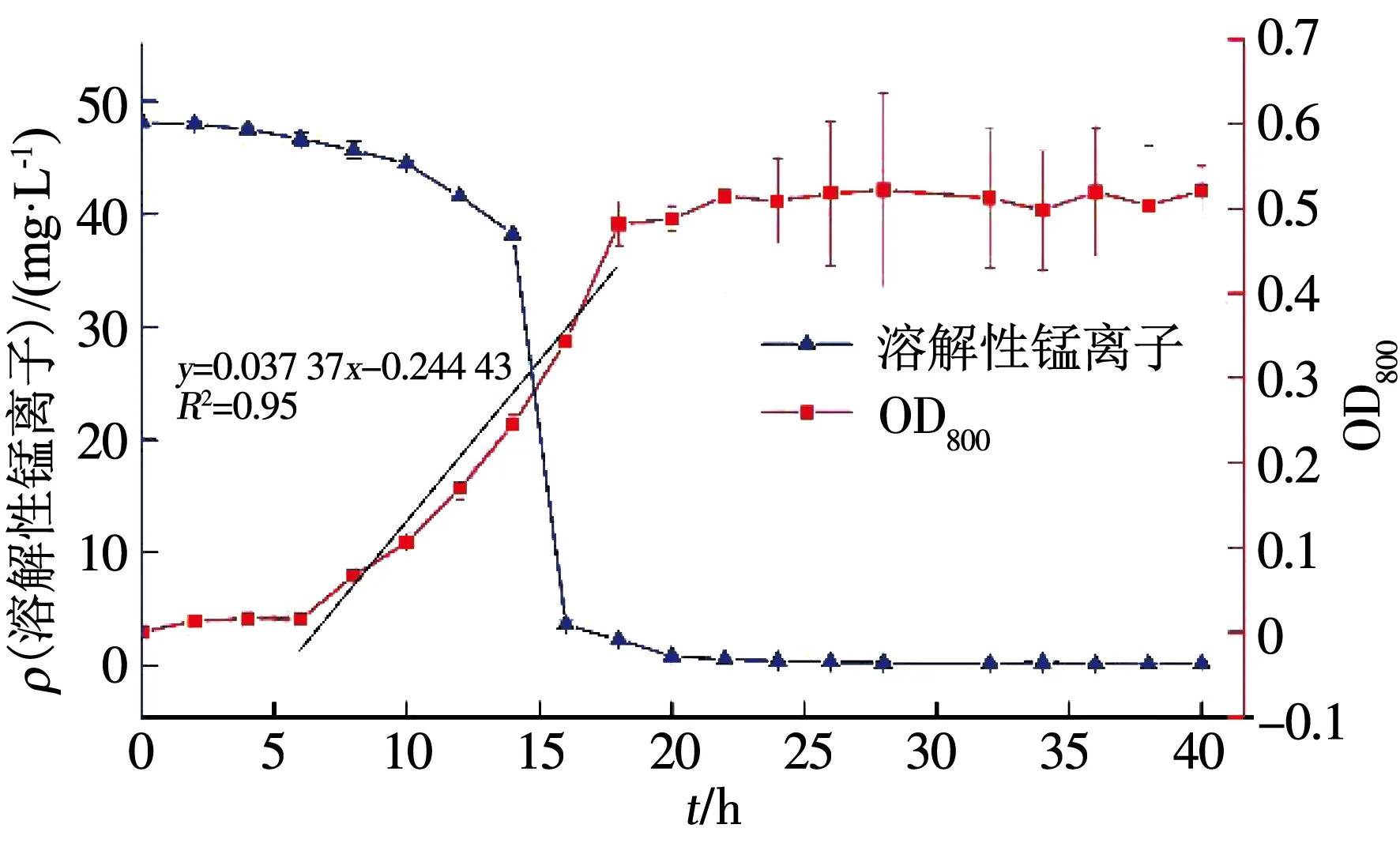
圖2 錳氧化物的形成
2.2 BioMnOx的形成過程對Fe(III)的吸附及對APAP的氧化
由圖3可知,BioMnOx對Fe(III)的吸附發生在對APAP的氧化之前.在APAP的共存體系中,無論APAP是低或高質量濃度(10,100 mg/L),Fe(III)的質量濃度變化趨勢一致,即0~12 h質量濃度變化不大,保持在123 mg/L左右,而12~16 h急劇下降至1.3 mg/L左右,在20 h后少量回增又下降至穩定,保持在1.2 mg/L左右.12~16 h是錳氧化物初級產物形成期,其結構正逐漸由正六邊形演化至假直角型[22],Tebo等[22]研究發現后者中的Mn(Ⅳ)缺位較少,而Mn(Ⅳ)空缺位點的數量直接影響到吸附能力.因此,在12~16 h BioMnOx對Fe(III)顯示出較強的吸附性能,16~20 h則保持穩定.20 h以后APAP開始被BioMnOx氧化,部分Mn(IV)氧化物作為電子受體轉化為溶解性的Mn(II),結構改變致使吸附位點減少,已吸附的Fe(III)被解吸釋放.通過比較10及100 mg/L的APAP體系可知,在100 mg/L體系中Fe(III)的釋放量(22.4 mg/L)幾乎為10 mg/L體系中(2.8 mg/L)的10倍.吸附后期隨著P.putida的氧化作用,持續地將Mn2+轉化為BioMnOx,繼而對釋放的Fe(III)重新吸附至接近1.2 mg/L.因此,APAP與Fe(III)共存時,BioMnOx對APAP的氧化影響了對Fe(III)的吸附,致使其發生解吸,但解吸可通過持續的BioMnOx生成而消除.
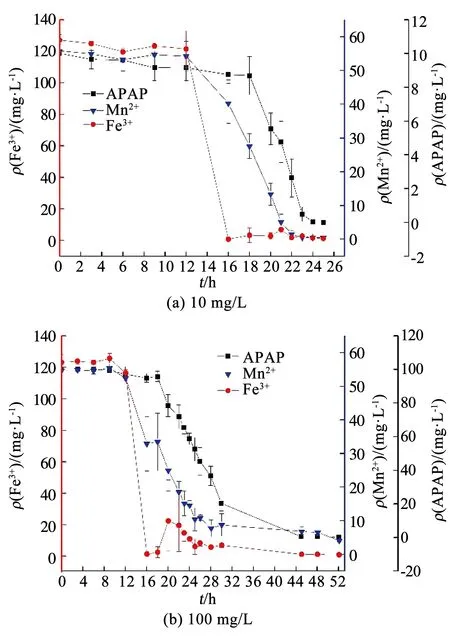
圖3 不同初始質量濃度APAP與Fe3+、Mn2+質量濃度隨時間的變化
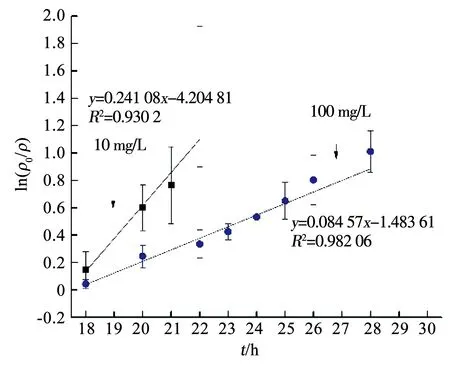
圖4 降解速率曲線
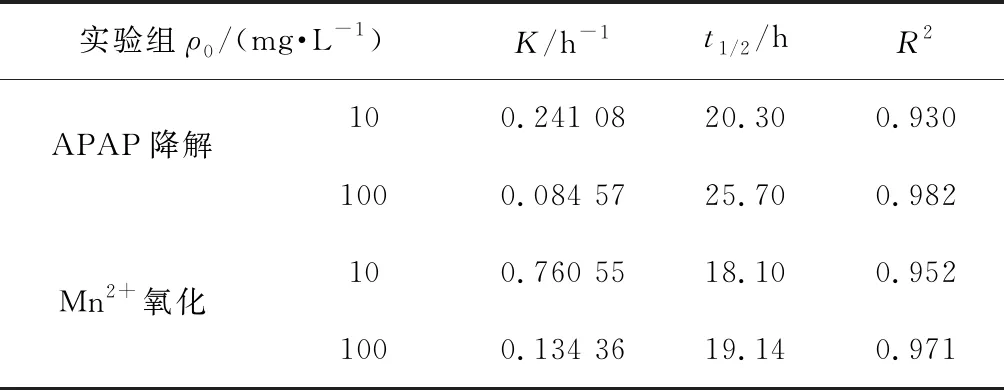
表1 APAP降解及錳氧化過程一級動力學方程參數
APAP的存在對Mn2+的變化規律亦產生了影響.由圖5可知,在只有Fe3+存在而無APAP時,Mn2+在14~16 h由38.2 mg/L急劇減少至3.62 mg/L,然而在APAP存在時,Mn2+減少速率放緩(圖3).為分析APAP質量濃度對Mn2+氧化速率的影響,取圖3(a)中18~23 h、圖3(b)中18~30 h Mn2+的氧化速率進行一級反應動力學擬合,反應速率方程擬合曲線如圖6所示,可以看出,Mn2+的氧化速率符合一級動力學方程,且速率常數與相對應質量濃度的APAP氧化速率常數接近,即10,100 mg/L APAP質量濃度下的Mn2+氧化速率常數KMn分別為0.760 55和0.134 36 h-1,K(Mn,10)遠大于K(Mn,100),同時K(APAP,10)也遠大于K(APAP,100)(表1),表明100 mg/L質量濃度下的Mn2+氧化速率低,導致該質量濃度下APAP的降解速率較慢.錳氧化速率的降低應該是由APAP對Pseudomonasputida生長抑制作用導致,本課題組前期實驗表明,高質量濃度下(100 mg/L)的APAP對Pseudomonasputida生長有抑制作用,100 mg/L的APAP培養基中細菌數量較10 mg/L減少了約75%,因此,對Mn2+的氧化速率產生影響,進而導致高質量濃度APAP降解速率降低.
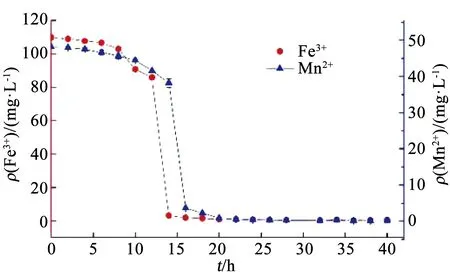
圖5 無APAP存在時鐵錳離子質量濃度變化
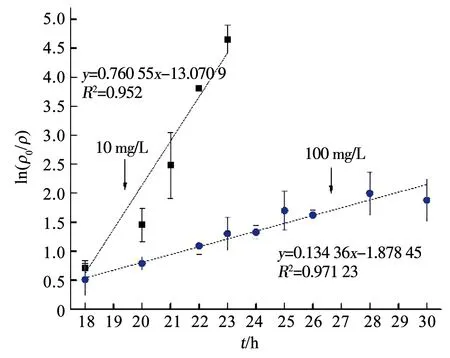
圖6 Mn2+氧化速率曲線
在Pseudomonasputida氧化Mn2+生成BioMnOx過程中,雖然對Fe(III)的吸附先于對APAP的氧化,但對Fe(III)的吸附并未對APAP的氧化速率產生影響;APAP的氧化過程中則會導致Fe(III)解吸的發生,但新增的BioMnOx可對Fe(III)再吸附;APAP質量濃度增加可抑制Mn2+的氧化速率來減緩APAP的降解速率.因此,Pseudomonasputida對Mn2+的氧化活性及BioMnOx的量將會對APAP降解造成影響.
2.3 Pseudomonas putida的氧化活性對Fe(III)吸附及APAP氧化的影響
本實驗利用疊氮化鈉抑制Pseudomonasputida的活性[9].由圖7可知,Pseudomonasputida的活性被抑制后APAP的降解效果變差,反應2 h時,對照組1中APAP的去除率為72%,而抑制組1中其去除率只有33%,反應24 h時,對照組1中APAP的去除率達100%,實現完全降解,而抑制組1中APAP的去除率與反應2 h時相比幾乎沒有變化,說明PseudomonasputidaMn2+氧化活性的抑制嚴重影響了APAP的降解.Sabirova等[24]也發現了疊氮化鈉可以抑制Pseudomonasputida的活性使其降解17α-炔雌醇的能力變差,這是因為由于疊氮化鈉的抑制作用,Pseudomonasputida活性受到抑制后就無法繼續氧化培養基中的Mn2+,使得培養基喪失持續產生BioMnOx的能力,進而導致有機污染物不能被完全降解.所以,抑制組1中APAP的去除率沒有隨反應時間的延長而有所變化.抑制組1中反應2 h時達到的33%的去除率可能是加入疊氮化鈉前培養基中已經生成的BioMnOx作用的結果.以上證明APAP質量濃度的增加可以抑制培養基中Mn2+的氧化速率進而減緩APAP的去除速率.

圖7 APAP降解效率
對照組1和抑制組1超聲后檢測溶液中溶解性鐵錳離子質量濃度,結果顯示兩組中鐵離子質量濃度均非常低,約為零,這表明Pseudomonasputida的氧化活性抑制對BioMnOx吸附沒有產生影響.抑制組1中Mn2+質量濃度平均為9.3 mg/L,對照組1中Mn2+質量濃度僅為0.5 mg/L.這也表明BioMnOx對Fe(III)的吸附并非為與Mn2+的離子交換機制.結合上文實驗結果,對照組1中APAP的去除率達100%,而抑制組1中APAP的去除率僅達33%,這說明培養基中Mn2+的持續氧化是實現APAP能夠達到完全降解的重要因素.對照組中由于BioMnOx表面負載少量Mn2+,在與APAP溶液混合后,表面的Mn2+不斷被釋放出來,Pseudomonasputida持續氧化Mn2+,繼而生成新的BioMnOx,不斷生成的BioMnOx能夠促使溶液中的APAP持續降解,所以,對照組1中的APAP去除效果較抑制組1更為顯著,同時,由于培養基中Mn2+被不斷消耗生成新的BioMnOx,其超聲后的質量濃度較低.而抑制組1中,由于Pseudomonasputida的活性被抑制,進而Mn2+氧化作用被抑制,不能生成新的BioMnOx,APAP的降解只能由培養基中原有的BioMnOx來實現,由于原有的BioMnOx量很少,抑制組1中的APAP不能實現完全降解,超聲后的Mn2+質量濃度也比對照組1中的高.因此,BioMnOx量對APAP的氧化產生一定影響.
2.4 BioMnOx量對APAP氧化的影響
BioMnOx量對APAP氧化速率常數的線性關系采用一級反應動力學進行擬合(見圖8和表2),其相關系數均較好(R2=0.92~0.99),符合一級反應動力學模型.Mn2+質量濃度為24.38,32.50 mg/L時所生成的BioMnOx能夠在14 h內實現APAP降解完全,而Mn2+質量濃度為8.13,16.25 mg/L時所生成的BioMnOx分別在24,18 h時才能實現APAP降解完全,說明APAP所需完全降解的時間與生成的BioMnOx的量成正相關.
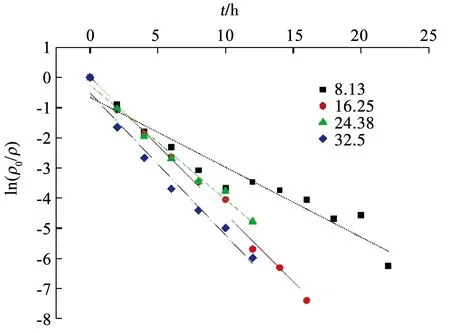
圖8 速率常數曲線
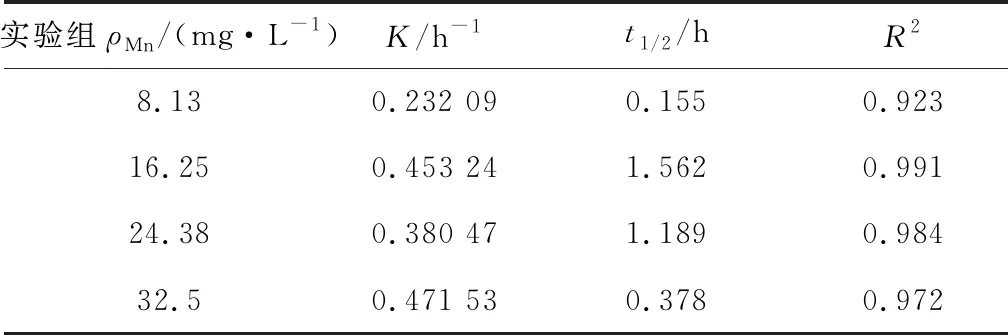
表2 速率常數曲線參數
2.5 APAP的氧化降解途徑推斷
采用GC-MS對APAP氧化降解的中間產物進行分析[12],結果列于表3,根據表3推測APAP氧化降解可能的降解途徑,結果見圖9.
首先APAP苯環上的乙酰基被取代生成乙酰胺(1)、對氨基苯酚和對苯二酚(6),(1)進一步被氧化為乙醇酸(2),繼而生成乙二酸(3),最終氧化為二氧化碳和水;同時對氨基苯酚的-NH2被取代生成(6),之后(6)脫下羥基生成苯醌(7),(7)進一步開環裂解、雙鍵打開生成順丁烯二酸,順丁烯二酸繼續被氧化生成(3)[25],最終被礦化為二氧化碳和水,或者對氨基苯酚被氧化生成苯醌亞胺(4),進一步再生成(7),然后重復上述降解途徑;(6)同時被氧化生成(7)和丁二酸(5),(5)繼續氧化生成(3),而(7)重復上述降解途徑,最終生成二氧化碳和水.

表3 APAP降解的中間產物結構推測
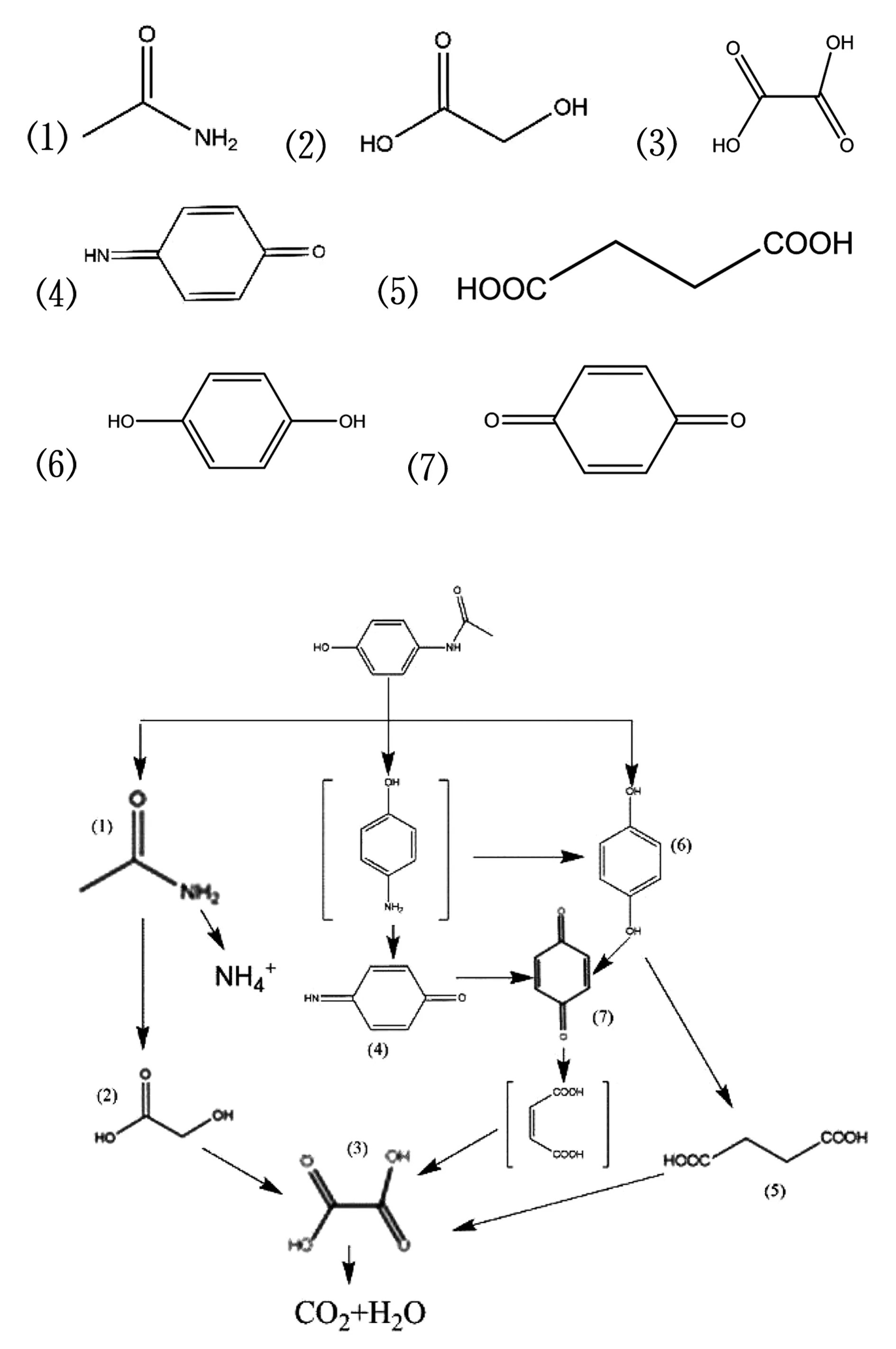
圖9 APAP氧化降解可能的降解途徑
3 結 論
1)BioMnOx為無定型的納米顆粒,在形成過程中自身結構發生變化,表面由平整變為密集、突出的顆粒狀,顆粒邊界更為清晰,顆粒粒徑從約49.9 nm長至約70 nm.BioMnOx在形成過程中Mn離子的急劇減少主要是由于BioMnOx對Mn離子的吸附.
2)BioMnOx形成過程中對Fe(III)的吸附發生在對APAP的氧化之前,但對Fe(III)的吸附并未對APAP的氧化速率產生顯著影響.APAP氧化降解過程以及不同APAP質量濃度對Mn2+氧化速率影響過程均符合一級動力學方程.
3)APAP質量濃度增加可抑制Mn2+的氧化速率來減緩APAP的降解速率.Pseudomonasputida對Mn2+的氧化活性及BioMnOx的量對APAP降解有一定的影響.
4)在APAP氧化降解過程中,生成了對苯二酚、乙酰胺、對氨基苯酚等一系列產物,隨后繼續被氧化為結構更簡單的有機物,最后生成CO2和H2O,實現APAP的降解.

