超聲復合堿處理大豆蛋白與EGCG復合物功能特性研究
李 楊 閆世長 徐靜雯 謝鳳英 武利春 齊寶坤
(1.東北農業大學食品學院, 哈爾濱 150030; 2.國家大豆工程技術研究中心, 哈爾濱 150030)
0 引言
大豆分離蛋白(Soybean protein isolate,SPI)具有加工性能好、營養價值高、成本低等優點,在食品工業中得到了廣泛的應用。SPI在特定食品中的應用形式因其性質而不同,如乳化性、溶解性、凝膠性、分散性以及粘度等。在天然狀態下,大豆蛋白的主要成分是儲藏蛋白,即7S和11S球蛋白,占總蛋白的65%~80%,蛋白質的致密球狀結構與低分子柔性以及不良的界面和乳化特性有關[1]。因此,研究者嘗試采用許多技術來修飾和改變大豆蛋白的結構和聚集狀態。
超聲已被引入來改變食品的功能特性,可依靠產生的空化作用或機械剪切應力破壞蛋白的肽鍵以及非共價相互作用,改變蛋白的二級結構和疏水性[2]。超聲與一些技術相結合可以改善蛋白質的功能特性。pH變換技術簡單、易操作,且可以利用靜電排斥作用使蛋白解折疊與亞基解離,尤其是在遠離蛋白等電點的pH值下,因此,超聲常與pH變換相結合來改善蛋白的功能特性[3]。文獻[4]報道了超聲聯合pH處理可使豌豆蛋白結構發生改變,進而改善其功能特性。文獻[2]研究發現,超聲復合酸處理可以改變SPI的結構,使蛋白聚集體粒徑減小、乳化性增強。文獻[3]闡明了超聲復合堿處理對Oleosin蛋白的結構及功能性的影響,超聲復合堿處理可改善蛋白結構,提高其乳化性。文獻[5]研究發現,超聲復合堿處理較單獨處理技術更能改善乳蛋白的結構與乳化特性。然而,超聲等物理改性雖可提高蛋白的功能特性,但產生的自由基卻可能加速蛋白的氧化[6],從而限制了其在工業中的高值化應用。
表沒食子兒茶素沒食子酸酯(Epigallocatechin gallate,EGCG)具有抗菌、抗氧化、抗炎以及抗腫瘤作用[7-9],且具有較強的蛋白親和性,可以與蛋白復合形成具有功能性質的復合體系[10]。文獻[11]研究發現,EGCG與SPI相互作用,可改變蛋白的結構,復合物的乳化性與抗氧化性均得到改善。文獻[12]研究發現,EGCG與卵清蛋白相互作用,降低了蛋白的致敏性,提高了蛋白的乳化性。一些學者還研究了改性蛋白與多酚的相互作用。文獻[13]研究發現,熱與花青素改性SPI使蛋白復合物乳化性得到改善。文獻[14]研究發現,超聲改性的大豆蛋白與花青素的相互作用使乳化性能明顯提高。文獻[15]利用超聲輔助大蒜素來改善乳清蛋白的結構,進而提高蛋白的溶解度與乳化特性。文獻[16]利用堿處理輔助EGCG改性乳清蛋白,復合物的乳化性與抗氧化性得到增強。由此可知,多酚類成分與蛋白相互作用可以用來改善蛋白的結構與功能,且可以清除氧化自由基,這拓展了蛋白在功能性食品中的應用。然而,關于超聲復合堿處理SPI與EGCG復合對蛋白的結構與功能的影響尚未見報道。
本文主要采用熒光光譜、紅外光譜探究超聲復合堿處理SPI和EGCG復合體系對蛋白結構的影響,通過粒度分析、Zeta電位、濁度、乳化性及乳化穩定性探究超聲復合堿處理SPI與EGCG復合體系對蛋白功能性質的影響及變化規律。
1 材料與方法
1.1 材料與試劑
大豆,市售;EGCG(純度99%以上),上海源葉生物科技有限公司;鹽酸、氫氧化鈉、磷酸二氫鈉、磷酸氫二鈉、甲醇,均為分析純,北京新光化工試劑廠;其他試劑均為分析純。
1.2 儀器與設備
AL204型分析天平,梅勒特-托利多儀器(上海)有限公司;PHS-3C型實驗室pH計,中國上海雷磁公司;F-6000型熒光分光光度計,日本Hitachi公司;TU-1800型紫外-可見分光光度計,北京普析通用儀器有限責任公司;JJ-1型增力電動攪拌器,江蘇金城國勝儀器廠;Allegra64R型臺式高速冷凍離心機,美國貝克曼公司;IRTracer-100型傅里葉變換紅外光譜分光光度計,日本島津公司。
1.3 方法
1.3.1樣品制備
(1)大豆分離蛋白制備
根據文獻[13]的方法,將大豆磨粉,過60目篩,用正己烷脫脂,將脫脂豆粉分散于去離子水中,液料比10 mL/g,用2 mol/L NaOH 溶液調節pH值至9.0,攪拌1 h,9 000 r/min離心30 min,取其上清液,然后用2 mol/L HCl溶液調節pH值至4.5,得到蛋白沉淀物,將蛋白沉淀物水洗3次,6 500 r/min離心30 min得到沉淀物,將該沉淀物溶解后,用2 mol/L NaOH溶液調節pH值至中性,凍干,即得大豆分離蛋白,使用凱氏定氮法測定蛋白含量,蛋白質量分數為(92.28±0.31)%。
(2)超聲復合堿處理SPI和EGCG復合物制備
SPI的處理方法參照文獻[2,16]的方法進行。
對照組(SPI):稱取大豆蛋白1.0 g,溶解到100 mL的去離子水中,在25℃下攪拌1 h,攪拌過程中利用0.1 mol/L NaOH 維持pH值為7.0,然后在5 000 r/min的條件下離心15 min,得上清液,然后凍干。
超聲復合堿處理(UHSPI):稱取大豆蛋白1.0 g,溶解到100 mL的去離子水中,25℃下攪拌1 h,攪拌過程中利用0.1 mol/L NaOH 維持pH 值7.0,200 W超聲處理5 min(工作5 s、間隔5 s),隨后調節pH值至12,保持1 h,隨后再調節pH值至7.0,然后在5 000 r/min條件下離心15 min,得上清液,然后凍干。
根據文獻[17]的方法進行SPI和EGCG復合物的制備,將SPI和UHSPI粉末溶解在10 mmo/L的PBS(磷酸鹽緩沖液,pH值7.0)中,在室溫(20℃)下連續攪拌30 min,加入EGCG粉末,蛋白與EGCG質量比為100∶1,連續攪拌90 min。絡合后,將混合溶液凍干進行后續分析。
1.3.2紅外光譜
用IRTracer-100型傅里葉變換紅外光譜分光光度計在室溫下記錄樣品的紅外光譜。將樣品與KBr混合,然后壓片。在500~4 000 cm-1范圍內記錄光譜,分辨率為4 cm-1。采用Peakfit 4.12軟件,利用高斯曲線擬合方法擬合α-螺旋、β-折疊、β-轉角和無規則卷曲的特征峰[17],分析其含量。
1.3.3熒光光譜
向10 mL的SPI溶液(0.5 mg/mL, 10 mmol/L PBS, pH值7.0)中分別逐滴加入100 μL濃度為2.5、5.0、7.5、10.0、12.5、15.0、17.5、20.0 μmol/L的EGCG溶液,旋渦振蕩后應用F-6000型熒光分光光度計測定樣品的熒光淬滅光譜[17]。光譜測定條件設置為:激發波長280 nm,掃描波長為300~450 nm,激發狹縫、發射狹縫為5 nm,掃描速率為600 nm/min。蛋白及復合物的熒光測定條件為,室溫條件下,以280 nm為激發波長,掃描波長為300~450 nm。熒光淬滅機制可分為動態淬滅與靜態淬滅兩種機制,應用Stern-Volmer方程判斷猝滅類型,公式為
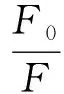
(1)
式中F0、F——未加入、加入EGCG時SPI溶液的熒光強度
Q——EGCG的濃度,mol/L
Kq——雙分子猝滅常數,L/mol
Ksv——動態猝滅速率常數,L/(mol·s)
τ0——猝滅劑不存在時熒光體的壽命,生物大分子的平均壽命約為10-8s
一般情況下,猝滅劑對于生物大分子最大動態猝滅速率常數為2×1010L/(mol·s),當大于這一速率時,則為靜態淬滅,靜態淬滅滿足公式
lg((F0-F)/F)=lgKa+nlgQ
(2)
式中Ka——表觀結合常數
n——結合位點數
1.3.4粒徑
利用Zetasize Nano ZS90型納米粒度及Zeta電位分析儀對樣品溶液進行粒徑分布測定。顆粒折射率1.45,分散劑折射率1.33,吸附率0.001。實驗采用體積平均直徑D[4,3]表征粒徑大小并記錄溶液粒徑的PDI(多分散指數)[13]。
1.3.5電位
采用Zeta電位儀測定樣品的Zeta電位,對樣品溶液進行適度稀釋(樣品質量濃度為1 mg/mL),上樣量為1 mL,測定溫度為25℃,溫度平衡時間為2 min[18]。
1.3.6濁度
將待測樣品適當稀釋后(樣品質量濃度為5 mg/mL)倒入石英比色皿中,并利用紫外分光光度計在波長600 nm處測定樣品吸光度,用吸光度表示其濁度[19]。
1.3.7乳化特性
參照文獻[13]的方法稍作修改。將樣品溶在PBS(10 mmol/L,pH值7.0)中至蛋白質量濃度為1 mg/mL,向稀釋的樣品中加入葵花油,水相與油相體積比為3∶1,使用高剪切均質機以10 000 r/min均質3 min形成乳狀液,立即從其乳狀液底部提取50 μL的乳液分散于0.1%的十二烷基硫酸鈉溶液稀釋100倍。經旋渦振蕩后用分光光度法在波長500 nm處測定樣品的吸光度A500nm,用相同濃度十二烷基硫酸鈉溶液作為空白對照,經10 min后再次測量其吸光度。乳化活性指數直接用乳液吸光度表示,乳化穩定性指數計算公式為
(3)
式中A0、A10——乳狀液在0、10 min時的吸光度
ESI——乳化穩定性指數,min
1.4 數據統計
所有實驗重復3次,實驗結果采用平均值±標準差表示。利用SPSS 20軟件進行ANOVA差異顯著性分析及相關分析,當P<0.05差異性顯著。利用Origin 2020進行制圖。
2 結果與分析
2.1 紅外光譜分析


表1 加入EGCG前、后SPI的二級結構相對含量Tab.1 Changes in the secondary structure content of SPI before and after adding EGCG %
2.2 熒光光譜分析
內源性熒光對蛋白質的色氨酸殘基所處的微環境變化和蛋白質三級結構變化具有較高的靈敏度,因此常作為檢測蛋白質空間結構變化的手段。如圖2所示,與SPI相比,UHSPI的熒光強度顯著增加且發生明顯的紅移現象,這可能由于pH值12遠離蛋白等電點(pI值約為4.5),提供較多的靜電斥力,超聲產生的空穴效應及剪切應力作用于SPI,破壞蛋白分子之間的相互作用,使蛋白分子展開,發色基團暴露[2,5,16]。此外,與EGCG復合之后,復合物的熒光強度均降低,表明EGCG對蛋白的熒光起到猝滅作用[17],同時發現SPI-EGCG復合物的最大吸收波長發生了紅移,UHSPI與EGCG作用熒光淬滅最明顯,表明EGCG與UHSPI的結合程度最強,可能是因為超聲處理、堿處理與EGCG協同改變了SPI的結構構象,發色基團的微環境發生改變,由疏水環境變為親水環境,肽鏈結構舒展[14,16]。
2.3 粒徑分析
粒徑可以直觀地表示蛋白聚集體的形成。如圖3(圖中不同字母表示差異顯著)所示,與SPI相比,UHSPI的粒徑明顯減小,這可能因為超聲的空化和機械作用、堿處理產生的靜電斥力而最大程度地誘導較大的聚集蛋白塌陷和解離[2,23],二者協同使蛋白結構展開、蛋白分子間作用減弱、亞基發生解離,粒徑變小[3,5],該結果與文獻[5]的研究結果一致。此外,與SPI相比,當SPI與EGCG復合后,其粒徑顯著減小,且UHSPI-EGCG具有更小的粒徑,溶液PDI最小(0.32),表明顆粒分布最為均一。這可能是由UHSPI與EGCG形成的復合物具有最強的負電性所致[13]。此外,文獻[24]表示,蛋白與多酚復合后,會較為明顯地改變蛋白的性質,使二者內部連接更緊密,從而改善溶液的粒徑分布情況。
2.4 電位分析
Zeta電位可以表征粒子之間的相互吸引能力。通過電位可以表征溶液的穩定性,電位的絕對值越大,產生的靜電斥力越大,粒子之間越不容易發生相互碰撞導致聚集,反之,絕對值越小,粒子間越易相互碰撞發生聚集形成大顆粒[13]。與對照SPI相比((-12.48±0.18)mV),UHSPI電位((-19.69±0.21)mV)絕對值顯著增加(P<0.05),這可能是當pH值變換(pH值由12到7)時,蛋白發生了解折疊的結構變化,帶電基團暴露[4,16]。此外,超聲利用空化作用打開蛋白結構[2],超聲的空穴效應及機械剪切與堿提供的靜電斥力相協同,導致蛋白結構伸展,疏水性殘基及帶電基團暴露,電位絕對值增加[5]。
SPI與EGCG復合后,溶液的電位絕對值均顯著增大(P<0.05), SPI-EGCG的電位為(-13.88±0.46)mV,UHSPI-EGCG的電位((-21.08±0.16)mV)絕對值最大。可能是由于EGCG帶負電荷,并且在中性條件下酚羥基可以去質子化,所產生的氧中心可以輸出較高的負電荷密度,與蛋白的正電基團結合,使得SPI的負電荷相對增加[13]。此外,文獻[18]研究表明,多酚與乳蛋白復合后,可降低蛋白的等電點,復合物的負電性增強。
2.5 濁度分析
濁度的變化可以反映粒子的聚集情況,濁度主要與溶液的顏色、粒子的粒徑等有關[25]。與SPI(0.26±0.014)相比,UHSPI濁度(0.083±0.013)明顯減小,這可能是因為超聲改變了蛋白的三、四級結構,以及堿處理提供的靜電斥力,使蛋白與蛋白的相互作用減小,濁度減小,從而提高溶液體系的穩定性[3-5,16]。
SPI與EGCG復合之后,所有復合物溶液的濁度與單純蛋白溶液相比均顯著增加,SPI-EGCG的濁度為0.367±0.012,且UHSPI-EGCG具有最小的濁度(0.135±0.016),這可能是由于復合物溶液的粒徑減小,PDI降低,溶液分散均勻,導致光發生漫反射,從而導致濁度的增加[24,26]。該結果與文獻[19]的研究結論一致,花青素與SPI相互作用,使蛋白的結構改變,粒徑更加均勻,光的漫反射增加,溶液濁度增加。此外,由于EGCG在中性及堿性條件下不穩定,易氧化成棕色的醌類物質,所以,溶液的顏色加深,也可能導致濁度增加[25]。
2.6 乳化特性分析
乳化活性指數(EAI)及乳化穩定性指數(ESI)可以表征乳狀液的乳化特性及穩定狀態。EAI表示乳化劑形成油-水界面的能力;ESI是指乳狀液形成小液滴的抗應變能力[27]。如圖4(圖中不同小寫字母表示乳化活性指數差異顯著,不同大寫字母表示乳化穩定性指數差異顯著)所示,未加入EGCG時,與SPI相比,UHSPI表現出最高的EAI和ESI,可能由于堿處理產生的靜電斥力與超聲產生的空化作用相輔相成,使蛋白的疏水基團暴露,蛋白的二級、三級結構舒展,分子柔性增加,從而提高其乳化性[2-5]。
SPI與EGCG復合后,UHSPI-EGCG具有最高的EAI(1.98)、ESI(394.52 min),可能是由于EGCG的加入增強界面薄膜的表面壓力和黏彈性,形成較穩定的界面膜,增加復合物的EAI[10]。另外,SPI與EGCG復合后,油-水界面層一部分被蛋白質占據,另一部分被EGCG占據,形成第1層乳化膜,蛋白質的疏水基團充分暴露和EGCG通過疏水相互作用形成第2層的乳化膜,因此EAI顯著提升[13]。EGCG與SPI復合后,液滴間空間斥力的增加及表面電荷的變化,導致蛋白的ESI增強[22,24]。
2.7 熒光淬滅光譜分析
通過評估EGCG對蛋白內源性熒光的淬滅情況,可分析EGCG與蛋白的結合強度[28]。如圖5所示,隨著EGCG濃度的不斷增加,SPI和UHSPI熒光強度均逐漸降低,說明EGCG對SPI的內源熒光產生了猝滅作用[17]。同時發現SPI的最大熒光發射波長隨著EGCG濃度的增加,發生了紅移,且UHSPI的變化程度最為顯著,這說明EGCG與SPI發生了結合,從而改變了SPI的結構構象,Trp和Tyr的微環境發生改變,由疏水環境變為親水環境,肽鏈結構舒展[29]。
為評估EGCG與SPI的結合強度(圖6),根據Stern-Volmer方程計算出SPI-EGCG復合物的動態猝滅速率常數(Ksv)和雙分子猝滅常數(Kq),如表2所示,所有樣品的Ksv均大于最大動態淬滅速率常數(2×1010L/(mol·s)),表明為靜態淬滅[17],另外,UHSPI具有最大的Ksv(3.094×1012L/(mol·s)),這表明EGCG與蛋白的結合強度最大,這可能是由于超聲產生的空化作用及堿誘導使蛋白的疏水性基團暴露,EGCG與蛋白的疏水性結合增強[16]。

表2 SPI-EGCG復合物的熒光猝滅常數、結合位點數、表觀結合常數Tab.2 Fluorescence quenching constant, number of binding sites and apparent binding constant of SPI-EGCG complex
對于靜態淬滅,利用式(2)計算EGCG與SPI間的表觀結合常數Ka和結合位點數n(表2)。從表2可以看出,EGCG與不同條件處理的SPI間的表觀結合常數數量級為104,說明EGCG與SPI發生了緊密的結合,且均形成了結合位點數接近于1的復合物,其中,UHSPI-EGCG的結合位點數最大(1.3),說明EGCG與其結合得最為緊密,這與上文討論的結果一致。
3 結論
(1)超聲復合堿處理可使SPI多肽鏈的骨架伸展、蛋白結構發生改變(α-螺旋相對含量減少,無規則卷曲相對含量增加),改變了蛋白的聚集狀態,SPI乳化性能明顯增加。
(2)EGCG與SPI形成復合物,改變了蛋白構象,顯著提高蛋白的乳化活性、乳化穩定性,復合物溶液的粒徑減小,其中UHSPI-EGCG乳化性最強(EAI為1.98;ESI為394.52 min)。
(3)EGCG對SPI的淬滅機制為靜態淬滅,二者均可形成結合位點數近似于1的復合物,其中UHSPI-EGCG結合位點數最大(1.3)。

