珍稀瀕危植物金絲李種子休眠解除的轉錄組分析
張俊杰,張靈藝,夏 科,蔣 冕,韋 霄*
(1.重慶交通大學建筑與城市規劃學院,重慶 400074;2.廣西壯族自治區中國科學院廣西植物研究所,廣西 桂林 541006;3.湖南農業大學植物保護學院,湖南 長沙 410128)
種子由休眠階段轉換到萌發階段,涉及非常復雜的生物學過程[1]。兩階段相比對,常存在較多的差異表達基因(DEGs)[2]。與種子休眠相關的基因功能研究主要集中在擬南芥(Arabidopsis thaliana(L.) Heynh)[3]、煙草(Nicotiana tabacumL.)[4]及水稻(Oryza sativaL.)[5]等模式植物中。近年來,有關重樓(Paris polyphyllaSmith)等中草藥[6-7]、杉木(Cunninghamia lanceolata(Lamb.) Hook.)和湖北梣(Fraxinus hupehensisChu)等林木[8-9]以及桃(Amygdalus persicaL.Spp.)[10-11]和芍藥(Paeonia lactifloraPall.)[12]等觀賞植物的種子休眠相關的基因功能研究也陸續被報道。
種子休眠解除涉及復雜的調控網絡。華重樓(P.polyphyllaSm.var chinensis (Franch.) Hara)種子在發育與休眠解除過程中,差異表達基因主要富集在次生代謝產物合成、碳代謝、磷酸戊糖途徑、多糖分解、蛋白質合成以及激素信號轉導等通路[7]。人參(Panax ginsengC.A.Mey.)后熟發育時期的DEGs 主要富集到代謝過程、次生代謝合成和植物激素信號轉導等通路[13]。具有形態生理休眠的遼東楤木(Aralia elataL.)種子在破眠起始階段的呼吸代謝途徑主要以糖酵解和三羧酸循環為主[14];而油菜(Brassica napusL.)種子休眠性則與脂肪酸代謝密切相關[15]。
內源激素在調控植物種子休眠與萌發過程中有十分重要的作用。近年來,在種子休眠與萌發過程中有關激素的合成與分解、信號轉導等基因的表達調控機制研究取得了較大進展,其中,脫落酸(ABA)、赤霉素(GA)、生長素(auxin)和乙烯(ETH)等是研究最多的內源激素。三七(Panax notoginsengWall.)種子中共篩選出78 個與其休眠釋放有關的DEGs,其中,15 個與ABA和GA 相關(如ABI5、GAI、KS、GA2ox等)[16]。擬南芥種子中的AtCYP707A2基因參與ABA 水平的調節,其休眠釋放也與該基因的表達有關[17]。催化GA 生物合成的基因GA20ox1、GA 活性轉化的關鍵酶基因GA3ox2與GA 分解代謝的關鍵基因GA2ox1[18]在西洋參(Panax quinquefoliusL.)種子休眠解除過程中表達量顯著變化[19]。擬南芥的GA 受體GID1基因突變后,突變體種子中α-淀粉酶的活性被抑制,從而導致種子不能萌發[20]。花生(Arachis hypogaeaL.)種子休眠解除過程中除了與GA 和ABA 相關的unigenes 顯著差異表達以外,與auxin 和ETH相關的DEGs 也較多[21]。ACO1基因轉錄調控乙烯生成,在打破山毛櫸屬(FagusL.)植物種子休眠過程中起主要作用[22]。
金絲李(Garcinia paucinervisChun et How)為藤黃科(Clusiaceae)藤黃屬(GarciniaL.)喬木,主要分布于廣西西部和云南東南部喀斯特山地,集經濟、生態、觀賞和藥用價值于一身。因其木材名貴,金絲李曾遭受過度采伐,成為了珍稀瀕危樹種。前期研究表明,金絲李種子萌發緩慢且不整齊,被歸為具有生理休眠的低度頑拗性種子[23-24],其休眠主要是由于胚和胚乳中存在內源抑制物的同時缺乏萌發促進物質。以外源6-BA 或GA3處理,亦或32℃條件下均可加快金絲李種子萌發的進程,在一定程度上可打破種子休眠。但處理后的種子平均萌發時間均大于100 d,萌發仍較為緩慢[25-26],這并不利于金絲李的育苗栽培和資源的保護利用。目前,有關金絲李的分子生物學研究有限,僅有關于其不同種群遺傳多樣性的報道[27],而藤黃屬植物種子休眠機理的分子方面研究幾乎空白。為了獲得更有效地打破金絲李種子休眠的方法,需探索其休眠的分子機理,分析其休眠解除與種子萌發過程中參與調控的基因及其調控方式。
轉錄組學(transcriptomics)屬于功能基因組學的研究范疇,可從整體水平上研究基因功能和基因結構,揭示不同轉錄組樣本中基因表達水平的變化,挖掘特定生物學過程中的分子機理[28]。種子能否解除休眠取決于種子休眠程度與胚胎克服休眠能力之間的相互博弈。然而,科學界對種子休眠解除和萌發啟始階段的界定十分困難[29]。金絲李種子萌發緩慢且不規律,很難把握其從休眠狀態轉為休眠解除狀態的關鍵時間,故本研究預設以種子萌發為其休眠解除的判斷標準。通過將新鮮成熟的金絲李種子、播種后同一時間未萌發和已萌發種子的種胚和胚乳進行無參考基因組轉錄組測序,找出種子從休眠向萌發轉化過程中的差異表達基因,挖掘調控其休眠解除的候選基因,以期為后續開展金絲李種子的休眠功能基因研究及分子育種實踐提供有益參考,為藤黃屬植物種子,甚至具有休眠屬性的頑拗性種子的基因組學研究奠定基礎,也為探討其分子調控網絡提供有價值的信息。
1 材料與方法
1.1 試驗材料
成熟金絲李種子于2017 年7 月采集自廣西龍州縣弄崗國家級自然保護區,經0.1%的K2MnO4溶液消毒并洗凈后,選取飽滿且無病蟲害的種子(經TTC 法測試其生活力達98.00%),一部分種子去除種皮后用滅菌刀片切取中部(包含胚和胚乳)約3 mm 部分,迅速用錫箔紙包裹放入液氮速凍,存于?80℃冰箱作為原種子,記為OS(original seeds);另一部分種子參照張俊杰等[25]的播種條件,以河沙為基質播種于25℃的培養箱中,經過60 d 取出種子(萌發率為(28.33 ± 2.36)%),未萌發的種子記為UG(ungerminated seeds);已萌發的種子記為GS(germinated seeds),去除種皮后取種子中部(包含胚和胚乳)約3 mm 部分(圖1),迅速用錫箔紙包裹放入液氮速凍,于?80℃冰箱保存(種皮不是其休眠的主要原因[23],故本研究采用了去種皮操作)。
1.2 金絲李種胚和胚乳的RNA 提取
使用廣州艾基生物技術有限公司的IPure TRizol植物RNA 提取試劑盒(K417-S)分別對OS、UG和GS 3 組材料進行種胚和胚乳(混合)的RNA提取。經超微量核酸蛋白測定儀(ScanDrop 100)測定提取的RNA 純度及濃度(選擇A260/280≈ 1.8~2.1,A260/230>1.8),再經過1.2%瓊脂糖凝膠電泳檢測所提取的RNA 完整性,合格后存于?80℃冰箱以備下一步試驗。

圖1 試驗材料與取樣部分Fig.1 Experimental materials and the extraction parts
1.3 cDNA 文庫的構建與轉錄組測序
將OS、UG 和GS 3 組材料各5 粒種子作為1組混池處理,3 個生物學重復。在上機前分別對總RNA 的純度、濃度及完整度用Nanodrop、Qubit及Agilent 2100 進行檢測,選用評定等級為A 的樣品。樣品RNA 經DNase I 處理后,用帶有Oligo(dT)的磁珠富集真核生物mRNA,加入打斷試劑將mRNA 打斷成短片段,并以打斷后的mRNA為模板用六堿基隨機引物(random hexamers)合成一鏈cDNA,然后加入緩沖液、dNTPs 和DNA polymerase I 合成cDNA 第二鏈,經QiaQuick PCR試劑盒純化回收、粘性末端修復、3′末端加上堿基“A”和連接測序接頭,得到的片段進行大小選擇后,PCR 擴增富集。構建好的文庫經Agilent 2100 Bioanalyzer 和ABI StepOnePlus Real-Time PCR System質檢合格后使用Illumina HiSeqTM2500 測序平臺進行測序。
1.4 轉錄組數據處理與分析
1.4.1 數據過濾和de novo 拼接 為減少測序錯誤對后續分析的影響,用FastaQC 軟件進行質量評估。測序得到的原始raw reads 中,將含有低質量的和帶接頭的reads 進行過濾(去掉包含adapter,不確定堿基N 比例超過5%及低質量堿基(Q ≤10),含量大于50%的reads)后得到clean reads。之后使用組裝軟件Trinity(version:trinityrnaseq_r20140717)對去重復的clean reads 進行組裝。然后使用Tgicl v2.1 去其冗余并進一步拼接,再對這些序列進行同源轉錄本聚類,獲得最終的unigenes。
1.4.2 unigene 功能注釋及差異表達基因的篩選
通過Blast 比對數據庫獲得功能注釋,使用Blast2GO 對unigenes 集進行GO 注釋。采用FPKM法來衡量基因的表達量。采用DESeq2 R package進行unigenes 的差異表達分析,對金絲李3 個比較組合的DEGs 進行篩選,條件為:|Log2Ratio| ≥1且錯誤發生率(FDR)≤0.01。在KOBAS2.0 網站上進行DEGs 的KEGG 的pathway富集分析。對于激素合成與降解及信號轉導的相關DEGs,在轉錄組測序數據中找到對應注釋,將其對應的CDS 序列分別在NCBI 上進行Blast 比對分析以確認。
1.5 qRT-PCR 分析驗證
采用qRT-PCR 技術驗證此次轉錄組測序數據的可靠性,測試3 個比較組合中12 個DEGs 的表達量變化。以Actin3做為參照基因,采用Primer Premier v5.0 設計引物,由生工生物工程(上海)有限公司合成(表1)。采用Aidlab 公司反轉錄試劑盒(TUREscript 1st Strand cDNA SYNTHESIS Kit)進行反轉錄操作。反應程序:95℃,3 min;95℃,10 s;58℃,30 s;72℃,20 s;39 個循環。以2?△△CT方法計算基因相對表達水平[30]。每個樣品進行3 次生物學重復與3 次技術重復,統計值以平均值 ± 標準誤(Mean ± SE)表示。使用Graphpad Prism 6 與SigmaPlot 11.0 軟件繪圖。
2 結果與分析
2.1 轉錄組測序結果的產量與質量統計
通過對金絲李種胚和胚乳的轉錄組測序,獲得了OS、UG 和GS 3 組樣品共9 個樣本轉錄本信息,共超過120 G 的數據量;9 個樣本的GC 含量均在45.70%~47.49%間,Q20、Q30 的范圍分別為96.08%~96.56%、90.81%~92.38%(表2)。表明構建的3 個轉錄組文庫測序質量較好,可以滿足后續分析要求。
組裝結果顯示:9 個樣本共獲得了120 040 個unigenes,平均長度為1 104.92 nt,N50 為1 874。所有樣品轉錄組的Unigenes 的長度有26.68%都在200~300 bp 的范圍內,3 000 bp 以上的Unigenes占5.95%。
2.2 熒光定量PCR 驗證
熒光定量PCR 驗證過程中發現,除CL7766.Contig1 與CL6835.Contig2 外,隨機挑選DEGs 的qRT-PCR 的相對表達量與轉錄組測序(RNASeq)的數據基本呈相似的變化趨勢(圖2),說明RNA-Seq 分析的基因表達譜數據結果在qRTPCR 分析中有較高的再現性,從而解釋RNA-Seq分析具有較高的可信度。

表1 熒光定量引物列表Table 1 List of primers sequence of selected genes
2.3 金絲李種胚和胚乳的差異表達基因
對金絲李種胚和胚乳的OS、UG 和GS 3 組樣本進行兩兩比較,篩選出一些DEGs,其中,GS相對OS 有1 174 個unigenes 上調表達,2 232 個下調表達;UG 相對OS 有849 個unigenes 上調表達,1 926 個下調表達;GS 相對UG 有814 個unigenes上調表達,670 個下調表達(圖3A),表明金絲李種胚和胚乳在播種后涉及復雜的生物過程。OS_VS_GS、OS_VS_UG 和UG_VS_GS 3 個比較組合的共同與特有的DEGs 分布圖見圖3B。
2.4 unigene 的KEGG 功能注釋
依據KEGG 數據庫注釋信息可以進一步獲得unigenes 的pathway 注釋,共56 224 個注釋到該基因庫。≥3%的pathway 名稱及其包含的基因數量見表3,其中,13 020 個代謝途徑(Metabolic pathways)的相關基因數量第一,占比23.16%,其次為6 727 個占比11.96%的次生代謝產物的生物合成(Biosynthesis of secondary metabolites)的相關基因。
2.5 差異表達基因的pathway 富集分析
利用KEGG 數據庫將3 個比較組合文庫篩選得到的DEGs 進行pathway 富集分析,以Qvalue ≤0.05 為標準。在3 個比較組合中注釋到的前4 條途徑一致,以代謝通路(Metabolic pathway)中的DEGs 最多,分別達709、533、256 個;其次是次生代謝產物的生物合成(Biosynthesis of secondary metabolites)途徑,分別有480、359、160 個DEGs被分別注釋到該途徑。說明金絲李種子從休眠到萌發過程中,其基因表達差異多集中在這些途徑中。

表2 轉錄組測序的組裝質量統計表Table 2 Summary of the sequence assembly after Illumina sequencing
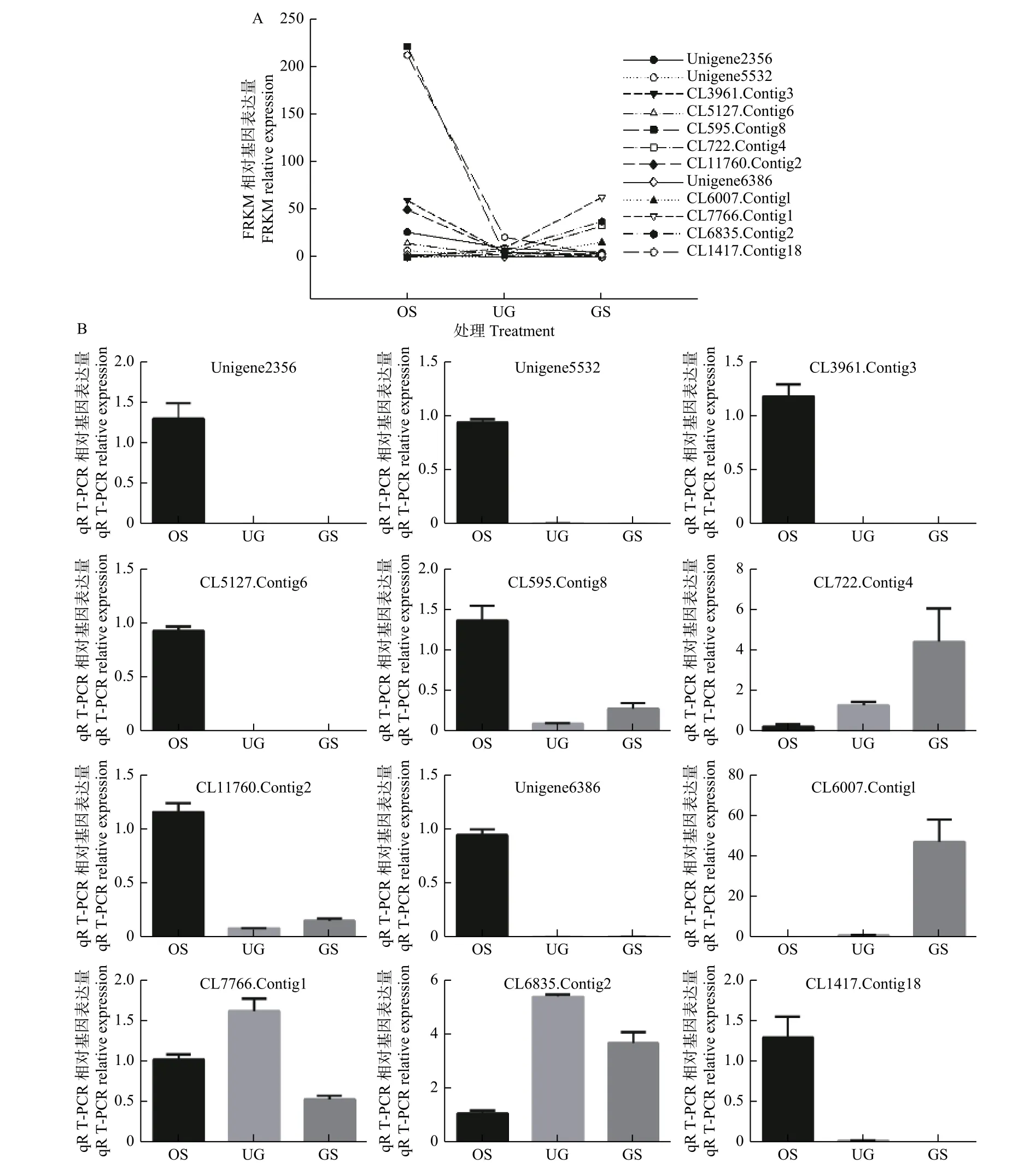
圖2 12 個差異表達基因qRT-PCR 的驗證分析Fig.2 qRT-PCR validation and analysis of 12 selected DEGs
2.6 休眠解除過程中的相關基因
2.6.1 與休眠解除相關基因的pathway 富集與表達OS_VS_GS 和UG_VS_GS 2 個比較組合牽涉到金絲李種子休眠的解除和萌發,筆者從中挑選出差異量較大的122 個基因(閾值log2|Fold Change| >2,且FDR <0.01)做熱圖,其富集到的pathway及其表達情況見圖4。從播種到萌發階段,富集到鈣信號通路(Calcium signaling pathway)、次生代謝產物合成(Biosynthesis of secondary metabolites)(包括萜類化合物、黃酮類化合物等)、核糖體(Ribosome)、植物激素信號轉導(Plant hormone signal transduction)等相關基因的表達量顯著升高;而富集到糖酵解/糖異生(Glycolysis/Gluconeogenesis)、脂肪酸合成與降解(Fatty acid biosynthesis and degradation)、內質網中的蛋白質加工(Protein processing in endoplasmic reticulum)、氨基酸合成(Biosynthesis of amino acids)等相關基因的表達量則顯著降低。

圖3 3 個比較組合間的差異表達基因數目統計(A)和共同與特有差異表達基因分布圖(B)Fig.3 Statistics of differentially expressed genes among three comparison groups of samples (A) and distribution of the genes commonly and specifically DEGs among three comparison groups of samples (B)

表3 金絲李種子的轉錄組unigene 的KEGG 代謝途徑注釋(≥ 3%)Table 3 KEEG pathway annotation of unigenes of transcriptome for G.paucinervis seeds (≥ 3%)
分析可知:在種子休眠解除的過程中,信號傳導、激素作用、蛋白質合成、細胞分裂與代謝、次生代謝產物合成等比較活躍,且從原種子到種子吸脹過程中糖、脂肪和蛋白質分解代謝也較旺盛,當種子開始萌發后,這些代謝相關基因逐漸關閉。
2.6.2 植物激素相關基因的篩選 在3 個比較的組合中篩選出40 個在種子休眠至萌發過程中與激素相關的基因,根據功能注釋可知,涉及到ABA、GA、auxin 和ETH 等相關的基因,其中,與激素合成、分解或衍生相關的基因有7 個,涉及ABA、GA 及ETH 共3 種植物激素;受體3 個,僅涉及GA 1 種植物激素;與信號轉導相關的基因有17 個,涉及到ABA、GA、auxin 和ETH 4 種激素;轉錄因子12 個,涉及ABA 和ETH 2 種激素,以ERF 家族成員最多;其他基因1 個。
與植物激素相關的DEGs 的表達情況見圖5,其中ZEP、GA2ox1、GA2ox3、GAI、GID1、SnRK2.2和ACO1在種子休眠解除時顯著下調表達,以ACO1下調最顯著,而CYP707A2、GA20ox1和GA3ox2在此過程中顯著上調表達。這些調控ABA、GA、auxin 和ETH 等相關基因的表達量發生顯著的變化,很可能導致對應激素的含量發生變化,促進種子休眠的解除。
2.7 差異表達的轉錄因子分析

圖4 OS_VS_GS 與UG_VS_GS 比較組合中共有的部分差異表達顯著的基因的表達情況Fig.4 Expression profile analysis of common DEGs in OS_VS_GS and UG_VS_GS comparison groups of samples
轉錄因子(transcription factor,TF)在種子發育、休眠與萌發等植物生命周期中起著非常重要的作用。從3 個比較組合中共發現375 個差異表達的TFs,分屬于57 個轉錄因子家族。OS_VS_GS樣本間有170 個差異表達的TFs,其中,ERF 和WRKY 家族各有20 個差異表達的TFs,MYB 和NAC 家族也均含14 個;OS_VS_UG 樣本間有147 個差異表達的TFs,其中,ERF 和NAC 家族各有20 個差異表達的TFs,MYB 和WRKY 家族也均含16 個;UG_VS_GS 樣本關系到種子從吸脹階段到萌發階段,它們間有75 個差異表達的TFs,其中,ERF 家族有14 個,HD-ZIP 和C3H 家族也均含6 個。
通過注釋發現,與結合蛋白、含結構域的家族蛋白、ABA 和乙烯有關的TFs 表達量變化較大,其中,與乙烯有關的差異表達的TFs 達10 個。說明有較多的轉錄因子家族和轉錄因子參與了金絲李種子由休眠到萌發的過程,推測它們在種子破眠的過程中也起著一定作用。

圖5 與植物激素相關的差異表達基因的表達情況Fig.5 Expression profile analysis of DEGs related to plant hormone
3 討論
3.1 休眠解除過程中與物質代謝、鈣信號通路相關的差異表達基因
糖酵解途徑是三條最基本的呼吸代謝途徑之一,為種子萌發提供所需能量[31]。Simmonds 等對野燕麥(Avena fatuaL.)種子休眠過程中糖代謝途徑研究證明,由糖酵解途徑/三羧酸循環向磷酸戊糖途徑轉變是解除其休眠的主要原因[32]。萌發前期的天女木蘭(Magnolia sieboldiiK.Koch)種子主要通過糖酵解途徑為種子萌發提供能量,定位于糖酵解/糖異生通路的5 種差異蛋白質均在種子萌發前期高峰度表達[33]。本研究中發現8 個與糖酵解/糖異生合成或分解相關DEGs 在播種到種子吸脹、萌發過程中逐漸下調表達,說明糖酵解途徑為種子萌發提供能量后,這些糖酵解/糖異生代謝相關基因逐漸關閉。
在營養物質合成與代謝相關基因中,脂肪酸是一些植物種子的主要能量來源之一。巫山淫羊藿(Epimedium wushanenseYing)種子休眠解除過程中各脂肪酸含量變化顯著[34]。水曲柳(Fraxinus mandshuricaRuprecht)種子在休眠解除過程中,脂肪酶活性和脂肪酸質量分數快速增加,脂肪酸合成或分解的相關基因在休眠解除過程中差異表達,將貯藏物質轉化為營養物質,可為細胞分裂及胚根、胚軸和子葉的分化提供能量,為種子的萌發作準備[35]。脂肪酸合成與降解相關的5 個基因CL5358.Contig3、CL6410.Contig10、CL5358.Contig9、CL3542.Contig2 和CL3542.Contig1 在金絲李種子休眠解除時表達量顯著變化,表明種子在破眠過程中脂肪酸代謝活躍。
鈣離子(Ca2+)作為第二信使參與調節植物的多種生理過程,參與許多胞內信息或胞外刺激的接收和傳遞[36]。Somyong 等從水稻中鑒定出與鈣信號轉導有關的候選基因,涉及ABA 信號轉導以及對萌發至關重要的功能蛋白關聯網絡[37]。此外,Ca2+信號參與GA 信號的轉導作用[38],Ca2+-CaM(Calmodulin,鈣調蛋白)信號系統參與乙烯生成,以間接方式調節乙烯生成中ACC 合酶向乙烯轉化[39]。5 個鈣信號通路相關基因CL629.Contig5、CL6715.Contig3、CL629.Contig3、CL7156.Contig2和CL629.Contig4 均在種子吸脹且未萌發時(UG)表達量變化不大,但在萌發時均顯著上調,說明鈣信號通路相關基因在休眠解除過程中可能起到一定的調控作用,可能參與了ABA、GA 和乙烯等激素有關基因的信號轉導或合成。
3.2 休眠解除過程中植物激素相關基因的表達
種子休眠解除受多種植物內源激素調控[40]。Qi 等利用高通量胚胎轉錄組測序技術挖掘出重樓在種子層積過程中的11 個激素相關的DEGs[6]。此外,植物激素與植物的玩拗性密切相關[41],而金絲李種子為較特殊的具有休眠屬性的玩拗性種子,故本文重點分析3 個比較組合中激素調控相關基因的差異表達。
GA 和ABA 的相關基因在種子休眠和萌發中的作用是通過合成、分解代謝與信號轉導的平衡來實現的[42]。杉木[8]、桃[10,12]等植物種子的休眠解除過程中,調控GA 和ABA 的相關基因表達量差異較大。金絲李種子在休眠解除過程中,ABA 和GA 合成途徑上的一些相關基因表達也有顯著差異,如ZEP是催化ABA 生物合成的關鍵酶基因[40],從播種到萌發,ZEP表達顯著下調,表明ABA 合成的關鍵步驟受阻。CYP707A家族編碼ABA 8′-羥化酶,其影響種子從休眠到萌發的過程[17],CYP707A2作用于ABA 的分解代謝[43],在金絲李種子播后60 d,無論萌發與否,CYP707A2表達量均顯著上升。因此,CYP707A2與ZEP可能共同參與調控ABA 含量的降低。SnRk2.2主要參與ABA 的信號轉導,正調控ABA 信號[44]。SnRk2.2在OS_VS_GS比較組合中表達量顯著下調。CL3120.Contig6 為一種RNA 結合蛋白,對ABI3、ABI4和ABI5起抑制作用,ABI3隸屬于bZIP轉錄因子家族,正向調控種子休眠,種子播后60 d,CL3120.Contig6 的表達量上調,說明ABI3的表達受到抑制。因此,推斷ABA 調控金絲李種子萌發是多基因協同作用的結果,通過控制基因的表達量調控ABA 的合成或者改變ABA 信號轉導過程,使得ABA 含量在種子萌發過程中發生變化。
GA20ox1與GA3ox2為GA 合成途徑中的關鍵調控基因,而GA2ox1的高表達能夠導致GA 失活,從而調控GA 降解代謝。擬南芥種子在吸脹過程中,GA 合成的相關基因GA20ox1和GA3ox表達量均顯著增加[45]。本研究發現,GA20ox1在播后60 d 已萌發種子中表達量顯著上調,而GA3ox2在播后60 d 有無萌發的種子中表達量均顯著上調,推測GA20ox1與GA3ox2在金絲李種子休眠解除過程中有一定作用;而GA2ox1則在3 個比較組合中均下調表達。類似的,西洋參種子在經過層積處理的休眠解除過程中,其GA20ox3逐漸上調表達,不同的是,西洋參種子GA2ox3和ZEP的表達量變化不顯著[46]。GAI屬于DELLA 家族的基因,負調控GA 信號轉導途徑[47]。本研究發現,播后60 dGAI的表達量均下調,說明對GA 信號的抑制作用減弱。GID1 通過蛋白質間的相互作用,增強DELLA 對GA 的阻遏反應[48]。GID1在播后60 d均下調表達,使得GA 的阻遏反應減弱。因此,GA 控制金絲李種子休眠解除也是一個多基因協同的復雜過程,通過控制基因的表達量使得GA 含量在種子休眠解除時發生變化。結合張俊杰等所測量的金絲李種子從休眠到萌發進程中內源激素的變化情況分析[23],其種子可能通過抑制ABA 的合成或促進其分解,加強GA 的合成同時減弱其降解,與激素信號轉導有關基因和有關轉錄因子相配合,使萌發促進物與抑制物的比例趨于促進以打破休眠。
ACO 控制種子萌發過程中乙烯的演化,是乙烯合成途徑中的關鍵酶。本研究播種后60 d 的種子中,ACO1的表達量均下調,且乙烯信號轉導相關基因和大部分乙烯應答轉錄因子均下調表達,很可能導致乙烯的合成降低。推測乙烯很可能參與調控了金絲李種子的休眠與萌發。一些研究表明,乙烯作用于ABA 代謝降低ABA 含量,負調控ABA信號途徑[49],在休眠解除過程中含量逐漸升高[21,50]。但在本研究中,乙烯含量變化趨勢與之相反,具體原因有待進一步研究。
轉錄因子是調控靶基因在特定的時間、空間和適當的強度進行表達的一類蛋白質分子。本研究發現,bZIP 轉錄因子家族的CL9649.Contig2 和CL9649.Contig4 涉及到ABI5,而ABI5 通過與ABA 應答元件(ABA-responsive-element,ABRE)結合來激活種子中ABA 介導的基因轉錄,在種子萌發階段加強種子對外源ABA 的應答[51]。在金絲李種子休眠解除時,與ABA 和乙烯有關的TFs 表達量變化較大,其中,與乙烯有關的差異表達的TFs 達10 個。無休眠的同屬植物山竹(G.mangostanaL.)種子在萌發過程中乙烯應答轉錄因子的表達量變化也較大[52],推測乙烯在藤黃屬植物種子中的作用具有更深入的研究意義。而金絲李種子休眠解除過程中各激素之間的互作機制,及其在種子休眠和萌發中的信號網絡、蛋白互作的體內證據及更多調控基因位點的發現都值得深入研究。
4 結論
本研究推測,金絲李種子休眠解除過程是通過上調鈣信號、次生代謝產物合成、核糖體和植物激素信號轉導等基因相關的通路,下調糖酵解/糖異生、脂肪酸合成與降解、內質網中的蛋白質加工和氨基酸合成等基因相關的通路,同時伴隨著上調GA 合成或ABA 分解的相關基因,下調ABA 的合成或GA 分解的相關基因,與有關轉錄因子等調控網絡相配合以打破休眠。乙烯很可能也參與調控其種子的休眠與萌發。

