不同沉淀劑制備Pd/TiO2催化劑對直接合成過氧化氫催化性能的影響
王耀丹,史連軍,秦紅,潘紅艷,林倩,張鑫
(1.貴州大學 化學與化工學院,貴州 貴陽 550025;2.貴州省綠色化工與清潔能源技術重點實驗室,貴州 貴陽 550025;3.中低品位磷礦及其共伴生資源高效利用國家重點實驗室,貴州 甕安 550400)
H2O2是一種重要的化工原料,應用于造紙、環保、食品、醫藥以及農業等領域[1-2]。氫氧直接合成H2O2前景極好,Pd基催化劑被認為是催化效果最好的[3-4]。本文使用不同沉淀劑制備催化劑Pd/TiO2-CD(X),討論不同沉淀劑制備的催化劑Pd/TiO2-CD(X)對直接合成H2O2催化性能的影響。
1 實驗部分
1.1 試劑與儀器
氯化鈀、無水碳酸鈉、氨水、二氧化鈦、尿素、甲醇、濃硫酸、硫代硫酸鈉等試劑均為分析純;實驗用水均為去離子水。
DC-3010低溫恒溫循環槽;JF電子天平;DF-1磁力攪拌器;GC9560氣相色譜儀;101-3AB恒溫干燥箱;KSS-1400 ℃高溫森管式爐;活性評價裝置,自制。
1.2 催化劑的制備
稱量0.99 g TiO2置于50 mL小燒杯中,加入10 mL 濃度為0.1 mol/L HCl,加入4.69 mL濃度為0.02 mol/L H2PdCl4溶液,在60 ℃下恒溫攪拌,滴加濃度為0.25 mol/L Na2CO3溶液,直至體系pH=9。攪拌3 h后,使用去離子水洗滌3次,80 ℃下干燥12 h,600 ℃下焙燒3 h,250 ℃還原2.5 h,得負載量為1%的 Pd/TiO2催化劑,將其命名為Pd/TiO2-CD(Na2CO3)。使用氨水作為沉淀劑,得到催化劑Pd/TiO2-CD(NH3·H2O);使用尿素作為沉淀劑時,先將載體TiO2、尿素和氯鈀酸溶液加入到去離子水中,80 ℃水浴5 h,再經過后期熱處理,得到催化劑Pd/TiO2-CD(Urea)。
1.3 表征
1.3.1 活性組分Pd 使用Auto ChemⅡ2920 化學吸附儀表征。測試條件:在50 mL/min 的H2氣氛中以10 ℃/min 的升溫速率程序升溫至350 ℃,在該溫度下進行還原3 h,之后用N2替換H2,該溫度下吹掃0.5 h,再降溫至40 ℃,基線平穩后就開始脈沖吸附CO,沒有被吸附的CO會通過熱導檢測器(TCD)進行檢測。
1.3.2 催化劑的比表面積以及孔結構參數 使用ASAP 2020 比表面積孔隙度測定儀表征。測試條件:在120 ℃脫氣處理后,在77 K下吸附N2。
1.3.3 催化劑的金屬氧化物的種類以及含量 使用AutoChem Ⅱ 2920 化學吸附儀表征。測試條件:10%H2/Ar,總流量50 mL/min,升溫速率10 ℃/min,熱導池檢測器檢測程序升溫還原過程中的耗氫量。
1.3.4 催化劑的晶相 使用XRD表征。測試條件:銅靶Kα光源(λ=0.154 32 nm),在0~90°區間掃描速度為5(°)/min。
1.4 催化劑活性評價
直接合成H2O2的活性評價在半間歇式三相玻璃反應器內進行,氣體流量O2(99.9% )10 mL/min、H2(99.999% )5 mL/min 和N2(99.99%)20 mL/min,同時,以80 mL 甲醇和0.9 mL 濃硫酸作為反應的介質。使用催化劑0.02 g,反應溫度0 ℃,反應壓力101.325 kPa,反應2 h。通過氣相色譜定量分析測定尾氣中的氣體組成,采用碘量法來測定反應介質中生成H2O2的濃度。
2 結果與討論
2.1 催化劑的表征
2.1.1 金屬分散度及其晶粒尺寸 表1為不同沉淀劑制備Pd/TiO2-CD催化劑的CO-脈沖吸附數據。

表1 不同沉淀劑制備Pd/TiO2-CD催化劑的CO-脈沖吸附Table 1 CO-pulse adsorption of Pd/TiO2-CD catalysts prepared by different precipitate
由表1可知,沉淀劑對活性組分Pd晶粒粒徑和分散度有明顯的影響,3個催化劑的Pd分散度順序為:Pd/TiO2-CD(Na2CO3)>Pd/TiO2-CD(Urea)> Pd/TiO2-CD(NH3·H2O),而晶粒粒徑的大小順序則與之相反,使用Na2CO3溶液作為沉淀劑所制備的催化劑Pd/TiO2-CD(Na2CO3)有著較高的分散度和較小的Pd粒子粒徑,其分散度為17.22%,Pd粒子粒徑為5.42 nm。這是因為沉積-沉淀法制備催化劑的時候,當Na2CO3溶液滴加到體系,將Pd從鹽溶液中轉化為沉淀,吸附并固定在載體TiO2上[5]。而催化劑Pd/TiO2-CD(Urea)的金屬分散度較小,分散度為2.32%,晶粒粒徑為40.10 nm,這是由于尿素在60 ℃以上的水溶液中才能發生緩慢的水解,得到弱堿性的水溶液,而這個過程時間較長,使得Pd沉淀容易團聚長大,所以得到了金屬分散度較低的Pd基催化劑。
使用氨水作為沉淀劑制備的催化劑Pd/TiO2-CD(NH3·H2O)的活性組分Pd的分散度相對較低,Pd粒徑卻較大,Pd的分散度僅僅只有0.11%,活性組分Pd幾乎團聚,晶粒粒徑增大為830.12 nm。 這是因為使用氨水作為沉淀劑的時候,氨水與溶液中的Pd鹽發生了絡合反應[6],并沒有有效的沉淀在載體的表面,在干燥過程中,發生了結晶,得到了較大的Pd鹽顆粒,焙燒時Pd顆粒發生了團聚,得到的催化劑有較小的金屬分散度和較大的晶粒粒徑。
2.1.2 孔結構分析 圖1(a)為使用不同沉淀劑制備的Pd/TiO2-CD催化劑的N2吸附等溫線。
由圖1(a)可知,使用不同沉淀劑制備的Pd/TiO2-CD催化劑的孔結構相對于載體都發生了不同程度的改變。3個Pd/TiO2-CD催化劑的N2等溫吸附線均屬于III型等溫吸附線,在P/P0<0.1時,他們的N2吸附量均較小,說明所制備的催化劑微孔含量較少,與圖1(b)中的孔徑分布圖相符。并且3個催化劑在P/P0大于0.8有H2型的滯后環,BET比表面積和孔容最大,說明這3個催化劑經熱處理后得到較多的大中孔,與圖1(b)中的孔徑分布圖相符,這是由于沉積-沉淀法制備催化劑時,沉淀pH大于TiO2的等電點,TiO2納米顆粒發生了團聚,使得制備的催化劑的孔徑主要分布在大中孔部分。表2為不同沉淀劑制備的催化劑Pd/TiO2-CD的比表面積及孔結構參數。

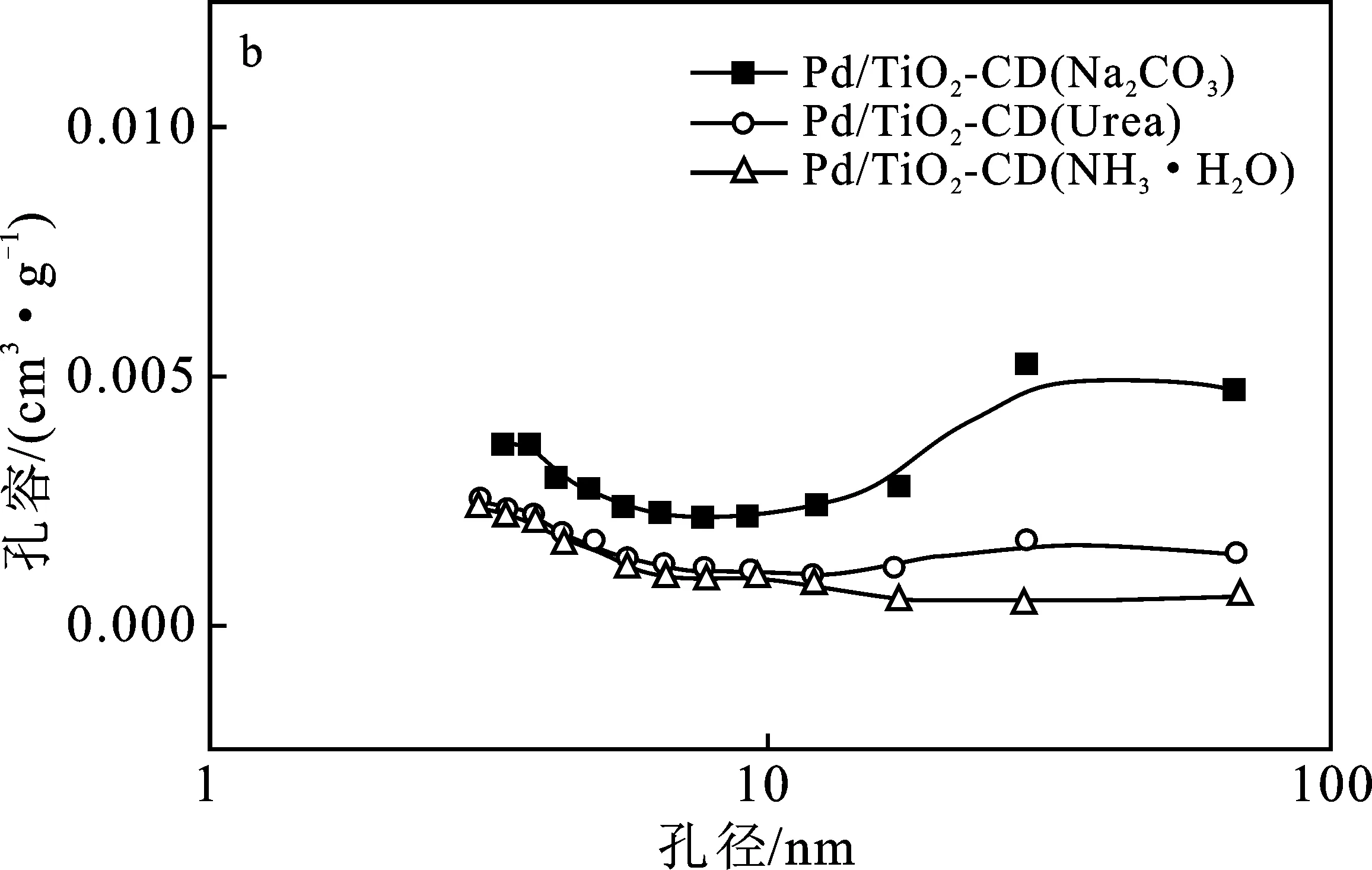
圖1 不同沉淀劑制備Pd/TiO2-CD催化劑的N2等溫吸附/脫附等溫線及孔徑分布圖Fig.1 N2 adsorption-desorption isotherms and pore size distribution of Pd/TiO2-CD catalysts prepared by different precipitate

表2 不同沉淀劑制備Pd/TiO2-CD催化劑的BET比表面積與孔結構參數Table 2 BET specific surface area and pore structure parameters of Pd/TiO2-CD catalysts prepared by different precipitate
由表2可知,催化劑Pd/TiO2-CD(Na2CO3)較其他兩個催化劑有更大的比表面積和孔容,催化劑Pd/TiO2-CD(Na2CO3)分散度最好,所以催化劑Pd/TiO2-CD(Na2CO3)比另外兩個有更好的比表面積和孔結構,這將有利于H2O2的反應物和生成物的進出,從而有利于提高H2O2的選擇性和產率。
2.1.3 H2-TPR 圖2是不同沉淀劑制備的催化劑Pd/TiO2-CD的H2-TPR圖。
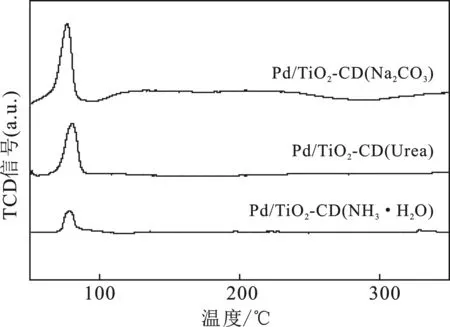
圖2 不同沉淀劑制備Pd/TiO2-CD催化劑的H2-TPR圖譜Fig.2 H2-TPR of Pd/TiO2-CD catalysts prepared by different precipitate
由圖2可知,3個催化劑均在80 ℃時出現了較大還原峰,為PdO的還原峰。可知,在TiO2和氧氣的參與下,使用不同沉淀劑制備的Pd/TiO2-CD催化劑均會形成部分氧化態的PdO活性組分。
對比3個催化劑上的PdO還原峰面積可知,催化劑的PdO還原峰面積大小順序為Pd/TiO2-CD(Na2CO3)>Pd/TiO2-CD(Urea)>Pd/TiO2-CD(NH3·H2O),可知,Pd/TiO2-CD(Na2CO3)上PdO含量最大,PdO能夠使O2分子發生非解離吸附,使得O2分子中的O—O鍵不容易發生斷裂,從而不易生成H2O,有效減少副反應的發生。
2.1.4 XRD表征 圖3為不同沉淀劑條件下制備的催化劑Pd/TiO2-CD的XRD圖。

圖3 不同沉淀劑制備的催化劑Pd/TiO2-CD的XRD圖Fig.3 XRD of Pd/TiO2-CD catalysts prepared by different precipitate
由圖3可知,在2θ=25.3,38,47.7,54.8°處3個催化劑都出現了銳鈦礦型TiO2的特征衍射峰,說明催化劑的制備過程中載體TiO2的晶型沒有發生轉變。
此外,在2θ=40.1,46.6,68.1,82.2°處3個催化劑都出現了比較弱的Pd特征衍射峰,表明3個催化劑上的活性組分主要為Pd。同時,XRD圖中沒有檢測出PdO的特征衍射峰,但從H2-TPR圖(見圖2)可知,3個催化劑都含有PdO。這是由于晶體尺寸小于5 nm的金屬(或金屬氧化物)顆粒不能被XRD檢測出,因此,可推測出3個催化劑中PdO的顆粒尺寸較小。
2.2 催化劑的活性評價
圖4為3個催化劑Pd/TiO2-CD催化H2、O2直接合成H2O2的活性評價。
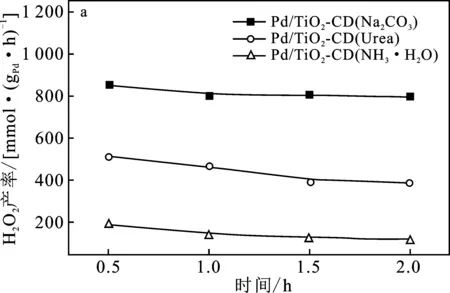
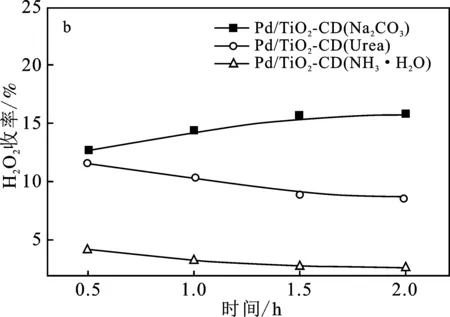
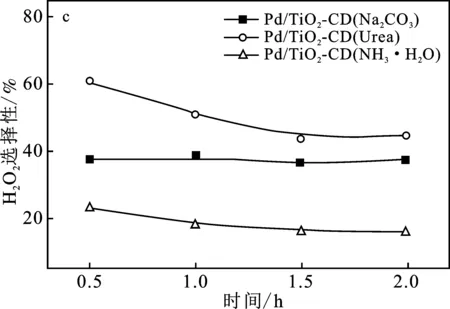

圖4 不同沉淀劑制備的催化劑Pd/TiO2-CD催化H2、O2直接合成H2O2活性評價Fig.4 The activity test of Pd/TiO2-CD catalysts prepared by different precipitate on the performance of direct synthesis of H2O2(a)H2O2產率;(b) H2O2收率;(c) H2O2選擇性;(d) H2轉化率
由圖4(a)可知,3個催化劑合成H2O2產率的大小順序是:Pd/TiO2-CD(Na2CO3) > Pd/TiO2-CD(Urea) > Pd/TiO2-CD(NH3·H2O)。可知,Pd/TiO2-CD(Na2CO3)有較好的催化性能,反應0.5 h,H2O2產率達到852.3 mmol H2O2/(gPd·h),而Pd/TiO2-CD(Urea)和Pd/TiO2-CD(NH3·H2O)催化劑在反應0.5 h時合成H2O2的產率卻分別低至517.0 mmol H2O2/(gPd·h)和187.8 mmol H2O2/(gPd·h)。這是由于Pd/TiO2-CD(Na2CO3)催化劑上活性金屬Pd的晶粒粒徑較小,僅為5.42 nm,分散度越大,提供的活性位點就越多,更有利于反應物分子在活性位點上的吸附和活化,從而提高合成H2O2的活性。此外,3個催化劑隨反應時間的增加,H2O2的產率變化較小,說明3種催化劑穩定性較好。因此,后續使用碳酸鈉溶液作為沉淀劑制備Pd/TiO2-CD催化劑進行研究。
3 結論
通過沉積-沉淀法,不同沉淀劑制備了催化劑Pd/TiO2-CD(Na2CO3)、Pd/TiO2-CD(Urea)、Pd/TiO2-CD(NH3·H2O),并使用CO 脈沖、孔結構分析、H2-TPR、XRD等表征手段分析催化劑的性質,討論催化劑對直接合過氧化氫的影響。結果表明,催化劑Pd/TiO2-CD(Na2CO3)的金屬分散度較高,Pd粒徑較小,分散度為17.22%,粒徑為5.42 nm,分散度越高,同時粒徑越小,意味著活性組分可以暴露出更多的活性位點,有利于合成過氧化氫。同時,催化劑Pd/TiO2-CD(Na2CO3)有較大的比表面積和平均孔容,比表面積為54.136 m2/g,平均孔容為0.437 cm3/g,這更加有利于反應物和生成物的進出。催化劑Pd/TiO2-CD(Na2CO3)上PdO含量最大,PdO能夠促進O2分子發生非解離吸附,使得PdO活性位上吸附的O2分子的O—O鍵不易發生斷裂,減少H2O的合成,從而提高H2O2選擇性。
當沉淀劑為Na2CO3時的催化劑Pd/TiO2-CD(Na2CO3)對直接合成過氧化氫有較好的催化性能,產率達到852.3 mmolH2O2/(gPd·h),較催化劑Pd/TiO2-CD(Urea)[517.0 mmol H2O2/(gPd·h)]和Pd/TiO2-CD(NH3·H2O)[187.8 mmol H2O2/(gPd·h)]產率最佳。

