TPGS修飾載精氨酸脫亞胺酶環糊精脂質納米粒的酶活性和藥動學研究
楊 強,馮 嬌,劉煜瑩,李開鈴,鐘彩靈,張景勍
(1. 重慶醫科大學藥學院,重慶 400016;2. 陸軍軍醫大學第二附屬醫院藥劑科,重慶 400036)
精氨酸脫亞胺酶(arginine deiminase,ADI)來源于各種微生物,如支原體、幽門螺桿菌等,是精氨酸專一水解酶,能將機體中精氨酸分解為瓜氨酸[1]。精氨酸屬于半必需氨基酸,也是腫瘤生存的營養來源之一,在正常情況下機體能夠在精氨酸琥珀酸合成酶1(argininosuccinate synthetase 1,ASS1)的參與下自主合成[2]。而在部分實體瘤中,如肝癌、黑色素瘤,腫瘤細胞由于缺乏ASS1基因而不能自主合成精氨酸,必須依賴血液循環中的外來精氨酸才能生存。ADI能將進入腫瘤微環境中的精氨酸直接分解為瓜氨酸,阻斷實體瘤的營養來源,故實體瘤對ADI誘發的營養剝奪療法敏感[3],這顯示出ADI在抗癌方面的廣闊潛力。但ADI作為典型的外來蛋白質類抗癌酶,在體內具有極不穩定、明顯的免疫原性、靶向能力差、易耐受等缺點,這嚴重限制了其臨床應用[4]。
ADI-PEG20為改良的聚乙二醇化的ADI,目前已經在多種腫瘤中進行了大量單獨或聯合使用的臨床研究,結果表明在肝癌患者中,接受ADI-PEG20協同治療后患者的中位生存期得到提高[5]。除了進行聚乙二醇化修飾外,還有研究者采用羧甲基殼聚糖來遞送ADI,通過納米粒遞送系統提高其穩定性和生物利用度[6]。但是目前尚沒有關于ADI脂質納米遞送系統的相關報道。已有研究使用羥丙基-β-環糊精脂質納米粒封裝天冬酰胺酶,以此提高了酶的生物利用度[7]。脂質體是一種常見的擬細胞膜的納米載體,具有良好的組織相容性,已用來包載尿酸酶和過氧化氫酶[8-9]。TPGS作為各國藥監局批準的安全佐劑,在藥物遞送中常作為抗藥物耐藥的有效輔料[10],且有研究表明其具有肝臟靶向性,可更有效遞送藥物至肝臟[11]。
鑒于此,我們首次制備了新型D-α-生育酚聚乙二醇琥珀酸酯修飾的載精氨酸脫亞胺酶環糊精脂質納米粒(D-α-tocopherol polyethylene glycol 1000 succinate-modified arginine deiminase cyclodextrin lipid nanoparticles,ACLN),擬解決ADI應用上的缺點。本文初步考察了ACLN的酶活性特點和體內藥代動力學行為,初步得知ACLN在包封ADI后,能夠提高ADI的酶活性和生物利用度,這為下一步研究ACLN的靜脈給藥療效奠定研究基礎。
1 材料與方法
1.1 材料與試劑重組精氨酸脫亞胺酶(來源支原體,規格:10 g·L-1,批號:20170901,重慶艾美迪生物科技有限公司);羥丙基-β-環糊精(規格:500 g,江蘇泰興新鑫醫藥輔料有限公司);Lipoid S 100(規格:25 g,德國Lipoid Gmb H公司);D-α-生育酚聚乙二醇琥珀酸酯(規格:1 g,大連美侖生物技術有限公司);L-精氨酸(規格:100 g,美國Sigma);L-瓜氨酸(規格:25 g,上海維塔化學試劑有限公司);其他試劑均為分析純。
1.2 儀器UV-2600型紫外-可見分光光度計(日本島津公司);干式恒溫器(杭州奧盛儀器有限公司);SB-1300旋轉蒸發儀(上海愛朗儀器有限公司);Zetasizer Nano ZS型粒度儀(英國馬爾文公司);JEM-1400Plus型透射電鏡(日本電子株式會社)。
1.3 實驗動物SPF級SD大鼠,體質量(220 ± 10)g,由重慶醫科大學實驗動物中心提供,使用許可證號:SYXK(渝)2016-0001。
1.4 制備采用逆相蒸發法制備TPGS修飾脂質體。稱取適量的磷脂、膽固醇和TPGS(摩爾比為1 ∶3 ∶1),加入適量二氯甲烷溶解,避光、45 ℃條件下減壓旋轉蒸發直至形成均勻薄膜。加入乙醚使薄膜溶解,再加入含多種微量金屬離子(Co2+、Ca2+、K+、Na+)的ADI的羥丙基-β-環糊精溶液,冰浴中超聲,再次旋轉蒸發除去有機溶劑,直至形成均勻的乳白色混懸液,最后通過0.22 μm濾膜即得ACLN。
1.5 酶活性
1.5.1測定方法 采用二乙酰一肟-氨基硫脲比色法測定ADI酶活性[12]。簡單來講,在酸性高溫下,精氨酸水解產物L-瓜氨酸能與二乙酰一肟-氨基硫脲反應顯紅色。精氨酸溶液置于37 ℃下水浴10 min,加入ADI或ACLN溶液,反應5 min后,混合酸-鐵溶液終止反應。加入顯色液混勻后在高溫下進行顯色反應,最后測定紫外吸收值(λ=530 nm)。1個酶活力單位是指特定條件(37 ℃、pH 6.5)下,1 min內能轉化1 μmol L-精氨酸所需的ADI的量。
1.5.2線性范圍 配制系列L-瓜氨酸標準溶液,濃度分別為0、60、70、80、90、100、110、120、130、140 mg·L-1,按“1.5.1”項下處理后,以濃度為0 mg·L-1的L-瓜氨酸標準溶液為對照,測定其它樣品在530 nm處的吸光度值,繪制標準曲線。
1.5.3重復性 配制5份低、中、高(60、100、140 mg·L-1)濃度的L-瓜氨酸標準溶液,按“1.5.1”項下方法測定吸光度值,計算測量值RSD,考察方法的重復性。
1.5.4回收率 配制“1.5.3”項溶液,同法處理后,計算測量值與實際值的比,以考察方法的準確性。
1.5.5最適溫度、pH及4℃穩定性 設置系列溫度(20-70 ℃)和系列pH(5.0-9.0)的反應體系,按照“1.5.1”的方法分別測定ADI和ACLN的酶活性,取ADI最高活性為100%,計算其他樣品的相對活性,取最大相對活力的點為最適溫度或pH。將ADI和ACLN放置在4 ℃條件下,按預設的天數取適量樣品,同“1.5.1”法計算ADI相對活性,考察穩定性。
1.5.6體外酶動力學 在特定條件下,以0.50、1.00、1.25、2.00、2.50、5.00和10.00 mmol·L-1的精氨酸溶液為底物,按“1.5.1”方法進行,計算L-瓜氨酸的量。以生成的L-瓜氨酸的量除以反應時間計算反應速度V,而L-精氨酸濃度為S,根據Lineweaver-Burk雙倒數作圖,計算ADI和ACLN的Km、Vmax值。
1.6 體內藥代動力學
1.6.1動物分組及處理 取12只♂ SD大鼠稱重后,隨機分為平均體重相似的兩組,按照80 U·kg-1分別尾靜脈給予原料藥ADI和ACLN,給藥前禁食24 h,處理整個過程中不禁水。
1.6.2樣品采集與處理方法 在給藥后168 h內的各個時間點,眼底靜脈叢取血300 μL。標本需進行抗凝處理。5 000 r·min-1離心15 min,取血漿100 μL于-80 ℃保存待用。血漿樣本用去離子水稀釋后,按“1.5.1”項下方法進行測定,計算酶的活性并繪制時間-酶活性曲線。
1.6.3數據分析 用DAS 2.1.1軟件計算主要藥代動力學參數。將游離ADI與ACLN的藥時曲線下面積AUC(0-168 h)及藥峰濃度Cmax進行方差分析,再采用雙向單側t檢驗、90%置信區間考察,達峰時間Tmax采用非參數統計Wilcoxon檢驗,評價游離ADI與ACLN相比是否具有生物等效性(α=0.05)。
2 結果
2.1 測定方法學L-瓜氨酸在60-140 mg·L-1濃度范圍內時,吸光度值與濃度呈線性相關。線性回歸方程為:A = 0.006 2 C-0.043 9,r=0.999。低、中、高濃度的L-瓜氨酸溶液測量結果RSD分別為3.55%、1.55%、1.93%,平均回收率分別為96.2%、101.4%、99.7%。結果表明,該方法重復性、準確性好,符合測定要求。
2.2 酶活性研究
2.2.1ACLN表征 ACLN為圓形或類圓形,ACLN粒徑為(201.23 ± 1.09)nm,表面電位為(-16.46 ± 0.48)mV,包封率為(59.39 ± 4.27)%。
2.2.2最適溫度、pH及4 ℃穩定性 如Fig 1A,B所示,ADI和ACLN的最適溫度均為37 ℃,最適pH均為6.5,而且在最適溫度或pH下,ACLN的活性分別為ADI的1.35和1.3倍。如Fig 1C所示,在低溫下放置約70 d后,ADI的活性幾乎消失,而ACLN酶活性保留了60%左右,表明ACLN在4 ℃條件下放置穩定性明顯高于ADI。

Fig 1 Optimum temperature, optimum pH and stability of ADI and ACLN n=3)
2.2.3體外酶學動力學 如Fig 2所示,由Lineweaver-Burk雙倒數作圖計算得到ADI和ACLN的Km值分別為0.87 mmol·L-1、0.74 mmol·L-1,Vmax值分別為53.28 μmol·L-1·min-1、62.50 μmol·L-1·min-1。ACLN的Km低于ADI酶,Vmax約為ADI的1.17倍。表明ACLN提高了酶與底物的親和性,提高了ADI酶活性。

Fig 2 Lineweaver-Burk plot of ADI and ACLN n=3)
2.3 藥動學評價
2.3.1藥動學參數 ACLN和游離酶ADI的活性-時間曲線(Fig 3)中,ADI酶活性下降隨時間較快,48 h失活。ACLN直到72 h仍然保留活性,且活性下降較ADI慢,表明了ACLN在體內被消除的速度更慢。DAS 2.1.1軟件分析得知,ADI體內代謝過程更符合非房室模型。由主要藥動學參數(Tab 1)可知,ACLN的AUC(0-168 h)和MRT(0-168 h)分別是ADI的3.81和2.69倍,ACLN的Tmax和Cmax分別是ADI的3.00和1.59倍,與游離ADI相比,ACLN的相對生物利用度為381.42%,以上結果表明,ACLN能夠延長ADI的體內滯留時間,并提高ADI的生物利用度。

Fig 3 Activity-time curves of ADI and ACLN n=6)
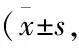
Tab 1 Non-compartment model pharmacokinetic parameters of ADI and ACLN after intravenous administration n=6)
2.3.2生物等效性 由Tab 2可見,ACLN與游離ADI的AUC(0-168 h)和Cmax的90%置信區間均不在生物等效性標準區間范圍內,對Tmax進行非參數Wilcoxon檢驗后發現ACLN與游離ADI的Tmax差異具有統計學意義(P<0.05),故而可以判定,ACLN與游離ADI不具有生物等效性,ACLN的體內生物利用度和藥效學標準更高。
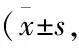
Tab 2 Bioequivalence comparison of ACLN and free ADI after intravenous administration n=6)
3 討論
ADI是一種高效、低毒的抗腫瘤蛋白類藥物,為精氨酸的專一水解酶。ADI可以消耗掉癌癥病灶中的精氨酸,進而誘發線粒體功能障礙、過度自噬、核DNA泄漏,最終導致癌細胞死亡[13]。ADI承擔的精氨酸剝奪療法能夠在多種腫瘤上發揮抗癌作用。本研究首次使用TPGS修飾的環糊精脂質體用來包載ADI,初步考察了ACLN的酶活性特點和體內藥動學行為。
本實驗中采用二乙酰一肟-氨基硫脲比色法測定ADI酶活性,方法可靠。與ADI相比,在最適溫度或pH下,ACLN的酶活性提高了約1.35和1.3倍,此外,ACLN的米氏常數低于ADI,說明ACLN對酶的親和性高于ADI。表明了TPGS修飾的環糊精脂質體包載ADI后,能夠提高ADI的酶活性。影響酶活性的因素有很多,比如超聲作用、溶液環境、基團互作等,導致蛋白結構域變構進而使酶活性中心受到影響[11]。ACLN是一種擁有環糊精中空結構的納米粒,包載ADI后并不影響酶的最佳反應條件(溫度和pH),但是在同等條件下表現出更高的酶活性,可能的原因在于:① 羥丙基-β-環糊精的疏水端與二聚體的酶的部分結構域相互作用,使得酶與環糊精組成一個復雜的超分子共和物,使得酶活性中心更暴露,與底物親和性增強[14];② 脂質體的雙分子層結構仿如質膜隔室,能夠將ADI-環糊精復合物約束在磷脂層類,而小分子量的精氨酸和催化產物瓜氨酸是不受限制的自由進出的,這種微型反應器能夠為ADI提供一個狹小獨立的反應空間,使得底物與ADI接觸的機會更大,這也是酶活性提高的可能原因。
在體內藥動學研究中,ACLN的生物利用度為ADI的3.81倍。表明將ADI包載與ACLN中,可以明顯提高藥物的生物利用度。可能原因如下:① 脂質體具有緩釋、良好的生物相容性等特點,能夠限制ADI的釋放,并阻止體內復雜環境對酶結構的直接破壞,從而延長的藥物的作用時間[8];② ACLN納米粒與酶相互作用,維持酶活性中心結構,增強其應對環境變化的能力,提高穩定性;③ TPGS是一種天然的P-gp抑制劑,能夠限制細胞將藥物從胞內轉至胞外,從而增加藥物在組織細胞中的滯留時間;④ 雙親性的TPGS可以加強對酶的包封,提高酶在機體內的穩定性[15]。綜上所述,本實驗制備的TPGS修飾環糊精脂質體提高了ADI的酶活性和生物利用度。另外,TPGS修飾脂質體具有肝臟靶向作用[11],因此可以進一步研究ACLN在肝癌細胞和動物模型上的靶向抗癌作用。
(致謝:本文實驗在重慶醫科大學藥學院高校藥物工程研究中心完成,特此致謝!)

