細菌長極性菌毛的研究進展
丁雪燕,王思權,龐勝美,常雅潔,朱國強
(1.揚州大學 獸醫學院 江蘇省動物重要疫病與人獸共患病防控協同創新中心/教育部農業與農產品安全國際合作聯合實驗室,江蘇 揚州 225009)
為了適應環境,細菌已經演化出不同的生存策略。細菌啟動感染模式通常開始于細菌附著到宿主易感細胞的表面,而菌毛在這一初始過程中發揮關鍵的作用。菌毛存在于許多革蘭陰性細菌和一些革蘭陽性細菌的表面,其對于細菌的毒力和致病性至關重要。無論是致病性還是非致病性菌株都具有多種負責不同菌毛生物合成、組裝和分泌機制的菌毛基因簇。菌毛是導致很多疾病的重要毒力因子,特別是泌尿、生殖和胃腸道感染性疾病,因此菌毛也被認為是疫苗開發的重要靶標。
長極性菌毛(long polar fimbriae,LPF)最初在鼠傷寒沙門菌(Salmonellatyphimurium,S.typhimurium)中作為一種潛在的黏附素被報道,并且與細菌的腸道定植有關,可在促進S.typhimurium黏附并侵襲宿主派氏結M細胞的同時引起IL-8的大量分泌[1-2]。TORRES等[3]曾通過Western blot試驗確定了大腸桿菌O157:H7菌株中LPF的表達,并用透射電鏡觀察到其形態。LPF屬于一種最常見的CU (chaperone/usher)菌毛類型,與經典Ⅰ型菌毛的fim操縱子結構相似,根據編碼菌毛基因簇組成的不同,將LPF分為LPF1和LPF2等2種類型。LPF1操縱子由lpfABCDE組成,LPF2操縱子則由lpfABCD編碼(部分菌株還攜帶重復的lpfD′)。與lpf2操縱子相比,lpf1操縱子多了一個編碼菌毛次要亞單位的基因lpfE[1,4]。事實上,在LPF被發現的若干年間,其介導的分子致病機制在很多細菌中得到了不斷的挖掘和探索。
本實驗室前期開展了對細菌菌毛的研究,近來集中關注了LPF分布的廣泛性和功能的多樣性。現綜述當前有關LPF的研究進展,旨在為控制與LPF相關的細菌性疾病提供參考。
1 LPF的發現和分布
LPF最初是在S.typhimurium中被發現,研究中通過Southern blot雜交技術在S.typhimurium染色體78 min處鑒定出一個7 065 bp的區域。克隆和序列分析表明該區域編碼了一個新的菌毛操縱子。當將該菌毛操縱子導入到非菌毛大腸桿菌ORN172中時,通過電鏡觀察到一種分布在細菌兩極的直徑為7~8 nm、長度為2~10 μm的長菌毛。因此,將編碼該菌毛的操縱子稱為lpf。極性分布表明,LPF不同于先前描述的Ⅰ型、Ⅲ型和GVVPQ菌毛,因為這些菌毛都是在細菌表面周身存在的(圖1)。事實上,LPF在長度、寬度和極性分布等形態上與腸桿菌科其他成員的Ⅳ型菌毛相似[1,5]。然而,對LPF蛋白一級結構分析比較表明,lpf操縱子與編碼S.typhimuriumⅠ型菌毛的fim操縱子的親緣關系比與編碼Ⅳ型菌毛的操縱子的親緣關系更加密切,而且fim操縱子和lpf操縱子具有相同的基因排列順序(圖2)[6]。后來在其他許多菌株中也發現了lpf基因或其類似物,如腸出血性大腸桿菌(enterohemorrhagicEscherichiacoli,EHEC)、黏附侵襲性大腸桿菌(adherent and invasiveEscherichiacoli,AIEC)、腸致病性大腸桿菌(enteropathogenicEscherichiacoli,EPEC)、產志賀毒素大腸桿菌(Shiga toxin-producingEscherichiacoli,STEC)、產腸毒素大腸桿菌(enterotoxigenicEscherichiacoli,ETEC)、禽致病性大腸桿菌(avian pathogenicEscherichiacoli,APEC)、致乳房炎大腸桿菌(mammary pathogenicEscherichiacoli,MPEC)、腸凝集性大腸桿菌(enteroaggregativeEscherichiacoli,EAEC)和多種大腸桿菌標準及參考菌株等[7-11]。根據操縱子的基因組成將LPF大致分為2類:LPF1和LPF2,在大多數菌株中只含有其中1種,但在少數菌株中則同時含有2種LPF(如EHEC O157:H7、EHEC O104:H4和兔特異性EPEC等)[4,12]。LPF分布的廣泛性提示其可能作為許多細菌中一個必要的輔助附屬結構,但其在其他更多菌株(尤其是對人和動物具有致病性的菌株)中的存在情況還有待進一步的鑒定和調查。
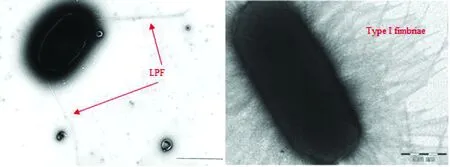
圖1 細菌的LPF和Ⅰ型菌毛在顯微鏡下的形態比較[1,13]

圖2 fim操縱子和lpf操縱子基因排列順序
2 LPF操縱子組成和各亞基的功能
菌毛一般是由一組基因簇編碼,在細菌中也稱為菌毛操縱子,負責菌毛亞基的生物發生、組裝和分泌機制。LPF1的操縱子lpf1由5或6個基因(lpfA,B,C,D和E,在某些菌株中存在重復的C')組成,而LPF2的操縱子lpf2則具有4或5個基因(lpfA,B,C,D,部分菌株中存在重復的D')(圖3)。
通過序列比較,在一些菌株中已經預測了lpf基因簇中每個基因所編碼蛋白質的功能。一般來說,LpfA是LPF的主要結構亞基,LpfB是伴侶蛋白,LpfC (LpfC')是外膜推進蛋白,LpfB和LpfC聚集在一起負責菌毛多肽鏈的有效聚合和跨膜運輸,LpfD (LpfD')是次要菌毛亞基,而LpfE可能是調節因子或次要亞基[14]。但LPF亞基的功能在不同研究中被描述的并不完全相同,因而我們要根據研究對象對其進行具體研究和識別。事實上,在一個菌毛操縱子中,并不是所有的亞基都在致病過程中發揮主要功能。例如:在K88菌毛中,FaeG亞基作為主要亞單位專門負責與宿主細胞上的受體結合,以促進K88+ETEC對豬小腸黏膜的黏附和定植,從而引起新生和斷奶仔豬發生腹瀉[15]。而在Sfm菌毛中,SfmH作為尖端黏附素對Sfm菌毛發揮功能起著決定性的作用[16]。因此,通過研究LPF菌毛蛋白結構亞單位和基因序列將有助于研發新型基因工程疫苗,阻斷宿主細胞上的菌毛受體,從而阻止細菌的黏附,有利于 LPF介導的細菌性疾病的預防和控制。
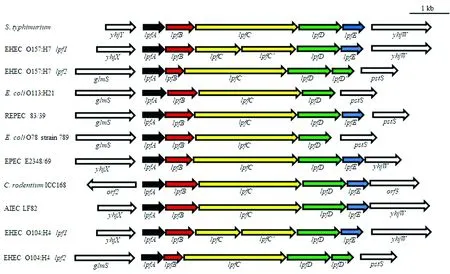
圖3 一些代表性菌株中lpf基因簇的結構和組成模式圖
3 影響LPF表達的因素
LPF的表達受到多種因素的嚴格調控,如相變(phase variation)機制、LEE編碼的調節因子(locus of enterocyte effacement-encoded regulator,Ler)和組蛋白樣類核結構蛋白(histone-like nucleoid-structuring protein,H-NS)調節機制、細菌本身的因素(如生長階段)或各種環境因素(如溫度、pH、滲透壓、鐵和膽鹽含量等)均可影響LPF的表達。
3.1 相變機制細菌通常可以通過2種機制來改變其表面的抗原特性,包括抗原變異和相變,通過相變能夠使細菌可逆性地獲取或丟失抗原。例如,相變可以調節包括LPF、Ⅰ型菌毛在內的多種不同菌毛抗原的表達。LPF的合成由一個處于開(ON)/關(OFF)狀態的“相變開關”(phase-variable genetic switch)控制,該開關調節LPF在不同組織和器官中的表達。lpf操縱子在Phase ON和Phase OFF表達狀態之間變化,導致LPF抗原表達的群體異質性[17-18]。NICHOLSON等[19]報道,受相變控制的LPF表達同時也為細菌提供了逃避不同血清型之間交叉免疫的手段,這直接支持了LPF的相變是S.typhimurium和腸炎沙門菌之間逃避交叉免疫的機制這一假說,從而使它們能夠在宿主群中共存。迄今為止,LPF的相變在沙門菌中已有很好的研究基礎,如早期對S.typhimurium的研究發現LpfA蛋白與宿主細胞的互作是調節LPF操縱子表達ON/OFF機制的關鍵[20]。但在其他細菌特別是致病菌中LPF的相變及其調控機制仍有待進一步探索。
3.2 Ler和H-NS調節機制以EHEC O157:H7的LPF1為例,H-NS結合到lpf1操縱子調控序列上沉默其轉錄,而Ler則充當抗沉默劑來抑制H-NS的功能并正向調節LPF1的表達[21]。H-NS是一種調節沉默蛋白,在結合DNA中起同型二聚體的作用,對彎曲雙鏈DNA表現出偏好。通過優先與內在彎曲的DNA相互作用,H-NS已被用作多種基因的轉錄阻遏物,特別是那些在細菌代謝和致病機理中負責環境適應性和毒力的基因[22-23]。H-NS有3個假定的結合位點,其中2個結合位點,分別稱為沉默調控序列1 (silencer regulatory sequence 1,SRS1)和沉默調控序列2(silencer regulatory sequence 2,SRS2),位于一個覆蓋了2個lpf1啟動子(P1和P2)的區域。第3個假定的H-NS結合位點位于ATG下游lpfA1基因區域內,但似乎該位點在lpfA1調節中不起作用。H-NS通過結合啟動子區域上的2個SRSs來沉默lpf1的表達,從而形成SRS-H-NS復合物以阻斷聚合酶介導的RNA轉錄(圖4)[21]。同時,Ler與Ler結合位點(Ler binding site,LBS)相互作用,LBS1和LBS2位于P1和P2啟動子的上游,LBS1與SRS1重疊,而LBS3與P1啟動子和SRS2重疊。在引發宿主細胞黏附及擦拭性損傷(A/E表型)的細菌中,Ler不僅是關鍵性因子,而且還作為除LEE以外的其他致病因子的正調控因子[24]。目前,Ler和H-NS作為轉錄調控因子的功能已經得到了很好的證實,而其他生物活性分子是否與lpf操縱子的調控機制有關有待進一步的探索。

圖4 H-NS和Ler調控的大腸桿菌O157:H7 lpfA1操縱子模型
3.3 其他可能影響LPF表達的因素除了上述調節因素,細菌本身的一些因素(如生長階段)或各種環境因素(如溫度、pH、滲透壓、鐵和膽鹽含量等),也可能影響LPF的表達。TORRES等[25-26]報道,lpf1和lpf2操縱子的表達響應于不同的生長階段和環境條件;在EHEC O157:H7中,lpf1的表達似乎受到生長時期、滲透壓和pH的影響,其最大量表達出現在pH6.5和37℃的指數生長后期。而lpf2操縱子則受到溫度、pH、膽鹽和鐵的調節,并受到鐵攝取調節蛋白(ferric-uptake-regulator,Fur)的控制,其表達在指數生長后期和鐵耗竭期間被顯著誘導。ARENAS-HERNANDEZ等[27]發現,pH值變化、膽鹽存在和鐵利用率的降低是在人類近端小腸中LPF2表達的重要環境因素。當EHEC到達遠端小腸時,鐵的可用性導致Fur結合到lpf2啟動子區域并抑制菌毛的表達。在該研究中建立的模型支持了在腸道定植過程中控制EHEC中LPF表達的分級環境信號的存在。另外,CHASSAING等[28]分析了胃腸道生長條件尤其是各種膽鹽對AIEC菌株中lpf操縱子表達的影響,發現膽鹽的存在大大提高了AIEC LF82菌株lpf操縱子的表達,并且FhlA轉錄因子是在膽鹽存在時lpf表達的關鍵細菌調節因子。因此,通過改變環境條件或細菌生長所需的各項營養指標來控制LPF的表達非常值得關注。同時也注意到在不同的細菌背景中LPF可能會對不同的條件做出反應或由不同的調節劑進行控制。
4 LPF的生物學功能
隨著對各種細菌中LPF的研究不斷探索,LPF的功能也不斷地被發現。現有證據表明,LPF在不同細菌中可能具有不同的功能,即使是在同一菌株中LPF的功能也是多方面的。
4.1 LPF促進細菌的黏附和定植大量的試驗數據表明,LPF能夠促進細菌對靶細胞和組織的黏附和定植。大腸桿菌O157:H7中lpf1操縱子的突變導致黏附在HeLa細胞上的細菌數量減少并降低微集落的形成[3]。類似地,O157:H7lpf2突變體對Caco-2細胞的黏附性有所降低,并且lpf2可能在早期黏附性中起關鍵作用[4]。JORDAN等[29]研究表明,LPF1和LPF2的突變降低了大腸桿菌O157:H7在綿羊和豬中的定植能力,其引起A/E損傷程度也有所減輕。另據報道,O157:H7菌株與lpf1和lpf2雙突變株的競爭試驗表明突變株在受試家兔腸組織中的競爭優勢明顯,證實了LPF對細菌腸道定植的促進作用[30]。與O157:H7相似,EHEC O113:H21菌株在敲除lpfA基因后喪失了對上皮細胞的黏附能力,提示LPF2在非O157分離株中也具有黏附素的作用[31]。另外,在APEC中,LPF2菌毛有助于非菌毛大腸桿菌K-12株在體外對禽肺組織和人上皮細胞的黏附作用,LPF2突變體在雞氣囊、肺和氣管中的定植也減少[32]。此外,ROSS等[33]在STEC O104:H4體內外模型中探究發現,ΔlpfA1突變體在非極化和極化腸上皮細胞上的黏附性降低,并減少了在小鼠大腸中的定植,這證實LPF1是導致O104:H4黏附和定植的致病因素之一。
那么LPF介導細菌黏附的機制如何?在S.typhimurium感染期間,LPF介導該細菌附著于宿主派氏結的M細胞[18]。FARFAN等[34]觀察到EHEC原型菌株和其他O157:H7臨床分離株能夠與腸道中最常見的細胞外基質(extracellular matrix,ECM)蛋白結合,這表明LPF是由ECM蛋白識別的,而且兩者的相互作用有助于EHEC對腸道細胞的黏附和在胃腸道內的定植。CORDONNIER等[35]還發現,LPF是EHEC O157:H7跨越人M細胞單層主動移位所必需的。與此一致的是:AIEC通過LPF1靶向小鼠和人類派氏結并在M細胞之間轉移[36]。此外,作為O157:H7中的同源菌毛,攜帶LPF1的細菌被證實通過靶向位于回腸遠端派氏結上的濾泡相關上皮細胞(follicle-associated epithelium,FAE)感染人類腸道[37-38]。然而,與Ⅰ型菌毛不同,LPF對細胞內的D-甘露糖受體并不敏感[39]。因此對LPF細胞受體的進一步識別將有助于闡明LPF介導的細菌-宿主相互作用。
4.2 LPF參與細菌生物被膜的形成在自然界中,細菌附著于有生命或無生命物體表面(如玻璃、塑料或真核細胞)被胞外大分子包裹后,可以形成復雜的三維生物被膜,從而使細菌對抗生素和宿主的免疫防御機制更具抵抗力。研究表明,LPF參與了幾個與生物被膜相關的過程,包括附著于底物、細胞間黏附和ECM的生物合成[40]。LEDEBOER等[41]研究發現,lpf突變體完全喪失了在雞腸道組織上形成生物被膜的能力,同時在組織培養細胞和塑料表面上形成生物被膜的能力也發生中等程度的喪失,從而證明LPF參與了S.typhimurium在HEp-2組織細胞和雞腸上皮細胞表面形成生物被膜的過程。ROSS等[33]研究測試了大腸桿菌O104:H4菌株中lpf操縱子突變體形成生物被膜的能力,發現lpfA1基因缺失株并不能形成穩定的生物被膜。近年來耐藥菌株逐漸增多,其中一個重要的影響因素就是生物被膜的形成,這給細菌性疾病的預防和治療工作提出了挑戰。因此,如果能夠從生物被膜的角度闡明細菌形成耐藥性的詳細機理,將有助于新抗菌藥物的開發和細菌性疾病的控制。
4.3 LPF影響細菌的組織嗜性細菌對宿主的不同組織具有不同的嗜性,其中細菌的多種毒力因子參與了此生物學過程。LPF作為細菌中存在的一種重要的毒力因子,也對細菌的組織嗜性產生一定的影響。FITZHENRY等[37]發現,大腸桿菌O157:H7 中LPF菌毛突變導致了O157:H7對近端和遠端小腸的定植并形成A/E損傷的新表型。LPF菌毛基因是在LEE區域外發現的第一個影響O157:H7人類腸道組織嗜性的基因。另外,與克羅恩病(Crohn's disease,CD)相關的71%的AIEC中存在LPF,提示LPF在AIEC的組織嗜性和毒力中起一定的作用[42-43]。由此可見,可能正是由于LPF對細菌組織嗜性的影響,從而導致其對細菌毒力造成了廣泛影響。
4.4 LPF參與誘導宿主炎癥反應VERGARA等[44]通過用EHEC O157菌株感染極化的T84細胞發現LPF1和LPF2都是重要的細菌毒力因子,參與EHEC感染相關的炎癥反應,并可以誘導IL-8的分泌和多形核中性粒細胞(polymorphonuclear neutrophils,PMNs)通過腸道單層細胞進行的遷移。作為一種重要的促炎標志物,腸道細胞高表達和分泌IL-8提示了EHEC發生感染的過程。另外,FARFAN等[45]在用STEC野生株和lpf等基因突變株感染腸道T84細胞后檢測了27種細胞因子,發現被lpfA1、lpfA2雙突變株感染的細胞分泌IL-8以及產生其他炎癥標志物的能力顯著降低。因此,與LPS、鞭毛蛋白和HCP一樣,LPF不再只是一種簡單的黏附素,而是一種影響宿主炎癥反應的必要細菌毒力。經典的LPS-TLR4和鞭毛蛋白-TLR5通路已經得到了很好的證實。HCP屬于細菌Ⅳ型菌毛家族,通過調節EHEC中的NF-κB和AP-1途徑,促進IL-8和TNF-α的分泌[46]。然而,LPF介導的促炎反應可能與NF-κB信號通路有關,因為腸道T84細胞中的NF-κB信號通路在表達LPF的STEC作用后被激活,這支持了LPF作為STEC因子介導腸道炎癥的作用[45]。此外,由于LPF在EHEC誘導的PMNs遷移中起著重要作用,所以LPF介導的炎癥反應可能參與了PMNs在乳腺內的募集和遷移,從而導致MPEC乳腺內感染時體細胞計數(somatic cell count,SCC)升高[47]。
綜上,LPF與細菌的黏附、侵襲、生物被膜形成、組織嗜性、宿主免疫等生物學過程有關,在腸細胞脫落位點 (locus of enterocyte effacement,LEE) 毒力島陰性的STEC菌株中還參與了嚴重腹瀉的發生,這些都提示LPF具有重要的科研和臨床意義。同時,沙門菌的LPF也被認為是優化沙門菌與宿主互作和新流行菌株出現的驅動因素[48]。然而LPF2不會影響EHEC O157:H7 86-24菌株對羔羊腸道外植體的黏附能力[25],這種現象可以用該菌株中具有2個lpf操縱子的事實來解釋,即其中一個lpf的突變可以被另外一個lpf操縱子所代償[49]。此外,TATSUNO等[50]發現,EPEC E2348/69菌株lpf基因簇對于感染過程中EPEC的黏附和A/E病變的形成不是必需的,C.rodentiumICC168菌株lpf基因簇也被報道在C3H/HeJ或C57BL/6小鼠感染模型中并不參與C.rodentium的毒力。由此可見,對LPF的生物學功能研究不能一概而論。因此,進一步挖掘更多菌株中LPF的功能將會有助于我們進一步全面地理解和掌握細菌的致病機理,從而更好地預防和控制細菌性疾病的發生。
5 總結和展望
細菌引起感染的首要一步,也是最關鍵的步驟就是與宿主細胞表面特定的大分子受體結合,從而啟動細菌的黏附和定植,該過程通常由暴露于細菌表面的黏附素介導。因此,菌毛黏附素被認為是疫苗開發的重要目標。自從LPF在S.typhimurium中被鑒定以來,在許多其他菌株中均發現了LPF,并且其各種功能正在被挖掘。LPF不僅作為黏附分子介導細菌和宿主間的黏附和定植,而且還參與細菌的生物被膜形成和感染組織嗜性。也發現LPF還能增強細菌對宿主細胞的定植和持久性存在并介導宿主炎癥反應。尤其在流行株EHEC O157:H7 中對其LPF進行了較為深入的探索研究,這可能為O157:H7引起疾病的預防和治療提供較好啟示。
另外,鑒于LPF的免疫原性,其在新型診斷技術的建立和基因工程疫苗的研發方面或許具有廣闊的應用前景。雖然近年來有關LPF的研究不斷深入,但仍然存在很多未知的領域。從分子水平上研究LPF與易感宿主細胞表面特異性受體結合、相互作用的精確機制將有助于開辟出阻斷細菌感染的高效途徑。同時,闡明LPF與細菌中其他毒力因子之間的協同作用或相互影響也是非常重要的。因為抵抗細菌感染的免疫保護作用通常需要多種抗原的協同參與,單一抗原一般不能對宿主提供足夠的保護。而且使用聯合抗原還可以達到廣譜的效果,還可能會增強免疫原性和交叉保護作用。然而,LPF的致病機制和免疫機理還需要進一步的揭示和闡明,從而實現更好的應用效果。

