磷脂對自微乳口服吸收、淋巴轉(zhuǎn)運(yùn)和體外特征的影響
廖恒鋒,廉春放,高越,張運(yùn),劉玉玲(中國醫(yī)學(xué)科學(xué)院,北京協(xié)和醫(yī)學(xué)院藥物研究所,天然藥物活性物質(zhì)與功能國家重點(diǎn)實(shí)驗(yàn)室,藥物傳輸技術(shù)及新型制劑北京市重點(diǎn)實(shí)驗(yàn)室,北京 100050)
自微乳化藥物遞送系統(tǒng)(SMEDDS)是一種由脂質(zhì)(油相)、表面活性劑(乳化劑)、助表面活性劑(助乳化劑)和藥物組成的均一混合物,可用于提高水難溶性藥物的生物利用度[1]。SMEDDS 口服后可在胃腸液中自發(fā)乳化為水包油型納米級乳滴,粒徑一般為10 ~300 nm[2],可通過增強(qiáng)藥物溶解度、提高藥物胃腸道黏膜滲透性和淋巴轉(zhuǎn)運(yùn)等方式改善藥物口服吸收[3]。SMEDDS 乳化后,藥物會從乳滴的油相進(jìn)入表面活性劑層,然后釋放到水相中。水相中的藥物被腸上皮細(xì)胞吸收后可通過門靜脈吸收入血,或是與脂蛋白結(jié)合形成乳糜微粒后通過腸道淋巴系統(tǒng)進(jìn)入血液循環(huán)。SMEDDS 形成的納米級乳滴也可以直接通過細(xì)胞旁路途徑、腸上皮細(xì)胞和腸道相關(guān)淋巴組織的內(nèi)吞作用進(jìn)入腸道淋巴系統(tǒng),而進(jìn)入腸道淋巴系統(tǒng)的藥物可經(jīng)腸系膜毛細(xì)淋巴管、淋巴結(jié)、乳糜池、腸干、胸導(dǎo)管等,最終在左頸靜脈和左鎖骨下靜脈的連接處匯入血液。同時(shí),由于淋巴系統(tǒng)是T、B 淋巴細(xì)胞等免疫細(xì)胞的轉(zhuǎn)運(yùn)通路,因此,與門靜脈吸收相比,藥物經(jīng)淋巴轉(zhuǎn)運(yùn)的優(yōu)勢在于不僅可避開肝臟的首過效應(yīng),而且可以增強(qiáng)免疫調(diào)節(jié)劑或化療藥物的淋巴靶向,有利于免疫調(diào)節(jié)類藥物直接作用于免疫細(xì)胞[4-8]。
為了獲得更好的乳化效果,口服自乳化制劑中通常以非離子型表面活性劑如吐溫等作為乳化劑,很少以兩親性的磷脂作為乳化劑。但有將藥物制備成磷脂復(fù)合物后再構(gòu)建SMEDDS 的報(bào)道,其目的是為了增加藥物的親脂性,提高載藥量。如Hui 等[9]報(bào)道的一種基于磷脂復(fù)合物的漢黃芩苷過飽和自乳化制劑(S-SEDDS),其載藥量遠(yuǎn)高于普通自乳化制劑(SEDDS),且粒徑從759.5 nm 減小到386.0 nm。同時(shí)相比于普通SEDDS,漢黃芩苷磷脂復(fù)合物S-SEDDS 的體外腸吸收和體內(nèi)生物利用度也顯著增加。此外,依托泊苷磷脂復(fù)合物自微乳、苦參堿磷脂復(fù)合物自微乳、桑色素磷脂復(fù)合物自微乳以及鞣花酸磷脂復(fù)合物自微乳等都取得了類似的結(jié)果[10-13]。在前期研究中,本課題組對黃芩素磷脂復(fù)合物自微乳(BA-PC-SMEDDS)進(jìn)行研究,其相對生物利用度高達(dá)448.7%(相對于黃芩素原料藥)。與傳統(tǒng)黃芩素自微乳(CBA-SMEDDS)相比,BA-PC-SMEDDS 的AUC0~t和Cmax分別提高了1.31倍和1.87 倍。而與黃芩素原料藥相比,BA-PCSMEDDS 可使黃芩素的淋巴轉(zhuǎn)運(yùn)比例從18.8%增加到70.2%[14]。
磷脂復(fù)合物中的磷脂進(jìn)入胃腸道后可被磷脂酶A2 代謝為游離脂肪酸和溶血磷脂酰膽堿,參與腸道脂蛋白的合成。在藥物淋巴轉(zhuǎn)運(yùn)的過程中,藥物可與脂蛋白的疏水性核心結(jié)合從而被攝入腸道淋巴系統(tǒng)[15]。因此推測,SMEDDS 中如加入游離磷脂,有可能對促進(jìn)吸收和促淋巴轉(zhuǎn)運(yùn)有積極作用。但關(guān)于磷脂作為聯(lián)合乳化劑對SEDDS 胃腸吸收和淋巴轉(zhuǎn)運(yùn)影響的研究相對較少。因此,本文以黃芩素為模型藥物,考察吐溫-80/磷脂為聯(lián)合乳化劑對黃芩素自微乳(BA-PC-SMEDDS)的體內(nèi)外特征影響,并與傳統(tǒng)不含磷脂的自微乳(CBA-SMEDDS)以及文獻(xiàn)報(bào)道的黃芩素磷脂復(fù)合物的自微乳(BAPCSMEDDS)[14]進(jìn)行比較,評價(jià)單純加入磷脂的效果。這對于難以形成磷脂復(fù)合物的模型藥物的自微乳制備,具有重要學(xué)術(shù)價(jià)值與實(shí)際借鑒意義。
1 材料
1.1 試藥
黃芩素(含量:98%,批號:ZL2017-01-22,南京澤朗生物科技有限公司);大豆磷脂(上海太偉藥業(yè)有限公司);油酸乙酯、吐溫-80、抗壞血酸(國藥集團(tuán)化學(xué)試劑有限公司);三羥基馬來酸甲酯、牛磺脫氧膽酸鈉(NaTDC)、豬胰腺胰脂肪酶、6-羥基黃酮(Sigma-aldrich);黃芩苷對照品(含量:98.0%,Lot:LG40S31)、放線菌酮、肝素鈉(百靈威);黃芩素對照品(含量:98.0%,上海詩丹德生物技術(shù)有限公司,Lot:5699);Transcutol HP(法國嘉法獅);乙腈、甲醇、甲酸(Fisher Chemical)為色譜純,其余試劑為分析純。
1.2 儀器
Agilent 1260 高效液相色譜儀、HPLC-MS/MS儀(安捷倫科技有限公司);NICOMPTM380ZLS型粒度儀(美國PSS 粒度儀公司)。
2 方法
2.1 黃芩素自微乳的制備
以油酸乙酯、吐溫-80 和Transcutol HP(2∶5∶3)分別作為油相、乳化劑和助乳化劑,黃芩素原料藥投料量2.2%,大豆磷脂(聯(lián)合乳化劑)投料量7.8%。按處方量稱取適量油酸乙酯(EO)、吐溫-80 和Transcutol HP 于適宜玻璃容器內(nèi),搖晃均勻,得空白自微乳濃縮液。再稱取黃芩素原料藥(BA)和大豆磷脂(PC)置空白自微乳中,并將其置于空氣浴振蕩器中(25℃,210 r·min-1),待黃芩素與大豆磷脂溶解完全后,12 000 r·min-1,離心15 min,取上清液即得黃芩素自微乳(BA-PCSMEDDS)。以不加大豆磷脂的自微乳濃縮液作為傳統(tǒng)自微乳(CBA-SMEDDS)。
2.2 黃芩素含量測定
采用高效液相色譜法(HPLC)測定BA-PCSMEDDS 和CBA-SMEDDS 中黃芩素的含量,以Agilent ZORBAX SB C18(250 mm×4.6 mm,5 μm)為色譜柱,0.05%磷酸-甲醇(35∶65,V/V)為流動(dòng)相,流速為1.0 mL·min-1,柱溫為25 ℃,進(jìn)樣量為10 μL,檢測波長275 nm。
2.3 乳化效率及粒徑、電位測定
用移液槍移取200 μL 自微乳濃縮液緩慢加入20 mL 蒸餾水中(37℃水浴,緩慢攪拌),記錄自乳化時(shí)間及外觀,并按照下列標(biāo)準(zhǔn)判斷自乳化效率的級別:Ⅰ.迅速分散乳化(時(shí)間≤1 min),形成澄清或微微泛藍(lán)的微乳;Ⅱ.迅速分散乳化(時(shí)間≤1 min),形成藍(lán)白色微乳;Ⅲ.分散乳化稍慢(時(shí)間≤2 min),形成亮白色奶狀乳劑;Ⅳ.分散乳化較慢(時(shí)間>2 min),液體呈暗灰白色,外觀略帶油狀;Ⅴ.分散乳化困難,無法形成均一體系,一直都有油滴存在。取乳化后的溶液,采用激光粒度儀測定自微乳乳滴的電位、粒徑及其分布。
2.4 濁點(diǎn)
用移液槍移取200 μL 自微乳濃縮液緩慢加入20 mL 蒸餾水中(37℃水浴,緩慢攪拌),梯度升溫(2 ℃·min-1),溶液出現(xiàn)渾濁現(xiàn)象時(shí)的溫度即為濁點(diǎn)溫度。
2.5 稀釋穩(wěn)定性
用移液槍移取適量自微乳濃縮液,按1∶5、1∶10、1∶20、1∶50、1∶100、1∶500、1∶1000的比例用適量蒸餾水稀釋乳化(37 ℃水浴,緩慢攪拌),考察不同稀釋倍數(shù)對自微乳乳化效率及乳滴粒徑的影響。
2.6 體外釋放度考察
2.6.1 不同pH 對藥物釋放的影響 取100 μL 自微乳濃縮液于5 mL 水中稀釋后,精密量取1 mL置經(jīng)純水過夜浸泡處理的透析袋內(nèi),透析袋兩端用夾子夾緊,放入盛有100 mL 釋放介質(zhì)(pH 1.0或pH 6.8)的燒杯中,于震蕩水浴鍋中37℃,100 r·min-1下攪拌,每個(gè)處方平行操作3 次,分別于0.5、1、2、4、8、12、24 h 取樣2 mL。每次取樣前攪拌充分,取樣后補(bǔ)加2 mL 釋放介質(zhì)。依法測定,計(jì)算BA-PC-SMEDDS 和CBA-SMEDDS 黃芩素的累積釋放度。
2.6.2 胰酶對藥物釋放的影響 取1 mL 自微乳置45 mL 人工腸液(2 mmol·L-1三羥基馬來酸甲酯、150 mmol·L-1氯化鈉、5 mmol·L-1氯化鈣、5 mmol·L-1牛磺脫氧膽酸鈉、1.25 mmol·L-1磷脂,pH 6.5)中稀釋乳化(37℃,緩慢攪拌1 min)。加入5 mL 豬胰酶溶液(16 mg·mL-1),體外脂解開始,精密量取1 mL 脂解液置經(jīng)純水過夜浸泡處理的透析袋內(nèi),透析袋兩端用夾子夾緊,放入盛有100 mL 釋放介質(zhì)(pH 6.5)的燒杯(250 mL)中,于震蕩水浴鍋中37℃、100 r·min-1下攪拌,每個(gè)處方平行操作3 次,分別于5、15、30、45、60、90、180 min 取樣2 mL。每次取樣前攪拌充分,取樣后補(bǔ)加2 mL 釋放介質(zhì)。照含量測定HPLC 方法,依法測定,計(jì)算BA-PC-SMEDDS 和CBASMEDDS 黃芩素的累積釋放度。
2.7 長期儲存穩(wěn)定性考察
分別制備BA-PC-SMEDDS 和CBA-SMEDDS,在4、25 和40℃條件下放置3 個(gè)月,并在0、1、2、3 個(gè)月時(shí)取樣觀察并記錄自微乳濃縮液的外觀形態(tài),測定其乳化效率和粒徑。
2.8 大鼠體內(nèi)藥代動(dòng)力學(xué)研究
雄性SD 大鼠10 只,體質(zhì)量(250±20)g,隨機(jī)分成兩組,實(shí)驗(yàn)前禁食12 h,不禁水,實(shí)驗(yàn)期間自由飲水。按40 mg·kg-1灌胃給予CBASMEDDS 和BA-PC-SMEDDS,給藥后分別于5、15、30、45、60、75、180、360、480、600、720和1440 min 眼眶后靜脈叢取血0.5 mL,置預(yù)先肝素化的1.5 mL 尖底離心管中,4000 r·min-1離心15 min,吸取上層血漿,置-80℃冰箱保存,測定前常溫放置解凍。
2.9 淋巴轉(zhuǎn)運(yùn)研究
雄性SD 大鼠10 只,體質(zhì)量(250±20)g,實(shí)驗(yàn)前禁食12 h,不禁水,實(shí)驗(yàn)期間自由飲水。隨機(jī)分成兩組,分別腹腔注射3 mg·kg-1的放線菌酮生理鹽水注射液,再于1 h 后按40 mg·kg-1劑量分別灌胃給予CBA-SMEDDS 和BA-PCSMEDDS,并 于5、15、30、45、60、75 和180 min 眼眶后靜脈叢取血0.5 mL,置預(yù)先肝素化的1.5 mL 尖底離心管中,4000 r·min-1離心15 min,吸取上層血漿,置-80℃冰箱保存,測定前常溫放置解凍。
2.10 體內(nèi)分析
2.10.1 樣品處理 取血漿100 μL,置1.5 mL 尖底離心管,加入抗壞血酸10 μL(200 mg·mL-1)、內(nèi)標(biāo)工作液20 μL(6-羥基黃酮,5 μg·mL-1),再加入300 μL 甲醇,渦旋混合60 s,于12 000 r·min-1離心10 min,然后吸取上清液,置離心管中,離心濃縮揮去溶劑(40℃),再加200 μL 甲醇-水(80∶20,V/V)溶解,渦旋30 s 后,于12 000 r·min-1離心5 min,取上清液20 μL 進(jìn)樣,按“2.10.2”項(xiàng)下色譜條件和質(zhì)譜條件測定血漿中黃芩苷藥物濃度。
2.10.2 色譜條件
① 色譜條件:色譜柱為Agilent ZORBAX SB C18柱(250 mm×4.6 mm,5 μm),進(jìn)樣體積為20 μL,柱溫為25 ℃,流動(dòng)相為乙腈-0.1%甲酸,流速為1.0 mL·min-1,采用線性梯度洗脫,洗脫程序如表1所示。
② 質(zhì)譜條件:離子源為電噴霧離子源(ESI),正離子方式檢測,多離子反應(yīng)監(jiān)測模式(MRM);霧化器壓力40 psi,干燥氣流速9 L·min-1,干燥氣溫度350℃,毛細(xì)管電壓4000 V,分流比1∶2。用于定量的MRM 檢測離子對:黃芩苷,CE18,F(xiàn)115,[M +H]+447.0 →271.1;6-羥基黃酮,CE30,F(xiàn)135,[M +H]+239.0 →137.0。

表1 梯度洗脫表Tab 1 Program of gradient elution
2.11 統(tǒng)計(jì)學(xué)方法
采用DAS 2.0 軟件計(jì)算相關(guān)藥代動(dòng)力學(xué)參數(shù),結(jié)果表示為±s。采用SPSS 17.0 軟件中獨(dú)立樣本t檢驗(yàn)進(jìn)行統(tǒng)計(jì)學(xué)分析,P<0.05 代表差異具有統(tǒng)計(jì)學(xué)意義。
3 結(jié)果
3.1 SMEDDS 質(zhì)量表征
本研究為了考察磷脂作為聯(lián)合乳化劑對黃芩素自微乳體內(nèi)外行為的影響,選擇20 mg·g-1作為兩種自微乳的載藥量。實(shí)驗(yàn)結(jié)果表明BA-PC-SMEDDS用水稀釋后,在1 min 內(nèi)乳化完全,且乳液澄清透明,靜置24 h 無相分離現(xiàn)象或藥物沉淀。BA-PCSMEDDS 和CBA-SMEDDS 的乳滴粒徑、電位及其多分散指數(shù)如表2所示,其中CBA-SMEDDS 的數(shù)據(jù)來自文獻(xiàn)[14]。由表2可知BA-PC-SMEDDS 乳化后的乳滴粒徑為(11.7±0.3)nm,其Zeta 電位(-35.63±0.58)mV 顯著高于CBA-SMEDDS 的Zeta 電位(-19.58±1.30)mV。而BA-PC-SMEDDS的多分散指數(shù)高于CBA-SMEDDS,推測可能是由于磷脂的親水親油平衡值(HLB)值(7)低于吐溫-80(15),致使SMEDDS 的乳化能力有所下降。此外,由于Zeta 電位可以反映乳滴表面電荷數(shù)量,當(dāng)乳滴表面電荷增加時(shí)可以抑制乳滴聚集增強(qiáng)微乳穩(wěn)定性,而表面電荷減小則有可能導(dǎo)致相分離[16]。因此,本實(shí)驗(yàn)結(jié)果表明磷脂作為聯(lián)合乳化劑可以增加黃芩素自微乳乳滴的表面電荷,增強(qiáng)微乳液的膠體穩(wěn)定性,避免微乳發(fā)生相分離。同時(shí),BA-PC-SMEDDS 的濁點(diǎn)溫度(71 ~75℃)高于37℃也保證了自微乳進(jìn)入胃腸道后不會發(fā)生相分離,進(jìn)而影響藥物的釋放及吸收。
將SMEDDS 用雙蒸水稀釋不同倍數(shù)后,考察自微乳乳滴粒徑變化及是否有藥物沉淀發(fā)生。結(jié)果如圖1所示,其中CBA-SMEDDS 的數(shù)據(jù)來自文獻(xiàn)[14]。當(dāng)稀釋倍數(shù)為20 ~100 倍時(shí),BA-PCSMEDDS 的乳滴粒徑無明顯變化。當(dāng)稀釋倍數(shù)小于20 倍或大于100 倍時(shí)BA-PC-SMEDDS 的乳滴粒徑小于15 nm,同時(shí)乳化后12 h 內(nèi)乳液未出現(xiàn)相分離、渾濁或藥物沉淀等現(xiàn)象。因此,結(jié)果表明BA-PC-SMEDDS 在5 ~1000 倍稀釋范圍內(nèi)均能穩(wěn)定乳化,同時(shí)從圖1中也可看出含磷脂的BA-PC-SMEDDS 的乳滴粒徑在各稀釋條件下均小于CBA-SMEDDS,說明磷脂作為聯(lián)合乳化劑可以提高黃芩素自微乳的稀釋穩(wěn)定性。
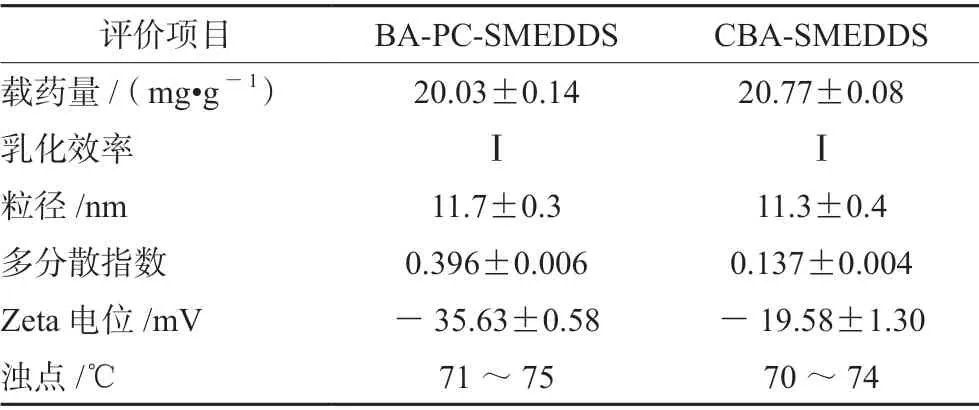
表2 BA-PC-SMEDDS 和CBA-SMEDDS 質(zhì)量評價(jià)(n =3)Tab 2 Characterization of BA-PC-SMEDDS and CBA-SMEDDS(n =3)
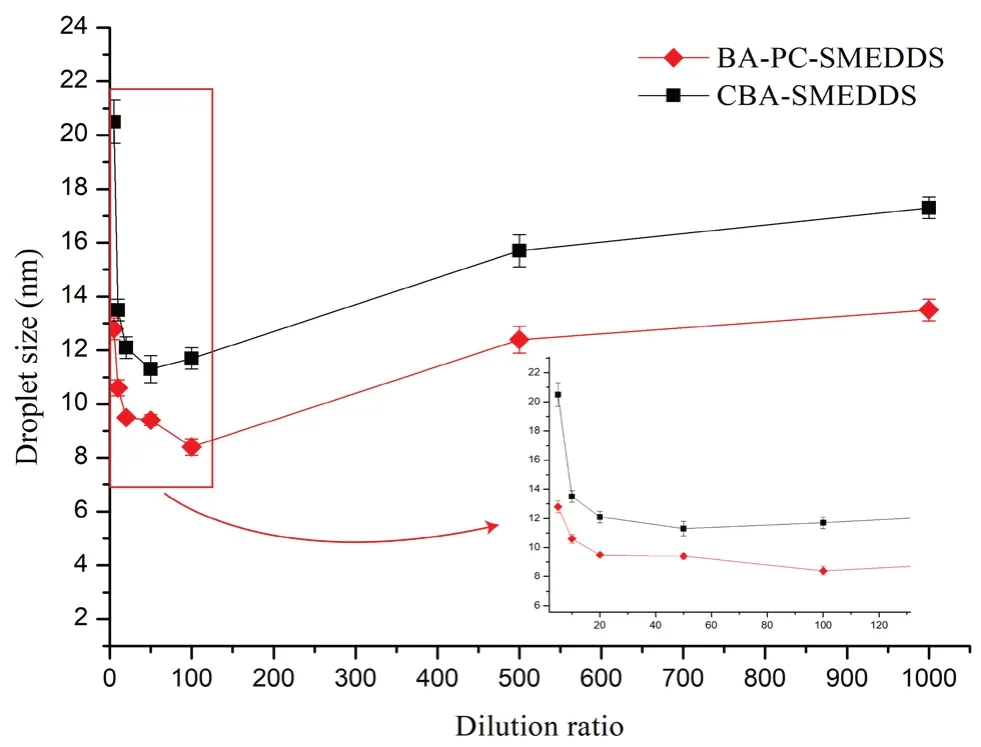
圖1 BA-PC-SMEDDS 和CBA-SMEDDS 在不同稀釋倍數(shù)下的粒徑分布(n =3)Fig 1 Size of BA-PC-SMEDDS and CBA-SMEDDS subject to different folds of dilution with purified water(n =3)
3.2 體外釋放度考察
采用透析法考察游離藥物從自微乳中的釋放,BA-PC-SMEDDS 和CBA-SMEDDS 在pH 1.0 和pH 6.8 緩沖介質(zhì)中的釋放曲線如圖2所示,其中CBASMEDDS 的數(shù)據(jù)來自于文獻(xiàn)[14]。結(jié)果表明,BAPC-SMEDDS 在開始2 h 內(nèi)釋放速度較快,2 h 后隨著時(shí)間的延長釋放速度逐漸變慢,12 h 內(nèi)的累積釋放度可達(dá)90%以上,但BA-PC-SMEDDS 和CBASMEDDS 的釋放曲線較為相似并無明顯區(qū)別。因此,可以推測磷脂的加入可能對于黃芩素自微乳體外釋藥速度并無明顯影響。此外,還考察了胰酶對自微乳體外藥物釋放的影響,如圖3所示,BAPC-SMEDDS 和CBA-SMEDDS 的釋放曲線顯示胰酶對自微乳體外釋藥速度并無明顯影響。該實(shí)驗(yàn)結(jié)果表明胰酶和人工腸液中其他成分均對自微乳中藥物釋放無明顯影響。
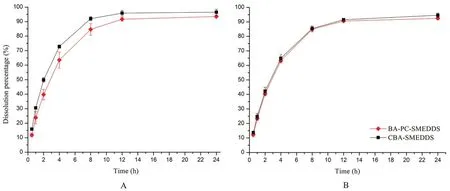
圖2 BA-PC-SMEDDS 和CBA-SMEDDS 在pH 1.0(A)和pH 6.8(B)不同介質(zhì)中的藥物釋放曲線(n =3)Fig 2 Release profile of baicalein in pH 1.0(A)and pH 6.8(B)medium from BA-PC-SMEDDS and CBA-SMEDDS(n =3)
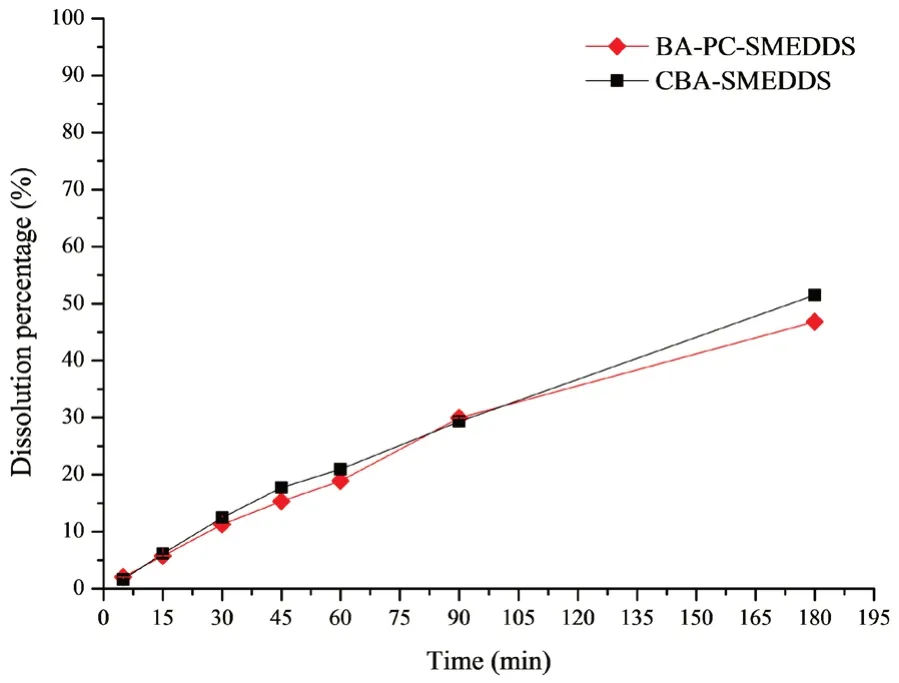
圖3 BA-PC-SMEDDS 和CBA-SMEDDS 在人工腸液中的藥物釋放曲線(n =3)Fig 3 Release profile of baicalein from BA-PC-SMEDDS and CBASMEDDS in the simulated intestinal fluid(n =3)
3.3 長期儲存穩(wěn)定性
實(shí) 驗(yàn) 表 明BA-PC-SMEDDS 在4、25 和40℃條件下放置3 個(gè)月,自微乳濃縮液均澄清透明,但傳統(tǒng)自微乳CBA-SMEDDS(數(shù)據(jù)來自文獻(xiàn)[14])在3 種條件下放置1 個(gè)月即出現(xiàn)藥物沉淀。同時(shí)BAPC-SMEDDS 在不同條件下放置后取出,均能在1 min 內(nèi)乳化完全,乳液澄清透明,其乳滴粒徑無明顯變化且均小于CBA-SMEDDS(見圖4)。因此,本實(shí)驗(yàn)表明磷脂作為聯(lián)合乳化劑有助于提高黃芩素自微乳的長期穩(wěn)定性,避免藥物析出。
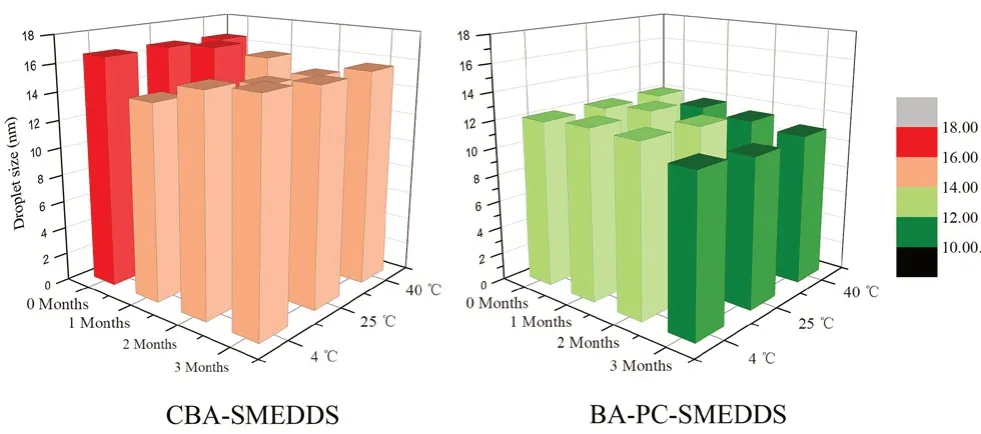
圖4 BA-PC-SMEDDS 和CBA-SMEDDS 在不同溫度下儲存3 個(gè)月后的乳滴粒徑分布Fig 4 Droplet size of BA-PC-SMEDDS and CBA-SMEDDS at different temperature for 3 months
3.4 大鼠體內(nèi)藥代動(dòng)力學(xué)研究
黃芩素口服進(jìn)入血漿后會迅速發(fā)生葡萄糖醛酸化代謝,在血漿中主要以其活性代謝產(chǎn)物黃芩苷的形式存在,而黃芩素原形藥的濃度較低。因此,我們選擇血漿中的黃芩苷對黃芩素自微乳的血漿藥代動(dòng)力學(xué)特征進(jìn)行研究。大鼠口服BA-PCSMEDDS 和CBA-SMEDDS 后,血漿中黃芩苷的濃度-時(shí)間曲線和藥代動(dòng)力學(xué)參數(shù)分別如圖5和圖6所示,其中CBA-SMEDDS 的數(shù)據(jù)來自文獻(xiàn)[14]。結(jié)果表明BA-PC-SMEDDS 的黃芩苷血漿藥物濃度顯著高于CBA-SMEDDS,Cmax為CBA-SMEDDS的1.39 倍,而AUC0~t為CBA-SMEDDS 的1.37倍。由此我們可以推測磷脂作為聯(lián)合乳化劑不僅可以增強(qiáng)自微乳的物理穩(wěn)定性而且可以進(jìn)一步提高黃芩素的口服吸收。
3.5 淋巴轉(zhuǎn)運(yùn)研究
研究表明脂溶性藥物被小腸上皮細(xì)胞吸收后可通過淋巴轉(zhuǎn)運(yùn)和門靜脈兩種途徑進(jìn)入血液循環(huán)系統(tǒng),而藥物的淋巴轉(zhuǎn)運(yùn)途徑則完全依賴于小腸上皮細(xì)胞中乳糜微粒的形成和分泌。根據(jù)文獻(xiàn)報(bào)道[17-19],乳糜微粒的分泌可以被放線菌酮完全阻斷,也就是說放線菌酮可以抑制藥物的淋巴轉(zhuǎn)運(yùn)途徑,且該效果與淋巴管插管的結(jié)果相同。根據(jù)前期體內(nèi)藥代動(dòng)力學(xué)研究的結(jié)果,發(fā)現(xiàn)黃芩素進(jìn)入血漿后會被快速代謝為黃芩苷,同時(shí)黃芩素的吸收與代謝過程主要發(fā)生在口服后3 h 內(nèi)。因此,本實(shí)驗(yàn)采用黃芩素口服后3 h 內(nèi)血漿中黃芩苷暴露量來進(jìn)行黃芩素的淋巴轉(zhuǎn)運(yùn)研究。
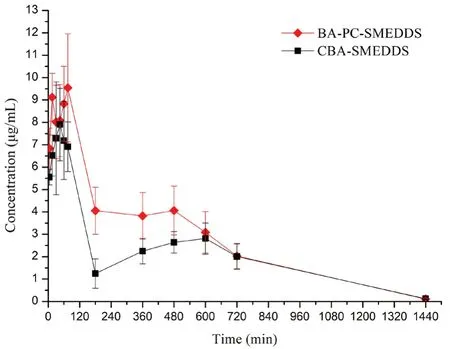
圖5 大鼠口服BA-PC-SMEDDS 和CBA-SMEDDS 后血漿中黃芩苷的藥物濃度-時(shí)間曲線(n =5)Fig 5 Mean plasma concentration-time curves of baicalin after the oral administration of BA-PC-SMEDDS and CBA-SMEDDS in rats (n =5)
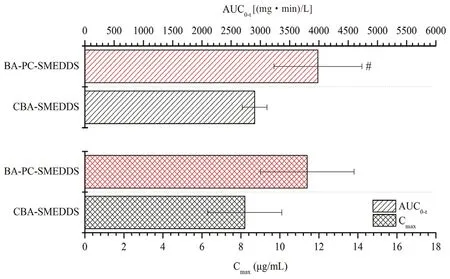
圖6 大鼠口服BA-PC-SMEDDS 和CBA-SMEDDS 后血漿中黃芩苷的藥代動(dòng)力學(xué)參數(shù)(n =5)Fig 6 Pharmacokinetic parameters of baicalin after the oral administration of BA-PC-SMEDDS and CBA-SMEDDS in rats (n =5)
未經(jīng)前處理的黃芩苷的AUC反映的是經(jīng)所有途徑吸收的黃芩素(包括門靜脈和淋巴轉(zhuǎn)運(yùn))。而腹腔注射放線菌酮后的黃芩苷AUC反映的是從除淋巴轉(zhuǎn)運(yùn)外其他途徑吸收的黃芩素,該部分黃芩素經(jīng)上皮細(xì)胞吸收后直接進(jìn)入血液循環(huán)系統(tǒng)。因此,藥物淋巴轉(zhuǎn)運(yùn)量由未經(jīng)前處理的黃芩苷血漿AUC減去腹腔注射放線菌酮后的血漿AUC計(jì)算而得,最終結(jié)果如圖7和圖8所示,其中CBA-SMEDDS 的數(shù)據(jù)來自文獻(xiàn)[14]。
藥代動(dòng)力學(xué)研究表明大鼠口服BA-PC-SMEDDS后,黃芩苷Cmax高達(dá)11.5 μg·mL-1。而從圖7中可以看出,腹腔注射放線菌酮后,BA-PC-SMEDDS 的黃芩苷血藥物濃度顯著下降,表明BA-PC-SMEDDS口服后大部分黃芩素經(jīng)淋巴轉(zhuǎn)運(yùn)進(jìn)入循環(huán)系統(tǒng)。此外,當(dāng)淋巴轉(zhuǎn)運(yùn)被完全抑制后,BA-PC-SMEDDS 和CBA-SMEDDS 的血漿藥物濃度-時(shí)間曲線除45 min和60 min 這兩個(gè)時(shí)間點(diǎn)外并無明顯區(qū)別。而圖8的結(jié)果表明,相比于傳統(tǒng)自微乳,磷脂可以將黃芩素口服吸收后的淋巴轉(zhuǎn)運(yùn)程度從56.2%提高到68.6%。由此可以推斷,磷脂作為聯(lián)合乳化劑主要是通過增強(qiáng)黃芩素的淋巴轉(zhuǎn)運(yùn)來提高自微乳口服吸收。而在45 min 和60 min這兩個(gè)時(shí)間點(diǎn)BA-PC-SMEDDS 的血藥濃度略高于CBA-SMEDDS,可能是由于磷脂為細(xì)胞膜的主要成分,BA-PC-SMEDDS 中磷脂的加入可以提高乳滴與細(xì)胞膜的生物相容性從而促進(jìn)腸上皮細(xì)胞對乳滴的攝取,使得BA-PC-SMEDDS 的血藥濃度略有增加。
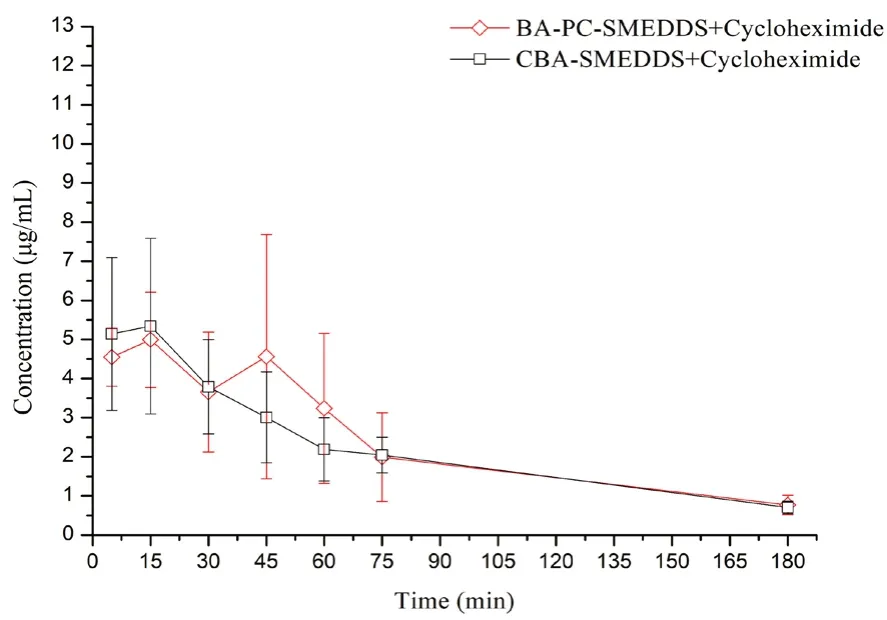
圖7 腹腔注射3.0 mg·kg-1 放線菌酮的大鼠口服BA-PC-SMEDDS和CBA-SMEDDS 后3 h 內(nèi)血漿中黃芩苷的藥物濃度-時(shí)間曲線(n=5)Fig 7 Mean plasma concentration-time curves of baicalin in rats within 3 h after the intraperitoneal pretreatment with 3.0 mg·kg- 1 cycloheximide following oral administration of BA-PC-SMEDDS and CBA-SMEDDS(n =5)
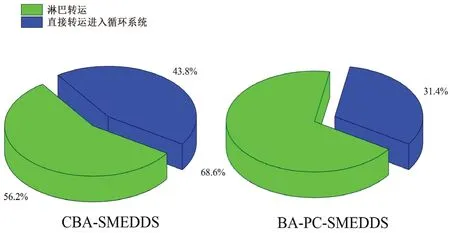
圖8 大鼠口服CBA-SMEDDS 和BA-PC-SMEDDS 后直接轉(zhuǎn)運(yùn)進(jìn)入循環(huán)系統(tǒng)的黃芩素和通過淋巴轉(zhuǎn)運(yùn)間接進(jìn)入循環(huán)系統(tǒng)的黃芩素Fig 8 Fraction of baicalein transported directly to the systemic blood circulation and fraction of baicalein transported indirectly to the systemic blood circulation via intestinal lymphatic system after the oral administration of CBA-SMEDDS and BA-PC-SMEDDS
4 討論
磷脂是一類具有兩親性的脂類分子,在結(jié)構(gòu)上由兩個(gè)疏水性的脂肪酸鏈“尾部”和一個(gè)親水性的磷酸基團(tuán)“頭部”組成,在水中可形成脂質(zhì)雙分子層。同時(shí),磷脂也可被用作乳化劑和表面活性劑,以及參與細(xì)胞膜的組裝和脂蛋白轉(zhuǎn)運(yùn)等過程。在藥物遞送系統(tǒng)中的磷脂可通過以下機(jī)制改善藥物吸收,如改變藥物釋放、促進(jìn)淋巴轉(zhuǎn)運(yùn)、降低藥物毒副作用、促進(jìn)經(jīng)皮滲透,以及作為增溶劑、表面活性劑、抗氧劑、滲透促進(jìn)劑等[20]。
在本研究中,磷脂作為聯(lián)合乳化劑可以通過對藥物的增溶作用顯著改善黃芩素SMEDDS 的儲存穩(wěn)定性,抑制儲存過程中藥物的析出。同時(shí),由于磷脂的親水性頭部由帶負(fù)電荷的磷酸基團(tuán)組成,含磷脂的SMEDDS 乳化后其乳滴顯示出更高的表面電荷,有利于減少微乳液中乳滴的積聚和相分離,提高自微乳的膠體穩(wěn)定性和稀釋穩(wěn)定性。同時(shí),磷脂可在磷脂酶的作用下水解產(chǎn)生游離脂肪酸,而游離脂肪酸被小腸上皮細(xì)胞吸收后可以再合成為甘油三酸酯,并與磷脂、膽固醇、載脂蛋白等合成腸道脂蛋白。在藥物淋巴轉(zhuǎn)運(yùn)的過程中,藥物可通過與這些脂蛋白的疏水性核心結(jié)合而被攝入腸道淋巴系統(tǒng)。因此,磷脂及其水解產(chǎn)生的脂肪酸可以通過促進(jìn)脂蛋白的生成來促進(jìn)藥物的淋巴轉(zhuǎn)運(yùn)。此外,磷脂作為細(xì)胞膜的重要組成部分,可提高腸上皮細(xì)胞膜的流動(dòng)性,從而增加藥物或載體的膜滲透性。因此,磷脂作為聯(lián)合乳化劑不僅可以通過提高藥物及乳滴的滲透性改善藥物的胃腸吸收,還可以通過增強(qiáng)藥物的淋巴轉(zhuǎn)運(yùn)提高藥物的生物利用度。
綜上所述,本研究表明磷脂可以通過一系列的機(jī)制提高自微乳的儲存穩(wěn)定性、生物利用度和淋巴轉(zhuǎn)運(yùn)。同時(shí),與黃芩素原料藥(pH 1.0 和pH 6.8 的釋放介質(zhì)中24 h 累積釋放度僅能達(dá)到60%和40%[14])相比,BA-PC-SMEDDS 的釋藥速度和程度顯著增加,BA-PC-SMEDDS 的Cmax也為原料藥的5.7 倍,相對生物利用度更高達(dá)470%[14]。這也表明BA-PC-SMEDDS 可以顯著改善黃芩素的體內(nèi)外釋放特征,有利于藥物的口服吸收。雖然與文獻(xiàn)報(bào)道的BAPC-SMEDDS 相比,本研究中BA-PC-SMEDDS 的Cmax僅 為BAPC-SMEDDS的74%,淋巴轉(zhuǎn)運(yùn)也略低于BAPC-SMEDDS[14]。但本研究表明處方中使用磷脂作為聯(lián)合乳化劑對于難以形成磷脂復(fù)合物的難溶性藥物的自微乳制備,仍然具有重要的學(xué)術(shù)價(jià)值與實(shí)際借鑒意義。

