Box-Behnken設計優化陽離子交換色譜分離牛初乳中乳鐵蛋白的工藝研究
劉佳欣,賀夢瑤 ,湯興楠,欒凱雯
(沈陽化工大學制藥與生物工程學院,遼寧 沈陽 110142)
乳鐵蛋白(Lactoferrin,LF)是一種鐵結合性糖蛋白,相對分子質量約為 80 kDa[1],最早是由Sorensen(1939)在牛乳中一個未知的“紅色組分”中發現[2]。乳鐵蛋白在乳中的含量最為豐富,特別是在初乳中含量較高,人初乳中乳鐵蛋白的質量濃度可達到7 mg·mL-1,牛初乳中乳鐵蛋白的質量濃度平均為1 mg·mL-1[3]。
乳鐵蛋白作為多功能糖蛋白具有多種生物活性,抗病毒、抗癌[4]、抗氧化、調節機體免疫反應[5],還具有抑菌功能[6-7],對腸道菌群的有一定調節作用。目前分離乳鐵蛋白的方法有很多種,如凝膠過濾層析法、膜分離法,親和色譜法[8-10]等。凝膠過濾層析操作簡便所需設備簡單,并且層析所用的凝膠屬于惰性載體,不會影響分離物。但凝膠過濾層析對流速要求較高,且對于分子量相差不多的物質難以達到很好的分離效果[11]。由于LF 的熱穩定性差,而膜分離法是一個不需要加熱,并且不需要化學試劑的分離方法,因此可以最大限度地保持LF 的生物活性,但膜容易堵塞,不易清洗,分離成本高[12-13]。親和色譜法是一種新興的分離技術,該技術通過利用固定相的結合特性實現對分子的分離,抗體與抗原作用專一性高、親和力強,可實現一步分離.但操作費用昂貴,不能用于工業化[14]。本試驗試驗采用陽離子交換色譜CM-Sepharose fast flow 分離牛初乳中的乳鐵蛋白,并對其分離條件進行優化,得到最佳的分離條件。
1 材料與方法
1.1 材料與試劑
95%乳鐵蛋白,biotopped 公司;牛初乳,木蘭花乳業奶牛養殖場;CM-Sepharose fast flow 5 mL,通用電氣公司;鹽酸,磷酸二氫鈉,磷酸氫二鈉,均為分析純,西隴化工股份有限公司。
1.2 儀器與設備
AKTA purifier,通用電氣公司;高速冷凍離心機,賽默飛世爾科技有限公司;Synergy2 多功能酶標儀,美國伯騰儀器有限公司;HH4 型數顯恒溫水浴鍋, 金壇市天瑞儀器有限公司;GB1302 型電子精密天平,梅特勒托利多儀器公司;SHZ-D (Ⅲ)循環水式真空泵,鞏義市予華儀器責任公司。
1.3 試驗方法
1.3.1 樣品預處理
將牛初乳裝入100 mL 離心管中,以10 000 r·min-14 ℃離心30 min,除去上層脂肪;加入1 mol·L-1的稀鹽酸,緩慢添加調至牛初乳溶液pH 為4.6,水浴加熱40 ℃,保溫30 min,然后放入高速冷凍離心機中,以10 000 r·min-140 ℃離心30 min,保留上層乳清蛋白,將得到乳清蛋白溶液;
進行抽濾,得到的粗樣品,用0.45μm 的微孔濾膜過濾,得到純凈的樣品。
1.3.2 色譜條件
色譜柱:CM-sepharose fast flow 預裝柱5 mL;流動相:A 溶液(pH 值為7.0,濃度為0.02 mol·L-1的磷酸緩沖鹽溶液);B 溶液(pH 值為7.0,濃度為1 mol·L-1NaCl 混合溶液);洗脫速度1 mL·min-1;進樣量: 1 mL,上樣速度1 mL·L-1;紫外檢測器,檢測波長280 nm、475 nm。
1.4 單因素試驗
以起始緩沖液pH7、洗脫液濃度1 mol·L-1、洗脫速度1 mL·min-1、上樣速度1 mL·min-1為基本條件,通過改變單一因素來探討其對乳鐵蛋白得率的影響。起始緩沖液分別為6.0、6.5、7、7.5、8.0;洗脫液濃度0.6、0.8、1.0、1.2、1.4 mol·L-1、洗脫速度0.4、0.6、0.8、1.0、1.2 mL·min-1; 上樣速度0.4、0.6、0.8、1.0、1.2 mL·min-1。
1.5 響應面優化試驗
在單因素試驗的基礎上,根據Box-Behnken 試驗設計原理,采用Design-Expert 軟件,以乳鐵蛋白的得率為影響值進行響應面優化,響應面因素和水平見表1。
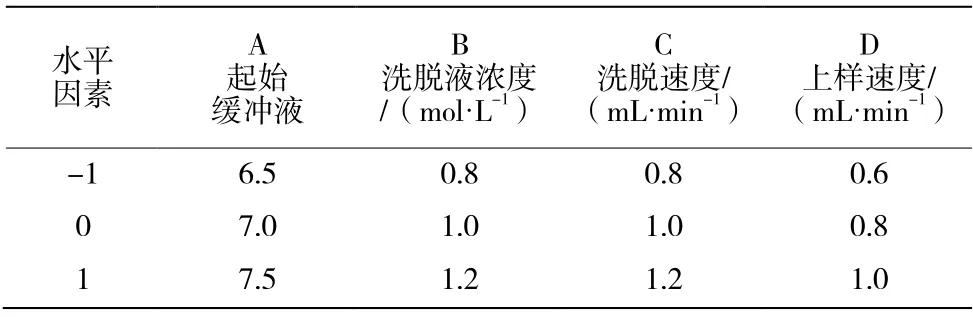
表1 響應面因素和水平表
1.6 乳鐵蛋白得率的測定方法
乳鐵蛋白得率(%)=乳鐵蛋白峰面積÷總蛋白峰面積×100%。
1.7 數據分析
所有試驗設置3 次重復,并通過SPSS17.0 軟件統計進行數據方差分析,p<0.01 差異具有顯著統計學意義,試驗結果用作圖軟件origin9.0 繪圖。
2 結果與分析
2.1 穿透曲線的繪制
標準乳鐵蛋白的在CM-Sepharose fast flow 離子交換色譜上的穿透曲線如圖 1。試驗在流速1 mL·min-1下進樣, 由圖1 可見上樣體積達到1 mL時達到穿透點, 2 mL 左右CM-Sepharose fast flow 離子交換色譜吸附基本達到飽和,之后吸附作用開始減弱,由此計算得到, 進樣2 mL 左右可以使預裝柱充分吸附, 因此確定最大上樣量為100 μg·mL-1。
2.2 單因素試驗結果
2.2.1 起始緩沖液pH 對乳鐵蛋白得率的影響
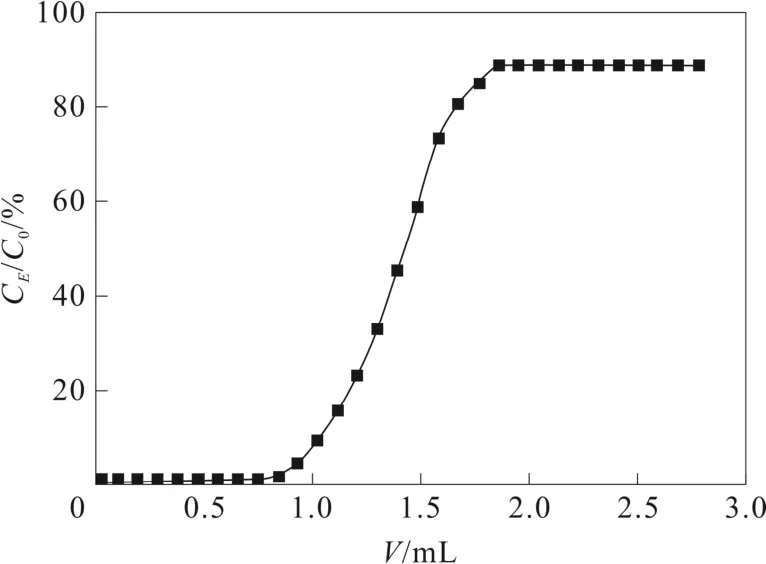
圖1 CM-Sepharose fast flow 穿透曲線
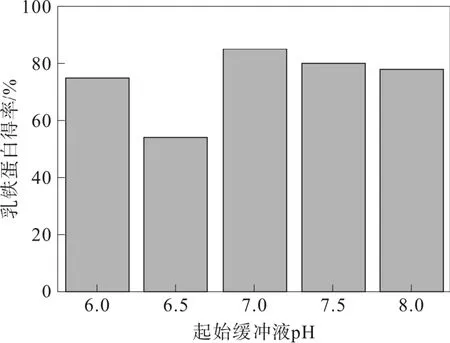
圖2 起始緩沖液對乳鐵蛋白得率的影響
當起始緩沖液pH 在6.0~6.5 時,乳鐵蛋白得率降低,見圖2,這是因為當起始緩沖液pH 值為6.5時,洗脫時需要高濃度的鹽溶液才可以將乳鐵蛋白洗脫下來,因此乳鐵蛋白得率降低。當起始緩沖液的 pH 為 8.0 時, 乳鐵蛋白基本無法吸附在CM-Sepharose fast flow 色譜柱上,乳鐵蛋白會與部分雜蛋白等組分一起率先被洗脫下來,此時的乳鐵蛋白得率不高[15-16]。
2.2.2 洗脫液濃度對乳鐵蛋白得率的影響
洗脫液NaCl 濃度在0.6~1.0 mol·L-1時,洗脫液濃度越大,乳鐵蛋白得率越高,當洗脫液濃度為 0.8 mol·L-1時乳鐵蛋白得率最高,見圖3。當洗脫液濃度繼續升高,乳鐵蛋白得率下降,這可能是因為少部分乳過氧化物酶被洗脫下來。乳過氧化物酶等電點9.0,高于乳鐵蛋白的等電點,與離子交換介質的相互作用力強于乳鐵蛋白。洗脫液濃度過大,乳過氧化物酶的相互作用力減弱,也被洗脫下來,導致乳鐵蛋白得率降低[17-19]。
2.2.3 洗脫速度對乳鐵蛋白得率的影響
由圖4 可以發現,洗脫速率為 1.0 mL·min-1的情況下,得到乳鐵蛋白得率最高,而低于或高于此濃度的洗脫流速情況下,CM-Sephadrose fast flow 色譜柱吸附乳鐵蛋白的未能及時被洗脫下來,使得乳鐵蛋白得率低。
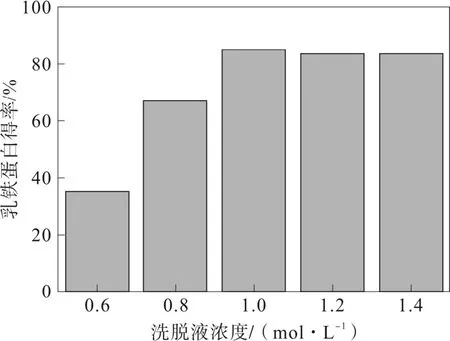
圖3 洗脫液濃度對乳鐵蛋白得率的影響
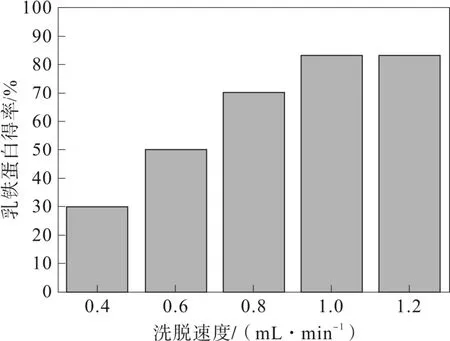
圖4 洗脫速度對乳鐵蛋白得率的影響
2.2.4 上樣速度對乳鐵蛋白得率的影響
上樣速率在 0.4~0.8 mL·min-1時,上樣速率對乳鐵蛋白得率無明顯影響,上樣液中的乳鐵蛋白可以充分擴散到CM-Sepharose fast flow 色譜柱表面。上樣速率超過0.8 mL·min-1后,乳鐵蛋白的得率開始下降,這是因為上樣速率過快,樣品中的乳鐵蛋白未及時被離子交換劑表面吸附就從層析柱中沖出,造成乳鐵蛋白流失[20-22]。
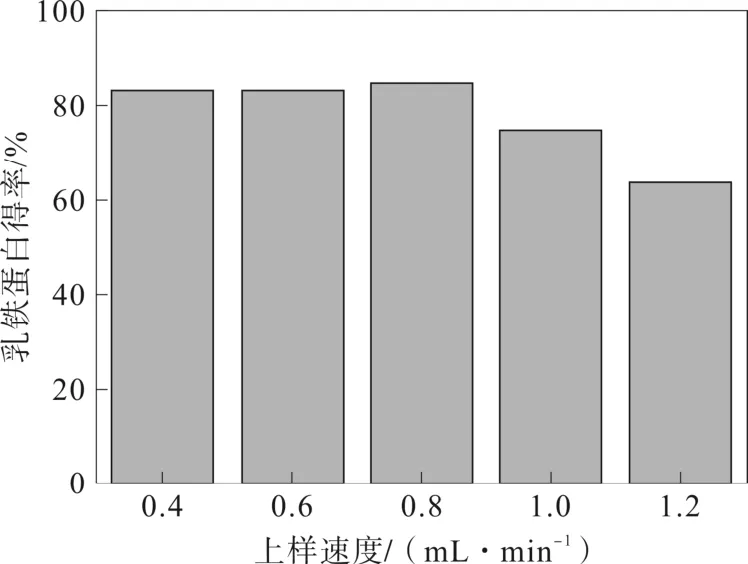
圖5 上樣速度對乳鐵蛋白得率的影響
2.3 響應面優化試驗結果
2.3.1 回歸模型的構建及方差分析
乳鐵蛋白分離試驗設計方案以及結果見表2,回歸方差分析見表3,擬合所得多元二次回歸方程Y=84.94+0.33A+0.36B+0.23C+0.14D+0.29AB-0.49A C+0.32AD+0.39CD-2.62A2-2.50B2-1.51C2-0.98D2。
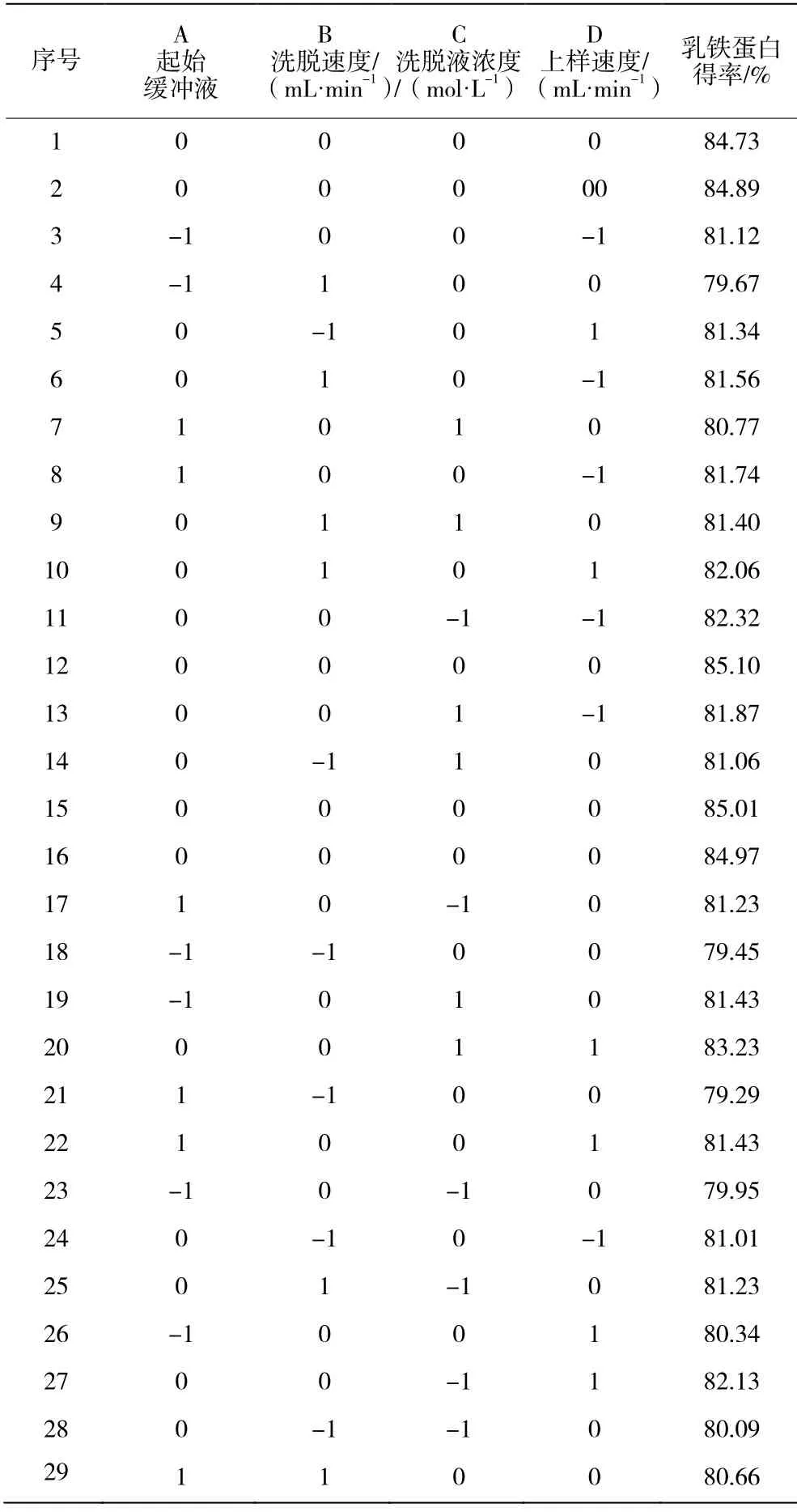
表2 響應面試驗設計和試驗結果
由表3 數據可知,該回歸模型達到極顯著水平(p<0.01),說明該方法是可靠的;失擬項不顯著,R2=0.987 9,表明此模型的擬合程度良好,乳鐵蛋白得率可以用該模型進行分析和預測。通過對比表3中的F值可以看出,影響乳鐵蛋白得率的主次順序為:B>A>C>D,即洗脫速度>起始緩沖液pH>洗脫液濃度>上樣濃度。
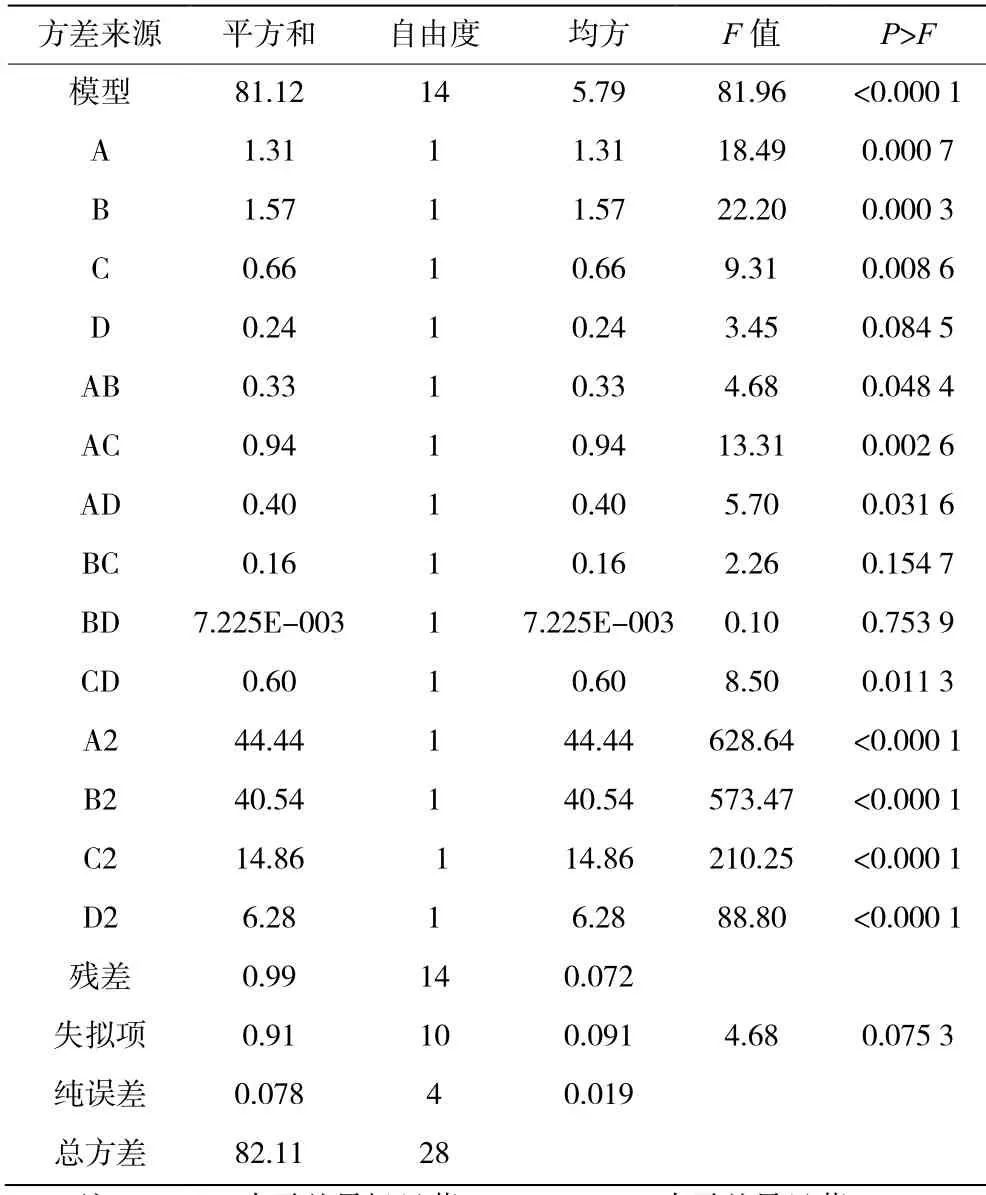
表3 回歸模型方差分析表
2.3.2 各因素之間的交互作用
根據回歸方程做出的各兩因素交互作用的響應面分析圖見圖6。起始緩沖液pH(A)和洗脫速度(B)交互作用對乳鐵蛋白得率的影響顯著。起始緩沖液pH(A)和洗脫液濃度(C)交互作用對乳鐵蛋白的得率的影響顯著。洗脫液濃度(C)和上樣速度(D)交互作用對乳鐵蛋白得率的影響顯著。
2.3.3 最優條件的確定及驗證實驗
用Design-Expert8.06 軟件對二次多項式回歸方程進行計算,得到陽離子交換色譜法分離乳鐵蛋白的最優制備工藝條件為:起始緩沖液pH7.03,洗脫速度1.01 mL·min-1, 洗脫液濃度1.01 mol·mL-1, 上樣速度0.82 mL·min-1, 乳鐵蛋白得率的理論最優值為84.98%。參照此條件進行驗證試驗,得到乳鐵蛋白得率為84.43%,理論值的相對誤差為0.55%,說明該方法具有一定的實際可操作性。
3 討論
乳鐵蛋白作為一種新興功能性食品配料,具有很高的營養價值。

圖6 各兩因素交互作用的響應面
近年來,乳鐵蛋白的分離純化工藝不斷提高,已成功應用于酸奶、嬰幼兒配方奶粉等產品中[23]。楊安樹[24]等采用 CM-Sepharose fast flow 陽離子交換柱對經脫脂、酪蛋白沉淀及超濾后的預處理樣品進行進一步分離,得到純度為95%的乳鐵蛋白。任璐等[25]對流動相不同pH 值對分離效果的影響作了分析并得出相似結論,pH 值在7.0~7.3 之間的流動相較為適宜,能夠較好地分離LF 與其他雜蛋白。可見通過此方法能很好地分離牛初乳中的乳鐵蛋白,為乳鐵蛋白的純化奠定了基礎。

