不同細胞病理學分級標準對超聲內鏡引導下細針穿刺診斷胰腺癌的影響
孟海輪, 李素文, 宋育林, 鮑峻峻, 劉 衡, 梅 俏
安徽醫科大學第一附屬醫院 消化內科, 合肥 230022
由于胰腺解剖位置特殊,胰腺癌患者早期多無癥狀,一經發現已進入中晚期,外科手術是胰腺癌的有效治療方法。但外科手術創傷大,術后生活質量差,因此早期診斷具有重要意義。胰腺癌診斷方法包括CT、MRI等影像學檢查,有助于精確分級和確定可切除狀態,但此類檢查方法敏感度不高,早期胰腺癌檢出率較低,同時難以獲得病理學診斷[1-2]。超聲內鏡(EUS)是近年來用于胰腺病變檢查的重要技術,不僅可以獲得近距離的高分辨率圖像,同時可以通過超聲內鏡引導下細針穿刺(EUS-FNA)獲得細胞病理學結果,明確胰腺病變性質[3-4]。EUS-FNA可以顯著提高胰腺癌診斷的準確性,具有較好的敏感度和特異度[5]。Eltoum等[6]研究發現,自引入EUS-FNA技術以來,通過獲取胰腺細胞病理學方法診斷胰腺病變的病例數越來越多,依靠細胞學診斷結果進行后續治療的胰腺病變比例從19%上升至51%;同時未進行細胞學檢查,僅依靠獲取胰腺手術病理診斷胰腺病變的比例從56%降低到23%。不同細胞病理學診斷標準可能影響EUS-FNA診斷胰腺腫瘤的準確程度[7]。Hewitt等[8]對胰腺病變EUS-FNA進行薈萃分析顯示,EUS-FNA診斷胰腺腫瘤具有較高的敏感度和特異度。當采用癌細胞作為陽性結果時,敏感度為85%,特異度為98%;當采用異型細胞、疑癌細胞和癌細胞作為陽性結果時,合并敏感度為91%,合并特異度為94%。因內鏡醫師操作和病理醫師診斷水平差異的影響,提高EUS-FNA對于胰腺占位性病變診斷的準確率是目前研究的熱點[7]。因此,本研究通過收集胰腺占位患者EUS-FNA的臨床資料并進行相關分析,采用不同細胞病理學診斷標準,探討EUS-FNA診斷胰腺癌的臨床效能。
1 資料與方法
1.1 研究對象 選取2011年5月—2019年3月本院收治并進行EUS-FNA檢查的胰腺占位患者。記錄患者一般資料,包括性別、年齡、吸煙史、飲酒史、糖尿病、胰腺炎病史、臨床表現、肝功能和腫瘤標志物等;EUS、CT等影像學資料以及EUS-FNA細胞病理學結果。隨訪時間為1年以上。
1.2 納入標準與排除標準 納入標準:(1)患者以腹痛、黃疸、乏力等癥狀就診,疑診胰腺占位病變;(2)患者均行EUS-FNA細胞學檢查;(3)所有患者簽署相關知情同意書;(4)患者術前均無胰腺手術或放化療治療史。排除標準:(1)EUS檢查禁忌證;(2)合并嚴重心、肺功能不全,難以耐受EUS-FNA檢查;(3)合并嚴重凝血功能障礙;(4)合并精神和意識障礙;(5)EUS-FNA獲取的胰腺標本量不充分,不足以進行病理學診斷。
1.3 方法
1.3.1 EUS檢查 所有患者行EUS術前均完善常規檢查,術前禁食12 h、禁水4 h。部分患者采用丙泊酚聯合芬太尼靜脈推注麻醉;部分患者術前30 min肌注哌替啶50 mg、地西泮10 mg。常規進鏡明確病變位置,調整EUS探頭顯示胰腺病變,記錄胰腺病變部位、形態、回聲、大小、邊界,胰管和膽總管是否擴張,周圍淋巴結,以及病變與血管的毗鄰關系等。
1.3.2 EUS-FNA檢查 所有EUS-FNA操作均由消化內科專職醫師完成。EUS定位掃查胰腺病灶,注意避開血管,選擇合適進針角度及深度,超聲實時監測下完成EUS-FNA。所用穿刺針為美國Wilson-Cook Medical生產的 ECHO 19/22G穿刺針。將穿刺針穿刺至病灶內,拔除針芯,連接10 ml負壓注射器常規穿刺。觀察穿刺點出血停止后退鏡。穿刺針所得組織涂片經HE染色后細胞學檢查。患者常規禁食24 h,監測生命體征。由病理科專職醫師完成細胞病理學檢查,細胞病理學診斷標準采用巴氏標準[5]:(1)癌細胞;(2)疑癌細胞;(3)異型細胞;(4)未見腫瘤細胞(包括炎細胞和正常上皮細胞等)。
1.4 診斷標準 行手術治療患者,最終診斷以手術病理結果為準。未行手術治療,相關輔助檢查(如PET-CT、CA19-9、CEA)等提示胰腺癌并且隨訪期間死亡的患者,最終診斷為胰腺癌[9-10];未行手術治療并且隨訪期間存活的患者,最終診斷為非胰腺癌。
1.5 倫理學審查 本研究方案經由安徽醫科大學第一附屬醫院倫理委員會審批,批號:PJ2018-12-17,所有患者均簽署知情同意書。
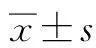
2 結果
2.1 一般資料 共收治胰腺占位患者256例,剔除失訪67例,最終納入研究189例,按巴氏細胞病理學標準,EUS-FNA診斷細胞病理學結果為異型細胞47例,疑癌細胞25例,癌細胞20例,未見腫瘤細胞97例。其中133例為胰腺癌(胰腺癌組),包括經術后病理證實者22例和臨床檢查結果為胰腺癌且隨訪期間死亡者111例;56例為非胰腺癌(非胰腺癌組)。兩組患者年齡、發生胰腺炎比例、PLT、DBil、GGT、CA19-9、CEA比較,差異均有統計學意義(P值均<0.05)(表1)。

表1 胰腺癌與非胰腺癌組患者的臨床特征比較
22例胰腺癌組術后獲得病理診斷的患者中胰腺導管腺癌16例(細胞學陽性11例,陰性5例),胰腺囊腺癌2例(細胞學均陽性),導管內乳頭狀黏液癌3例(細胞學陽性2例,陰性1例),乳頭狀囊腺癌1例(細胞學陰性)。其余167例患者未行手術治療,其中放化療63例,未做任何積極治療104例。
胰腺癌組中假陰性患者共52例,其中年齡>70歲45例,肝功能損害和CA19-9升高不明顯;年齡<70歲7例,肝功能損害和CA19-9升高明顯,患者多因高齡體弱,拒絕放化療及手術治療。非胰腺癌組中假陽性11例,多有慢性胰腺炎病史,肝功能正常或輕度異常,CA19-9無明顯升高等。
2.2 兩組患者EUS特征比較 189例患者中,病變位于胰頭部116例,胰體尾部73例。EUS顯示為實性病變145例(76.7%),囊性/囊實性病變44例。胰腺癌患者的EUS多表現為胰腺不均質低回聲占位,以實性包塊為主,病變邊界不規則,胰管擴張顯著;非胰腺癌患者EUS多表現為胰腺囊性或囊實性病變,回聲不均勻,病變邊界相對清晰,胰管多不擴張(表2)。

表2 胰腺癌與非胰腺癌組患者EUS特征比較
2.3 采用不同細胞學分級標準對EUS-FNA胰腺癌診斷效能的影響 189例患者中胰腺癌患者133例,EUS-FNA細胞病理學檢查結果分別為:未見腫瘤細胞52例,異型細胞36例,疑癌細胞25例,癌細胞20例。按照診斷金標準,EUS-FNA細胞病理學診斷胰腺癌效能結果如圖1所示,ROC曲線下面積(AUC)為0.643(95%CI:0.561~0.724)。

圖1 EUS-FNA診斷胰腺癌的ROC曲線
聯合不同的細胞病理學分級標準,即分別以“發現異型細胞或可疑癌細胞或癌細胞均為陽性”“發現可疑癌細胞或癌細胞均為陽性”和“發現癌細胞為陽性”為診斷標準進行分析[6],結果顯示,以“發現異型細胞或可疑癌細胞或癌細胞均為陽性”為診斷標準,EUS-FNA診斷胰腺癌的效能最顯著,敏感度為50.38%,特異度為75.00%(表3)。
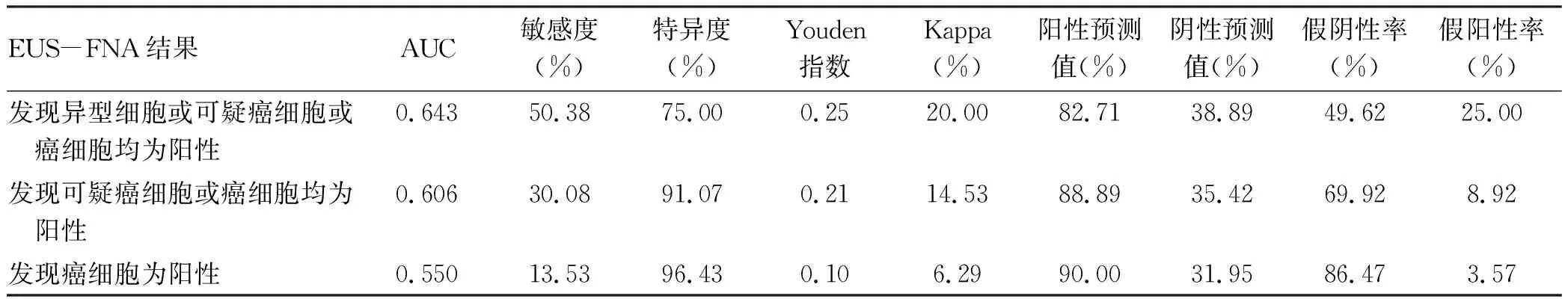
表3 EUS-FNA細胞學結果診斷胰腺癌效能分析
2.4 EUS-FNA檢查術后相關并發癥 189例患者行EUS-FNA檢查術后并發癥發生率為 6.88%(13例),其中7例出現血淀粉酶升高,予以對癥治療后好轉,6例出現腹痛,未予以特殊處理,1~6 h后自行緩解;未出現發熱、感染、出血、穿孔、重癥胰腺炎等其他并發癥。
3 討論
胰腺癌具有惡性程度高、起病隱匿、病情進展快、病死率高等特點,早期診斷是提高療效的重要方法。在胰腺癌高危患者篩查中,除了腫瘤標志物和上腹部CT外,聯合EUS檢查可以顯著提高診斷率、敏感度和特異度[8],尤其是小胰腺癌的EUS檢查可與傳統的影像學檢查形成優勢互補[11]。本研究結果表明,在臨床特征方面,胰腺癌患者具有高齡、梗阻性黃疸以及發生胰腺炎比例較低等特點,EUS表現為胰腺不均質低回聲占位,以實性包塊為主,病變邊界不規則,胰管擴張顯著,機制上均與胰腺癌侵犯周圍器官的占位效應有關。因此,對于EUS-FNA假陰性患者如具有上述臨床和EUS特征,則需要高度懷疑胰腺癌,積極手術治療。EUS-FNA是一項可以安全、準確獲取病變標本并行病理診斷的技術,目前廣泛用于胰腺腫瘤的定性診斷[11-12],對胰腺癌具有較高的敏感度和準確度,為診斷胰腺病變性質提供了新的思路[13]。與既往研究結果[14]類似。本研究結果顯示,當以細胞病理學查見癌細胞為陽性結果時,EUS-FNA診斷胰腺癌的特異度為96.43%,但敏感度為13.53%。Hewitt等[8]進行Meta分析表明,以發現癌細胞為標準,假陰性率在5%~46%范圍內波動,假陽性率在0~29%范圍內波動,以發現異型細胞或可疑癌細胞或癌細胞為標準,則假陰性率降低到4%~32%,但假陽性上升到0~33%。Layfield等[7]研究表明,采用不同分級的細胞學診斷標準,即“腫瘤”“異型性”“可疑惡性”和“惡性”時,假陰性率分別為15.77%、20.72%、28.83%、37.39%,假陽性率分別為16.05%、12.35%、6.17%、2.47%,因此,采用不同病理標準EUS-FNA的假陰性率和假陽性率均有明顯不同。本研究采用不同細胞學診斷標準,發現假陰性率分別為49.62%、69.92%、86.47%,假陽性率分別為25.00%、8.92%、3.57%。若采用癌細胞作為細胞學診斷標準,可能出現假陰性率過高的結果。
有研究[15-16]表明,EUS-FNA診斷胰腺病變總體敏感度為80%~90%,總體特異度高達90%~100%,診斷準確度>85%。病灶大小、部位及是否伴有血管侵犯等因素是影響EUS-FNA漏診胰腺癌的重要因素[17]。盡管EUS-FNA診斷胰腺癌的準確性高,但在實際工作中需注意假陽性,并且降低假陰性率。EUS-FNA假陽性多見于慢性胰腺炎。研究[18]表明,EUS-FNA的假陽性病例主要是由于慢性胰腺炎背景下的細胞學錯誤解釋所致。對于被炎性組織或纖維化組織所包裹的胰腺癌,在穿刺時由于局部病灶硬化,增加穿刺難度,影響胰腺癌診斷的敏感性[19]。對于EUS-FNA假陰性患者如臨床高度懷疑胰腺癌,則仍需要積極手術治療。假陰性主要是受穿刺部位選擇不當以及穿刺前新輔助化療等因素影響,標本處理不當同樣影響EUS-FNA病理結果分析。標本影響因素包括取材量不足、標本處理和染色時間等,以及與細胞學醫師進行診斷時比較謹慎有關。與國外研究比較,本研究中EUS-FNA診斷胰腺癌假陰性率過高,主要與細胞病理學診斷醫師的臨床經驗和標準過嚴有關,還與內鏡醫生識別胰腺病變EUS圖像的熟練程度、穿刺病變部位的選擇和技術等因素有關。因此,加強EUS-FNA操作者與病理醫生的溝通,可能有助于病理醫生對EUS-FNA組織的分析判斷。另一方面,細胞學醫師需要綜合細胞數量和具體病變的超聲形態學改變對穿刺標本進行評估[20]。本研究提示,操作人員應熟知胰腺及周圍組織的解剖關系,并熟練掌握EUS及穿刺技術,與細胞學醫師緊密配合,同時聯合不同的細胞學診斷標準,以降低假陰性率的發生,提高EUS-FNA的診斷效能。采用巴氏細胞學不同分級標準聯合分析,結合患者臨床表現、實驗室檢查結果及影像學結果,有助于提高EUS-FNA細胞病理學診斷胰腺癌的準確性和病情評估。
EUS-FNA總體并發癥發生率和致死率低。常見的并發癥主要包括胰腺炎、疼痛、出血、發熱、感染、穿孔及腫瘤細胞針道種植等[21]。本研究中EUS-FNA并發癥發生率為6.88%,提示EUS-FNA具有較高的操作安全性。
總之,EUS-FNA在臨床診斷胰腺癌中具有準確性較好的優點,與細胞病理學醫師協同有助于提高胰腺癌的診斷率。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突,特此聲明。
作者貢獻聲明:孟海輪、李素文、劉衡負責課題設計,資料分析,撰寫論文;鮑峻峻、宋育林參與收集數據,修改論文;梅俏負責擬定寫作思路,指導撰寫文章并最后定稿。

