非肥胖型非酒精性脂肪性肝病的病因及治療進展
李洋洋, 謝正元
南昌大學第二附屬醫院 消化內科, 南昌 330006
非酒精性脂肪性肝病(NAFLD)在全球的發病率呈逐年上升趨勢,根據BMI可分為肥胖型NAFLD和非肥胖型NAFLD。在亞太地區,BMI>25 kg/m2被定義為肥胖,而在歐美等西方國家BMI>30 kg/m2被定義為肥胖。NAFLD亦經常見于BMI正常的人群[1]。早在2017年,Naderian等[2]進行的一項基于超聲的研究發現,非肥胖人群中NAFLD的患病率為17.5%。然而超聲檢查不能評估非酒精性脂肪性肝炎(NASH)的存在,可能低估了NAFLD的真實患病率,因此其實際患病率可能更高。Zeng等[3]的一項調查研究發現,即使腰圍正常,在非肥胖中國成年人中NAFLD也不罕見。除此之外,Ye等[4]進行的薈萃分析發現,全球NAFLD人口中約40%被歸類為非肥胖,其中近五分之一是瘦人,非肥胖和瘦人組均具有大量的長期肝臟和非肝臟并發癥。非肥胖型NAFLD和肥胖型NAFLD均存在代謝紊亂[5],且非肥胖型NAFLD患者發生心血管疾病的風險更大[6]。因此,本文將對非肥胖型NAFLD的病因及治療進展作一綜述。
1 非肥胖型NAFLD的危險因素
目前研究表明,生活方式、遺傳因素、環境、種族因素等均可導致非肥胖人群NAFLD的發生(圖1),這一點在亞太地區尤為明顯。但目前非肥胖型NAFLD的病因及發病機制仍不清楚,需要大量的實驗數據和臨床實踐的積累。
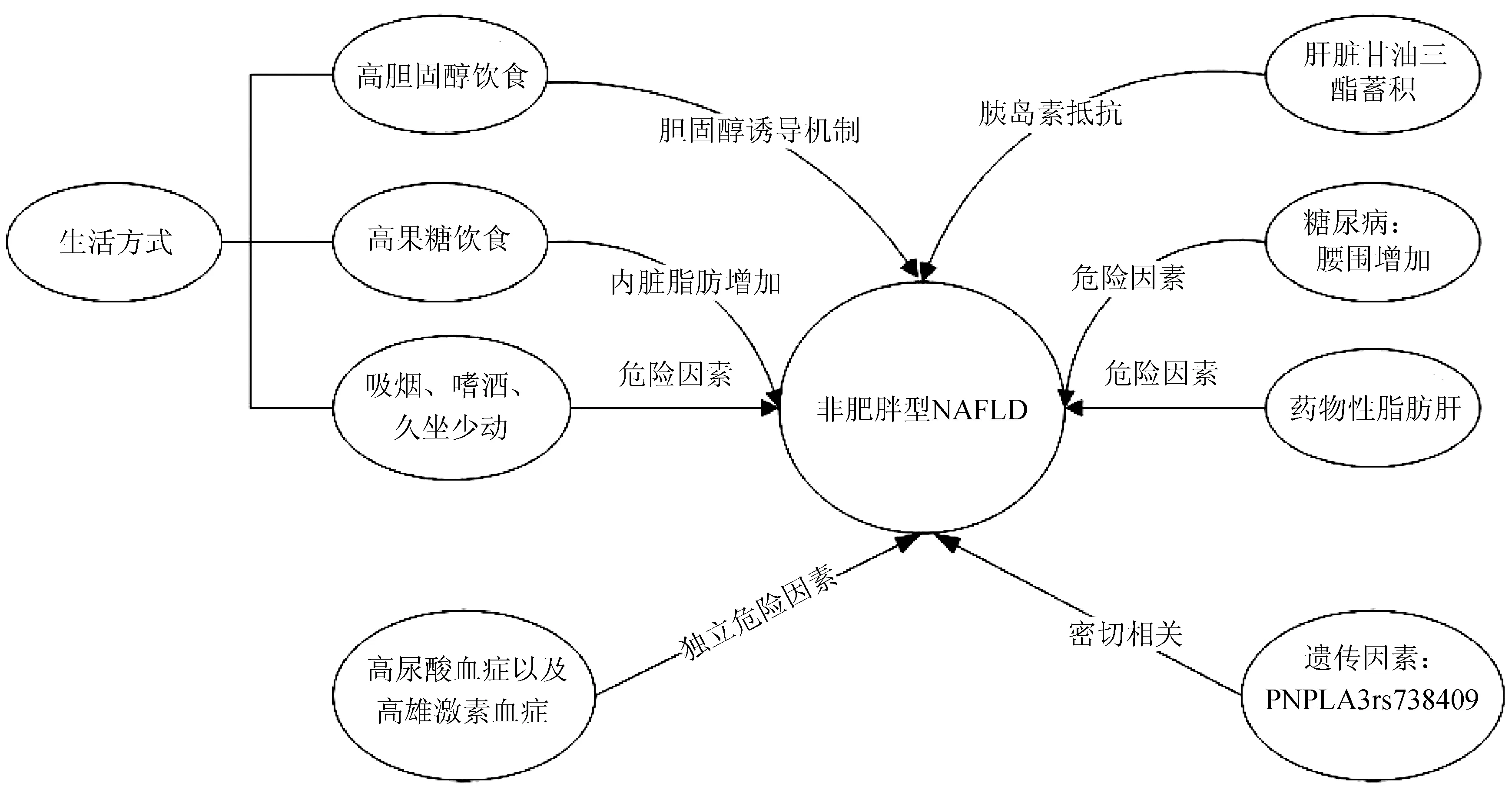
圖1 非肥胖型NAFLD的危險因素
1.1 肝臟甘油三酯蓄積 胰島素抵抗在NAFLD發生及發展中起到關鍵作用。關于這一點已被人們普遍接受,即使在非肥胖和瘦人個體中也是如此[7]。有研究[8]表明非肥胖型NAFLD更有可能出現胰島素抵抗。Gonzalez-Cantero等[9]研究表明胰島素抵抗與NAFLD獨立相關,與腰圍或BMI并無關系,并通過回歸分析發現肝臟甘油三酯含量才是胰島素抵抗最重要的決定因素。在非肥胖型NAFLD的發生及發展過程中,肝臟甘油三酯蓄積增加更有可能導致胰島素抵抗的發生。
1.2 遺傳因素 含Patatin樣磷脂酶域蛋白3(PNPLA3)是編碼脂肪細胞表達脂肪酶的相關基因。近期,許多研究發現PNPLA3基因型與非肥胖型NAFLD發生、發展密切相關。2016年,Honda等[10]發現在非肥胖型NAFLD中,PNPLA3rs738409GG基因型所占比例較高,明顯高于肥胖型NAFLD。并通過進一步研究發現,rs738409GG基因型與肝臟小葉炎癥、肝細胞腫脹及NAFLD活動評分密切相關。隨后,許多研究[11-12]相繼發現,非肥胖型NAFLD中rs738409的風險等位基因(G等位基因)頻率高于肥胖組,并在NAFLD的發展中起著關鍵作用。而目前PNPLA3rs738409基因具體作用機制尚不清楚,有待進一步研究。
1.3 生活方式 近年來許多研究表明,生活方式如高膽固醇、高果糖飲食,吸煙、嗜酒及久坐少動等均與非肥胖型NAFLD發病密切相關。流行病學研究表明,在NAFLD中,肥胖患者的總能量、脂肪(包括多不飽和脂肪酸)及碳水化合物膳食攝入量明顯高于非肥胖患者及健康志愿者,而非肥胖患者膽固醇攝入量明顯高于肥胖患者。因此,高膽固醇飲食可能會導致非肥胖型NAFLD的發生。Tu等[13]提出的膽固醇誘導機制表明,游離膽固醇、膽固醇酯和膽酸升高與鞘磷脂和磷脂酰膽堿代謝變化相關,并共同驅動及誘導非肥胖型NAFLD的發生及發展,這為解釋高膽固醇飲食對非肥胖型NAFLD/NASH患者的影響提供了第一批代謝物參考資料。而高果糖飲食可以使機體產生脂質,并促進炎癥,果糖在細胞內迅速磷酸化,導致細胞內ATP耗竭、尿酸產生及隨后的細胞損傷[14]。在非肥胖NAFLD患者中,果糖攝入發揮著更大的作用。特別是對于瘦人型或營養缺乏卻患有NAFLD的人群來說,雖然脂質果糖攝入相對較少,但相比而言,果糖攝入量是一個更容易改變的環境因素。對此類人群,基因多態性起著更為重要的作用,它會使過量的卡路里更易轉化為肝臟脂肪,而在非肥胖型NAFLD的發展過程中,內臟脂肪是較全身脂肪或腰圍更重要的風險因素[15-16]。此外,也有大量流行病學證據表明吸煙、嗜酒、久坐少動等均與非肥胖型NAFLD發病密切相關。因此,養成良好的生活飲食習慣及加強體力活動有助于預防NAFLD的發生。
1.4 糖尿病 糖尿病與NAFLD的發生及發展密切相關,約半數糖尿病患者有NAFLD[17]。近期,對于患有糖尿病的非肥胖人群,楊春偉等[18]發現,85 cm≤腰圍<90 cm組發生新發NAFLD的風險是腰圍<78 cm組的1.97倍,腰圍≥90 cm組發生新發NAFLD的風險是腰圍<78 cm組的2.19倍;在糖尿病非肥胖人群中,腰圍≥85 cm很有可能是新發NAFLD的危險因素。其發生機制可能為糖尿病患者存在胰島素抵抗和胰島素絕對或相對不足,由于高胰島素血癥抑制了脂肪酸氧化,使脂肪沉積在肝細胞引起脂肪肝。或是由于胰島素缺乏,血漿脂蛋白清除能力降低所致。因此,糖尿病患者更易發生脂肪肝。
1.5 高尿酸血癥 近年來,許多研究證據表明,血尿酸(SUA)升高與NAFLD的發生及發展有關。Zheng等[19]根據脂肪肝的超聲分級探討SUA與非肥胖型NAFLD的關系時發現,在中國內地95 924例成年人受試者中,7503例(8.16%)非肥胖者患有NAFLD,6967例(7.58%)輕度脂肪變性,536例(0.58%)中重度脂肪變性。在這些非肥胖受試者中,脂肪肝患者的SUA水平顯著高于非脂肪肝患者,而中度和重度脂肪肝患者的SUA水平顯著高于輕度脂肪肝患者。其結果表明SUA水平與非肥胖型NAFLD發生和發展呈正相關,并由此推測SUA可以作為一種簡單、非侵入性的方法來隨訪非肥胖型NAFLD患者。目前其具體機制尚不清楚,還需要進一步臨床干預試驗來探究降低SUA水平是否會產生有利影響。
1.6 高雄激素血癥 Kim等[20]采用前瞻性研究方法比較患有和未患有多囊卵巢綜合征(polycystic ovary syndrome,PCOS)的非肥胖女性中NAFLD的患病率。其肝臟超聲檢查結果顯示,非肥胖PCOS女性NAFLD患病率顯著高于非PCOS女性(5.5% vs 2.8%,P=0.027);而在調整了年齡和BMI后,PCOS與非肥胖型NAFLD相關(OR=2.62,95%CI:1.25~5.48)。因此,PCOS合并高雄激素血癥確實是一個值得考慮的新危險因素。
1.7 藥物性脂肪肝 非肥胖人群中,過多服用胺碘酮類藥物抑制脂肪酸的β氧化并抑制呼吸鏈,導致脂質過氧化發生脂肪肝。另外,大劑量使用皮質激素數周后,可使脂肪分解,血漿中游離脂肪酸增多而導致脂肪肝。
2 非肥胖型NAFLD治療進展
目前針對非肥胖型NAFLD主要的治療方法有藥物、生活方式干預等。近些年來,還有許多新穎的治療方式如膽汁酸抑制劑、益生菌制劑、降膽固醇類藥物及胰島素增敏劑等也備受人們關注(圖2)。
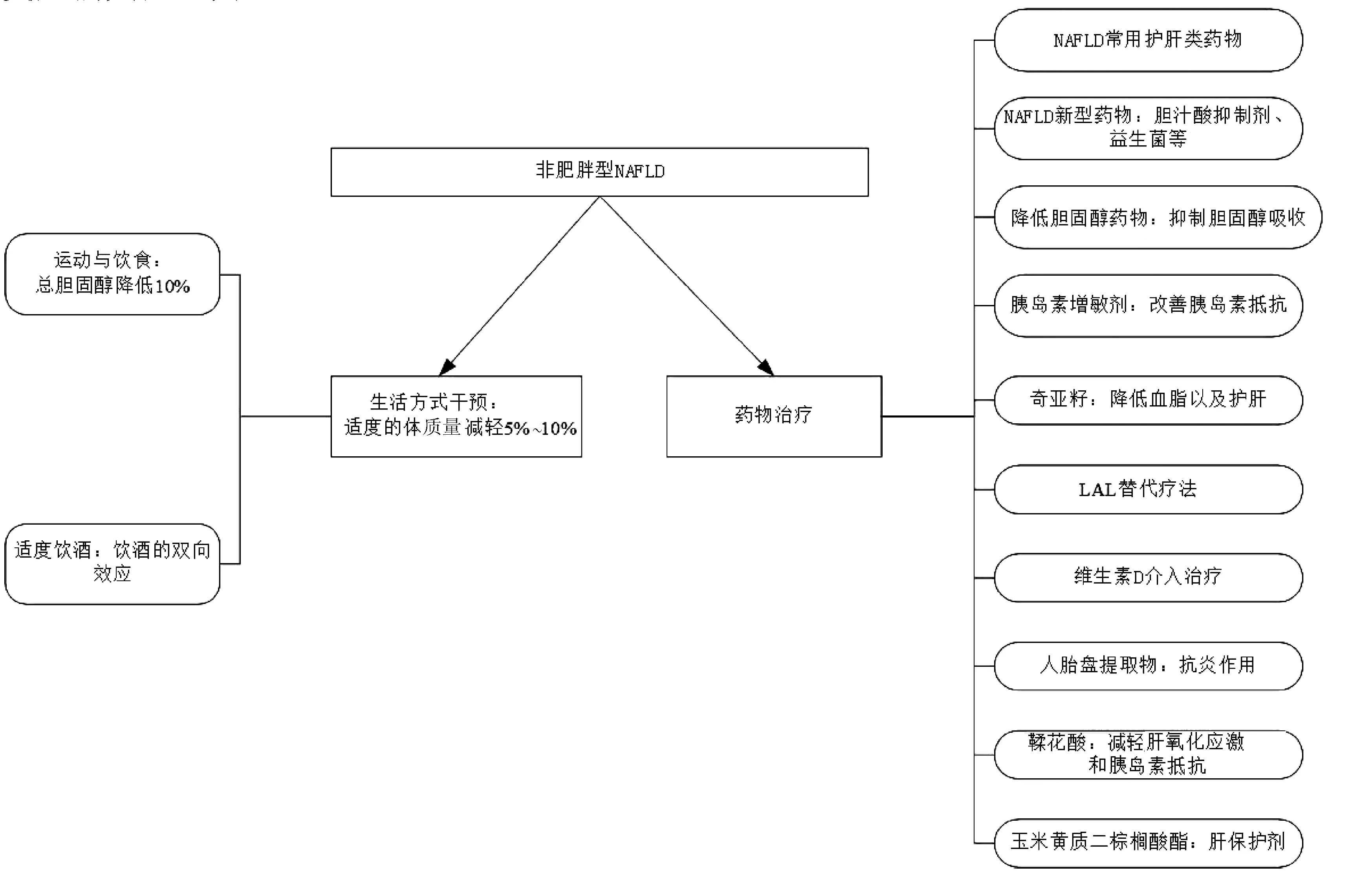
注:LAL,溶酶體酸性脂肪酶。
2.1 生活方式干預
Wong等[21]發現,非肥胖型NAFLD進行生活方式干預后,67%的患者可以得到緩解。大多數患者可以在體質量下降3%~10%的情況下實現NAFLD的緩解。生活方式干預對非肥胖和肥胖患者都能有效地治療NAFLD。從長遠來看,非肥胖患者通過減輕體質量緩解NAFLD的效果更明顯。因此,對于非肥胖患者,適度的體質量減輕5%~10%可能就有明顯的療效。
2.1.1 運動與飲食 適當的運動及飲食調整可以減輕非肥胖型NAFLD患者的體質量。隨著體質量的減輕,特別是內臟脂肪的減少,會明顯改善患者的代謝紊亂,如高脂血癥和胰島素抵抗。有證據[22]表明,適當運動及飲食調整能有效降低患者肝臟的脂肪變性,并且總膽固醇降低10%可作為改善的無創性預測指標。
2.1.2 適度飲酒 早期研究表明,過量飲酒是導致肝臟脂肪變性和肝損傷的原因之一。近年來的研究卻發現,飲酒對脂肪肝的發展有雙向影響。2015年,Takahashi等[23]研究發現在非肥胖受試者中,大量飲酒組(每天>50 g酒精攝入量)的脂肪肝患病率明顯高于少量飲酒組(每天<20 g酒精攝入量)和中度飲酒組(每天20~50 g酒精攝入量);而中度飲酒組患病率低于其他兩組。該結果表明,在非肥胖人群中,大量飲酒雖是脂肪肝的一個危險因素,但適度飲酒可能對脂肪肝有預防作用。臨床中,對于治療有習慣性飲酒的非肥胖型NAFLD患者,考慮到這種雙向效應是很有必要的。但酒精在胰島素抵抗和脂肪肝中的作用及作用機制仍存有爭議,還有待進一步研究。
2.2 藥物治療
2.2.1 NAFLD常用藥物 國內常見的抗脂肪肝輔助類藥物包括多烯磷脂酰膽堿、甘草酸制劑、雙環醇、熊去氧膽酸、腺苷蛋氨酸、還原型谷胱甘肽、水飛薊素(賓)及維生素E等[24]。這類藥物對細胞膜結構及細胞代謝具有較好的穩定作用,能抵抗肝細胞的壞死,減輕脂肪肝變性,修復損傷的肝細胞,保護肝臟。近年來,國內輔助護肝治療藥物在不斷更新,多種機制治療脂肪肝的聯合用藥已成為趨勢。這類藥物同樣適用于非肥胖型NAFLD的輔助護肝治療,但其對于非肥胖型NAFLD的療效還需要更多的實驗探究。
2.2.2 NAFLD新型藥物 近期,許多研究發現腸道-腸道微生物-肝軸可能在NAFLD的病因中起著重要作用,并進而發現膽汁酸抑制劑及益生菌能顯著改善體質量、循環代謝異常、肝臟炎癥和纖維化以及由高脂飲食引起的腸屏障損害,能極大的延緩NAFLD的進程。目前,基于調節膽汁酸的藥物,包括法尼醇X受體(FXR)和G蛋白膽汁酸受體(GPBAR)1以及頂端鈉依賴性膽汁酸轉運蛋白(ASBT)抑制劑。這些藥物如奧貝膽酸等均表現出逆轉脂肪性肝炎和纖維化的功效[25-26]。而腸道菌群參與人類生理學的許多方面,現已被認為在健康中起著關鍵作用。基于腸道菌群的藥物如益生菌補充劑,有證據[27]表明能改善肝脂肪變性和肝纖維化,且沒有發現重大不良反應。腸道菌群改變和脂聯素變異性可能是NAFLD進展的驅動力,靶向腸道菌群(例如通過施用益生菌)可能會通過脂聯素延遲NAFLD進程[28]。目前雖無在非肥胖型NAFLD中使用膽汁酸抑制劑及益生菌的臨床指南,但這些藥物對非肥胖型NAFLD確實有著巨大的潛在治療價值。未來的研究對于評估此類藥物在非肥胖型NAFLD患者中的療效很有必要。
2.2.3 降低膽固醇藥物 許瑞華等[29]發現依折麥布能較好地改善肝功能酶學指標、肝臟脂肪變性及調節膽固醇代謝,從而提高非肥胖型NAFLD患者的臨床治療效果。在此之前,Enjoji等[30]回顧8例依折麥布治療非肥胖型NAFLD患者1年的隨訪資料發現,雖然脂肪肝的超聲檢查結果在1年內沒有明顯改善,但其血清ALT水平在6個月內顯著降低,并且4例患者的ALT水平達到正常范圍(<30 U/L),同時血清總膽固醇和低密度脂蛋白-膽固醇至少降低了10%。膽固醇吸收抑制劑依折麥布可以改善肝功能障礙,延緩脂肪肝進展,可能為非肥胖型NAFLD提供了一種新的治療方法。
2.2.4 胰島素增敏劑 現有的研究[31]已證實在非肥胖2型糖尿病合并NAFLD患者治療中應用胰島素增敏劑,可明顯改善肝臟組織學及肝功能酶學指標,并且這可能為脂肪肝治療提供新的方向,進而對肝細胞炎癥、壞死和纖維化甚至肝衰竭的發生有重要的預防意義。
2.2.5 奇亞籽 奇亞籽富含α-亞麻酸和酚類物質。近些年來,由于其潛在的藥理作用,備受人們關注。Fernández-Martínez等[32]以非肥胖小鼠為動物模型,添加奇亞籽為實驗組,添加常規飼料為對照組。結果顯示,與對照組相比,實驗組小鼠肝臟重量顯著減輕。進一步研究發現,長期服用奇亞籽,可預防脂肪性肝炎,并降低實驗組小鼠的血脂。該作用可能與α-亞麻酸和酚類物質有關。因此,在非肥胖型NAFLD患者飲食中加入奇亞籽可能會改善肝臟脂肪變性,預防肝硬化或肝癌。
2.2.6 酶替代療法 LAL是參與脂質代謝的關鍵酶,負責水解膽固醇酯和甘油三酯。LAL缺乏可表現為脂肪肝、轉氨酶水平升高、肝腫大和血脂異常。然而LAL缺乏常常被人們忽略。Burton等[33]應用酶替代療法治療3期試驗發現,用α-海貝脂酶替代治療嚴重LAL缺乏患者20周后,經MRI評估,幾乎所有接受治療的患者其肝臟脂肪含量都顯著降低。該結果表明,酶替代療法可能也適用于LAL缺乏或LAL活性降低的非肥胖型NAFLD患者。對非肥胖型NAFLD患者進行LAL活性檢測,針對他們使用LAL替代療法可能會極大的降低其肝臟脂肪含量。
2.2.7 維生素D 維生素D在調節肝臟脂肪流動方面起著至關重要的作用,較高的維生素D水平對非肥胖型NAFLD有保護作用。曲玉蕾等[34]發現NAFLD患者血清維生素D及骨密度明顯低于正常人,對NAFLD并發骨質疏松癥進行合理的早期篩查,以提高NAFLD患者的預后及生活質量。在此之前,也有許多研究[35-37]發現,補充維生素D和骨化三醇可顯著降低血清ALP和GGT水平,并且延長療程,增加維生素D劑量可能會取得更積極的結果。因此,維生素D補充劑在一定程度上可降低非肥胖人群NAFLD的患病率,并改善肝臟脂肪病變,提高患者的預后。
2.2.8 人胎盤提取物 人類胎盤提取物富含酶、核酸、維生素、氨基酸、類固醇、脂肪酸和礦物質。其具有多種功能,包括抗炎功能、抗氧化效果和促進肝再生等。早在2015年,Shimokobe等[38]分析了4例完成24周人類胎盤提取物療程的非肥胖型NAFLD患者轉氨酶(AST和ALT)及其肝臟組織學改變情況。發現使用人類胎盤提取物治療8周后,轉氨酶水平明顯低于治療前;12周和24周后,轉氨酶活性下降至略低于治療前水平。然而,當進一步觀察這4例患者的肝臟組織學改變時發現,僅1例肝細胞氣球消失。雖然人類胎盤提取物治療對肝組織學影響不大,但血清轉氨酶(AST和ALT)水平較治療前顯著降低。人類胎盤提取物治療仍有望改善患者的轉氨酶活性,成為治療非肥胖型NAFLD的候選藥物。
2.2.9 鞣花酸 鞣花酸是一種在漿果和堅果中發現的天然抗氧化劑多酚。近年來,由于其潛在的價值,相比于合成抗氧化劑,備受人們的關注。Polce等[39]以非肥胖自發性2型糖尿病大鼠為實驗動物模型研究鞣花酸發現,鞣花酸治療能減輕肝臟氧化應激以及顯著降低空腹血糖和胰島素抵抗,表現為穩態模型胰島素抵抗指數(HOMA-IR)降低21.8%。這項研究為口服鞣花酸治療非肥胖型NAFLD提供了新的見解。鞣花酸可作為飲食補充參與非肥胖型NAFLD合并糖尿病并發癥的食物治療計劃中,以減緩肝病的進展。其在臨床中具有極大的應用潛力,但仍需要進一步的臨床研究。
2.2.10 玉米黃質二棕櫚酸酯 玉米黃質二棕櫚酸酯是枸杞多糖的重要成分,具有調節免疫和神經內分泌功能。許多研究已經證實枸杞多糖在化學和NAFLD誘導的肝損傷中的肝臟保護特性。Li等[40]通過非肥胖轉基因小鼠建立非肥胖NASH模型來研究玉米黃質二棕櫚酸酯時發現,對患有NASH的非肥胖轉基因小鼠,每周加用玉米黃質二棕櫚酸酯灌胃后,能部分抵消血清ALT、AST和ALP改變,并且其肝臟脂肪滴沉積減少,肝纖維化程度明顯減輕。此外,還對玉米黃質二棕櫚酸酯進行了90 d的安全性評估,發現在非肥胖小鼠中,長期服用玉米黃質二棕櫚酸酯沒有出現任何不良影響。因此,玉米黃質二棕櫚酸酯可以作為一種安全、有前途的肝臟保護劑,并具有極大的潛力替代草藥衍生物來治療非肥胖型NAFLD,以減緩NAFLD進展為NASH造成的肝損傷。
3 非肥胖型NAFLD患者的預后
以往研究認為非肥胖型NAFLD患者預后較好。但Cruz等[41]進行的一項長期(>12年)國際研究發現,盡管非肥胖型NAFLD胰島素抵抗較少,肝纖維化進展較慢,但其全因死亡率是超重和肥胖患者的2倍(28% vs 14%)。隨后,許多研究[42-43]相繼發現,盡管非肥胖型NAFLD占NAFLD的比例很小且纖維化程度較低,但發生意外代謝并發癥的風險與非瘦型NAFLD相似,長期預后更差,全因死亡率甚至更高。肥胖型和非肥胖型NAFLD均可能逐漸進展為NASH和肝臟晚期纖維化,都應考慮作為藥物治療的潛在人群。目前關于此方面的研究并不多, 仍需進一步的探索。
4 總結與展望
目前,非肥胖型NAFLD患者在NAFLD中占據的比例已不容忽視,但因缺乏肥胖表型故未引起足夠的重視。相比于肥胖型NAFLD患者,盡管非肥胖型NAFLD胰島素抵抗較少,肝纖維化進展較慢,但其發生心血管疾病的風險更大、全因死亡率更高。因此,非肥胖型NAFLD更應早期發現、早期治療、早期預防。非肥胖型NAFLD的發病機制、病因以及其對心血管系統或腎臟系統的具體影響仍有待進一步的研究。目前針對非肥胖型NAFLD尚無特效的藥物治療,改變生活方式、飲食結構及運動仍然是非肥胖型NAFLD現有的有效治療方式。
作者貢獻聲明:李洋洋負責參與收集數據,資料分析,撰寫論文,修改論文;謝正元負責擬定寫作思路,指導撰寫文章并最后定稿。

