動物布魯氏菌病抗體補體結合試驗與cELISA檢測結果比較
沈紅霞,倪柏鋒,王 彬,虞一聰,周 煒,周芷錦,穆 琳,桂平雄,趙靈燕
(浙江省動物疫病預防控制中心,浙江 杭州 311199)
布魯氏菌病血清學檢測方法主要有平板凝集試驗(BPAT)、虎紅平板凝集試驗(RBPT)、試管凝集試驗(SAT)、補體結合試驗(CFT)、酶聯免疫吸附試驗(ELISA)和熒光偏振試驗(FPA)等,以補體結合試驗診斷布病的特異性最強,其敏感性也較高,是國際公認的血清學確診方法。
補體結合試驗包括兩個系統,并需要5種成分。第一個系統是反應系統,將布魯氏菌抗原與被檢血清以及補體混合,如果被檢血清含有布病抗體,抗體與布魯氏菌抗原結合形成復合物,抗體的分子構型改變,處于Fc段上的補體結合位點暴露,這時補體與之結合,結合的補體不再游離,使其不能再參與第二指示系統即溶血系統反應。在加入被致敏的綿羊紅細胞(即與溶血素結合的紅細胞)時,由于所有補體已在第一系統反應時被結合,則不會發生溶血,即判定為陽性反應;反之則會發生溶血,判定為陰性反應[1]。本文著重介紹了補體結合試驗實驗方法,并將其結果與cELISA結果進行比較,以供同行參考。
1 材料
1.1儀器設備 培養箱(4111,Thermo),水浴鍋(WNB45,MEMMERT),滅菌器(SX-700,TOMY),生物安全柜(1300 SERIES A2,Thermo),移液器(100~1000 μL,Eppendorf),一次性移液管、玻璃試管、試管架、滅菌移液器吸頭等。
1.2試劑
1.2.1補體結合抗原、溶血素、補體、陰陽性標準血清 補體結合抗原(批號:2020),溶血素(批號:2019),補體(批號:2019),陽性標準血清(批號:202005)),陰性標準血清(批號:202005),上述試劑均購于青島中創匯科。
1.2.2綿羊紅細胞懸液 采取成年公綿羊血,按常規方法脫纖、洗滌、離心,用稀釋液洗滌至上清無色為止,最后以2000 r/min離心定容。取紅細胞用稀釋液配制成2.5%紅細胞懸液(2.5 mL/100 mL)備用。
1.2.3滅菌生理鹽水 本實驗室自制。
1.3檢測樣品 經cELISA試劑盒(批號18121701,購自中國獸醫藥品監察所)檢測的43份牛羊血清,其中:牛陽性血清11份,羊陽性血清12份;牛陰性血清10份,羊陰性血清10份。
2 方法
按動物布魯氏菌病診斷技術(GB/T18646-2018)補體結合試驗常量法進行操作及判定[2]。
2.1溶血素效價測定 按表1加入各成分混勻后置37~38 ℃水浴20 min,從水浴中取出,立即判定結果。結果判定見表1,能使2.5%紅細胞液完全溶血的最小量溶血素為溶血素效價或一單位溶血素,本次試驗溶血素效價為3000倍稀釋液500 μL,二單位溶血素的工作效價為1500倍稀釋液500 μL。

表1 溶血素效價測定表(μL)
2.2補體效價測定 按表2加入各成分混勻后經2次37~38 ℃水浴20 min,最后一次水浴后立即判定結果。結果判定見表2,三個對照管及陽性血清加抗原的試管為完全不溶血,陽性血清未加抗原及陰性血清無論有無加抗原的試管發生完全溶血所需最小補體量,即為補體效價或一單位補體。本次試驗補體效價為14倍稀釋補體310 μL,計算得主試驗原補體稀釋倍數為22.58,補償操作中效價降低,使用濃度比補體效價大10%,因此最終使用補體工作效價為20.32倍稀釋原補體500 μL。
2.3溶血標準比色管制備 按表3配置溶血標準比色管,用于抗原效價測定及主試驗結果的判定。
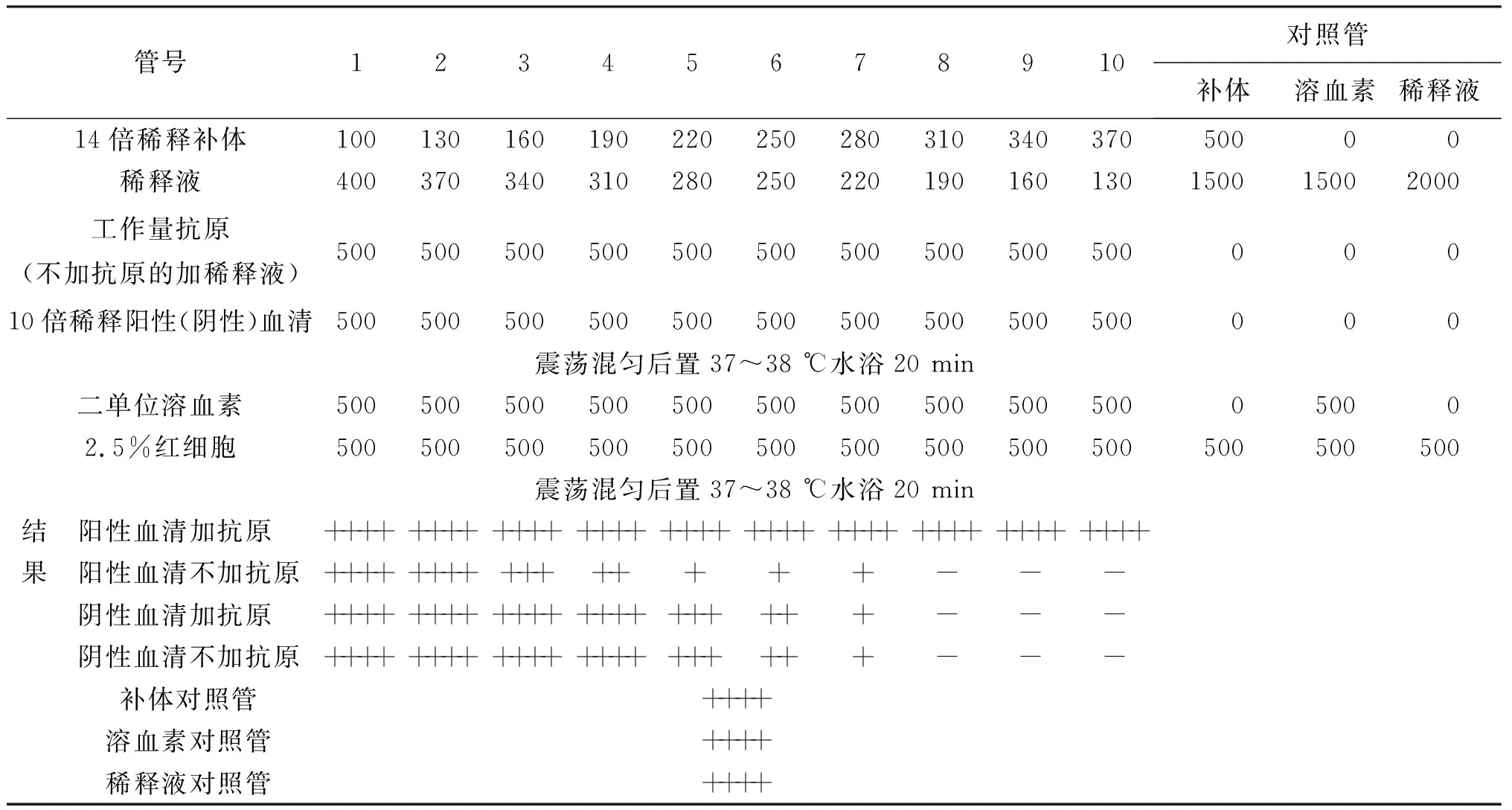
表2 補體效價測定(μL)
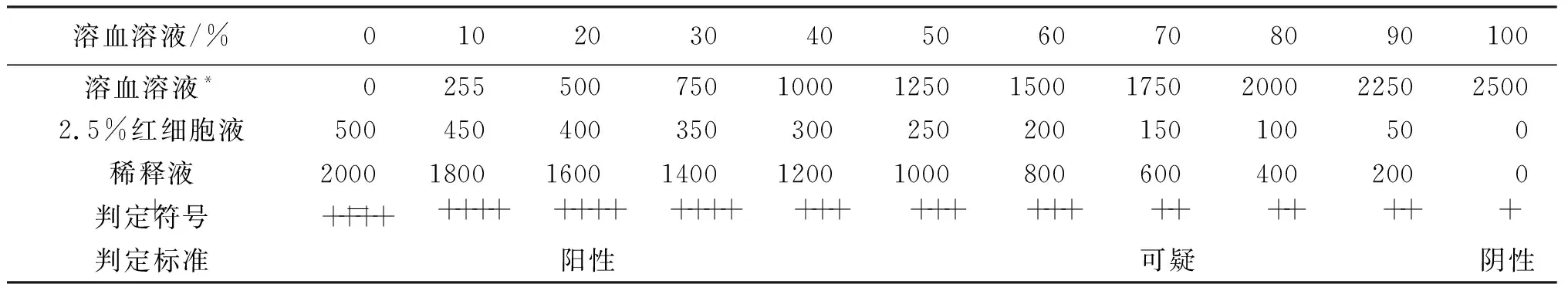
表3 補體結合試驗溶血標準比色管制備(μL)
2.4抗原效價測定 將陰性對照血清作1∶10稀釋,陽性血清稀釋成1∶10,1∶25,1∶50,1∶75,1∶100,5個稀釋度,分別按表4加入各種成分,經2次37~38 ℃水浴20 min,最后一次水浴后立即判定結果,觀察記錄各管溶血百分數。結果判定見表5,抗原對陰性血清應完全溶血,陽性血清各稀釋度發生抑制溶血最強的抗原最高稀釋度為抗原效價。本次試驗抗原效價為1∶150,主試驗使用抗原稀釋度應比測定效價濃25%,最終抗原工作效價為1∶112.5。
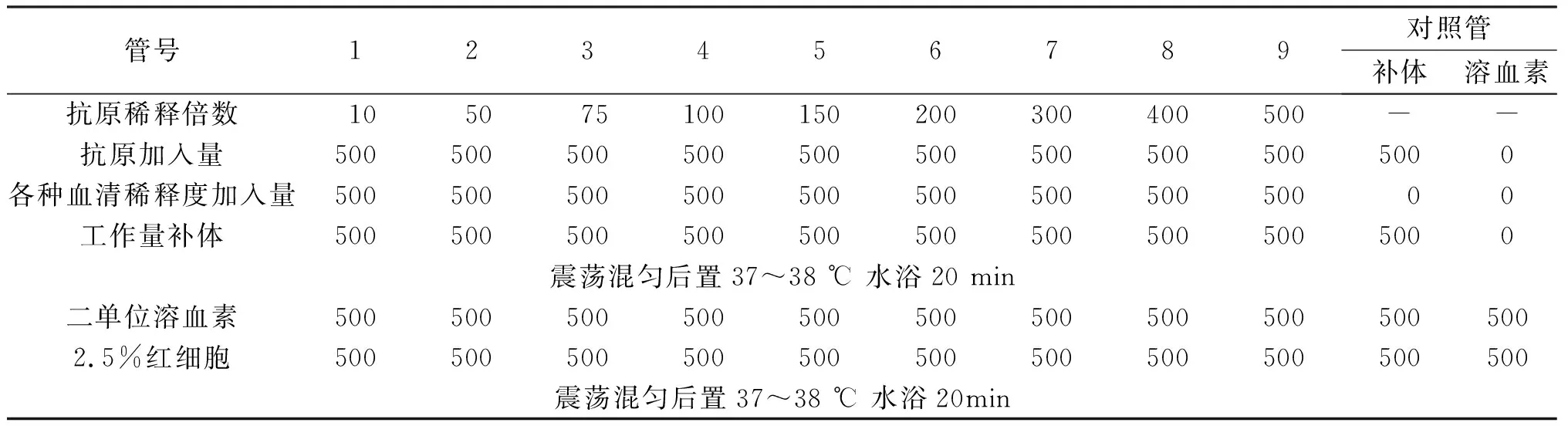
表4 抗原效價測定(μL)
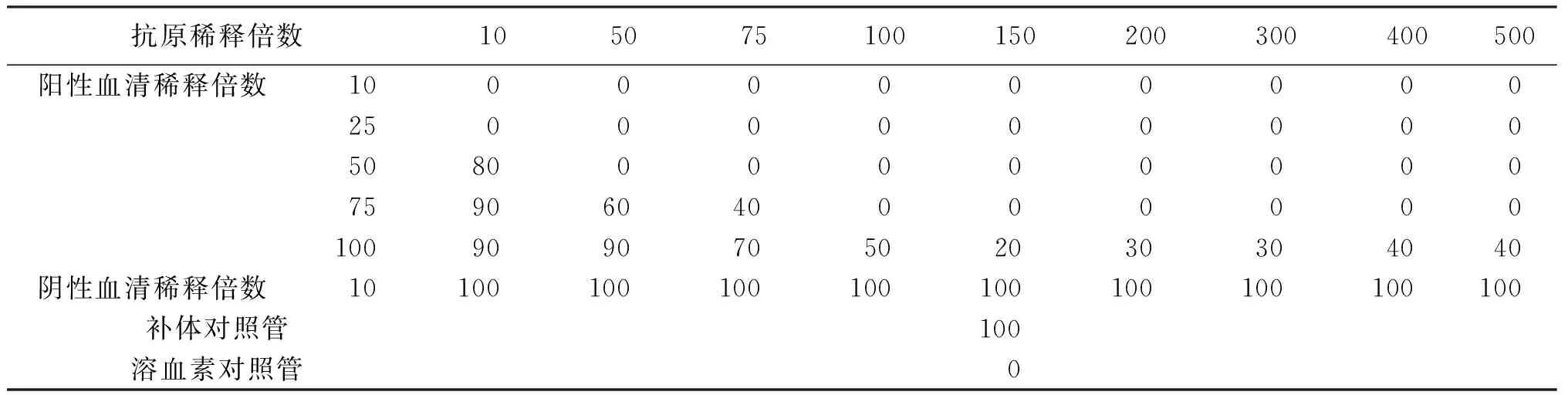
表5 抗原效價滴定結果
2.5主試驗 對43份牛羊血清進行檢測,試驗設陰性血清、陽性血清、抗原、溶血素和補體對照,主試驗各要素添加量和順序見表6。具體操作如下:
(1)將1∶10稀釋受檢血清、陰陽性對照血清滅能,分別加入2支玻璃試管內,每管500 μL。其中一管加工作量抗原500 μL,另一管加稀釋液500 μL。
(2)上述2管均加工作量補體,每管500 μL,震蕩混勻。
(3)置37 ℃水浴20 min,取出放于室溫環境中。每管各加2單位的溶血素500 μL和2.5%紅細胞懸液500 μL。充分震蕩混勻。
(4)再置37 ℃水浴20 min,取出立即進行第一次判定。
結果判定,以溶血標準比色管為參照,0~40%溶血判為陽性反應;50%~90%溶血判為可疑;100%溶血判為陰性反應。初判后靜置12 h作第二次判定。
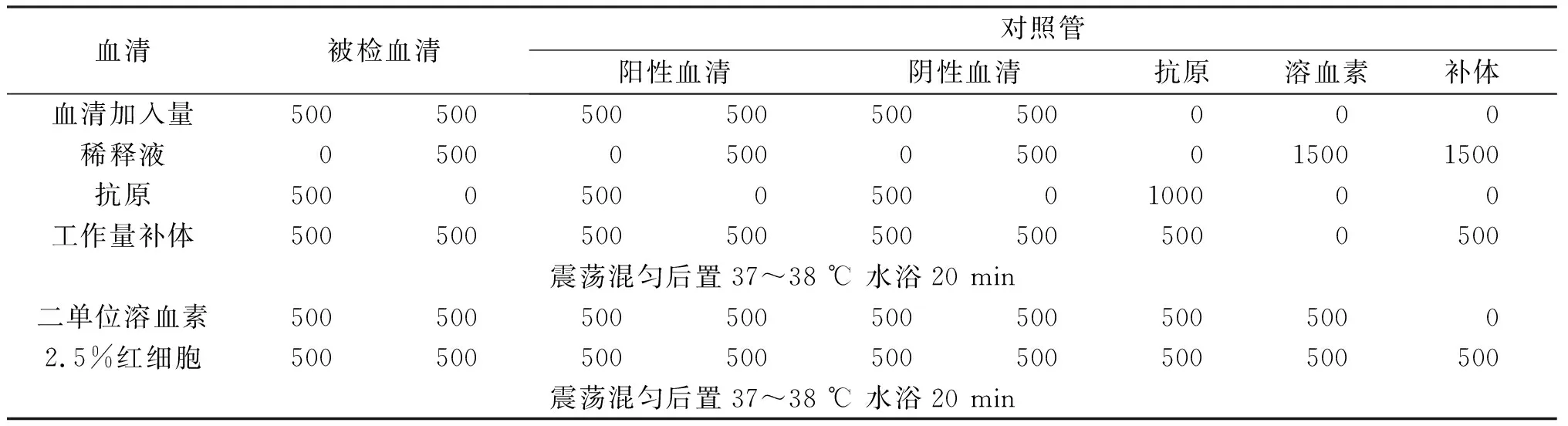
表6 補體結合試驗主試驗(μL)
3 結果與分析
3.1補體結合試驗檢測結果 通過上述補體結合試驗方法檢測43份牛羊血清,經兩次判定后,試驗結果見表7。

表7 補體結合試驗結果
3.2補體結合試驗與cELISA結果分析 以cELISA結果作為參照標準,采用四格表法分別對補體結合試驗結果的Kappa一致性、敏感性、特異性、準確性進行比較分析(表8-9)[3]。本次試驗兩種檢測方法結果一致性較差,Kappa值為0.3499,CFT特異性為70%,較敏感性(65.22%)及準確性(67.44%)稍高。
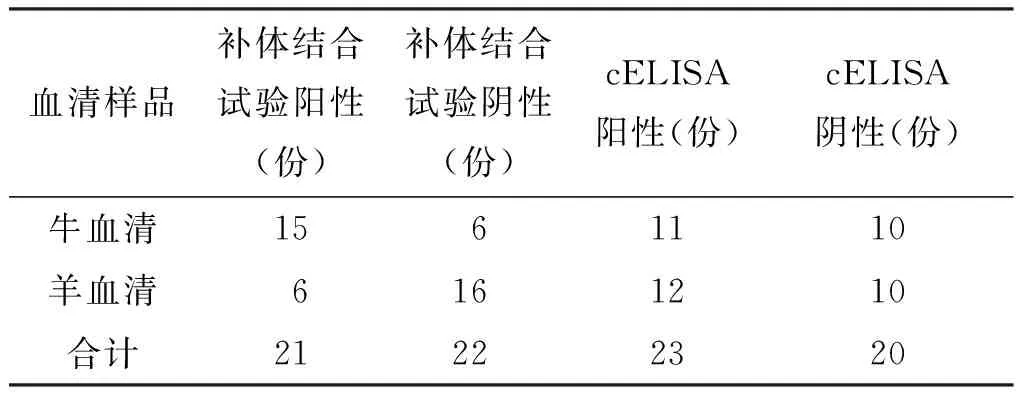
表8 補體結合試驗與cELISA結果
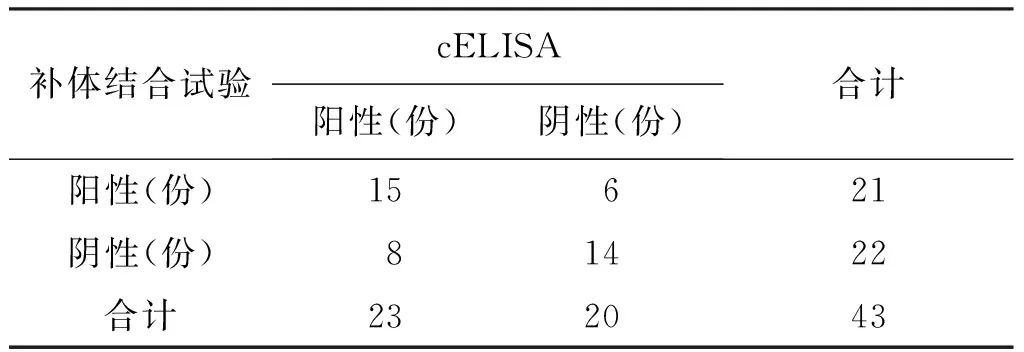
表9 補體結合試驗與cELISA比較
一致性:Kappa=[43×29-(21×23+22×20)]÷[43×43-(21×23+22×20)]≈0.3499
敏感性:M=15÷(15+8)×100%=65.22%
特異性:T=14÷(6+14)×100%=70.00%
準確性:Z=(15+14)÷43×100%=67.44%
4 討論
我國現行標準中補體結合試驗抗原系用我國自主知識產權的疫苗株布魯氏菌S2株或S2和A99菌株,通常使用S2株[1]。在反芻類動物中,補體結合試驗對接種牛種布魯氏菌S19或A19、羊種布魯氏菌RevI弱毒疫苗所產生的抗體相對不敏感,而對自然感染布魯氏菌病的動物有很高的敏感性和特異性。在反芻類動物,主要的補體結合抗體為IgG1,IgG2不結合豚鼠補體而且能夠阻止其他的免疫球蛋白結合補體而產生前帶現象[1]。IgM可結合補體但其結合能力可因滅活血清時的加熱而受到影響。在56 ℃滅活時幾乎沒有影響,而溫度升高到65 ℃時,IgM結合補體的能力則被完全破壞[1]。
抗補體現象是補體結合試驗中必須注意的問題。產生這種現象的原因較多,如血清中存在的某種脂類和變性的球蛋白能吸附大量的補體、血清存放時間太久或被細菌污染以及所用的玻璃試管等儀器不潔凈均能導致抗補體現象的出現[4][5]。為防止產生抗補體現象,要求血清和所用的診斷抗原均不能被細菌所污染。采血后要立即分離血清,并及時操作或冰凍保存,所用的玻璃試管等器材必須十分清潔。
為了準確測定被檢血清中的布病抗體,補體結合試驗中除了被檢血清,其他4種成分效價必須經過仔細測定,在主試驗中處于平衡狀態。補體量少導致不完全溶血,容易出現假陽性結果;反之,補體過量不能被第一反應系統的免疫復合物完全結合從而出現假陰性結果;溶血素量少,則溶血不完全,陰性血清被誤判弱陽性;溶血素過量,則會延緩溶血時間;抗原過量會影響補體的結合;抗原不足不能完全結合補體等情況,最終都有可能導致假陽性或假陰性結果的出現[1,4]。每次進行補體結合試驗前,各成分效價都要重新測定,操作繁瑣,量化要求嚴格,這也就導致該方法難以普遍推廣應用。

