海藻酸鈉-納米纖維素膠粒對乳酸菌胃腸液耐受性的影響
陳秉彥,林曉姿,李維新,林曉婕,鄭寶東,何志剛,*
(1.福建省農業科學院農業工程技術研究所,福建 福州 350002;2.福建省農產品(食品)加工重點實驗室,福建 福州 350002;3.福建農林大學食品科學學院,福建 福州 350002)
近年來,乳酸菌作為一種功能性益生菌,被廣泛用于發酵果汁以及各種奶制品(軟硬奶酪、冰淇淋、酸奶、冷凍乳制品甜點)加工。乳酸菌不僅賦予食品特殊的發酵風味,同時也通過改善腸道微生物群落平衡,有效抑制有害菌生長從而有益于宿主健康[1]。有研究表明,至少需要106~107CFU/g的乳酸菌定植于腸道才可以發揮其對人體的益生效應[2]。然而,人體攝入活性乳酸菌產品時,菌體在經過低pH值胃酸以及高膽汁酸鹽腸液環境后活性損失相當嚴重。因此,如何提高乳酸菌在胃腸液中的耐受性受到越來越多研究人員的關注。
微膠囊化是保護益生菌的有效方法,微膠囊將菌體與外界逆環境隔離,減少了不利因子對乳酸菌的干擾及破壞,增加了乳酸菌的穩定性。海藻酸鈉的價格低廉、凝膠條件溫和并具有良好的生物相容性,含有的α-L-古洛糖醛酸可與二價陽離子作用形成“蛋盒”凝膠結構[3]。許多研究都報道了海藻酸鈉可通過擠壓滴入法包埋乳酸菌,海藻酸鈉的濃度[4]、分子質量與α-L-古洛糖醛酸比例[5]以及交聯劑[6]都會改變微膠囊膠粒的尺寸與機械強度,從而影響乳酸菌的包埋率及保護效果。然而,海藻酸鈉膠粒表面粗糙、呈現出部分孔狀結構,易受外界環境因素影響導致凝膠強度下降[7],限制了它在食品以及醫藥領域中的應用。目前,通過海藻酸鈉與高分子聚合物進行復配凝膠的方式,是修飾海藻酸鈉膠粒結構、提高其機械強度的有效方法。
納米纖維素是直徑為納米尺寸、具有一定長徑比的線性或顆粒狀高分子聚合物。根據微觀形態的差異,可分為纖維素納米微晶(cellulose nanocrystal,CNC)以及纖維素納米微纖絲(cellulose nanofibrils,CNF)。納米纖維素已被證實具有多羥基結構[8-9],可通過非共價作用力提高如淀粉[10]、蛋白[11]、果膠[12]等親水膠體的凝膠強度。基于此推測,利用納米纖維素可強化海藻酸鈉膠粒結構,提高膠粒對乳酸菌的保護效果。目前,關于海藻酸鈉-納米纖維素膠粒對乳酸菌胃腸液耐受性的影響研究鮮見報道。
因此,本實驗以果蔬加工副產物豆渣為原料,通過酸法與機械法分別制備豆渣纖維素納米微纖絲(soybean cellulose nanofibrils,SCNF)與豆渣纖維素納米微晶(soybean cellulose nanocrystal,SCNC),利用不同種類的納米纖維素協同鈣離子誘導海藻酸鈉溶液形成微膠粒,研究兩種復合微膠粒的包埋率、表面形態、膠體結構;進一步考察兩種微膠粒對乳酸菌胃腸液逆環境存活率的影響。本研究有利于拓展果蔬納米膳食纖維在乳酸菌等益生菌保護領域中的應用,可為構建新型載菌遞送體系以提高乳酸菌的胃腸道耐受性提供新思路。
1 材料與方法
1.1 材料、菌株與試劑
豆渣由三明市揚晨食品有限公司提供。
副干酪乳桿菌R37(CCTCC:M 2012311)由福建省農產品(食品)加工重點實驗室提供,該菌從枇杷果酒中分離得到。
堿性蛋白酶(200 000 U/g)、胃蛋白酶(50 000 U/g)江蘇銳揚生物有限公司;海藻酸鈉(分析級)、胰酶(4 000 U/g)、胰蛋白酶(250 000 U/g)、膽鹽(純度高于65%) 北京索萊寶生物科技公司;溴化鉀(光譜級)德國默克試劑公司;MRS肉湯及培養基 廣東環凱微生物科技有限公司;其余有機溶劑均為國產分析純。
1.2 儀器與設備
GM-200型德國萊馳刀式研磨儀 上海弗爾德儀器有限公司;SPCH-35型超高壓納米均質機 英國STANSTED儀器公司;FD5-3型冷凍干燥機 美國SIM公司;Nova NanoSEM 230場發射掃描電子顯微鏡 美國FEI儀器公司;TENSOR II型傅里葉變換紅外光譜儀 德國布魯克儀器有限公司;NMI-25型低頻氫譜核磁共振儀 江蘇泰紐科技有限公司;TA.XT Plus質構儀 英國SMS公司。
1.3 方法
1.3.1 豆渣納米纖維素的制備
采用堿提法[13]制備豆渣纖維素,獲得的纖維素經干燥粉碎,密封保存。實驗進一步以豆渣纖維素粉為原料,采用酸法與微射流均質制備SCNC以及SCNF。
參考Yang Xue等的方法[14]并略作修改,通過酸解制備SCNC:粉碎過篩的20 g豆渣纖維素粉溶于1 L硫酸中,攪拌降解36 h,加水稀釋為2 倍體積后離心(13 000 r/min、20 min)。沉淀經水洗再次離心后調節pH值為中性,透析24 h后凍干保存。
參考Wang Yihong等的方法[15]并略作修改,通過微射流均質制備SCNF:粉碎過篩的20 g豆渣纖維素粉溶于1 L去離子水,經微射流均質降解(150 MPa,循環5 次)后凍干保存。
1.3.2 乳酸菌R37的培養
采用MRS肉湯活化培養副干酪乳桿菌R37,接種量為培養基體積的5%,培養溫度為37 ℃,時間為24 h。活菌數量采用平板計數法計算(菌量大于108CFU/mL),乳酸菌菌懸液經離心(5 000 r/min、5 min)、水洗后收集,用于后續包埋實驗。
1.3.3 載菌海藻酸鈉-納米纖維素膠粒的制備
采用擠壓滴入法制備載菌膠粒:SCNC或SCNF粉末添加至菌懸液使其終質量濃度分別為10 g/L與30 g/L,之后添加海藻酸鈉至終質量濃度為10 g/L,攪拌水合1 h,擠壓滴入氯化鈣溶液(檸檬酸調節pH值至3.5,溶液保持攪拌狀態),硬化20 min,抽濾獲得濕基復合膠粒,凍干后密封保存。海藻酸鈉-纖維素納米微晶膠粒根據納米纖維素不同質量濃度分別命名為SA-SCNC(10 g/L)與SA-SCNC(30 g/L);海藻酸鈉-纖維素納米微纖絲膠粒根據納米纖維素不同質量濃度分別命名為SA-SCNF(10 g/L)與SA-SCNF(30 g/L);未添加納米纖維素粉末的樣品作為對照。濕基膠粒用于包埋率、低頻氫譜核磁共振、質構以及胃腸液耐受性的分析,而干基膠粒用于掃描電子顯微鏡觀察以及傅里葉變換紅外光譜的結構分析。
1.3.4 海藻酸鈉-納米纖維素膠粒的乳酸菌包埋率
根據Darjani等的方法測定膠粒對乳酸菌的包埋率[16]。取1 g海藻酸鈉-納米纖維素膠粒,加入9 mL磷酸二氫鈉緩沖溶液(0.1 mol/L、pH 7.5、37 ℃),漩渦振蕩5 min使膠粒溶解,乳酸菌完全釋放。之后,取1 mL樣液進行梯度稀釋,根據平板計數法測得包埋菌的數量。海藻酸鈉-納米纖維素膠粒對乳酸菌的包埋率按照公式(1)計算。
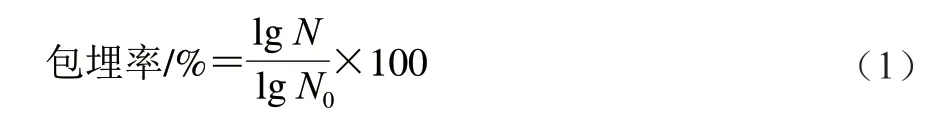
式中:N為包埋后膠粒釋放的活菌數量/(CFU/g);N0為初始活菌數量/(CFU/g)。
1.3.5 海藻酸鈉-納米纖維素膠粒的微觀形態觀察
將凍干的膠粒黏附在貼有導電膠的載物平板上,進行噴金處理,之后采用Nova NanoSEM 230場發射掃描電子顯微鏡對凍干膠粒的整體形態及微觀結構進行觀察,放大倍數分別為100 倍與10 000 倍。
1.3.6 海藻酸鈉-納米纖維素膠粒的傅里葉變換紅外光譜分析
采用TENSOR II型傅里葉變換紅外光譜儀對凍干膠粒的基團結構進行分析。凍干粉碎的海藻酸鈉-納米纖維素膠粒25 mg,加入500 mg干燥的光譜純溴化鉀(105 ℃、2 h),快速研磨,之后取少量粉末倒入模板夾具中進行壓片,置于傅里葉變換紅外光譜儀通道中進行分析。儀器的測定波數范圍為400~4 000 cm-1、分辨率為4 cm-1、掃描32 次。
1.3.7 海藻酸鈉-納米纖維素膠粒的低頻氫譜核磁共振分析
采用NMI-25型低頻氫譜核磁共振對濕基海藻酸鈉-納米纖維素膠粒的水分分布進行分析,取2 g膠粒于25 mL核磁管中,以CPMG序列進行弛豫時間T2掃描,回聲時間為400 μs,回聲次數為8 000 次,等待時間為8 s,每次測量掃描8 次,溫度為25 ℃,獲得弛豫時間曲線。
1.3.8 海藻酸鈉-納米纖維素膠粒的硬度分析
采用TA.XT Plus型質構儀,選取TP-2型探頭,觸發力為1 g,測前速率1.0 mm/s、測試速率1.0 mm/s、測后速率1.0 mm/s、觸發力5.0 g、壓縮程度30%,每個樣品重復實驗3 次,用TPA軟件分析海藻酸鈉-納米纖維素膠粒經胃腸液消化后的硬度變化。
1.3.9 海藻酸鈉-納米纖維素膠粒經胃腸液消化后的活菌損失量分析
根據Li Kailing等的方法[17]并稍作修改進行胃腸液耐受實驗,取1 g海藻酸鈉膠粒或海藻酸鈉-納米纖維素膠粒加入9 mL模擬胃液(pH 2,含3 g/L胃蛋白酶)在37 ℃條件下孵化2 h,之后將膠粒轉移至9 mL腸液(pH 6.5,含5 g/L胰酶、3 g/L胰蛋白酶、5 g/L膽鹽)中混合均勻,繼續孵化3 h。待靜置結束后,加入10 mL 0.1 mol/L磷酸鹽緩沖液,漩渦振蕩5 min,使膠粒完全溶解,吸取1 mL樣液進行梯度稀釋,根據平板計數法測得活菌數量。對照組采用1 g未包埋的菌懸液進行模擬胃腸液耐受實驗。乳酸菌的損失量根據公式(2)計算。

式中:C為乳酸菌的損失量(lg(CFU/g));N為嵌入膠粒的乳酸菌數量/(CFU/g);N0為膠粒經消化后溶解釋放的乳酸菌數量/(CFU/g)。
1.4 數據處理與分析
各組實驗數據均重復3 次,結果用平均值±標準差表示。采用DPS 9.05軟件中最小顯著性差異法進行顯著性分析,以P<0.05表示數據之間具有顯著差異;采用Origin Pro 8.5軟件作圖。
2 結果與分析
2.1 海藻酸鈉-納米纖維素膠粒對乳桿菌R37的包埋率
不同類型的海藻酸鈉-納米纖維素膠粒對副干酪乳桿菌R37的包埋率如圖1所示。所有凝膠樣品的初始菌量基本一致,活菌量為9.41(lg(CFU/g))。當凝膠與Ca2+交聯后,不同膠粒對乳酸菌的包埋程度存在差異。海藻酸鈉膠粒的包埋率為87.51%。當海藻酸鈉體系中加入SCNC與SCNF后,膠粒的載菌量與包埋率顯著提高。當SCNC或SCNF添加質量濃度為10 g/L時,SA-SCNC與SA-SCNF的包埋率分別為92.77%與96.80%。此結果高于Darjani等報道的海藻酸鈉-多糖復合膠粒的包埋率(約90%)[16]。進一步研究發現,提高SCNC與SCNF的添加量對副干酪乳桿菌R37的包埋率影響不顯著。這些結果說明SCNF的加入能更好地提高海藻酸鈉膠粒的包埋率,這可能與CNF具有更高的比表面積[18],能夠較大程度地黏附菌體有關。
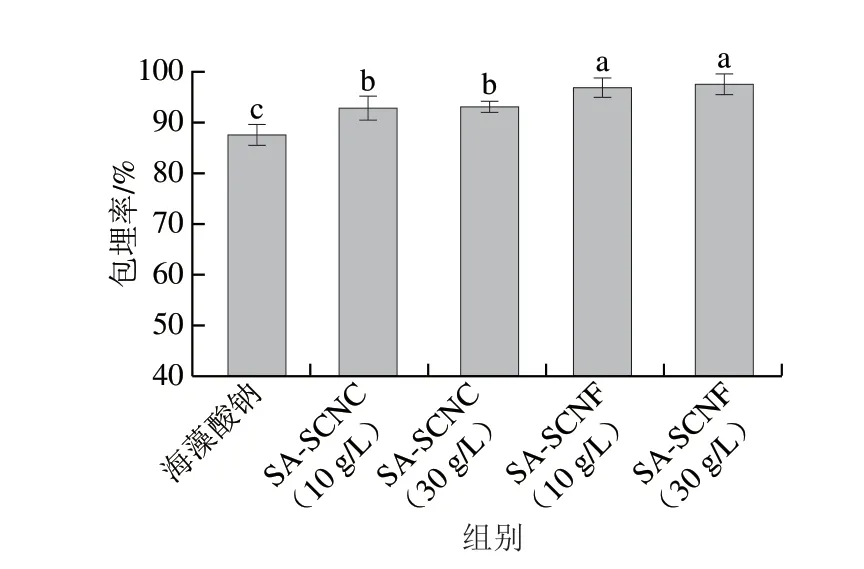
圖1 海藻酸鈉-納米纖維素膠粒對乳酸菌的包埋率Fig.1 Encapsulation efficiency of LAB in SA-nanocellulose beads
2.2 海藻酸鈉-納米纖維素膠粒的微觀形態
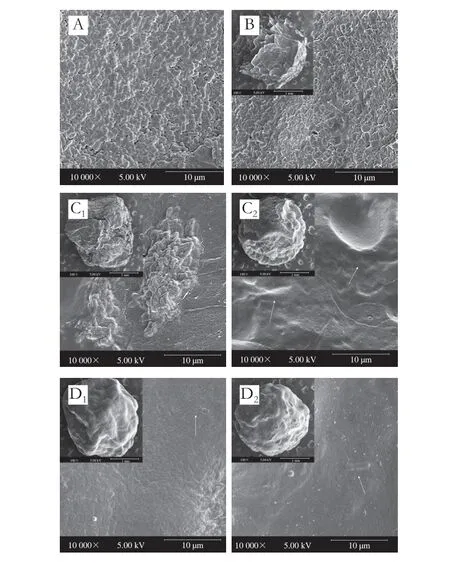
圖2 海藻酸鈉-納米纖維素膠粒的形態(×100)及表面結構(×10 000)Fig.2 Morphology (× 100) and microstructure (× 10 000) of SA-nanocellulose beads
不同類型的海藻酸鈉-納米纖維素膠粒的微觀形態如圖2所示。副干酪乳桿菌R37呈現乳酸菌典型的棒狀形態,菌體表面平整,尺寸約為2~5 μm(圖2A)。海藻酸鈉膠粒呈現扁球狀,表面粗糙且伴有孔狀間隙,經海藻酸鈉膠粒包埋的乳桿菌R37主要分布于膠粒的表面。當SA體系中加入納米纖維素后,膠粒呈現圓球狀,但表面形態發生明顯變化,變化程度與納米纖維素的種類有關。與海藻酸鈉膠粒相比,SA-SCNC膠粒表面缺少孔隙結構,呈現粗糙的表面形態,大量的乳桿菌R37聚集黏附在膠粒表面。當SCNC的添加量為30 g/L時,SA-SCNC膠粒的表面裂紋消失。另一方面,當海藻酸鈉中添加SCNF后,SA-SCNF膠粒表面的粗糙起伏程度變弱,呈現出更加致密的表面形態,只有少量的乳酸菌在表面上可觀察到,說明大量的乳桿菌R37被包裹在膠粒的內部。進一步觀察發現,SCNF添加量的增大使得復合膠粒的表面變得更加光滑平整。這些觀察結果表明納米纖維素的加入會優化海藻酸鈉膠粒的表面形態,從而影響乳桿菌R37在膠粒中的分布狀況,相比于添加SCNC,海藻酸鈉能夠與SCNF形成更加致密的微觀結構。基于此,有必要對不同形態膠粒的結構進行研究。
2.3 海藻酸鈉-納米纖維素膠粒的官能團結構及氫鍵結合狀態
不同類型的海藻酸鈉-納米纖維素膠粒的官能團結構如圖3A所示。海藻酸鈉膠粒顯示出4 個明顯的特征峰(1 030、1 430、1 600、3 400 cm-1),其中1 030 cm-1處的特征峰表示鈣離子鹽橋上醚鍵(—O—)的拉伸振動[19],1 430 cm-1與1 600 cm-1處的特征峰表示海藻酸鈉羧酸基團(—COOH)的不對稱振動與對稱拉伸振動[20],而3 400 cm-1處的特征峰表示海藻酸鈉分子間羥基的伸縮振動[21],其強度反映體系中氫鍵的締合程度。所有樣品的傅里葉變換紅外光譜圖在1 700 cm-1處均顯示出一個明顯的羰基振動吸收峰,但該吸收峰可能是來源于酸度調節劑檸檬酸的羧基[22]。當海藻酸鈉體系中添加納米纖維素后,這些特征峰的位置并沒有出現明顯偏移,說明在離子交聯形成膠粒的過程中未有新的化學鍵生成。進一步觀察發現,當納米纖維素的添加量增大時,1 030 cm-1與3 400 cm-1振動吸收峰透光率下降,振動吸收強度增加。其中SA-SCNF(30 g/L)膠粒顯示出最低的透光率,分別為0.641與0.507,分別是海藻酸鈉膠粒的75.32%與71.10%。這些結果表明納米纖維素有利于強化海藻酸鈉凝膠體系的鹽橋結構與氫鍵結構,其中纖維素微纖絲比較纖維素微晶發揮著更加重要的作用。
T2弛豫時間對1H原子運動十分敏感,可間接反映海藻酸鈉凝膠中水分的結合狀態,從而判定凝膠體系中的氫鍵形成強弱[23-24]。根據水分的自由程度差異,水分的結合狀態可被大致分為3 類:結合水(T21:1~10 ms)、束縛水(T22:10~100 ms)、自由水(T23:100~1 000 ms)[25]。海藻酸鈉-納米纖維素膠粒中水分的T2弛豫時間如圖3B所示。所有膠粒都展現出唯一的單峰形態,說明膠粒的水分分布均一,從而能夠有效束縛溶劑中的水分子。與海藻酸鈉膠粒相比,SA-SCNC膠粒的水分分布向低弛豫時間轉移,且偏移程度隨納米纖維素的添加量增加而增大,SA-SCNF膠粒較SA-SCNC膠粒具有更低的弛豫時間。當SCNF的添加量為30 g/L時,SA-SCNC膠粒的弛豫時間為25.53 ms。這些結果表明納米纖維素的多羥基結構可提高海藻酸鈉體系的成氫鍵能力,從而增強對自由水的有效束縛。另外,Mishnaevsky等采用計算機系統模擬了納米纖維素結構與高聚物之間的相互作用,確定了納米纖維素的強化機制不僅與分子間非共價作用力(氫鍵、范德華力)的強弱有關,同時還取決于纖維素是否呈現封閉的微觀形態[26]。SCNF在形態上表現為相互纏繞[27],具有更大的比表面積,在空間內能形成更加致密的網絡結構,這可能也是微纖絲能夠提高海藻酸鈉膠粒持水能力的重要原因。此結果與海藻酸鈉-納米纖維素膠粒的傅里葉變換紅外光譜分析結果一致,進一步證明了與SCNC相比,SCNF能夠通過強化分子間氫鍵相互作用,更好地維持海藻酸鈉凝膠的網絡結構。
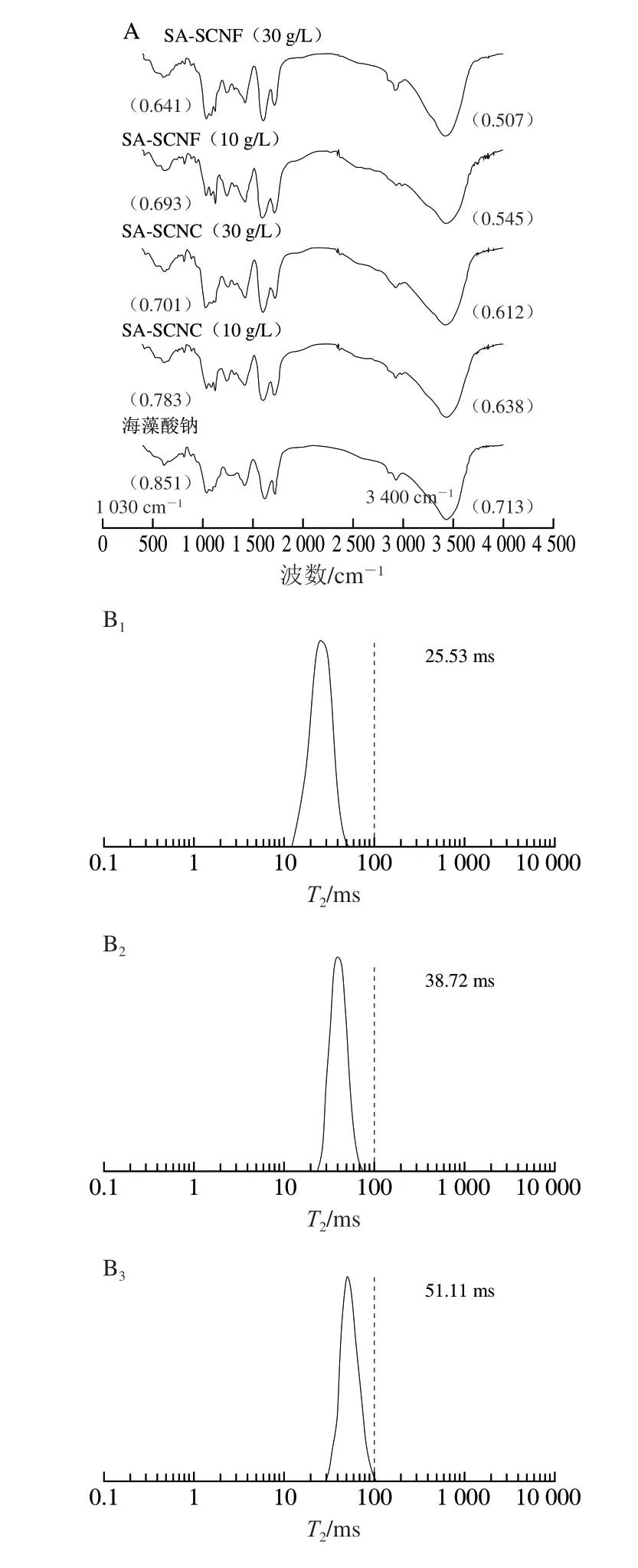
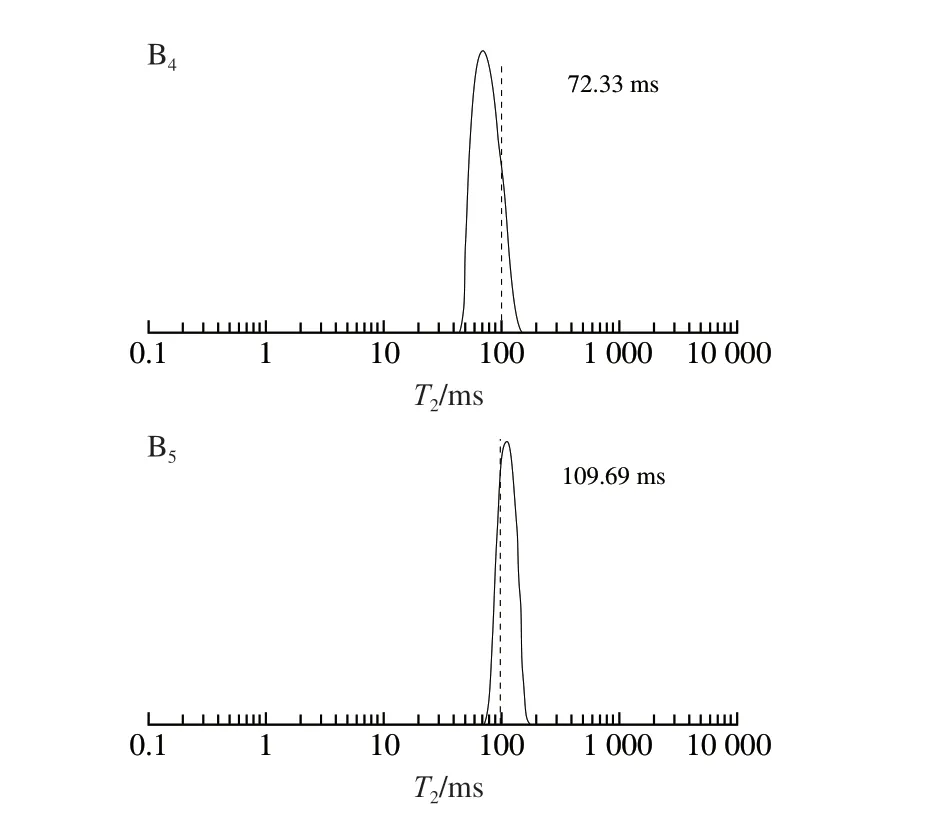
圖3 海藻酸鈉-納米纖維素膠粒的傅里葉變換紅外光譜圖(A)與低頻氫譜核磁圖(B)Fig.3 Fourier transform infrared spectra (A) and low-frequency 1H nuclear magnetic resonance (B) of SA-nanocellulose beads
2.4 海藻酸鈉-納米纖維素膠粒經胃腸液消化后的硬度變化
不同類型的海藻酸鈉-納米纖維素膠粒經胃腸液消化后的硬度差異如表1所示。海藻酸鈉膠粒在模擬胃液消化過程中結構穩定,膠粒的硬度未發生明顯變化。然而,海藻酸鈉膠粒經模擬腸液消化后,硬度下降為初始值的31.1%,這可能是海藻酸鈉分子鏈的—COOH在堿性條件下電離程度下降,分子鏈趨向展開所致[28-29]。納米纖維素可顯著增加海藻酸鈉膠粒的硬度并表現出濃度依賴性,SA-SCNC(30 g/L)膠粒與SA-SCNF(30 g/L)膠粒的硬度分別為海藻酸鈉膠粒的153.8%與215.1%。進一步研究發現,與海藻酸鈉相比,SA-SCNF膠粒經胃腸液消化后的硬度變化大幅度減小,這說明SCNF的加入更有利于穩定海藻酸鈉膠粒的凝膠網絡結構,避免膠粒經胃腸液消化后機械強度發生較大程度變化。推測SCNF具有強氫鍵締合能力[30],能夠抑制海藻酸鈉的分子鏈在腸液環境中的快速溶脹。
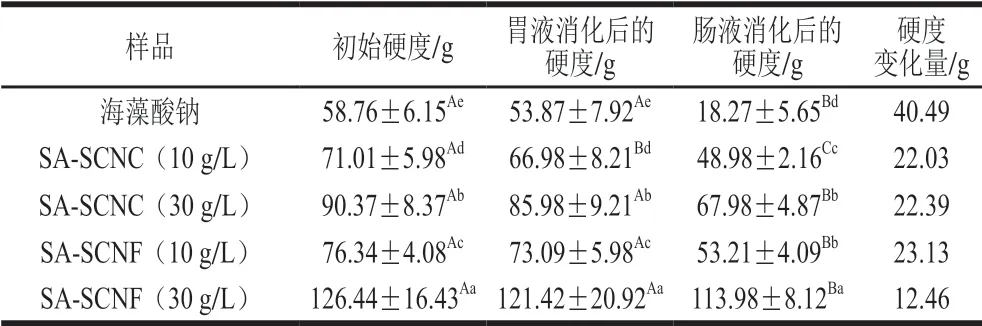
表1 海藻酸鈉-納米纖維素膠粒在胃腸液消化后的硬度變化Table 1 Changes in hardness of SA-nanocellulose after digestion in stimulated gastrointestinal fluid
2.5 海藻酸鈉-納米纖維素膠粒在胃腸液消化過程中的活菌數量變化
不同類型的海藻酸鈉-納米纖維素膠粒經模擬胃腸液消化后活菌損失量如圖4所示。乳酸菌R37經模擬胃腸液消化后活菌數量出現大量損失,由9.27(lg(CFU/g))下降為5.43(lg(CFU/g))。與裸菌相比,海藻酸鈉載菌膠粒經模擬胃腸液耐受后活菌數量由9.25(lg(CFU/g))減少為6.26(lg(CFU/g)),下降了2.99(lg(CFU/g))。此結果與許多研究報道相似,證實了單純采用海藻酸鈉膠粒負載乳酸菌對提高其胃腸道耐受能力十分有限[31-32]。當納米纖維素的添加質量濃度為30 g/L時,SA-SCNC膠粒經模擬胃腸液消化后活菌數量由9.37(lg(CFU/g))減少為7.21(lg(CFU/g)),下降了2.16(lg(CFU/g));然而,SA-SCNF膠粒的活菌數量變化幅度更小,由9.32(lg(CFU/g))減少為7.81(lg(CFU/g)),下降了1.51(lg(CFU/g))。這些結果說明納米纖維素的加入對提高乳酸菌的胃腸道耐受能力有著積極的影響,不同類型的納米纖維素的影響效果不同,添加SCNF比SCNC能更好地改善海藻酸鈉膠粒對乳酸菌R37的保護效果。有研究報道了高聚物膠粒的機械強度與乳酸菌的胃腸道存活率呈現正相關關系[33]。這與本研究結果一致,增加納米纖維素質量濃度有利于提高海藻酸鈉膠粒機械強度與穩定性,從而增強膠粒對胃腸液的阻隔效果。
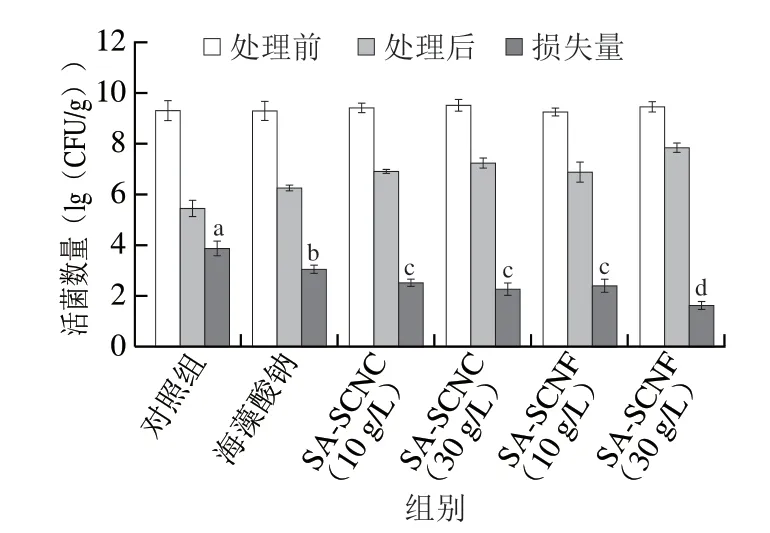
圖4 載菌海藻酸鈉-納米纖維素膠粒經模擬胃腸液消化后的活菌數量變化Fig.4 Changes in viability of LAB in SA-nanocellulose beads after simulated gastrointestinal fluid treatment
3 結 論
豆渣納米纖維素可改善海藻酸鈉膠粒的表面形態與分子間作用力,進而影響膠粒對乳酸菌的保護作用,其中SCNF較SCNC表現出更好的改性效果。SCNF的加入不僅提高了海藻酸鈉膠粒的包埋率,同時也降低了膠粒表面的粗糙度,抑制了孔隙產生,賦予膠粒更加致密平整的微觀形態,這與SCNF能夠提高海藻酸鈉分子鏈的氫鍵締合能力以及增加與Ca2+之間形成鹽橋數量有關。進一步研究發現,這些結構致密的SA-SCNF膠粒經模擬胃腸液消化后能夠更好地維持原有的機械強度,并對乳酸菌胃腸道逆環境起到良好的保護效果。另一方面,SCNF的添加對增加乳酸菌胃腸道逆環境耐受性具有積極影響。SCNF復合膠粒經模擬胃腸液消化后活菌數量超過107CFU/g,顯著高于海藻酸鈉載菌膠粒的106CFU/g。

