敲除ABRO1對小鼠胚胎成纖維細胞(MEF)LPS/TLR4通路活化的影響①
李東旭 張 文 葛志強 詹軼群 尹榮華 楊曉明
(天津大學化工學院制藥工程系,天津 300072)
脂多糖(LPS)是革蘭氏陰性細菌細胞壁外壁的組成成分,由脂質和多糖構成,是天然免疫反應中最有效的刺激因子之一[1]。Toll樣受體4(TLR4)是一種與天然免疫反應密切相關的受體,廣泛分布于免疫細胞的細胞膜表面。TLR4通過識別LPS活化NF-κB和MAPK信號通路等,誘導多種炎癥相關基因的表達,進而介導免疫應答和抵抗病原體入侵[1-2]。此外,LPS誘導的TLR4信號通路的過度激活是多種炎癥性疾病發生的主要原因,如敗血癥、內毒素導致的慢性肝病重癥化等[3]。發現新的LPS/TLR4信號通路的調控因子及調控機制對相關疾病的治療具有重要意義。
ABRO1(abraxas brother 1),也被稱為KIAA0157或FAM175B,與BRCC36、MERIT40和BRCC45共同組裝形成BRISC復合體。BRISC復合體是一種特異性去除K63泛素化的去泛素化酶,其中ABRO1與BRCC3是最重要的兩個亞基,BRCC3具有去泛素化功能,ABRO1具有酶活性的催化功能,共同調節BRISC的去泛素化酶活性[4]。ABRO1在各類細胞中均有表達,參與不同的生理過程,包括炎癥反應、細胞分裂、DNA損傷反應等[5-6]。ABRO1敲除小鼠可以抵抗LPS誘導的敗血癥,其外周血單個核細胞中,IL-1β和IFN-β等細胞因子的mRNA水平明顯降低,在小鼠骨髓來源巨噬細胞(BMDM)中,敲除ABRO1和BRCC3并不影響LPS/TLR4信號通路活化,然而ABRO1和BRCC3缺失會阻斷NLRP3炎癥小體組裝,進而抑制IL-1β和IL-18分泌[7-8]。綜上所述,ABRO1在LPS/TLR4通路活化中的作用仍未確定。
本文主要探討ABRO1在小鼠胚胎成纖維細胞(mouse embryonic fibroblast,MEF)細胞中對LPS/TLR4信號通路的調節作用[8]。研究發現敲除ABRO1并不影響LPS/TLR4信號通路的活化,提示ABRO1對LPS/TLR4通路的調節可能具有細胞選擇性。
1 材料與方法
1.1材料
1.1.1小鼠 ABRO1敲除小鼠(C57BL/6)由本實驗室建立并飼養于軍事科學院軍事醫學研究院實驗動物中心。選取SPF級8周齡、體重20~22 g、雌雄ABRO1雜合小鼠進行交配,選擇孕期為13.5 d的孕鼠分離MEF細胞。
1.1.2細胞和質粒 HEK-293T細胞購自ATCC,用含10%FBS的DMEM完全培養基培養;慢病毒包裝質粒psPAX2、pMD2和熒光素酶報告基因載體pCDH-NF-κB-Luciferase為實驗室保存。
1.1.3主要試劑 DMEM培養基、RPMI1640培養基、胎牛血清(FBS,Gibco公司);LPS(Sigma公司);Pierce ECL化學發光底物(美國Thermo scientific 公司);ABRO1抗體為實驗室定制(ABclonal公司);ACTB抗體(ABclonal公司);p-P65、P65、p-IκBα、IκBα、p-P38、P38、p-ERK、ERK、p-JNK和JNK抗體(CST公司);IL-6流式微球陣列(CBA)試劑盒(BD公司);雙熒光素酶報告基因活性檢測試劑盒、反轉錄試劑盒(Promega公司);TRIzol(北京威格拉斯公司);定量PCR試劑盒(Thermo 公司);慢病毒包裝試劑盒(System Biosciences公司)。
1.1.4主要儀器 細胞培養箱3111型(美國Thermo scientific 公司);NanoDrop 2000超微量分管光度計(美國Thermo scientific 公司);流式細胞儀LSRFortessa型(BD公司);PCR儀(美國Bio-Rad公司);電泳儀(美國Bio-Rad公司);顯微鏡成像(奧林巴斯);熒光檢測儀(Promega公司)等。
1.2方法
1.2.1MEF的分離培養 將懷孕13.5 d的ABRO1雜合小鼠放到鼠籠里,脫頸椎法處死小鼠,將小鼠浸泡在酒精中3~4 min,然后將已處死的孕鼠拿到超凈臺上的盤子中,用剪刀和鑷子取出胚胎,將胚胎放到PBS中,去除頭、四肢和內臟,轉移至新的培養皿中,用手術刀細細切碎,37℃胰酶消化30 min,每隔5 min輕輕吹打使之消化充分,然后加入含10%FBS的DMEM終止消化,用200目的尼龍網過濾后,將濾液轉移至新的50 ml離心管中,4℃,1 000 r/min 離心5 min,DMEM清洗2次,棄上清,用1 ml DMEM重懸細胞沉淀,計數板計數,按一定密度接種于新的60 mm細胞培養皿中,用含有10%FBS,1%P/S的DMEM傳代培養1~2代。
1.2.2細胞因子檢測 傳代培養2代后,進行消化處理,重新按1×106個/ml接種到24孔板,細胞貼壁過夜。加入10 ng/ml、100 ng/ml或1 μg/ml LPS刺激,分別于0、6、12 h收取細胞培養基上清。參照說明書,利用CBA法檢測IL-6的濃度,簡述如下:取50 μl樣本,用PBS稀釋5倍,與含有2 μl 磁珠、2 μl PE和100 μl PBS混合后,室溫避光孵育1.5 h,用PBS清洗1次,然后流式細胞儀檢測。
1.2.3Western blot 分別接種ABRO1 KO和WT的MEF細胞于12孔板中,貼壁過夜,更換新的不含血清的DMEM饑餓3 h,用1 μg/ml LPS刺激0、15、30、60 min后,吸棄培養基,用PBS清洗1次后吸棄,每孔加入120 μl 2× loading buffer裂解細胞,收集于1.5 ml EP管中,將細胞裂解液樣品沸水煮 15 min 后,每孔8 μl樣品進行SDS-聚丙烯酰胺凝膠電泳,電轉至PVDF膜上,用5%脫脂牛奶封閉2 h,4℃旋轉孵育ABRO1、ACTB、p-P65、P65、p-IκBα、IκBα、p-P38、P38、p-ERK、ERK、p-JNK和JNK等抗體,孵育過夜,TBST洗3次,每次7 min,室溫孵育二抗1 h,TBST洗3次,每次7 min,ECL法暗室顯影檢測相關通路蛋白。
1.2.4qPCR 提取ABRO1 KO和WT小鼠MEF細胞RNA:每個樣品加1 ml TRIzol,反復吹打,搖床搖10 min,使蛋白與核酸完全分離;每個樣品加入200 μl氯仿,振蕩15 s,4℃,12 000 r/min離心15 min,把上層轉移至新的RNase-free EP管中;加入同等體積異丙醇,上下顛倒混勻,冰上孵育30 min;4℃,12 000 r/min離心10 min,棄上清,75%酒精洗滌沉淀;4℃,12 000 r/min離心5 min,吸棄上清,待乙醇完全揮發干凈,加入50 μl無RNase水,使其充分溶解后,NanoDrop 2000測定RNA濃度和純度,樣本無明顯雜峰,OD值在1.8~2.0之間即為合格樣本。將RNA逆轉錄后,進行qPCR,檢查溶解曲線、擴增曲線、CT值等,然后計算作圖。PCR 引物序列:IL-6上游5′-GGCGGATCGGATGTT-GTGAT-3′;下游:5′-GGACCCCAGACAATCGGTTG-3′;TNF-α上游:5′-GACGTGGAACTGGCAGAAGAG-3′;下游:5′-TTGGTGGTTTGTGAGTGTGAG-3′;IL-1β上游:5′-GAAATGCCACCTTTTGACAGTG-3′,下游:5′-TGGATGCTCTCATCAGGACAG-3′;GAPDH 上游5′-AGGTCGGTGTGAACGGATTTG-3′,下游 5′-TGT-AGACCATGTAGTTGAGGTCA-3′。
1.2.5慢病毒包裝制備和MEF細胞感染 為制備慢病毒顆粒,在10 cm細胞培養皿中培養293T細胞,用15 μg pCDH-NF-κB-Luciferase表達載體、10 μg psPAX2(Addgene)和5 μg pMD2.G(Addgene)進行轉染,轉染8 h后,更換為含10%FBS,1%P/S的DMEM培養基,再過40 h后,收集培養基上清,1 000 r/min 離心10 min,上清液通過0.45 μm膜過濾,預冷的PEG-it 病毒沉淀溶液(System Bioscien-ces,LV810A)加入到上清中,上清與PEG-it的混合液4℃條件過夜,4℃,1 650 r/min離心 30 min,去除沉淀,收集懸浮著慢病毒顆粒的上清液,10 μl等量分裝儲存于-80℃冰箱中。用制備好的慢病毒顆粒對MEF細胞進行感染。
1.2.6熒光素酶報告基因活性檢測 吸棄感染熒光素酶報告基因的MEF細胞上清,加入被動裂解液,室溫裂解15 min,收集細胞裂解液上清,轉移至新的96孔板中,參照儀器和熒光素酶報告基因活性檢測試劑盒說明書,用熒光檢測儀檢測熒光。計算報告基因與內參基因的熒光素酶活性比值,即熒光素酶活性。
1.3統計學處理 采用GraphPad Prism 7.0軟件進行數據分析,組間差異采用雙側t檢驗,P<0.05為差異具有統計學意義。
2 結果
2.1ABRO1敲除和WT小鼠MEF細胞的分離培養與表達鑒定 取孕期為13.5 d孕鼠胚胎,制備成ABRO1 KO和WT MEFs,Western blot鑒定MEF細胞,證實ABRO1 KO MEF細胞中無ABRO1表達,而WT MEF細胞中ABRO1正常表達(圖1)。說明ABRO1 KO和WT MEF細胞構建成功。
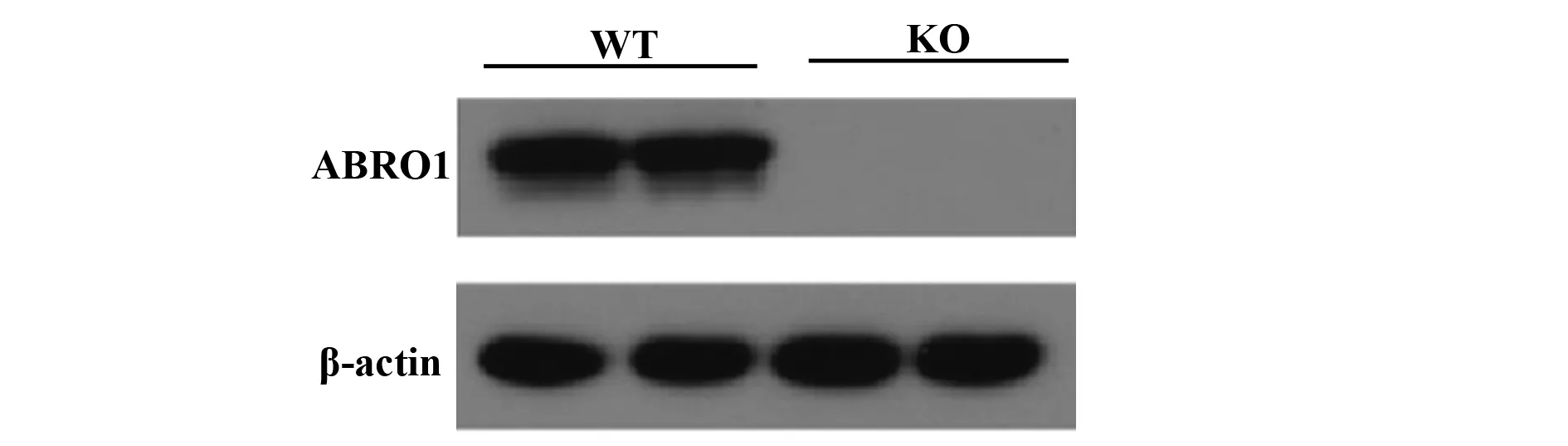
圖1 MEFs細胞中ABRO1蛋白表達鑒定
2.2敲除ABRO1不影響MEF細胞中LPS誘導的IL-6釋放 傳代2次后的MEF細胞重新消化,種板,分別用10 ng/ml、100 ng/ml和1 μg/ml 3種劑量的LPS刺激MEF細胞0、6、12 h,收取細胞培養基上清,流式CBA法檢測炎癥因子IL-6的含量,結果顯示,靜息態MEF細胞分泌極少量IL-6,而LPS刺激6 h或12 h可以促進IL-6的大量分泌;但是,無論在何種刺激濃度和刺激時間下,ABRO1 KO和WT MEF細胞產生的IL-6水平都基本一致(圖2A~C)。
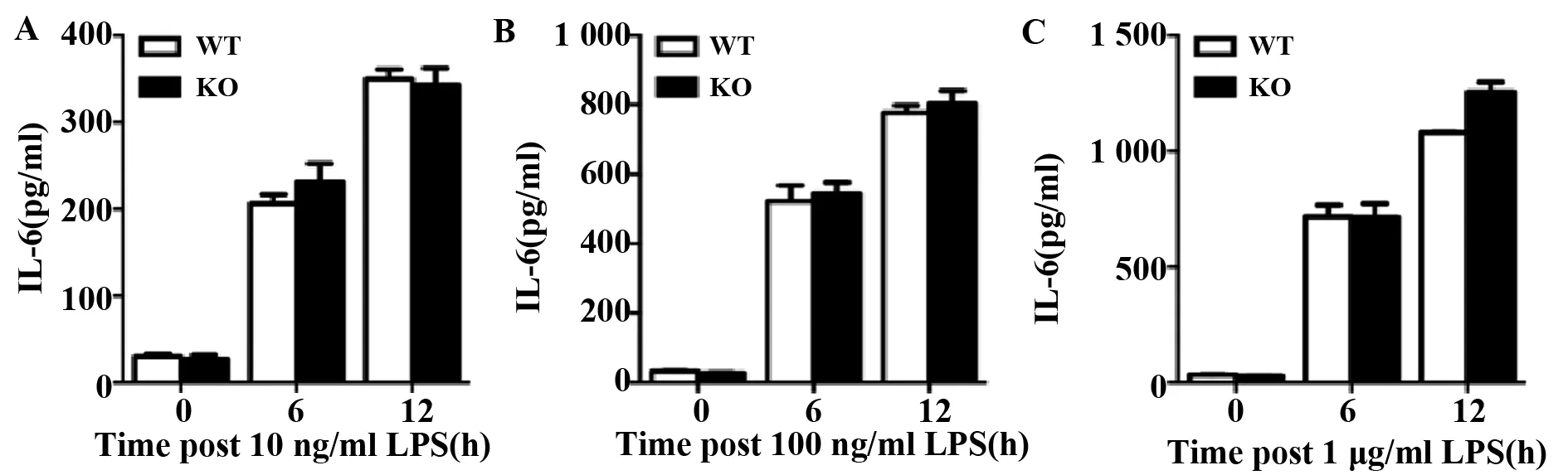
圖2 敲除ABRO1不影響MEF細胞中LPS誘導的IL-6的釋放
2.3敲除ABRO1不影響MEF細胞中LPS誘導的IL-6、IL-1β和TNF-α的mRNA水平 1 μg/ml LPS刺激MEF細胞0 h和3 h,收集細胞提取RNA,用qPCR檢測IL-6、IL-1β和TNF-α的mRNA水平。結果顯示,LPS刺激3 h顯著提高了IL-6、IL-1β和TNF-α的mRNA水平,但ABRO1 KO和WT MEF細胞中這3種細胞因子的mRNA水平基本一致(圖3A~C)。
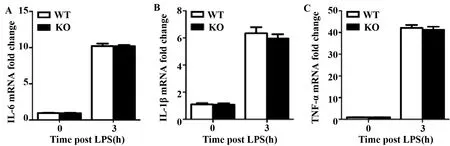
圖3 敲除ABRO1不影響MEFs細胞中LPS誘導的IL-6、IL-1β和TNF-α的mRNA水平
2.4敲除ABRO1不影響MEF細胞中LPS-TLR4信號通路的活化 進一步檢測了敲除ABRO1對TLR4下游信號通路活化的影響,主要包括NF-κB和MAPK信號通路。Western blot結果顯示,LPS刺激后MEF細胞IκBα蛋白水平迅速降低,在之后60 min 恢復到較高水平;p-IκBα和p-P38在15 min和60 min出現2次表達峰;但ABRO1敲除并不影響IκBα降解以及P65、IκBα、P38、ERK、JNK磷酸化水平的動態變化(圖4)。

圖4 敲除ABRO1不影響MEF細胞LPS/TLR4信號通路的活化
2.5敲除ABRO1不影響MEF細胞中NF-κB報告基因活性 利用慢病毒將NF-κB報告基因轉入到MEF細胞中,1 μg/ml LPS分別刺激0、3、6 h,結果顯示,LPS刺激顯著提高NF-κB報告基因活性,但ABRO1 KO和WT的MEF細胞中NF-κB報告基因的活性無顯著差異(圖5)。
3 討論
本研究重點揭示了敲除ABRO1對MEF細胞LPS/TLR4通路活化的影響。結果顯示,缺失ABRO1并不影響MEF細胞中LPS誘導的IL-6的分泌及IL-6、IL-1β和TNF-α的mRNA水平;ABRO1 KO MEF細胞中,LPS誘導的TLR4下游NF-κB和MAPK信號通路的活化并無明顯異常;敲除ABRO1也并不影響LPS對NF-κB報告基因的激活。因此,敲除ABRO1不影響MEF細胞中LPS/TLR4通路的活化。LPS/TLR4通路活化后會激活多種轉錄因子,其中NF-κB最為關鍵。正常情況下NF-κB/P65被IκBα限制在胞質,LPS刺激促進IκBα磷酸化,進而IκBα發生降解,釋放NF-κB,NF-κB入核后與目的基因特異性結合并使其轉錄[9]。類似NF-κB通路,LPS/TLR4活化也會促進ERK、JNK和P38發生磷酸化,激活相關核蛋白和轉錄因子,如AP1等[10]。IL-6等炎癥細胞因子是轉錄因子NF-κB所調控的靶基因,在LPS/TLR4介導的炎癥反應及相關疾病中起關鍵作用[11-12]。本研究重點檢測了ABRO1 KO及WT MEF細胞中NF-κB和MAPK信號通路的活化、NF-κB報告基因的活性、炎癥因子IL-6、IL-1β和TNF-α的轉錄以及IL-6的分泌,以探討ABRO1對MEF細胞LPS/TLR4通路的影響。
已有研究表明,BRISC在免疫反應中發揮著重要作用。BRISC可以調節Ⅰ型干擾素受體IFNAR1的去泛素化并促進其活化,進而參與抗病毒反應[13]。BRISC也可以調節NLRP3去泛素化,進而促進NLRP3炎癥小體活化[7]。BRISC還可以通過調節HIV-1病毒Tat蛋白K63位去泛素化,控制其自噬途徑的降解[14]。在小鼠骨髓來源巨噬細胞(BMDM)中,敲除ABRO1和BRCC3并不影響LPS/TLR4信號通路的活化[15]。但是LPS處理后的ABRO1敲除小鼠外周血單個核細胞中,IL-1β和IFN-β等細胞因子的mRNA水平明顯降低,提示敲除ABRO1可能抑制了某些細胞中LPS/TLR4通路的活化[13]。MEF細胞是研究天然免疫的重要材料,MEF細胞并不是發揮免疫功能的細胞,只有在外界刺激下才產生應答并分泌炎癥因子或化學因子等,分泌細胞因子的能力強,MEF細胞的分離比分離純化免疫細胞更方便,MEF細胞屬于貼壁培養細胞,而大多數免疫細胞屬于懸浮細胞,因此選用MEF細胞實驗過程更容易控制[16]。目前MEF是研究天然免疫過程中某個基因或信號通路較佳的細胞模型[8]。而ABRO1在小鼠MEF細胞中的功能研究尚未報道。我們分離了ABRO1 KO和WT MEF細胞,建立了LPS誘導小鼠MEF細胞炎癥模型,發現ABRO1敲除并不影響LPS誘導的炎癥細胞因子IL-6的分泌以及TLR4下游NF-κB和MAPK信號通路的活化。說明ABRO1對LPS/TLR4通路的影響可能具有細胞特異性,需要后續進一步確定。

