辣蓼黃酮對小鼠免疫功能調節作用的研究
謝映紅,李 璐,肖 琦,于美玲,胡庭俊
(廣西大學動物科學技術學院,廣西 南寧 530005)
辣蓼是蓼科蓼屬一年生草本植物,味辛、溫,具有祛風利濕、散瘀止痛、解毒消腫等功效[1]。辣蓼的主要成分有黃酮類、揮發油、鞣質類、脂肪酸、三萜類、糖苷、蓼酸等。黃酮類化合物是一類重要的植物次生代謝產物,普遍存在于天然植物的根莖葉及花果中,具有抑菌、抗氧化、抗腫瘤、抗心血管病、抗炎癥等藥理作用[2-4]。但關于辣蓼黃酮在免疫藥理方面的研究報道較少。環磷酰胺(CTX)是臨床上常用的細胞毒性化療藥物,其在殺傷腫瘤細胞的同時,可損傷機體的免疫器官,抑制機體的體液免疫和細胞免疫反應,造成免疫功能的低下[5]。本試驗選用環磷酰胺作為抑制劑建立小鼠免疫抑制模型,旨在研究辣蓼黃酮正丁醇部分(FNB)對小鼠的免疫功能的調節作用,為辣蓼黃酮的進一步研究提供參考。
1 材料與方法
1.1 試驗材料
1.1.1 試驗藥物
辣蓼黃酮正丁醇部分(FNB),FNB中黃酮含量為52.84%,由廣西大學動物科學技術學院藥理實驗室提取。
1.1.2 試驗動物
試驗選用SPF清潔級別健康的5~6周齡昆明小鼠60只,雌、雄各半,體重18~22 g,生產許可證號為:SCXK桂2014-0002,購自廣西醫科大學實驗動物中心。
1.1.3 試驗飼料
SPF飼料由廣西醫科大學實驗動物中心提供的小鼠全價飼料。
1.1.4 試驗試劑
結晶紫溶液(天津富宇精細化工)、苦味酸(斯百全化學有限公司,貨號:P1691)、中性樹膠(上海國藥集團,批號:20150730)、瑞士-姬姆薩染液(貝索Baso)、甲醛(成都市科龍化工試劑廠)、注射用環磷酰胺(安道生,0.2g/瓶/盒,批號:5K087A)、氯化鈉(貴州天地藥業公司,批號:H20033973)、無水乙醇(天津富宇精細化工有限公司)。小鼠溶菌酶試劑盒、小鼠黃嘌呤氧化酶試劑盒、小鼠髓過氧化物酶試劑盒、小鼠一氧化氮合酶試劑盒、小鼠一氧化氮試劑盒、小鼠微量還原型谷胱甘肽試劑盒均購自南京建成研究所;小鼠γ干擾素試劑盒、小鼠免疫球蛋白試劑盒、小鼠白細胞介素12試劑盒、小鼠白細胞介素2試劑盒均購自江蘇晶美生物公司。
1.1.5 試驗儀器
電子分析天平(METTLER TOLEDO,AB104-L,EL204瑞士)、超純水機(Direct-Q,5UV型,密理博)、去離子水機(CD-UPT-1,成都純越)、電熱恒溫水浴鍋(HH-W21型,北京長源設備廠)、高速離心機(Eppendorf,Centrifuge 5418)、超低溫冰箱(-80 ℃)(SANYO,MDF-U5386S)、超速低溫離心機(SIGMA,3K15)、全自動切片機(德國,徠卡)、多功能酶標儀(瑞士)、紫外分光光度儀(型號:Uvmini1240,日本,島津)、光學顯微鏡(奧林巴斯,日本株式會社)、微量離心機(Sigma,1-14型,美國)、電熱恒溫培養箱培養箱(天津泰斯特,WP25)、通風柜(型號:HDR-B07,科藝)、超凈工作臺(安泰空氣技術有限公司,SWCJ-2F)、高壓滅菌器(致微(廈門)儀器有限公司,GI36D)。
1.2 試驗方法
1.2.1 動物試驗
將SPF清潔級別60只昆明種小鼠隨機分成6組,每組10只,雌、雄各半,分籠飼養,每籠5只。小鼠正常飼養3 d后進行正式試驗。試驗設空白對照組、陽性對照組、最低劑量組(CTX+25 mg/kg FNB)、低劑量組(CTX+50 mg/kg FNB)、中劑量組(CTX+100 mg/kg FNB)、高劑量組(CTX+150 mg/kg FNB),連續給藥7 d。各組小鼠處理方式見表1。
1.2.2 測定指標及方法
1.2.2.1 臨床表現
每天定時觀察并記錄小鼠的臨床表現及活動情況,包括飲水、采食、精神狀況、被毛狀況、健康狀況及日常活動。觀察小鼠是否出現與藥物相關的不良反應,記錄小鼠不良反應出現的時間、程度、持續時間。
表1 各組小鼠處理方式Tab.1 Treatments of mice
1.2.2.2 血液生化指標及炎性因子水平
給藥7 d后,最后一次給藥后1 h,剖殺小鼠,對小鼠進行眼球采血,各組分別用1.5 mL EP管裝取小鼠眼眶所采集的血液,所采的血液不加抗凝劑,血液樣品于常溫下傾斜靜置2 h,取上層血清,嚴格按照試劑盒說明書分別測定白細胞介素2(IL-2)、白細胞介素12(IL-12)、免疫球蛋白(IgG)、γ干擾素(IFN-γ)、溶菌酶(LZM)、黃嘌呤氧化酶(XOD)、髓過氧化物酶(MPO)、一氧化氮合酶試劑盒(NOS)、一氧化氮(NO)、微量還原型谷胱甘肽(GSH)的含量。
1.2.2.3 臟器指數
采血后所有試驗小鼠頸椎脫臼處死,迅速解剖,采取脾臟和胸腺稱重,以小鼠臟器質量(mg)/體重(g)計算脾臟、胸腺的臟器指數。將脾臟和胸腺浸泡在福爾馬林固定液中固定7 d,制作組織切片,觀察胸腺和脾臟的組織學是否發生變化。
1.2.3 病理組織學檢查
給藥7 d后采血處死的小鼠,取脾臟和胸腺分別制作病理組織切片。通過固定、脫水、透明、浸蠟、包埋、修片與切片、展片與貼片、蘇木素伊紅(HE)染色、封片等步驟進行制作切片。觀察組織切片的組織形態是否發生變化,并且將病理變化攝成圖片。
1.3 數據統計與分析
采用SPSS 22.0軟件進行統計學分析,單因素方差分析檢驗其組間差異顯著性,用Duncan氏法進行多重比較,結果以“平均值±標準差”表示,P<0.01表示差異極顯著,P<0.05表示差異顯著。
2 結果與分析
2.1 臨床表現
試驗期間,陽性對照組(即注射環磷酰胺的試驗組)小鼠精神狀態較差、食欲減退、被毛粗亂,有部分小鼠出現脫毛現象,個體較消瘦。空白對照組和添加不同劑量的FNB試驗組飲食正常,精神狀態良好,組間體重差異不明顯。
2.2 FNB對免疫抑制小鼠臟器指數的影響(見表2)

表2 FNB對免疫抑制小鼠臟器指數的影響Tab.2 Effect of FNB on organ indices of immune suppressed mice (n=10) 單位 :mg/g
由表2可知,與空白對照組比較,陽性對照組各種臟器指數極顯著降低(P<0.01),表明成功建立免疫抑制的小鼠模型;與陽性對照組比較,不同劑量的FNB試驗組小鼠脾臟和胸腺指數有升高的變化。
2.3 FNB對免疫抑制小鼠細胞因子的影響(見表3)
由表3可知,與空白對照組比較,陽性對照組血清中IL-2、IL-12、IgG、INF-γ、LZM水平均明顯降低,(P<0.05),表明成功建立免疫抑制小鼠模型;與陽性對照組比較,不同劑量的FNB組中IL-12和IgG的水平顯著升高(P<0.05),其中在FNB中劑量組時LZM活性極顯著升高(P<0.01)。試驗結果表明,一定濃度的FNB能夠通過升高免疫抑制小鼠中的細胞因子水平而改善其免疫功能。
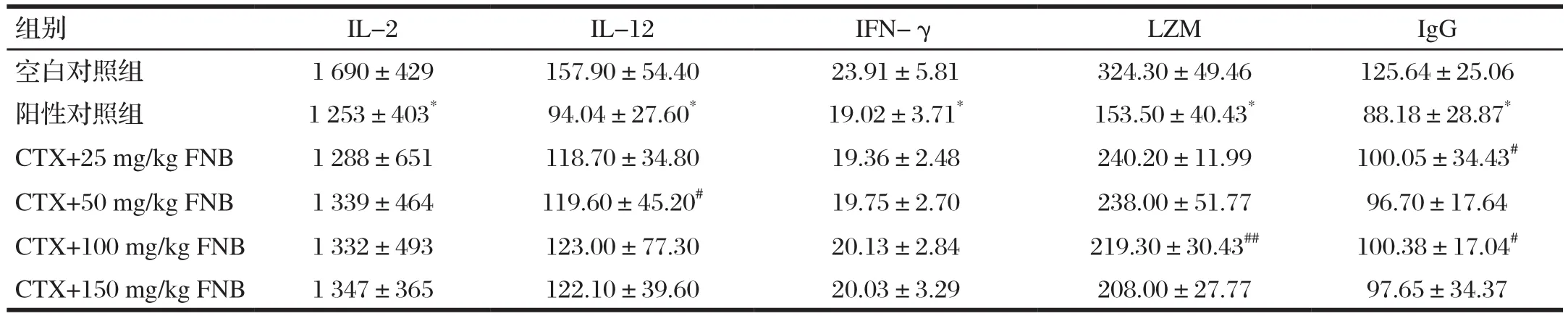
表3 FNB對免疫抑制小鼠細胞因子的影響Tab.3 Effect of FNB on cytokines in immunosuppressed mice(n=10) 單位 :ng/L
2.4 FNB對免疫抑制小鼠生化指標的影響(見表4)
由表4可知,與空白對照組比較,陽性對照組血清中的XOD、MPO、NOS、NO、GSH活力均顯著降低(P<0.05);各劑量FNB組中小鼠血清中的XOD、MPO、NOS、NO對比陽性組顯著升高(P<0.05),當FNB劑量達到150 mg/kg時,各指標水平均有下降的趨勢。結果表明,一定濃度的FNB能提高免疫抑制小鼠血清中MPO、NOS、NO等生化指標的活力,有利于維持機體自由基的產生和清除平衡,降低免疫抑制帶來的影響,從而改善其免疫功能。
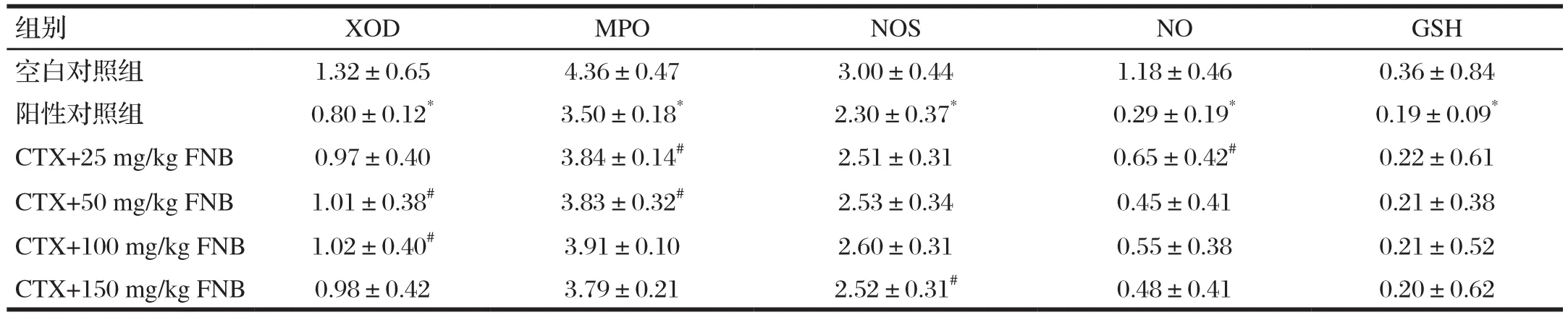
表4 FNB對免疫抑制小鼠生化指標的影響Tab.4 The effect of FNB on the biochemical indexes of immunosuppressed mice(n=10) 單位 :ng/L
2.5 小鼠脾臟和胸腺的病理組織學變化(見圖1、圖2)
由圖1可知,空白對照組小鼠脾臟的脾小體結構完整、脾淋巴細胞密集、細胞輪廓清晰。環磷酰胺對照組小鼠脾臟脾小體數量顯著減少、淋巴細胞稀疏、紅髓區內有數量不等的嗜中性粒細胞浸潤;不同濃度FNB組小鼠的脾小體尚可辨認,體積縮小,但淋巴細胞輪廓較清晰,局部見淋巴濾樣增生。
由圖2可知,空白對照組胸腺皮質和髓質結構清晰可辨,皮質區內淋巴細胞數量密集。環磷酰胺對照組和不同濃度FNB組小鼠胸腺皮質結構模糊,淋巴細胞數量減少,但環磷酰胺組胸腺組織內淋巴細胞明顯稀疏,不同濃度FNB組小鼠胸腺內淋巴細胞數量較多,呈小結樣增生。
3 討論
本試驗采用環磷酰胺建立小鼠免疫抑制模型,試驗觀察FNB對小鼠免疫功能的調節作用。結果表明,小鼠經環磷酰胺處理后,臨床表現個體消瘦、被毛粗亂、精神不佳;組織切片顯示脾臟脾小體數量顯著減少、胸腺皮質結構模糊;胸腺、脾臟指數低于空白對照組;同時環磷酰胺處理組小鼠血清中IL-2、IL-12、IgG、INF-γ的顯著下降,表明免疫抑制小鼠模型建立成功。
免疫調節可維持機體生理平衡與相對穩定,在預防感染、免疫監視中發揮著重要的作用。脾臟是機體重要的外周免疫器官,是成熟淋巴細胞定居場所,胸腺是T細胞發育成熟的重要場所,與細胞免疫和體液免疫密切相關[6]。李振卿[7]對地衣多糖對免疫抑制小鼠免疫功能進行研究,結果表明,地衣多糖能夠明顯提高免疫抑制小鼠的脾臟指數、胸腺指數,顯著提高免疫抑制小鼠的免疫功能。在本試驗中,與環磷酰胺處理組比較,不同劑量的FNB組中IL-12、LZM、IgG的水平顯著升高,其中IL-12可以有效激活NK 細胞,通過增強NK細胞的細胞毒性達到消除機體病原體和殺傷腫瘤細胞的目的,同時IL-12是T淋巴細胞的誘導因子,輔助T淋巴細胞增殖參與細胞免疫應答[8]。有研究表明,LZM通過破壞微生物細胞壁結構及抑制細胞膜內活性,從而致使機體內病原體裂解死亡[9]。此外,IgG也在自然被動免疫中起著至關重要的作用,IgG水平顯著升高從側面反映機體抵抗病原體的能力增強。因此,本試驗結果說明一定濃度的FNB能夠通過升高免疫抑制小鼠中的細胞因子水平而改善其免疫功能。
MPO可以使過氧化氫和氯離子反應生成次氯酸,次氯酸會氧化細胞成分,對病原微生物有殺滅作用,但當生成過量次氯酸,超過機體抗氧化防御能力時,反而會導致組織損傷[10]。胡小艷等[11]在金絲桃素對免疫抑制小鼠免疫功能和抗氧化能力的研究中發現,由環磷酰胺所致的免疫抑制小鼠MPO活性顯著下降,但金絲桃素對MPO活性無顯著影響。本研究中,免疫抑制小鼠血清中MPO活性也同樣顯著下降,但FNB處理后發現小鼠血清MPO活性增強,說明FNB可以調節MPO活性,降低機體免疫抑制帶來的影響。NOS有3種亞型,分別是神經元型(nNOS)、誘導型(iNOS)、內皮型(eNOS),對機體內神經系統、血管、平滑肌等發揮著重要的調節功能,NO是在NOS的催化作用下產生[12]。NO作為一種自由基,具有病理與生理的雙向調節作用,過量的NO會產生細胞毒性作用從而使機體正常細胞受損;體內適量的NO有利于維持機體穩態,發揮著免疫防御的作用[13-14]。因此,機體內的NOS活力和NO水平均需要維持在某種動態平衡狀態。在本試驗中,免疫抑制組小鼠的NOS活力和NO水平均顯著降低,對其給予各劑量的FNB后發現小鼠NOS活力和NO水平顯著升高。朱丹等[15]在金黃扶正茶對免疫抑制小鼠細胞免疫功能的研究中,免疫抑制組小鼠腹腔巨噬細胞NOS活力顯著降低,藥物組顯著上升。在對水產動物的研究中也呈現出相似結果。李義等[16]對竹筍多糖對免疫抑制中華絨螯蟹的免疫調節研究中發現,免疫抑制組中華絨螯蟹血清中NOS活性顯著下降,給予竹筍多糖后NOS活性上調,這與本試驗結果相一致。提示FNB可以使免疫抑制小鼠血清中失調的NOS、NO靠近正常水平,促使其恢復正常生理活性,從而提高免疫功能,但其中的具體調控機制還需要進一步研究。
徐璐等[17]對黃芪總黃酮對小鼠免疫功能進行研究,結果表明,黃芪總黃酮能顯著增強小鼠的免疫功能。劉愛華等[18]對木瓜總黃酮抗腫瘤活性進行研究,結果表明,木瓜總黃酮可以促進機體對腫瘤的免疫應答,最終達到抑制腫瘤生長,提高腫瘤鼠存活率的作用。皮建輝等[19]對金銀花黃酮對小鼠免疫調節作用進行研究,結果表明,金銀花黃酮能顯著提高免疫抑制小鼠的臟器指數,金銀花黃酮能顯著調節小鼠血清免疫酶活性,提高淋巴器官的抗氧化功能,表明其具有良好的免疫調節功能。本研究結果表明,辣寥黃酮對環磷酰胺引起的小鼠免疫功能抑制有拮抗作用,可以增強小鼠的免疫功能。
4 結論
辣寥黃酮不僅可以通過升高機體細胞因子水平來對抗環磷酰胺引起的小鼠免疫功能抑制,還可以通過調節NO水平和MPO、NOS等活性來降低免疫抑制帶來的影響,從而增強小鼠免疫功能。

