高產木糖醇菌株的誘變選育及其發酵培養基優化
陳雪松 楊勝利
1 浙江樹人大學生物與環境工程學院 (浙江杭州 310015)
2 浙江工業大學藥學院 (浙江杭州 310014)
木糖醇是一種天然甜味劑,化學名為“戊五糖”,是一種五碳糖。木糖醇外觀和味覺與蔗糖相似,具有清涼甜味。和其他糖醇相比,木糖醇是多元醇中最甜的甜味劑[1],目前已被廣泛應用于食品、印染、紡織、醫藥、國防、化工及皮革等領域[2]。
木糖醇的傳統生產方法主要以玉米芯和甘蔗渣為原料,利用酸水解預處理,經多次精制獲得木糖,再加氫生產木糖醇,存在污染重、資源消耗大、產量低、成本高等缺點[3-4]。采用生物轉化法生產木糖醇,可省去多次提純、精制步驟,同時實現綠色生產[5]。
生物轉化法生產木糖醇以反應條件溫和、資源消耗少和對環境污染小等優點成為研究熱點,但存在木糖醇生產率低、菌株生產能力低的缺點[6]。為提高生物轉化法的木糖醇轉化率,本研究通過對前期自然篩選得到的菌株進行復合誘變,探討其木糖醇轉化率,同時對發酵培養基的氮源和無機鹽進行了優化,以期為后期工業化應用提供技術基礎。
1 材料與方法
1.1 材料
1.1.1 菌種
木糖醇轉化菌,Y-3 號(木糖醇轉化率36.5%),浙江工業大學生物制藥研究所篩選并保存。
1.1.2 培養基
種子培養基:D-木糖20 g、酵母膏5 g、磷酸二氫鉀2 g、二水氯化鈣0.1 g、七水硫酸鎂0.2 g、硫酸銨5 g、瓊脂20 g、蒸餾水1 000 mL,pH=6.0,于121℃濕熱滅菌20 min。
菌種保藏培養基:葡萄糖20 g、酵母膏5 g、磷酸二氫鉀2 g、二水氯化鈣0.1 g、七水硫酸鎂0.2 g、硫酸銨5 g、瓊脂20 g、蒸餾水1 000 mL,pH=6.0,于121 ℃濕熱滅菌20 min。
發酵培養基:竹筍殼水解液(含木糖20 g)、蛋白胨10 g、酵母粉10 g、蒸餾水1 000 mL,pH=6.0,于121 ℃濕熱滅菌20 min。
1.1.3 試劑
實驗所用化學試劑均為分析純,購自生工生物工程(上海)股份有限公司、杭州邦易化工有限公司。
DNS 試劑:750 mL 去離子水微熱后依次加入10.00 g 3,5-二硝基水楊酸、16.00 g 氫氧化鈉、5.00 g苯酚、5.00 g 亞硫酸鈉和300.00 g 酒石酸鉀鈉,溶解后移入棕色容量瓶,定容至1 000 mL,于室溫下暗處放置一周后使用。
試劑a:將0.320 g 高碘酸鉀溶于100 mL 1%的鹽酸中。
試劑b:鼠李糖1.11 g/L。
NaSH 試劑(現配現用):100 mL 150 g/L 的乙酸銨溶液中,分別加入0.2 mL 乙酸及乙酰丙酮,搖勻。
1.1.4 主要儀器
D 型單人式凈化工作臺,上海恒勤儀器設備有限公司;TDL-5 低速臺式大容量離心機,南京東邁科技儀器有限公司;ZHWY-2102C 恒溫培養搖床,上海智城分析儀器制造有限公司;752 紫外可見分光光度計,上海天翔光學儀器有限公司;LS-B50L 立式壓力蒸汽滅菌器,上海博迅實業有限公司醫療設備廠;EYELA NVC-2000 旋轉蒸發儀,東京理化器械株式會社。
1.2 方法
1.2.1 菌懸液的制備
將Y-3 號菌株接入10 支斜面培養基,30 ℃、180 r/min 培養48 h;取菌落大而厚,濕潤,表面光滑,質地均勻,正、反面及中央與邊緣顏色一致的5支,用生理鹽水洗下菌苔,3 000 r/min 離心10 min,棄上清液,用生理鹽水洗滌兩次,轉入大試管制成菌懸液。
1.2.2 誘變處理
1.2.2.1 化學誘變
向大試管中依次加入0.2 mol/L 亞硝酸鈉溶液和菌懸液各1 mL 后,立即加入1 mL pH=4.5 的醋酸緩沖液,充分混合后,置于27 ℃水浴中誘變5 min,然后加0.07 mol/L pH=8.6 的磷酸氫二鈉溶液2 mL以終止反應。將經亞硝酸鈉處理后的菌懸液用無菌水稀釋104倍后,各取0.1 mL 均勻地涂布3 套平板,30 ℃避光培養48 h。
1.2.2.2 紫外誘變
將亞硝酸鈉誘變后木糖醇轉化率最高的菌株接入10 支斜面培養基,同方法1.2.1 制備菌懸液。取無菌平皿5 套,分別加入5 mL 菌懸液,開啟磁力攪拌器,15 W 紫外燈30 cm 處照射120 s。將經紫外線照射的菌懸液稀釋104倍后,各取0.1 mL 均勻地涂布3 套平板,30 ℃培養48 h,計算木糖醇轉化率。
1.2.2.3 二輪復合誘變
取紫外誘變后木糖醇轉化率最高的菌株按上述方法再依次進行化學誘變和紫外誘變。
1.2.3 菌落的篩選與發酵
從每套平板中挑選至少3 個長勢較好、形狀規則、直徑較大的單菌落接入100 mL 種子培養液中,30 ℃、200 r/min 搖床培養24 h。按5%的接種量接入100 mL 發酵培養基,30 ℃、200 r/min 搖床培養48 h后靜置24 h。
1.2.4 發酵培養基氮源與無機鹽的優化
1.2.4.1 單因素實驗
將經過二輪誘變后木糖醇轉化率最高的菌株接入斜面培養基,30 ℃培養48 h。用接種環從斜面培養基上挑取適量接種到100 mL 種子培養基中,30℃、200 r/min 搖床培養24 h。按5%接種量用無菌移液管將種子液接種到100 mL 發酵培養基中,30 ℃、200 r/min 搖床培養。
分別用10 g/L(以氮計)的牛肉膏、蛋白胨、硫酸銨和尿素作為氮源,每個變量各做3 個平行組,測定木糖醇轉化率。另分別用0.2 g/L 的硫酸鎂、硫酸亞鐵、氯化鈣和0.5 g/L 的磷酸二氫鉀作為無機鹽,每個變量做3 個平行組,測定木糖醇轉化率。
1.2.4.2 四因素三水平正交試驗
發酵培養基的優化:在氮源和無機鹽單因素實驗的基礎上,對氮源和無機鹽按表1 進行四因素三水平的正交試驗。
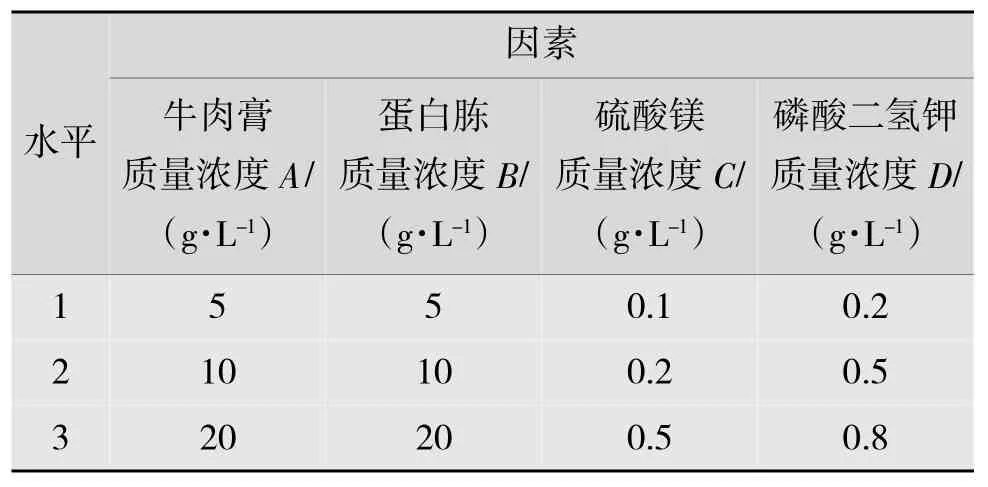
表1 正交試驗因素水平表
1.2.5 發酵液木糖和木糖醇質量濃度測定
取10 mL 經搖勻的發酵液,3 500 r/min 離心10 min,取上清液適當稀釋。在25 mL 試管中加入1 mL稀釋后的上清液和3 mL DNS 試劑,沸水浴5 min,冷卻定容至25 mL,測量540 nm 處吸光度,根據木糖標準曲線回歸方程計算水解液中木糖質量濃度。
取10 mL 經搖勻的發酵液,3 500 r/min 離心10 min,取上清液適當稀釋。取1 mL 稀釋液,與1 mL 試劑a 室溫反應10 min,再加入2 mL 試劑b 和4 mL NaSH 試劑,混勻后于53 ℃水浴中保溫15 min,冷卻后測量412 nm 處吸光度,再根據木糖醇標準曲線回歸方程計算發酵液中木糖醇的質量濃度。
1.2.6 木糖醇轉化率的計算
初始培養基的木糖質量濃度均為20 mg/mL。木糖醇轉化率按公式(1)計算。
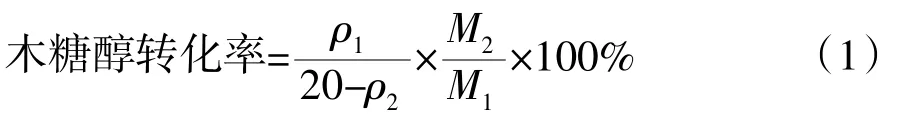
式中:ρ1為發酵液中木糖醇質量濃度,mg/mL;ρ2為發酵液中殘留木糖質量濃度,mg/mL;M1為木糖醇摩爾質量,g/mol;M2為木糖摩爾質量,g/mol。
2 結果與分析
2.1 高產木糖醇菌株復合誘變及突變株篩選
將每次誘變結束后的誘變菌各做3 組平行試驗,得到其木糖醇轉化率,結果如表2 所示。對原菌Y-3 號進行亞硝酸鈉和紫外復合誘變,得到一株木糖醇轉化率50.3%的Y-3-7 號菌株。
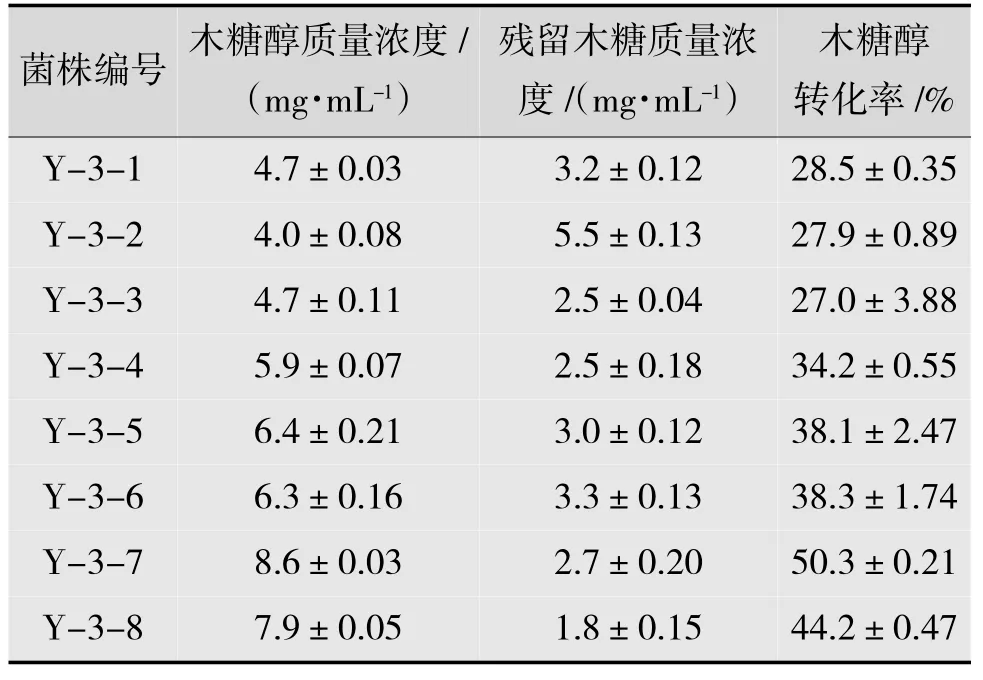
表2 第一輪復合誘變結果
以Y-3-7 號菌株作為出發菌株再次進行亞硝酸鈉和紫外誘變,得到一株木糖醇轉化率54.5%的菌株Y-3-7-4,其比原出發菌株的木糖醇轉化率提升了49.3%,結果如表3 所示。同時也有一些菌株在誘變后轉化率出現了下降,這可能與致死率有關[7];可以通過控制致死率來提高正向突變的概率。
2.2 高產木糖醇發酵培養基氮源的選擇優化
氮源對微生物的生長發育和代謝產物的生成非常重要作用。不同種類氮源可能影響代謝產物合成的量。牛肉膏、蛋白胨、硫酸銨、尿素等都是常用氮源。分別以該4 種氮源為單一氮源,以Y-3-7-4 菌株為出發菌株,進行氮源優化,結果如圖1 所示。從圖1 可知,在其他條件相同時,選用蛋白胨、牛肉膏時木糖醇轉化率較高。說明酵母以有機氮源為氮源時更有利于轉化木糖,可能是因為有機氮源中含有多種生長因子。其中:蛋白胨效果最好,木糖醇轉化率可達56.04%;無機氮源硫酸銨的效果較差,木糖醇轉化率為46.36%;尿素作氮源時,木糖醇轉化率為45.66%。

表3 第二輪復合誘變結果
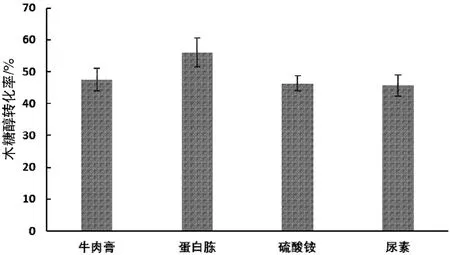
圖1 不同氮源的木糖醇轉化率
2.3 高產木糖醇發酵培養基無機鹽的選擇優化
無機鹽是微生物生長代謝過程中酶活性中心的組成部分,不同的無機鹽可能會影響酶的活性,從而影響菌株的代謝途徑和木糖醇的積累。以Y-3-7-4菌株為出發菌株進行無機鹽優化,選用4 種無機鹽,木糖醇轉化率如圖2 所示。由圖2 可知,在其他條件相同時,選用0.2 g/L 的硫酸鎂和0.5 g/L 的磷酸二氫鉀,木糖醇轉化率較高。硫、鎂、磷、鉀都是酵母發酵過程中必需的微量元素,可以激活酶促反應或參與生物合成反應。尤其是Mg2+,它是酵母生長必需的,以酶的激活劑發揮作用,在磷酸轉移酶類和許多脫羧酶的激活中發揮重要作用;而H2PO4-有利于酵母細胞的代謝進入磷酸戊糖途徑。因此硫酸鎂和磷酸二氫鉀是酵母木糖轉化的較好的無機鹽。
2.4 高產木糖醇發酵培養基正交試驗優化
根據氮源和無機鹽優化結果,選擇牛肉膏、蛋白胨作為氮源,硫酸鎂、磷酸二氫鉀作為無機鹽,對牛肉膏、蛋白胨、硫酸鎂及磷酸二氫鉀的質量濃度進行四因素三水平的正交試驗,通過測定木糖醇最高轉化率來確定最佳培養基配方。結果如表4 所示。
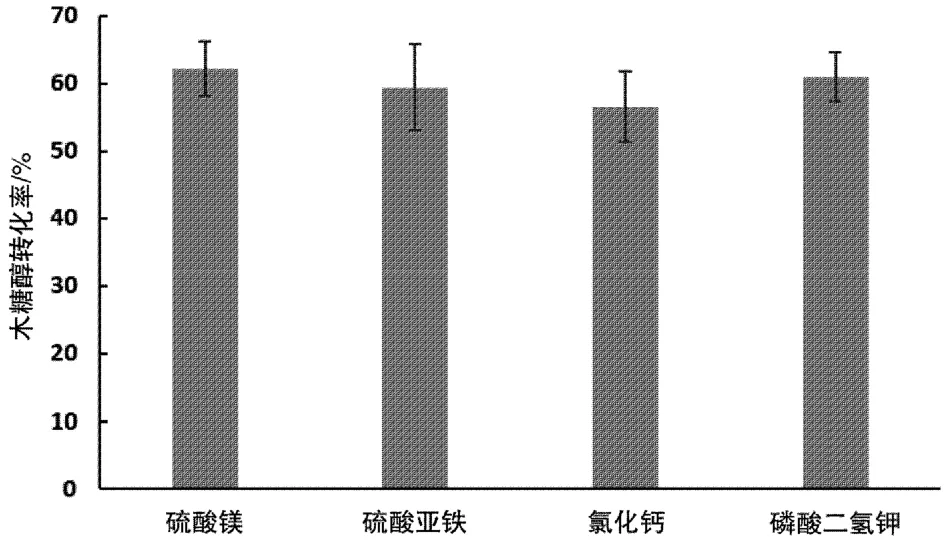
圖2 不同無機鹽的木糖醇轉化率
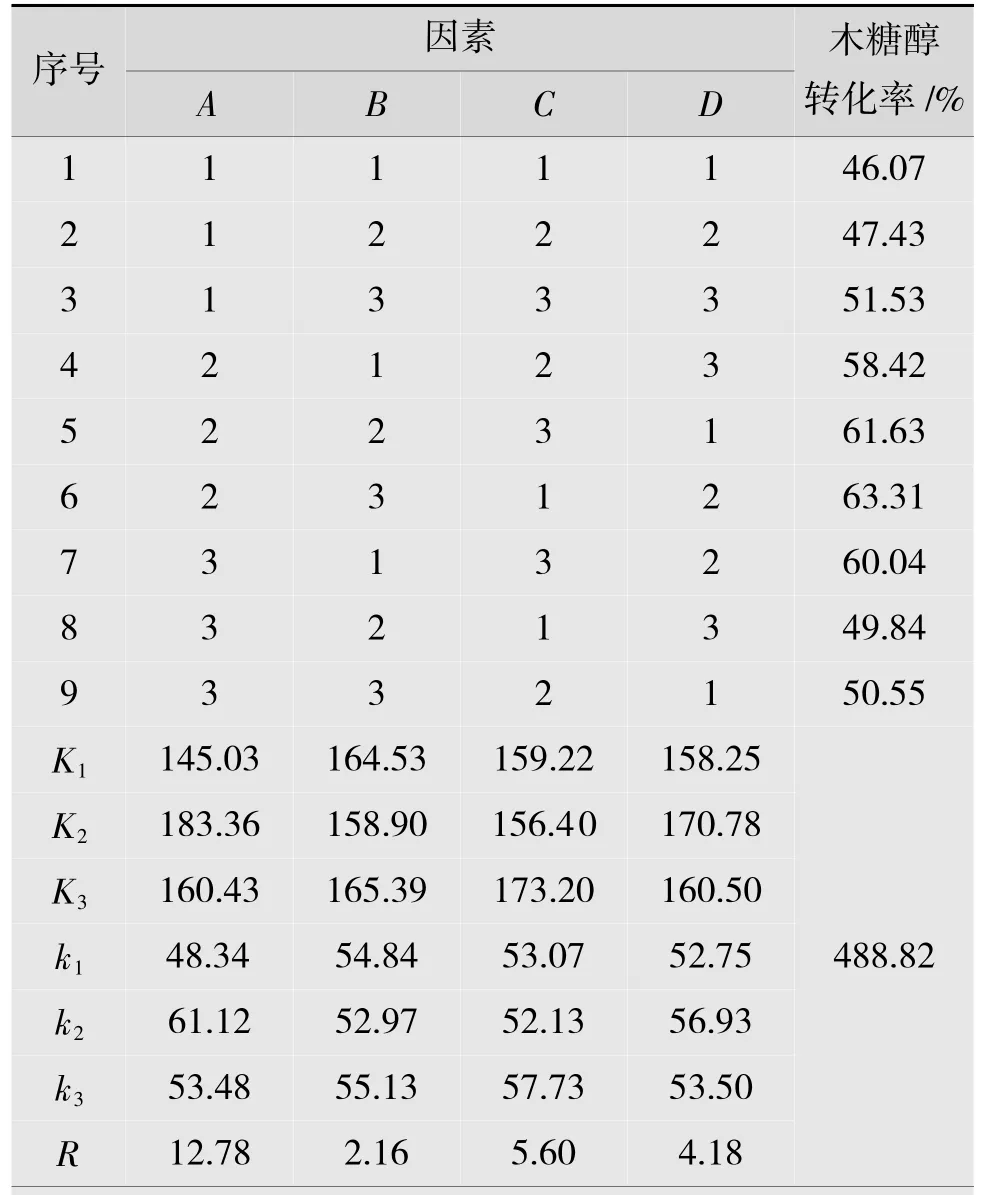
表4 正交試驗結果表
從表4 可以看出,不同發酵培養基組合對木糖醇轉化率都有影響。其中牛肉膏極差最大,是影響木糖醇轉化率的最關鍵因子,其次是硫酸鎂和磷酸二氫鉀,蛋白胨影響最小。4,5,6,7 號試驗中木糖醇轉化率較高,而其他組木糖醇轉化率不高,與原始培養基相比甚至出現了抑制木糖轉化為木糖醇的現象。根據各因素水平,A取A2,B取B3,C取C3,D取D2為好,即最佳培養基為A2B3C3D2。由于B的極差最小,對木糖醇轉化率的影響最小,因此將其作為誤差項對A,C,D作方差分析。
2.5 方差分析
方差分析結果如表5 所示。

表5 方差分析結果
從表5 中F值的大小看出,各因素對木糖醇轉化率影響的大小順序為A>C>D,即牛肉膏質量濃度對木糖醇轉化率的影響最為顯著。
3 結論
本研究以一株產木糖醇菌株為出發菌株,對其進行紫外和化學復合誘變,經過兩輪復合誘變得到一株高產木糖醇菌株,木糖醇轉化率為54.5%,比出發菌株提高了49.3%。
通過單因素實驗確定了蛋白胨和牛肉膏為最佳氮源,硫酸鎂和磷酸二氫鉀為最佳無機鹽;通過4 種因素的正交試驗,發現牛肉膏對木糖醇轉化率影響最大,硫酸鎂、磷酸二氫鉀的影響依次變小,蛋白胨的影響最小。最佳發酵培養基配方為:牛肉膏10 g/L、蛋白胨20 g/L、硫酸鎂0.5 g/L、磷酸二氫鉀0.5 g/L。菌株木糖醇轉化率提高到63.0%,比出發菌株提高了72.6%,為后續通過產木糖醇菌株生產木糖醇技術的應用奠定了基礎。

