聚多巴胺仿生摻鍶羥基磷灰石涂層的制備及對骨髓間充質干細胞生物學特性的影響*
孫儀庭 陳思悅 陳 昱 王天鴿 周志捷 林開利 劉加強
鈦及其合金具有優良的力學性能,作為硬組織替代材料被廣泛應用于口腔種植和骨缺損修復等領域[1]。然而,鈦合金與周圍組織結合強度低,表面無法直接成骨,會影響植入物的長期穩定性。
與其他如等離子噴涂、電化學沉積法、溶膠-凝膠法等表面改性方法[2-4]不同,仿生礦化法是指通過具有和人體血液相似的PH值以及離子組成的模擬體液中,促進材料表面的離子沉積形成羥基磷灰石。該成分與天然骨的無機結構相似,能強化鈦合金與周圍組織的骨結合[5,6]。
鍶(Sr)與鈣(Ca)有相似的物理和化學特性,是參與骨骼形成過程的微量元素之一[7],被證實有影響骨吸收以及骨形成的雙重作用[8-10]。當兩者同時存在時,Sr2+會替代部分Ca2+形成新的晶體,稱摻鍶羥基磷灰石,提高鈦合金的生物相容性和成骨能力[11,12]。
通過鄰苯二酚和氨基功能基團發生氧化-聚合等反應,形成的聚多巴胺薄膜具有良好黏附作用[13,14]。吸附鈦表面的聚多巴胺分子能夠與模擬體液里的鈣離子螯合,通過靜電作用將Ca2+與PO43-結合形成羥基磷灰石[15,16]。
為此,本實驗擬采用聚多巴胺仿生礦化法,利用聚多巴胺良好的黏附能力,增強模擬體液中離子與材料表面的結合,改善羥基磷灰石涂層的厚度和穩定性。同時摻入一定比例的鍶離子,于鈦合金表面制備摻鍶羥基磷灰石涂層。通過一系列體外實驗探究材料對骨髓間充質干細胞生物學性能的調控作用。
1.材料及方法
1.1 聚多巴胺及摻鍶羥基磷灰石涂層的制備
1.1.1 鈦片清洗 根據文獻[17]將鈦片(10mm×10mm×2mm)用砂紙打磨拋光后以丙酮、無水乙醇及去離子水超聲清洗。反復3次后,室溫晾干鈦片。
1.1.2 制備聚多巴胺涂層 將鹽酸多巴胺(Sigma Aldrich)溶解在Tris溶液(10mM,PH=8.5)制備成2g/L多巴胺溶液[18]。把超聲清洗完的鈦合金材料置于溶液,室溫避光反應24h。取出后用大量去離子水反復清洗去除未附著的聚多巴胺單體,室溫干燥。
1.1.3 摻鍶羥基磷灰石涂層制備 首先根據Kokubo等[19]先前的研究制備1.5倍模擬體液(1.5×SBF,Na+213.0;Ca2+3.75,Cl?221.7,HPO42?1.5,K+7.5 Mg2+2.25,SO42?0.75,HCO3-6.3 mM)。按照Sr2+/(Sr2++Ca2+)=10%的比例用鍶離子替代鈣離子,制備含鍶模擬體液(PH=7.4)[12]。將上述聚多巴胺修飾的鈦合金材料浸泡至該溶液,放置于37℃恒溫搖床反應,每兩天更換新的模擬體液保證一定的離子濃度。7d后取出鈦片,大量去離子水沖洗,室溫干燥。
1.2 材料表征 場發射掃描電子顯微鏡(FE-SEM;S-4800,Hitachi)觀察噴金處理后各組材料的表面形貌;通過X 射線光電子能譜(XPS;EscaLab250,Thermo)測定不同樣品的表面元素組成;借由拉曼光譜(Raman;RW2000,Renishaw)在波長532nm處驗證PDA是否成功負載;X射線衍射分析(XRD;Buker D8,ADVANCE)測定材料的化學組成和晶體結構,2θ角范圍:10-90°,掃描速率:6°/min,掃描步長:0.02;通過接觸角測角儀(WCA;SL200B;Kono)測定各組材料的水接觸角。
1.3 BMSCs的細胞黏附和增殖
1.3.1 CLSM用于檢測BMSCs細胞骨架的絲狀肌動蛋白 將鈦片、聚多巴胺修飾鈦片、聚多巴胺-羥基磷灰石修飾鈦片以及聚多巴胺-摻鍶羥基磷灰石修飾鈦片共4種材料置于24孔板,并以2×104/孔密度將大鼠骨髓間充質干細胞接種于材料表面。使用含有10%胎牛血清以及雙抗的α-MEM培養基,于37℃,5%CO2培養箱中培養。培養24h后吸取培養基。加入4%多聚甲醛固定30min,接著用1%TritonX-100孵育10min,然后用PBS漂洗。1%牛血清白蛋白封閉30min后,配制一定濃度的異硫氰酸熒光素(FITC)標記鬼筆環肽(Sigma Aldrich),并加入各組樣品,在37℃下孵育30min。之后,將樣本用PBS洗滌后,加入DAPI室溫孵育10min,再次用PBS洗滌。隨后借由激光掃描共聚焦顯微鏡觀察細胞的鋪展形態。
1.3.2 細胞增殖試驗 按照1×104/孔密度將細胞接種于材料表面。分別在第1、4和7d進行細胞增殖測定。吸除培養基并用PBS漂洗。向每孔加入等體積的含溴化-3-(4,5-2甲基噻唑基-2)-2,5-二苯基四唑(MTT)的培養基,避光孵育4h。之后棄上清,加入同體積DMSO室溫孵育15min并振蕩,而后吸取100μL溶液轉移至新96孔板,用酶標儀(Multiskan FC,Thermo Scientific)在490nm波長下測定OD值。
1.4 BMSCs的成骨分化
1.4.1 細胞堿性磷酸酶活性半定量及定性檢測 通過ALP染色及半定量實驗探究各組材料對細胞成骨分化能力的影響。以2×104/孔密度將BMSCs接種于材料表面進行共培養。1d后改為成骨誘導培養基。
于第4d終止培養。加入1% Triton-100X裂解并12000rpm/min離心10min,提取上清液,根據試劑盒的說明測定不同組的細胞堿性磷酸酶活性。第7d棄去培養基,PBS漂洗后用4%多聚甲醛固定30min,根據BCIP/NBT堿性磷酸酯酶顯色試劑盒進行染色,顯微鏡下觀察并拍照記錄。
1.4.2 成骨基因相對表達qPCR 將BMSCs與四組材料共培養,24h后更換為成骨誘導培養基。分別在細胞與材料成骨誘導培養的第4和第7d提取總RNA。按照PrimeScriptTMRT reagent Kit說明書(Takara,Japan)逆轉錄成cDNA,在Light Cycler 96實時PCR系統(Roche,Switzerland)上使用SYBR green PCR反應混合物(Roche,Switzerland)研究聚多巴胺仿生摻鍶羥基磷灰石涂層對細胞的成骨分化能力的影響。檢測RUNX2、ALP、COL-I和BSP等成骨相關基因的相對表達量。
1.5 統計學分析 數據以平均值±標準差表示,采用SPSS 22.0統計分析軟件。通過單因素方差分析(One Way ANOVA)對數據進行統計學分析。P<0.05,差異具有統計學意義。
2.結果
2.1 材料表征檢測結果 圖1顯示材料實物圖以及掃描電鏡觀察的表面形貌。可見鈦合金(Ti)組表面相對光滑,聚多巴胺修飾后的鈦合金(Ti@PDA)在低倍鏡下形貌與鈦合金組相似,在高倍鏡下可見均勻分散的球形顆粒,為納米尺寸。聚多巴胺-羥基磷灰石組(Ti@PDA+SBF)表面凹凸不平,可見呈針葉狀的納米顆粒晶體層層堆疊于材料表面。聚多巴胺-摻鍶羥基磷灰石組(Ti@PDA+SBF(Sr))在高倍鏡下顯示礦物層形成,為球狀納米顆粒的團聚。

圖1 (A)各組材料的實物圖;(B)材料的掃描電鏡圖
圖2依次顯示了鈦合金組、聚多巴胺-鈦合金組、聚多巴胺-羥基磷灰石組以及聚多巴胺-摻鍶羥基磷灰石組表面元素的X射線光電子能譜(XPS)結果。不同的修飾階段呈現不同的變化,鈦合金組主要呈現Ti,O和C的峰。與先前的文獻結果一致,修飾聚多巴胺后XPS結果記錄明顯的N峰,且Ti明顯減弱,側面證實PDA的均勻涂覆[20]。在SBF溶液中浸泡后,Ca(2p,2s)和P(2p,2s)峰的強度顯著增加,這表明在PDA膜上形成了磷酸鈣化合物。Ca2p和P2p峰的存在,說明有類羥基磷灰石的結構[21]。Sr3p特征峰的出現則證明鍶離子的成功負載。
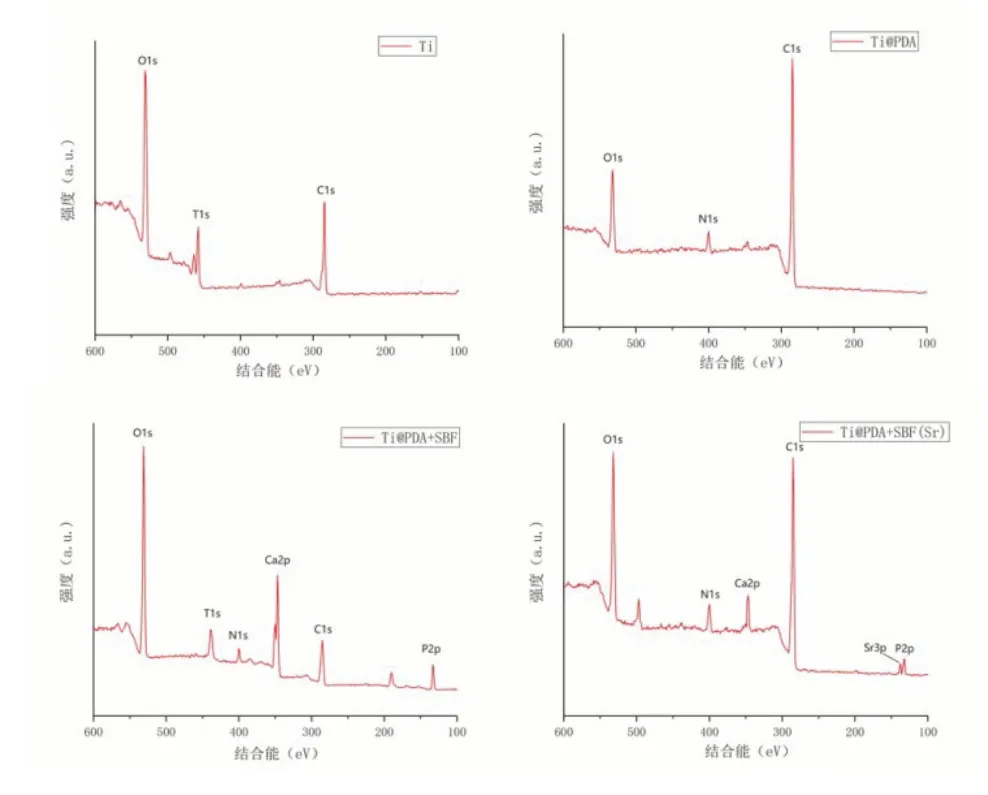
圖2 X線光電子能譜分析各組材料表面的元素組成
如圖3 拉曼光譜所示:在1350cm-1和1580cm-1波長處,聚多巴胺-鈦合金組樣品表面可見聚多巴胺的特征峰,由此可進一步證明聚多巴胺成功地沉積在鈦合金組樣品表面[22]。
Ti@PDA+SBF 和Ti@PDA+SBF(Sr)的XRD譜(圖4)顯示仿生礦化后于2θ=26°和2θ=32°處出現了HA 的特征衍射峰。與Ti@PDA+SBF 組相比,Ti@PDA+SBF(Sr)組的HA 特征衍射峰強度減弱,說明涂層的結晶性降低。
從圖5 接觸角測量的結果來看,Ti 組的接觸角角度最大,與各組之間均有統計學意義。再者是Ti@PDA 組,其 次 是Ti@PDA+SBF(Sr)組。Ti@PDA+SBF 組的接觸角測量值最小。后三組兩兩之間比較均有統計學差異。一般認為接觸角角度越小,親水性越高。
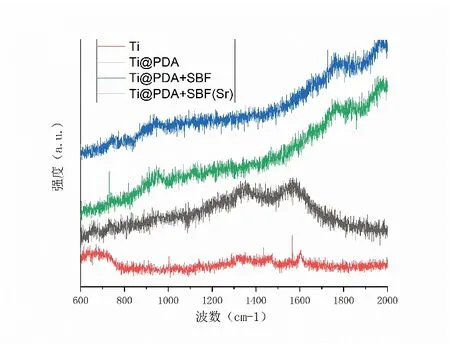
圖3 各組材料的拉曼光譜
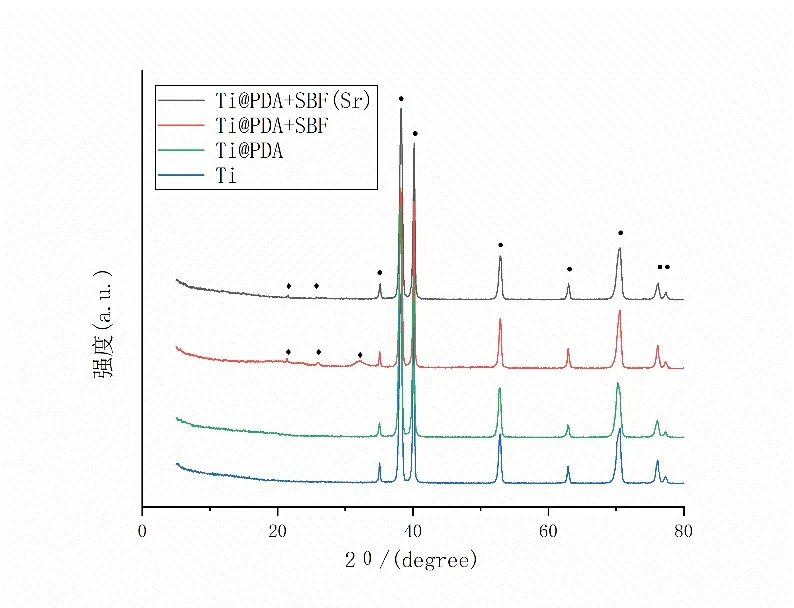
圖4 各組材料的X射線衍射圖譜分析
2.2 各組材料表面的細胞黏附和細胞增殖 材料植入后會與周圍組織直接接觸,是否具有良好的生物相容性至關重要。圖6 為BMSCs 在各組材料表面早期黏附的情況。可見Ti 組表面細胞多呈梭形,細胞鋪展面積較小,偽足伸展少。Ti@PDA+SBF 組表面細胞數量略多余對照組,且細胞鋪展面積有所增加。Ti@PDA+SBF(Sr)以及Ti@PDA 兩組材料上的BMSCs 鋪展面積顯著大于Ti 組,表現出融合,多層和聚集的形態。此外,細胞通過更多的肌動蛋白絲與相鄰細胞相連,可見絲狀偽足伸展,而聚多巴胺-摻鍶羥基磷灰石組表面細胞密度略大于聚多巴胺-鈦合金組。細胞早期完全鋪展有利于后續細胞的增殖和分化。
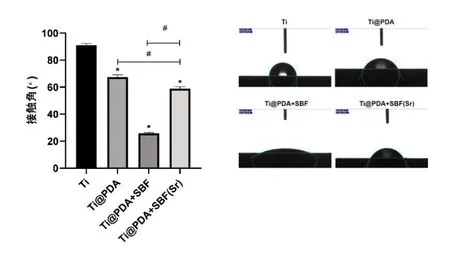
圖5 各組材料的水接觸角測量比較,采用單因素方差分析比較各組材料的水接觸角,*代表與Ti組比較P<0.05,#代表與Ti@PDA+SBF(Sr)比較P<0.05
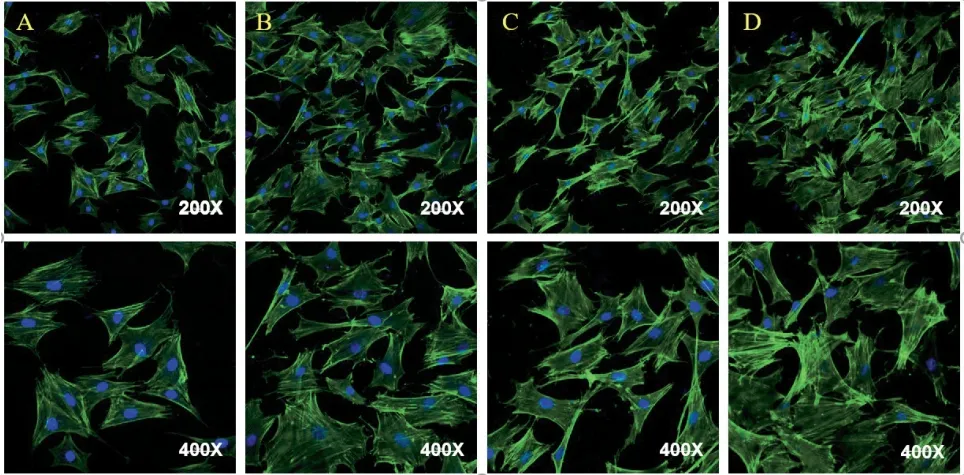
圖6 (A)Ti(B)Ti@PDA(C)Ti@PDA+SBF(D)Ti@PDA+SBF(Sr),大鼠骨髓間充質干細胞在材料表面培養24h的CLSM圖
圖7為BMSCs在Ti、Ti@PDA、Ti@PDA+SBF和Ti@PDA+SBF(Sr)上培養1、4和7d后的MTT實驗結果。圖中可見每組細胞均有良好的增殖能力,細胞數隨時間呈上升趨勢。總體來說Ti@PDA組表面細胞增殖最為顯著,與Ti組相比在第1、4和7d均顯著增強了細胞的增殖能力(P<0.05)。Ti@PDA+SBF(Sr)組有著相似的結果,但兩組之間無顯著性差異。Ti@PDA+SBF 組在第4d的細胞數較低于Ti組,而第1和7d 的結果略高,但兩組細胞數量均無明顯差異。研究表明細胞在材料表面的黏附和伸展有利于細胞增殖。而圖7 MTT結果也顯示細胞在Ti@PDA和Ti@PDA+SBF(Sr)組有更好的增殖能力,這與細胞在材料表面鋪展結果(圖6)相一致。
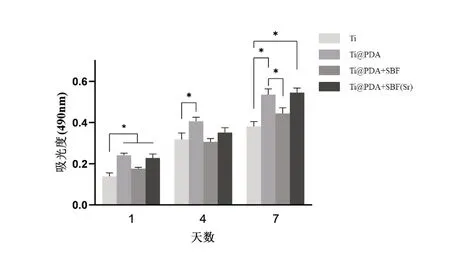
圖7 BMSCs在各組材料表面培養1、4和7d的增殖情況,采用單因素方差分析比較各組吸光度,*P<0.05
2.3 細胞ALP 活性 圖8 所示為成骨誘導4d 后各組材料表面細胞的堿性磷酸酶活性。Ti@PDA組的ALP 水平略高于Ti 組,但未見統計學意義。Ti@PDA+SBF 組的ALP 水平高于Ti@PDA 以及Ti 組,Ti@PDA+SBF(Sr)組表面BMSCs 細胞內堿性磷酸酶活性明顯高于其他3 組(P<0.05),說明有更好的促進細胞成骨分化的能力。
ALP 定性結果如圖9 所示,成骨誘導培養7d后,Ti@PDA+SBF(Sr)組染色最深,其次為Ti@PDA+SBF 組,再者是Ti@PDA 組,最后是對照組。整體趨勢與細胞堿性磷酸酶活性半定量測試結果一致,證明聚多巴胺仿生的摻鍶羥基磷灰石涂層能較強的促進細胞成骨分化。ALP 是BMSCs早期成骨分化的標志,是參與骨形成過程的重要酶之一,與成骨細胞的分化有正向關系。ALP活性越高說明成骨細胞前體細胞向成骨細胞分化越顯著。結果說明經聚多巴胺修飾和復合鍶離子的羥基磷灰石涂層有望提高成骨活性。
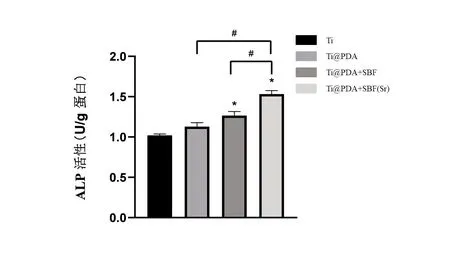
圖8 不同材料表面的細胞成骨誘導培養4d后的細胞堿性磷酸酶活性。采用單因素方差分析比較各組的ALP活性,*代表與Ti組比較P<0.05,#代表與Ti@PDA+SBF(Sr)比較P<0.05
2.4 BMSCs 成骨相關基因表達的檢測 圖10為BMSCs在各組材料表面培養4 和7d 時成骨相關基因的相對表達量。在第4d,Ti@PDA+SBF(Sr)組細胞的各基因表達量均高于對照組且具有統計學意義(P<0.05)。第7d 各組材料表面細胞的基因表達量均有所升高,其中Ti@PDA+SBF(Sr)組升高更為顯著,且與其他三組的表達差異均有統計學意義。表明聚多巴胺仿生摻鍶羥基磷灰石涂層促進 了RUNX2、ALP、COL-I 和BSP 成 骨 因 子 的表達。
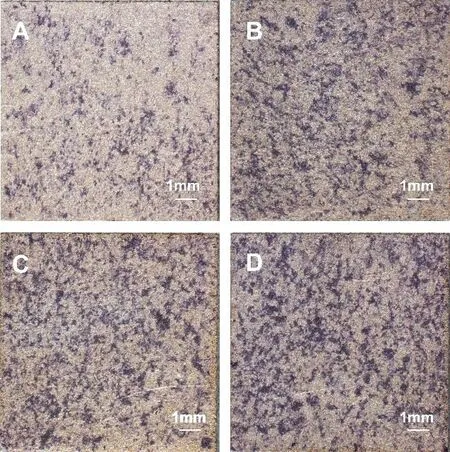
圖9 (A)Ti(B)Ti@PDA(C)Ti@PDA+SBF(D)Ti@PDA+SBF(Sr)不同材料表面的細胞成骨誘導培養7d后的ALP定性結果

圖10 細胞在不同材料表面成骨誘導培養4和7d,成骨相關基因表達情況。采用單因素方差分析比較各組的相對基因表達量,*代表與Ti組比較P<0.05,#代表與Ti@PDA+SBF(Sr)比較P<0.05
3.討論
鈦及鈦合金是骨/齒科廣泛應用的硬組織替代材料。理想的植入體在植入體內后應起到良好的骨引導作用,便于做到骨性結合。對其進行表面改性旨在做到植入體能夠即刻負載,有良好的骨整合性并且滿足長期穩定性的需求[23]。
羥基磷灰石是動物和人骨骼的主要無機組成成分[24],作為人體骨骼中最常見的磷酸鈣鹽并且與骨骼中礦物相的化學組成成分相似,同時具備理想生物相容性以及骨誘導性。研究普遍認為磷灰石類材料相對于鈦合金材料能更早的達到骨整合,但負載能力較差。為了結合鈦合金優秀的力學性能以及羥基磷灰石涂層良好的骨引導能力,關于鈦及羥基磷灰石涂層的復合材料倍受關注[25]。目前的電化學沉積法、等離子噴涂和微弧氧化法等可以一定程度改善形成的羥基磷灰石涂層的結合強度和形態結構以優化鈦合金材料[26,27]。
仿生礦化法于20世紀90年代首次被提出,通過將材料直接浸入具有與人體血液相近的PH值和無機成分模擬體液中形成羥基磷灰石結構。優點在于制備方法簡單溫和,不受限于材料本身[20]。根據羥基磷灰石的結構特性,我們可以通過復合不同離子改善羥基磷灰石涂層的生物活性和穩定性。骨骼中含有多種微量元素,低劑量的鍶離子可以促進成骨及成血管作用[28,29]。其中鍶離子的半徑小于鈣離子,可以取代部分鈣離子摻入羥基磷灰石晶格并在骨形成和礦化中起重要作用。
聚多巴胺在貽貝中首次被發現,是多巴胺的衍生物之一,可以通過簡單的方法在弱堿性條件下自聚合[30]。帶有PDA涂層的植入物表面親水性更佳,有利于蛋白的吸附和細胞反應,例如促進細胞黏附和細胞增殖[31]。聚多巴胺直接影響黏著斑蛋白的表達,經FAK/MAPK途徑涉及BMSCs成骨分化過程,因此認為具有聚多巴胺涂層的植入物在體內有優秀的直接骨結合能力[22,32]。聚多巴胺含有多種鄰苯二酚基團和氨基活性基團,與物體之間可以通過各種化學鍵產生結合[33-35],其末端豐富的酚羥基和醌基,能夠螯合模擬體液中的Ca2+形成有機金屬絡合物并進一步吸附PO43-,加強羥基磷灰石在聚多巴胺薄膜表面的沉積和穩定性。
與其他復雜的表面改性方法相比,在本研究中,我們關注具有良好黏附能力聚多巴胺,通過構建該涂層加強仿生礦化工藝過程離子的沉積從而穩定形成的羥基磷灰石結構。向模擬體液中摻入一定比例的鍶離子改變涂層的成分,進一步促進其促成骨的能力。
從掃描電鏡觀察材料表面形貌的結果來看,聚多巴胺顆粒以及羥基磷灰石能均勻的修飾到鈦合金表面。同先前的研究一致發現鍶離子會減小晶體的尺寸,改變經典羥基磷灰石的針狀結構。XPS、XRD和拉曼光譜能進一步證明聚多巴胺仿生摻鍶羥基磷灰石涂層的制備。接觸角測試說明Ti@PDA+SBF(Sr)組有僅次于Ti@PDA+SBF組的親水性,這可能是由于晶體結構的變化,納米顆粒尺寸減小。
通過細胞黏附和細胞增殖實驗發現聚多巴胺的修飾可以促進細胞在材料表面的黏附鋪展,而復合摻鍶羥基磷灰石涂層后該作用進一步增強。材料植入體內后直接與細胞和組織反應,良好的細胞黏附能力和促進細胞增殖能力對后續骨整合起到重要意義。
除此之外,聚多巴胺仿生摻鍶羥基磷灰石涂層表面的細胞與其他組相比有更高的細胞堿性磷酸酶活性和成骨相關基因的表達。這可能是因為聚多巴胺可以直接影響骨整合,而羥基磷灰石與天然骨骼相似的無機成分和優秀的生物相容性可促進細胞的成骨分化。低劑量摻入的鍶離子本身也具有促進成骨,減少骨吸收的作用。
本實驗通過簡單的仿生礦化法,在鈦合金表面結合聚多巴胺并復合摻鍶的羥基磷灰石,成功制備一具有良好生物相容性的復合涂層。通過一系列體外實驗驗證材料促進了大鼠骨髓間充質干細胞的細胞黏附、增殖和細胞的成骨分化。證明了該材料對細胞生物學活性的正向調控作用。

