基于Rho/Rho-kinase 信號通路探討丙泊酚減輕大鼠腦缺血再灌注損傷的效果
鄧 莉趙延禮何宗釗司立寧呂志堅
(1.青海大學附屬醫院麻醉科, 西寧 810001; 2.青海大學醫學院基礎醫學部, 西寧 810001;3.青海省人民醫院重癥醫學科, 西寧 810007; 4.青海大學附屬醫院重癥醫學科, 西寧 810001)
缺血性中風是導致全球成人死亡和獲得性殘疾的主要因素之一。 目前,大約有1500 萬中風患者,每年因此造成500 萬人死亡[1-2]。 腦缺血/再灌注損傷的發生主要有如下幾種機制,包括興奮性毒性,炎癥,神經元凋亡和腦水腫。 此外,眾所周知,急性炎癥反應和細胞凋亡在由腦再灌注損傷產生的神經元細胞的繼發性損傷中起關鍵作用[3]。 Rho是小分子GTPase 超家族的一部分,在多種細胞過程中起關鍵作用,包括基因轉錄,細胞遷移,運動,凋亡,神經再生和細胞形態,并能夠通過磷酸化調節細胞肌動蛋白的重組Rho 激酶(Rho-kinase),Rhokinase 是一種絲氨酸/蘇氨酸蛋白激酶,Rho-kinase激活并調節多種細胞功能,包括形態,粘附,運動性和增殖。 研究結果表明,Rho-kinase 被抑制后,可減少神經元的炎癥和細胞凋亡,并在腦缺血/再灌注中維持神經功能[4],抑制Rho 激酶可以保護神經細胞免受內皮素1 誘導的缺血性損傷[5]。 丙泊酚為烷基酸類的短效靜脈麻醉藥。 靜脈注射后迅速分布于全身,40 s 內可產生睡眠狀態,進入麻醉迅速、平穩。 丙泊酚的鎮痛效應較弱,可使顱內壓降低、腦耗氧量及腦血流量減少。 對呼吸系統有抑制作用,可出現暫時性呼吸停止;對循環系統也有抑制作用,可出現血壓降低。 先前的研究表明[6],丙泊酚在體內對大鼠心肌缺血再灌注損傷(MIRI)發揮了有益的作用;丙泊酚對MIRI 大鼠模型的保護作用涉及抗氧化和抗炎癥過程[7]。 本研究擬基于Rho/Rho-kinase 信號通路探討丙泊酚減輕大鼠腦缺血再灌注損傷的效果,為腦缺血再灌注損傷的治療提供理論依據。
1 材料和方法
1.1 實驗動物
清潔級SD(Sprague Dawley)大鼠100 只,年齡6周;體重225 ~243 g,雌雄各半;青海大學醫學院動物實驗中心提供并飼養[SCXK(青) 2018-0013][SYXK(青) 2017-0014],本研究經青海大學附屬醫院科研倫理委員會批準(20180815),大鼠飼養環境為:22℃~24℃;50%~55%;12 h 黑暗/光照循環。實驗研究過程中嚴格遵循3R 原則。
1.2 主要試劑與儀器
戊巴比妥鈉(30 mg/kg; H31020240,上海新亞洲制藥有限公司,中國 上海);TRIzol(sigma 美國,56262);RNeasy Mini Kit(TaKaRa,中國,2544);RIPA 緩沖液(Santa Cruz,USA,52547);BCA 試劑盒(賽默飛世,美國,20147);12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE,sigma,45955);聚偏二氟乙烯(PVDF,sigma,854175);牛血清白蛋白(BSA, 碧 云 天 科 技, 410254); 兔 抗 大 鼠 Rho(ab54835;1 ∶1000; Abcam,Cambridge,MA,USA);Rho-kinase(ab45171,1 ∶2000; Abcam,Cambridge,MA,USA);β-actin 單克隆抗體(ab134181;1 ∶1000;Abcam,Cambridge,MA,USA);山羊抗兔二抗(C86 SSA004;1 ∶1000,上海Canspec 科技有限公司,中國上海);NanoDrop2000c 分光光度計(美國塞默飛世);Applied Biosystems 7500(美國通用)。
1.3 實驗方法
1.3.1 動物分組
根據體重隨機分成5 組:對照組、模型組、丙泊酚低劑量組(20.0 mg/kg)、丙泊酚中劑量組(40.0 mg/kg)、丙泊酚高劑量組(80.0 mg/kg)、每組20只,雌雄各半。 前期預實驗求出丙泊酚對腦缺血再灌注大鼠LC50為160 mg/kg,以1/2 LC50為高劑量,2倍間距求出中、低劑量。
1.3.2 各實驗組的制備及神經運動功能評分
模型組、丙泊酚各劑量組通過腹膜內注射用3%戊巴比妥鈉麻醉大鼠,并固定頭和四肢放在不銹鋼手術臺上。 刮毛和滅菌后進行宮頸正中切口,暴露左頸內動脈(ICA)后,將尼龍手術絲插入其中,當遠端遇到阻力時,停止插入,并用根據Koizumi 方法測量的插入深度結扎ICA,閉塞2 h 后,取下線以允許缺血區域的完全再灌注,然后建立大腦中動脈閉塞(MACO)的大鼠模型。 術后給予20 萬U 青霉素肌肉注射,連續使用3 d。 對照組除不阻斷大鼠大腦中動脈外,其余操作同上。 丙泊酚各劑量各劑量術后第1 天開始腹腔給予相應藥物,持續給予4 周,對照組和模型組給予等體積生理鹽水。 試驗結束后(第29 天),對每只大鼠的神經功能缺損評分。 包括運動、感覺、反射和平衡能力測試等。 采用以下評分制度:0 級,無赤字;1 級,右前爪未能伸展; 2級,向右旋轉;3 級,從右到右;4 級,無法自發行走,意識水平降低。
1.3.3 貼紙去除及平衡木行走實驗
實驗結束后(第29 天), 依據相關文獻對大鼠行貼紙去除及平衡木行走實驗[8-9]。 簡而言之:邊長為10 mm 的正方形黏性紙粘住大鼠前肢掌面,記錄大鼠去除黏性紙的時間;大鼠于平衡木上行走,平衡木長80 cm、寬2.5 cm,距離地面高10 cm 并,記錄大鼠穿越平衡木的時間。
1.3.4 各組大鼠海馬區病理結構觀察
實驗結束后(第29 天)處死大鼠,獲取海馬組織,對海馬組織常規脫水、脫臘,HE 染色觀察病理結構變化。 簡而言之:(1)二甲苯(Ⅰ)15 min、二甲苯(Ⅱ)15 min、二甲苯:無水乙醇=1 ∶1 2 min、100%乙醇(Ⅰ)5 min、100%乙醇(Ⅱ)5 min、80%乙醇5 min、蒸餾水5 min、蘇木精液染色5 min、水洗10 min或流水沖洗5 min、1%鹽酸乙醇30 s、水洗30 s、蒸餾水過洗5 s、0.5%伊紅液染色1 ~3 min、蒸餾水稍洗30 s、80%乙醇稍洗30 s、95%乙醇(Ⅰ)1 min、95%乙醇(Ⅱ)1 min、無水乙醇(Ⅰ)3 min、無水乙醇(Ⅱ)3 min、二甲苯(Ⅰ)3 min、二甲苯(Ⅱ)3 min、中性樹膠封固。
1.3.5 各組大鼠海馬區病理評分
在高倍視野下(×40),每1/10 病變面積計一個單位,一個單位的變性評為0.2 分,一個單位的壞死評為2 分。
1.3.6 大鼠腦組織海馬區中Rho、 Rho-kinase mRNA 水平的測定
試驗結束后(第29 天)處死大鼠,獲取腦組織海馬區,TRIzol 提取腦組織海馬區總RNA。 使用NanoDrop2000c 分光光度計(A260:A280>1.8)測量RNA 的純度和濃度,通過瓊脂糖凝膠電泳結合溴化乙錠染色評估RNA 的完整性。 根據制造商提供的說明使用RNeasy Mini Kit 進行逆轉錄反應。 簡而言之,在42℃下用DNA 酶從1 μg 總RNA 中去除污染的基因組DNA 2。 接下來,將1 μL 包含寡核苷酸(dT)和隨機引物的逆轉錄引物混合物,1 μL 逆轉錄酶,4 μL 5×逆轉錄緩沖液和4 μL DEPC 處理過的水添加到上述DNase 處理的RNA 中模板中的總反應體積為20 μL。 將反應液在37℃孵育15 min,然后在85℃孵育5 s,然后保存在4℃下。 使用Applied Biosystems 7500 檢測系統進行實時PCR。實 時 PCR 的 引 物 序 列 如 下: Rho: 5′-TACCCTGGGAGACAGAATGAAAAGC-3′(正 向) 和5′-CACCTGTGTTTCTCAGCCCTTCTCT-3′ ( 反 向);Rho-kinase:5′-ATGACAGGGCTGGAAGTGACC-3′(正向) 和 5′-ACTATGTCCCAGTCAGGGCTCT-3′ ( 反向); β 肌動 蛋 白:5′-CTTAGTTGCGTTACACCCTT TCTTG-3′(正 向) 和5′-CTGTCACCTTCACCGTTCC AGTTT-3'(反向)。 引物由生工科技合成(上海,中國)。 對于反應,將1 μL cDNA,12.5 μL 2× SYBR Green I Master Mix,10 pmol 特定正向引物,10 pmol反向引物和0.5 μL ROX II 合并,并用DEPC 處理過的水加入最終體積為25 μL。 反應參數包括在95℃下孵育30 s,然后在95℃下進行40 次循環,每次5 s,然后在60℃下進行34 次循環。 使用2-ΔΔCt方法計算相對靶基因定量,其中ΔΔCt =[Ct(治療組)靶基因- Ct(治療組)內部對照]-[Ct(對照組)靶基因-Ct(對照組)內部控制]。 β-肌動蛋白用作內部對照。
1.3.7 大鼠腦組織海馬區中Rho、Rho-kinase 蛋白水平的測定
實驗結束后(第29 天)處死大鼠,獲取腦組織海馬區,用預冷的PBS 洗滌,并在RIPA 緩沖液中裂解,然后使用BCA 試劑盒測量蛋白質濃度。 用12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離25 μg蛋白質樣品,并通過半干電泳轉移將其轉移到聚偏二氟乙烯膜上。 用5%牛血清白蛋白封閉過夜后,將標本與兔抗大鼠Rho,Rho-kinase 和β-actin 單克隆抗體在搖床上于4℃放置2 h。 然后將PVDF 膜與山羊抗兔二抗在搖床上孵育4 h。 隨后進行化學發光,并使用Quantity One 軟件進行定量分析。
1.4 統計學方法
采用SPSS 23.0 對數據進行錄入、統計學分析。計量資料以平均數±標準差()表示,采用單因素方差分析比較,多重比較采用LSD-t檢驗,檢驗水準α 為0.05。
2 結果
2.1 各組大鼠神經運動功能評分及海馬組織病理評分的比較
模型組神經功能缺損評分、雙側貼紙去除時間、平衡木過桿時間、海馬組織病理評分明顯高于對照組(P<0.05);丙泊酚各劑量組神經功能缺損評分、雙側貼紙去除時間、平衡木過桿時間、海馬組織病理評分明顯低于模型組(P<0.05);且隨著丙泊酚給藥劑量的增加,神經功能缺損評分、雙側貼紙去除時間、平衡木過桿時間、海馬組織病理評分逐漸降低,劑量-效應關系明顯(P<0.05)(見表1)。
2.2 丙泊酚對各組大鼠海馬結構的影響
圖1 可見,對照組海馬區神經元細胞完整,排列緊密;模型組海馬區神經元排列松散,細胞深染固縮,有片狀壞死,神經細胞間質隔離;丙泊酚高劑組神經元細胞趨于正常;丙泊酚中、低劑量組較模型組而言,神經細胞疏松、固縮程度輕,神經元細胞核仁清楚可見。
2.3 各組大鼠腦組織海馬區Rho、Rho-kinase mRNA 表達水平的比較
模型組Rho、Rho-kinase mRNA 表達水平明顯高于對照組(P<0.05);丙泊酚各劑量組Rho、Rhokinase mRNA 表達水平明顯低于模型組(P<0.05);且隨著丙泊酚給藥劑量的增加,Rho、Rho-kinase mRNA 表達水平逐漸降低,劑量-效應關系明顯(P<0.05)(見表2)。
2.4 各組大鼠腦組織海馬區Rho、Rho-kinase 蛋白表達水平的比較
模型組Rho、Rho-kinase 蛋白表達水平明顯高于對照組(P<0.05);丙泊酚各劑量組Rho、Rhokinase 蛋白表達水平明顯低于模型組(P<0.05);且隨著丙泊酚給藥劑量的增加,Rho、Rho-kinase 蛋白表達水平逐漸降低,劑量-效應關系明顯(P<0.05),見表3 及圖2。
表1 各組大鼠神經運動功能評分及海馬組織病理評分的比較(,n =20)Table 1 Comparison of neuromotor function score and hippocampal histopathology score of rats in each group

表1 各組大鼠神經運動功能評分及海馬組織病理評分的比較(,n =20)Table 1 Comparison of neuromotor function score and hippocampal histopathology score of rats in each group
注:與對照組比較,1)P<0.05;與模型組比較,2)P<0.05;與丙泊酚組低劑量比較,3)P<0.05;與丙泊酚組中劑量比較,4)P<0.05。Note.Compared with the control group,1)P<0.05.Compared with the model group, 2)P<0.05.Compared with the low dose of the propofol group,3)P<0.05.Compared with the dose in the propofol group, 4)P<0.05.
組別Groups劑量(mg/kg)Dose神經功能缺損評分(分)Neurological impairment score (points)雙側貼紙去除時間(s)Double-sided sticker removal time平衡木過桿時間(s)Balance beam crossing time海馬組織病理評分(分)Hippocampal histopathology score(points)對照組Control group - 0.00±0.00 26.34±6.87 1.99±0.34 0.00±0.00模型組Model group - 10.66±0.4711) 103.63±25.6511) 16.54±6.8711) 9.96±0.561)丙泊酚組Propofol Group 20 8.14±0.3411)2) 80.76±8.1211)2) 12.30±0.5111)2) 8.65±0.441)2)40 6.23±0.2311)2)3) 51.28±9.8811)2)3) 8.65±0.5111)2)3) 5.98±0.481)2)3)80 5.35±0.1611)2)3)4) 50.32±9.1611)2)3)4) 4.71±0.5011)2)3)4) 3.99±0.391)2)3)4)

圖1 丙泊酚對各組大鼠海馬結構的影響(HE 染色)A, Control group.B, Model group.C, Propofol group low-dose group.D, Propofol group medium-dose group.E, Propofol group high-dose group.Figure 1 Effect of propofol on the hippocampus structure of each group of rats(HE staining)
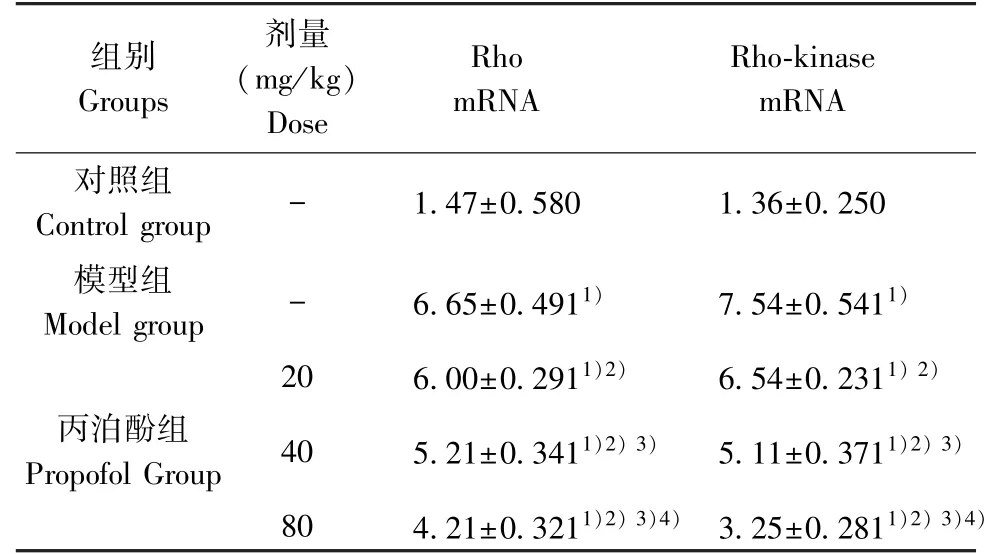
表2 各組大鼠腦組織海馬區Rho、Rho-kinase mRNA表達水平的比較(n=20)Table 2 Comparison of Rho and Rho-kinase mRNA expression levels of rats in each group

表3 各組大鼠腦組織海馬區Rho、Rho-kinase蛋白表達水平的比較(n=20)Table 3 Comparison of Rho and Rho-kinase protein expression levels of rats in each group

圖2 各組大鼠腦組織海馬區Rho、Rho-kinase 蛋白表達水平的比較Note.A, Control group.B, Model group C, Propofol group low-dose group.D, Propofol group medium-dose group.E, Propofol group high-dose group.Figure 2 Comparison of Rho and Rho-kinase protein expression levels of rats in each group
3 討論
丙泊酚是一種短效的靜脈催眠麻醉劑,可通過多種機制為腦缺血再灌注提供保護。 丙泊酚(2,6-二異丙基苯丙醇)是一種速效,持續時間短的靜脈內催眠麻醉劑,在腦手術期間和之后被廣泛使用。異丙酚的化學結構類似于具有抗氧化特性的α-生育酚(維生素E)的活性核[10]。 本研究結果顯示;丙泊酚各劑量組神經功能缺損評分、雙側貼紙去除時間、平衡木過桿時間、海馬組織病理評分明顯低于模型組。 這說明,丙泊酚能減輕大鼠腦缺血再灌注神經功能損傷。 根據先前的研究,炎癥,氧化應激和細胞凋亡是腦缺血再灌注損傷有害過程的三個主要機制,被證明是全球第二大常見致死因素,也是成人神經系統殘疾的主要原因。 此外,凋亡是腦缺血再灌注損傷的主要原因之一,因此,抑制神經元凋亡是治療缺血性中風的關鍵目標。 證據表明凋亡在缺血后神經細胞死亡中起重要作用,這表明抑制凋亡性細胞死亡的治療性干預措施可能會減輕腦缺血再灌注損傷。 近期研究表明[11-12],丙泊酚可抑制神經細胞線粒體細胞色素c 的釋放,進而抑制神經細胞凋亡。 本次研究病理結果顯示:對照組海馬區神經元細胞完整,排列緊密;模型組海馬區神經元排列松散,細胞深染固縮,有片狀壞死,神經細胞間質隔離;丙泊酚高劑組神經元細胞趨于正常;丙泊酚中、低劑量組較模型組而言,神經細胞疏松、固縮程度輕,神經元細胞核仁清楚可見。 這與上述討論一致。
本研 究 結 果 顯 示: 模 型 組Rho、 Rho-kinase mRNA 和蛋白表達水平明顯高于對照組;丙泊酚各劑量組Rho、Rho-kinase mRNA 和蛋白表達水平明顯低于模型組;且隨著丙泊酚給藥劑量的增加,Rho、Rho-kinase mRNA 表達水平逐漸降低,劑量-效應關系明顯。 這說明,丙泊酚能抑制Rho、Rho-kinase mRNA 和蛋白表達水平的表達進而抑制Rho/Rhokinase 信號通路的激活。 炎癥反應,神經細胞內鈣超載和細胞凋亡已被證明是腦I/R 損傷的主要原因。 屬于高度保守的先天免疫受體GTPase 超家族的Rho 可以識別從死亡/垂死細胞釋放的外源病原體或與損傷相關的分子模式(DAMP)。 Rho 是第一個被表征的哺乳動物GTPase,主要在小膠質細胞,星形膠質細胞,神經元和內皮細胞中表達。 許多研究表明,Rho 在腦缺血/再灌注的病理過程中起關鍵作用,并且在缺血后小鼠腦中Rho 的mRNA 上調[13-14]。 免疫組織化學研究表明,在MCAO 小鼠模型中,缺血/再灌注后Rho 陽性細胞從1 h 逐漸增加至22 h。 此外,在缺血/再灌注后,Rho-KO 小鼠的梗死面積和神經功能缺損均低于野生型小鼠[15]。 Rho可以激活Rho-kinase 和有絲分裂原激活的蛋白激酶(MAPK)信號傳導途徑,導致神經炎癥反應。 c-jun氨基末端激酶(JNK)是Rho-kinase 的主要組成部分,已被證明在腦缺血/灌注損傷后的神經元凋亡中起關鍵作用[16]。 大量證據表明,Bcl-2 充當Rhokinase 的非核底物,并通過調節線粒體膜的通透性在細胞內凋亡信號轉導中發揮關鍵作用。 Caspase-3是凋亡執行過程中的關鍵分子,抑制其激活可能在凋亡級聯反應的最后一步起作用并阻止凋亡細胞的死亡[17-18]。 結合本次研究結果,提示對Rho/Rho-kinase 信號通路的抑制可能是治療腦缺血再灌注損傷的新方向。
綜上所述,丙泊酚能減輕大鼠腦缺血再灌注神經功能損傷;其機制與丙泊酚能抑制Rho、Rhokinase mRNA 和蛋白的表達進而抑制Rho/Rhokinase 信號通路的激活有關。

