化風丹藥母指紋圖譜的建立及不同發酵時間樣品中7種核苷類成分的含量測定
曹國瓊 游珊麗 徐劍 張永萍


摘 要 目的:建立化風丹藥母的指紋圖譜,并測定不同發酵時間樣品中7種核苷類成分的含量。方法:采用高效液相色譜法(HPLC),色譜柱為Pntulips BP-C18,流動相為甲醇-水(梯度洗脫),流速為0.8 mL/min,檢測波長為260 nm,柱溫為35 ℃,進樣量為10 μL。以黃嘌呤為參照,繪制12批化風丹藥母的HPLC指紋圖譜;采用《中藥色譜指紋圖譜相似度評價系統(2012版)》進行相似度評價,確定共有峰;同法測定不同發酵時間(0、1、2、3、4周)樣品中尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷的含量。結果:12批化風丹藥母共有8個共有峰,相似度為0.712~0.954;指認了7種成分,分別為尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷。不同發酵時間樣品中上述7種成分檢測質量濃度的線性范圍分別為0.87~8.7 μg/mL(r=0.999 6)、1.51~15.1 μg/mL(r=0.999 7)、6.08~60.8 μg/mL(r=0.999 5)、1.52~15.2 μg/mL(r=0.999 6)、1.82~18.2 μg/mL(r=0.999 6)、1.48~14.8 μg/mL(r=0.999 6)、1.63~16.3 μg/mL(r=0.999 3);定量限分別為 0.027 4、0.076 3、0.250 4、0.172 3、0.101 1、0.078 3、0.084 2 μg/mL,檢測限分別為0.008 7、0.025 5、0.007 9、0.084 1、0.035 7、0.026 9、0.027 5 μg/mL;精密度、重復性、穩定性(12 h)試驗的RSD均小于3%;加樣回收率分別為94.16%~100.16%(RSD=2.24%,n=6),93.87%~100.65%(RSD=2.67%,n=6),93.52%~99.66%(RSD=2.30%,n=6),93.67%~98.24%(RSD=1.89%,n=6),96.00%~102.18%(RSD=1.96%,n=6),94.62%~101.54%(RSD=2.82%,n=6),97.72%~104.56%(RSD=2.97%,n=6)。發酵0~4周時,上述7種成分及總核苷的含量分別為0.042~0.232、0.027~0.181、0.039~0.651、0.026~0.225、0.034~0.111、0.009~0.124、0.079~0.099 、0.647~1.292 mg/g;發酵1~4周時的尿嘧啶、次黃嘌呤、黃嘌呤及總核苷的含量均較發酵0周時顯著升高,而尿苷、肌苷、鳥苷的含量較發酵0周時顯著降低。結論:所建指紋圖譜特征性強且操作簡便,可用于化風丹藥母的質量控制;含量測定方法準確、可靠,可用于同時測定其中7種核苷類有效成分的含量;化風丹藥母中的核苷類成分含量受發酵時間的影響。
關鍵詞 化風丹藥母;高效液相色譜法;指紋圖譜;核苷類成分;含量測定
ABSTRACT? ?OBJECTIVE: To establish fingerprint of Huafengdan yaomu, and to determine the contents of 7 nucleosides in samples of different fermentation time. METHODS: HPLC method was adopted. The determination was performed on Pntulips BP-C18 column with mobile phase consisted of methanol-water (gradient elution) at the flow rate of 0.8 mL/min. The detection wavelength was set at 260 nm, and column temperature was 35 ℃. The sample size was 10 μL. Using xanthine as reference, HPLC fingerprint of 12 batches of Huafengdan yaomu was drawn. The similarity of samples were evaluated with Similarity Evaluation System of TCM Chromatographic Fingerprints (2012 edition). Common peaks were confirmed. The contents of uracil, hypoxanthine, xanthine, uridine, inosine, guanosine and thymidine were determined in samples of different fermentation time (0, 1, 2, 3, 4 weeks) by the same method. RESULTS: There were 8 common peaks in 12 batches of Huafengdan yaomu, with similarities ranging from 0.712 to 0.954; 7 components were identified, namely uracil, hypoxanthine, xanthine, uridine, inosine, guanosine and thymidine. The linear ranges of mass concentrations of above 7 components in samples at different fermentation time were 0.87-8.7 μg/mL (r=0.999 6), 1.51-15.1 μg/mL(r=0.999 7), 6.08-60.8 μg/mL(r=0.999 5), 1.52-15.2 μg/mL(r=0.999 6), 1.82-18.2 μg/mL(r=0.999 6), 1.48-14.8 μg/mL(r=0.999 6), 1.63-16.3 μg/mL(r=0.999 3). The limits of quantification were 0.027 4, 0.076 3, 0.250 4, 0.172 3, 0.101 1, 0.078 3, and 0.084 2 μg/mL, and the detection limits were 0.008 7, 0.025 5, 0.007 9, 0.084 1, 0.035 7, 0.026 9, 0.027 5 μg/mL, respectively. RSDs of precision, repeatability and stability tests (12 h) were all less than 3%. The sample recovery rates were 94.16%-100.16% (RSD=2.24%, n=6), 93.87%-100.65% (RSD=2.67%, n=6), 93.52%-99.66% (RSD=2.30%, n=6), 93.67%-98.24% (RSD=1.89%, n=6), 96.00%-102.18% (RSD=1.96%, n=6), 94.62%-101.54% (RSD=2.82%, n=6), 97.72%-104.56% (RSD=2.97%, n=6). After fermentation for 0-4 weeks, the contents of the above 7 components and total nucleosides were 0.042-0.232, 0.027-0.181, 0.039-0.651, 0.026-0.225, 0.034-0.111, 0.009-0.124, 0.079-0.099, 0.647-1.292 mg/g, respectively. After fermentation for 1-4 weeks, the contents of uracil, hypoxanthine, xanthine and total nucleosides were significantly increased, compared with 0 week of fermentation; the contents of uridine, inosine and guanosine were significantly lower than those in 0 weeks. CONCLUSIONS: The established fingerprint has strong characteristics and simple to operate, which can be used for the quality control of Huafengdan yaomu; the content determination method is accurate and reliable, and can be used to simultaneously determine the contents of 7 active nucleosides; the content of nucleosides in Huafengdan muyao is affected by fermentation time.
KEYWORDS? ?Huafengdan yaomu; HPLC; Fingerprint; Nucleosides; Content determination
中圖分類號 R283.1;R917 文獻標志碼 A 文章編號 1001-0408(2021)02-0158-06
DOI 10.6039/j.issn.1001-0408.2021.02.06
化風丹是貴州省傳統名藥,具有息風鎮痙、豁痰開竅的功效,臨床用于治療風痰閉阻、中風偏癱、癲癇等癥,療效顯著[1-2]。化風丹的制備分為藥母制備和成藥制備。其中,藥母是將川烏、半夏、天南星、白附子、郁金等藥材粉碎,再加入六神曲和牛膽汁混勻,于自然條件下發酵,經陰干后即得[3-5]。含有毒性成分的中藥是中藥重要組成部分,在中藥復方制劑中的應用十分廣泛,在臨床實踐中發揮了重要治療作用[6]。化風丹藥母中含有川烏、半夏、天南星等多種含毒性成分的中藥,有研究認為,發酵可以減弱藥物毒副作用,增強療效,改變藥物的原有性能,有利于成分溶出并產生新的活性成分和治療作用[7]。而化風丹藥母采用發酵法進行炮制,目的就在于減少副作用、增強療效。
目前,關于化風丹藥母質量檢測僅有藥母中毒性生物堿烏頭堿、新烏頭堿、次烏頭堿、苯甲酰烏頭堿、苯甲酰新烏頭堿、苯甲酰次烏頭堿的報道[8],暫無有關其藥母中有效成分含量的研究,且關于化風丹藥母質量控制及發酵前后主要化學成分或指標性成分的變化也未見相關文獻報道。因此,建立綜合評價化風丹藥母質量的方法尤為重要。化風丹藥母中的天南星、半夏、白附子為天南星科植物,化學成分相似,都含有生物堿、核苷、揮發油、氨基酸、有機酸等成分[9-11]。其中,核苷類如肌苷、尿苷、鳥苷、黃嘌呤、尿嘧啶、次黃嘌呤、胸苷等成分具有廣泛的藥理活性,如調節免疫、調節腦細胞代謝、鎮靜中樞神經、抗血小板聚集等[12-15]。有文獻報道,半夏、天南星和白附子均含有肌苷、尿苷、鳥苷、黃嘌呤等成分[16],因此核苷類成分可以作為化風丹藥母的指標性成分。
指紋圖譜及多成分檢測能提供豐富的指標成分或藥效成分信息,可全面反映藥品的質量,近年來已被廣泛應用于中藥材和中成藥的質量控制領域[17-18]。為此,本研究建立了化風丹藥母的高效液相色譜(HPLC)指紋圖譜,同時采用HPLC法測定不同發酵時間樣品中尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷等7種核苷類成分的含量,旨在為化風丹藥母的整體質量評價和質量控制提供參考。
1 材料
1.1 儀器
本研究所用的儀器有:LC-20AT型HPLC儀(包括LC-20AT型二元泵、SPD-20A型紫外-可見光檢測器,日本Shimadzu公司)、METTLER AE240型萬分之一電子分析天平(瑞士Mettler Toledo公司)、KQ-500DE型數控超聲波清洗器(昆山市超聲儀器有限公司)、SHZ-D(Ⅲ)型循環水真空泵[邦西儀器科技(上海)有限公司]、HSX-250型恒溫恒濕培養箱(上海海向儀器設備廠)。
1.2 藥品與試劑
尿嘧啶對照品(批號100469-201302,純度99.6%)、次黃嘌呤對照品(批號140661-201704,純度100%)、黃嘌呤對照品(批號140662- 201606,純度100%)、尿苷對照品(批號110887-201802,純度99.5%)、肌苷對照品(批號140669-201606,純度98.6%)、鳥苷對照品(批號111977- 201501,純度93.6%)、胸苷對照品(批號101215-201401,純度100%)均購自中國食品藥品檢定研究院;藥材樣品天南星、半夏、白附子、川烏、郁金(批號分別為20190506、20190412、 20190215、20190116、20190309)和六神曲(批號190207)均購自亳州康美中藥城,5種藥材經貴州中醫藥大學中藥民族藥資源研究院肖承鴻高級實驗師鑒定分別為天南星科植物天南星Arisaema erubescens (Wall.) Schott的干燥塊莖,天南星科植物半夏Pinellia ternata (Thunb.) Breit.的干燥塊莖,天南星科植物獨角蓮Typhonium giganteum Engl.的干燥塊莖,毛茛科植物烏頭Aconitum carmichaelii Debx.的干燥母根,姜科植物溫郁金Curcuma zvenyujin Y. H. Chenet C. Ling的干燥塊根;牛膽汁收集自屠宰場(按前期研究篩選pH值為6.27~7.29);甲醇為色譜純,其余試劑均為分析純,水為超純水。
2 方法與結果
2.1 化風丹藥母的制備
按化風丹藥母處方比例(生川烏 ∶ 白附子 ∶ 生半夏 ∶ 生南星 ∶ 郁金 ∶ 六神曲=1 ∶ 1 ∶ 1 ∶ 1 ∶ 0.5 ∶ 0.005,g/g,下同)稱取川烏、白附子、半夏、天南星、郁金和六神曲,置于研缽中混勻,加入與上述藥材總質量相等的牛膽汁攪拌均勻,置于密閉容器內,于35 ℃、濕度60%的恒溫恒濕培養箱中發酵4周,取出,干燥,即得化風丹藥母。
2.2 化風丹藥母發酵樣品的制備
按化風丹藥母處方比例稱取川烏、白附子、半夏、天南星、郁金和六神曲,共12份,按“2.1”項下方法制備發酵1周樣品(編號S1~S12),用于指紋圖譜的建立及含量測定的方法學考察(前期預試驗發現,無論發酵幾周,所得樣品均可用于指紋圖譜的建立及含量測定的方法學考察,故本研究選擇發酵時間最短的樣品)。另按化風丹藥母處方比例稱取川烏、白附子、半夏、天南星、郁金和六神曲,共15份,按“2.1”項下方法分別于發酵0、1、2、3、4周時取出,每周平行取出3份,置于- 80 ℃冰箱中保存,用于不同發酵時間樣品的含量測定。
2.3 指紋圖譜的建立
2.3.1 色譜條件 以Pntulips BP-C18(250 mm×4.6 mm,5 μm)為色譜柱;以甲醇(A)-水(B)為流動相,梯度洗脫(0~24 min,100%B;24~48 min,100%B→80%B;48~55 min,80%B→100%B);流速為0.8 mL/min,檢測波長為260 nm,柱溫為35 ℃,進樣量為10 μL。
2.3.2 供試品溶液的制備 精密稱取“2.2”項下化風丹藥母發酵1周樣品(編號S3),約3 g,精密稱定,置于具塞錐形瓶中,加入水20 mL,精密稱定,超聲(功率100 W,頻率53 kHz)處理30 min,放冷,再次稱定質量,用水補足減失的質量,以20 000? r/min離心10 min,取上清液,經0.45 μm微孔濾膜濾過,取續濾液,即得。
2.3.3 混合對照品溶液的制備 精密稱定尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷對照品適量,加水制成上述成分質量濃度分別為0.174、0.151、0.152、0.152、0.182、0.148、0.163 mg/mL的單一對照品貯備液。分別精密吸取上述單一對照品貯備液0.5、1、4、1、1、1、1 mL,置于10 mL量瓶中,用水定容,混勻,制得尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷質量濃度分別為0.008 7、0.015 1、0.060 8、0.015 2、0.018 2、0.014 8、0.016 3 mg/mL的混合對照品溶液。
2.3.4 精密度試驗 取“2.3.2”項下供試品溶液(編號S3)適量,按“2.3.1”項下色譜條件連續進樣測定6次,以4號峰為參照,記錄各共有峰的相對保留時間和相對峰面積。結果,8個共有峰相對峰面積的RSD為1.65%~2.24%(n=6),相對保留時間的RSD為0.42%~1.73%(n=6),表明方法精密度良好。
2.3.5 穩定性試驗 取“2.3.2”項下供試品溶液(編號S3)適量,分別于室溫下放置0、1、2、4、6、8、12 h時按“2.3.1”項下色譜條件進樣測定,以4號峰為參照,記錄各共有峰的相對保留時間和相對峰面積。結果,8個共有峰相對峰面積的RSD為1.09%~2.85%(n=7)、相對保留時間的RSD為0.49%~1.67%(n=7),表明供試品溶液于室溫下放置12 h內穩定性良好。
2.3.6 重復性試驗 取“2.2”項下化風丹藥母發酵1周樣品(編號S3),約3 g,共6份,按“2.3.2”項下方法制備供試品溶液,再按“2.3.1”項下色譜條件進樣測定,以4號峰為參照,記錄各共有峰的相對保留時間和相對峰面積。結果,8個共有峰相對峰面積的RSD為1.37%~2.65%(n=6),相對保留時間的RSD為0.53%~1.64%(n=6),表明方法重復性良好。
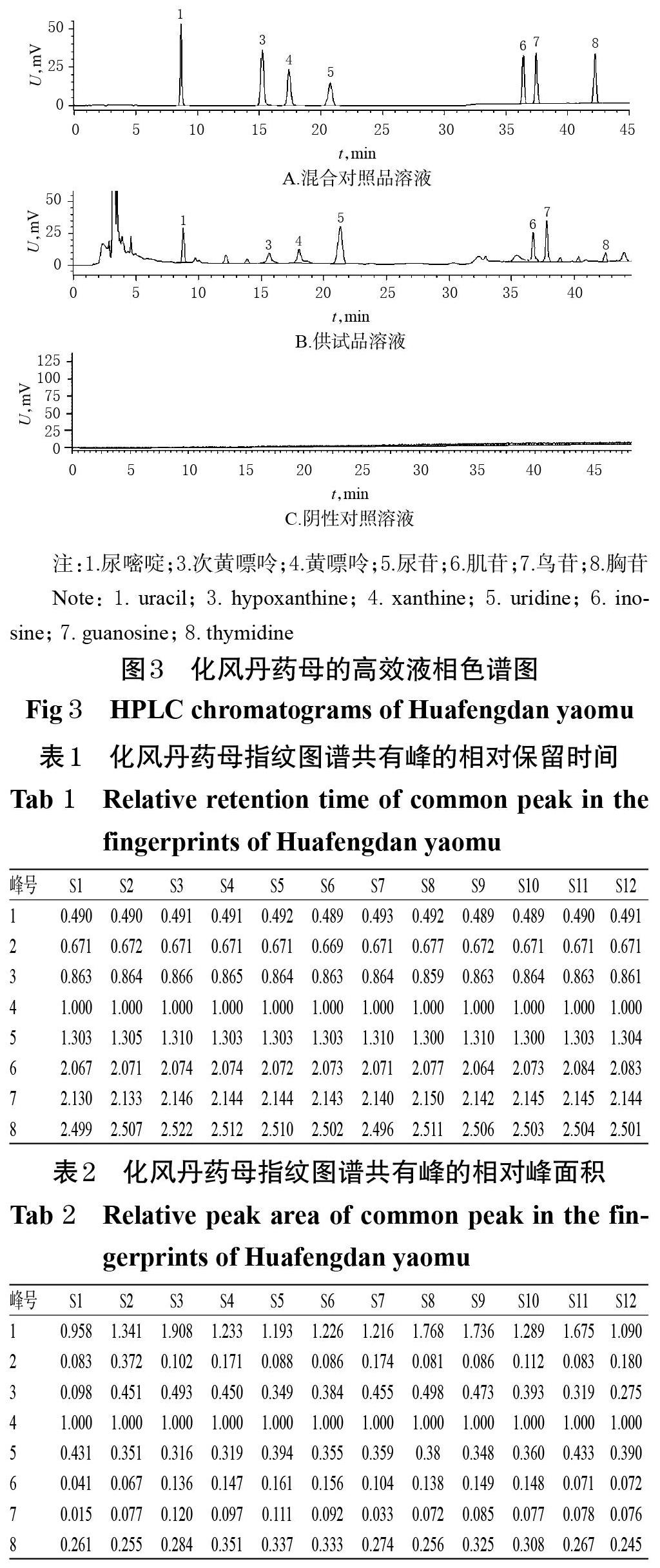
2.3.7 HPLC指紋圖譜的建立 取12批“2.2”項下化風丹藥母發酵1周樣品(編號S1~S12)適量,按“2.3.2”項下方法制備供試品溶液,再按“2.3.1”項下色譜條件進樣測定,采用《中藥色譜指紋圖譜相似度評價系統(2012 版)》,以S1樣品(隨機選取)色譜圖作為參照色譜,對照指紋圖譜采用中位數法,設定時間窗為 0~47 min,時間寬度為 0.3 min,經多點校正后自動匹配,采用平均值法生成HPLC 疊加指紋圖譜和對照指紋圖譜,詳見圖1、圖2。
2.3.8 共有峰的指認 12批化風丹藥母發酵1周樣品共有8個共有峰,通過與混合對照品溶液(圖3 A)色譜峰比對,共指認7個色譜峰,分別為尿嘧啶(1號峰)、次黃嘌呤(3號峰)、黃嘌呤(4號峰)、尿苷(5號峰)、肌苷(6號峰)、鳥苷(7號峰)、胸苷(8號峰)。其中,4號峰黃嘌呤色譜峰保留時間適中,與其余色譜峰分離良好,故以其為參照峰(S),計算各共有峰的相對保留時間和相對峰面積,結果見表1、表2。
2.3.9 相似度評價 采用《中藥色譜指紋圖譜相似度評價系統(2012版)》,以S1為對照,對12批化風丹藥母發酵1周樣品進行整體相似度評價。結果,12批化風丹藥母指紋圖譜與對照指紋圖譜的相似度為0.712~0.954,詳見表3。
2.4 7種核苷類成分的含量測定
2.4.1 色譜條件 同“2.3.1”項下色譜條件。
2.4.2 溶液的制備 供試品溶液制備同“2.3.2”項下,混合對照品溶液制備同“2.3.3”項下方法,以水為陰性對照溶液。
2.4.3 系統適用性試驗 取上述混合對照品溶液、供試品溶液、陰性對照溶液各適量,按“2.4.1”項下色譜條件進樣測定,記錄色譜圖。結果,各待測成分色譜峰與相鄰色譜峰的分離度均大于1.5,理論板數均不低于10 000,詳見圖3。
2.4.4 線性關系考察 取“2.4.2”項下混合對照品溶液1、2、4、6、8、10 mL,分別置于10 mL量瓶中,加水定容,混勻,得系列線性工作溶液;精密吸取上述系列線性工作溶液,按“2.4.1”項下色譜條件進樣測定,記錄色譜圖,以待測成分質量濃度(X,μg/mL)為橫坐標、峰面積(Y)為縱坐標進行線性回歸,結果見表4。
2.4.5 定量限與檢測限考察 取“2.4.2”項下混合對照品溶液適量,用水逐級稀釋,按“2.4.1”項下色譜條件進樣測定,分別以信噪比10 ∶ 1、3 ∶ 1計算定量限、檢測限。結果,尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷的定量限分別為0.027 4、0.076 3、0.250 4、0.172 3、0.101 1、0.078 3、0.084 2 μg/mL,檢測限分別為0.008 7、0.025 5、0.007 9、0.084 1、0.035 7、0.026 9、0.027 5 μg/mL。
2.4.6 精密度試驗 取“2.4.2”項下混合對照品溶液,按“2.4.1”項下色譜條件連續進樣測定6次,記錄峰面積。結果,尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷峰面積的RSD分別為1.57%、0.92%、2.20%、1.16%、1.15%、1.39%、1.42%(n=6),表明儀器精密度良好。
2.4.7 重復性試驗 取化風丹藥母發酵1周樣品(編號S3),約3 g,共6份,按“2.4.2”項下方法制備供試品溶液,再按“2.4.1”項下色譜條件進樣測定,記錄峰面積并按外標法計算樣品含量。結果,尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷的含量分別為0.169、0.081、0.324、0.161、0.037、0.009、0.098 mg/g,RSD分別為1.25%、1.97%、1.18%、2.03%、2.94%、2.77%、2.02%(n=6),表明方法重復性良好。
2.4.8 穩定性試驗 取“2.4.2”項下供試品溶液(編號S3),分別于室溫下放置0、1、2、4、6、8、12 h時按“2.4.1”項下色譜條件進樣測定,記錄峰面積。結果,尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷峰面積的RSD分別為2.00%、2.13%、2.46%、1.58%、2.43%、1.27%、2.78%(n=7),表明供試品溶液于室溫放置12 h內穩定性良好。
2.4.9 加樣回收率試驗 取已知含量的化風丹藥母發酵1周樣品(編號S3),約1.5 g,共6份,精密稱定,分別精密加入各單一對照品溶液(精密稱定尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷、胸苷對照品各12.85、6.20、12.35、12.25、13.75、3.25、7.45 mg,加水制成上述成分質量濃度分別為0.257、0.124、0.494、0.245、0.055、0.013、0.149 mg/mL的單一對照品溶液)1 mL,按“2.4.2”項下方法制備供試品溶液,再按“2.4.1”項下色譜條件進樣測定,記錄峰面積并計算加樣回收率,結果見表5。
2.4.10 樣品含量測定 精密稱取“2.2”項下不同發酵時間的化風丹藥母樣品,約3 g,按“2.4.2”項下方法制備供試品溶液,再按“2.4.1”項下色譜條件進樣測定,記錄峰面積并按外標法計算樣品含量,結果見表6。
由表6可知,發酵0周(未發酵)時,化風丹藥母中尿嘧啶、次黃嘌呤、黃嘌呤及總核苷的平均含量分別為0.042、0.027、0.039、0.647 mg/g;發酵不同時間(1~4周)后,上述3種成分及總核苷的平均含量均明顯高于發酵0周時,平均含量分別為0.160~0.232、0.070~0.181、0.298~0.651、0.845~1.292 mg/g。發酵0周時,化風丹藥母中尿苷、肌苷、鳥苷的平均含量分別為0.225、0.111、0.124 mg/g;發酵不同時間(1~4周)后,上述3種成分的平均含量均明顯低于發酵0周時,平均含量分別為0.026~0.162、0.034~0.071、0.009~0.032 mg/g。發酵0周時,胸苷的平均含量為0.079 mg/g;發酵不同時間(1~4周)后,其含量稍有增加,為0.084~0.099 mg/g。
3 討論
中藥復方制劑化學成分復雜,選擇梯度洗脫能有利于不同極性成分的分離[19]。本研究參考相關文獻方法[20],選擇甲醇-水為流動相,對不同流動相梯度洗脫程序[(0~6 min,100%B;6~60 min,100%B→80%B)、(0~30 min,100%B;30~60 min,100%B→80%B)、(0~24 min,100%B;24~48 min,100%B→80%B;48~55 min,80%B→100%B)]、柱溫(25、30、35 ℃)、流速(8.0、1.0 mL/min)等進行比較。結果發現,采用本研究“2.3.1”項下色譜條件時各色譜峰分離良好,能達到指紋圖譜及定量分析的要求。
指紋圖譜技術能全面反映中藥的內在化學特征,具有整體性和模糊性特點,已成為控制中藥質量的最有效手段[21]。本研究首先建立了化風丹藥母的HPLC指紋圖譜,結果顯示共有8個共有峰,并指認了其中7個共有峰,分別為尿嘧啶、次黃嘌呤、黃嘌呤、尿苷、肌苷、鳥苷和胸苷。
中藥發酵是指藥物在一定的溫度和濕度條件下,借助微生物和酶的催化分解作用,使藥材發泡,并生成黃白色霉衣,從而改變藥材原有藥性,以更好地滿足臨床用藥的需要[22]。本研究結果顯示,不同發酵時間化風丹藥母中核苷類成分含量存在顯著差異,其中不同發酵時間(1~4周)樣品中尿嘧啶、次黃嘌呤、黃嘌呤及總核苷含量與發酵0周時比較均顯著增加,其原因可能為未發酵的化風丹藥母中存在其他大分子核苷(酸)類成分等,這些成分在發酵條件下進行降解,產生小分子的核苷類成分,從而導致部分核苷及總核苷成分含量顯著增加,提示化風丹藥母發酵具有增加有效成分的作用。而尿苷、肌苷、鳥苷的含量與發酵0周時比較均顯著降低,其原因可能為發酵過程中微生物對這幾種成分進行分解或轉化,也可能為發酵時加入的牛膽汁呈弱酸性,核苷呈堿性,發酵過程中發生了化學反應。
綜上所述,所建指紋圖譜特征性強且操作簡便,可用于化風丹藥母的質量控制;含量測定方法準確、可靠,可用于同時測定其中7種核苷類有效成分的含量;化風丹藥母中的核苷類成分含量受發酵時間的影響。
參考文獻
[ 1 ] 向文英,楊武,梅朝葉,等.化風丹血清藥物化學的初步研究[J].中國藥房,2016,27(28):3911-3914.
[ 2 ] 徐文峰,李怡,金鵬飛,等.化風丹的研究進展[J].中南藥學,2017,15(8):1100-1105.
[ 3 ] 曹國瓊,張永萍,徐劍,等.高效液相色譜法測定化風丹藥母中3種雙酯型生物堿含量[J].貴州農業科學,2014,42(11):58-61.
[ 4 ] 曹國瓊,張永萍,徐劍,等.神曲與酶對化風丹藥母發酵過程中毒性成分的影響[J].中國實驗方劑學雜志,2015,21(4):1-4.
[ 5 ] 曹國瓊,張永萍,徐劍,等.牛膽汁對化風丹藥母發酵減毒的影響[J].中成藥,2019,41(4):868-873.
[ 6 ] 嚴妍,吳娟,焦月華,等.毒性中藥復方臨床安全性再評價的思考[J].中國新藥雜志,2017,26(15):1762-1766.
[ 7 ] 孟彬,孫敬鋒,呂愛軍.發酵中草藥在水產養殖中的應用[J].水產科學,2018,37(3):421-426.
[ 8 ] 馬奮剛,張永萍,曹國瓊,等. HPLC法測定化風丹藥母在發酵過程中6個酯型生物堿的含量[J].藥物分析雜志,2020,40(3):413-419.
[ 9 ] 翟興英,張凌,李冰濤,等.采用UPLC-Q-TOF-MS/MS分析半夏藥材中的化學成分[J].中國實驗方劑學雜志,2019,25(7):173-183.
[10] 何達海,丁克毅,王曉玲.天南星屬植物化學成分研究進展[J].西南民族大學學報(自然科學版),2014,40(6):861-865.
[11] 顧曉玲,金陽,張麗穎,等.白附子正丁醇部位化學成分研究[J].現代中藥研究與實踐,2017,31(4):30-32.
[12] 王銳.嘧啶核苷的研究進展[J].生物技術通訊,2007,18(3):539-542.
[13] SCHNEIDER B,SARFATI R,DEVILLE-BONNE D,? ?et al. Role of nucleoside diphosphate kinase in the activation of anti-HIV nucleoside analogs[J]. J Bioenerg Biomembr,2000,32(3):317-324.
[14] SUN Q,LI X,GONG S,et al. A novel synthesis of antiviral nucleoside phosphoramidate and thiophosphoramidate prodrugs via nucleoside H-phosphonamidates[J]. Nucleosides Nucleotides Nucleic Acids,2013,32(11):617-638.
[15] LEE J,CHUANG TH,REDECKE V,et al. Molecular basis for the immunostimulatory activity of guanine nucleoside analogs:activation of Toll-like receptor 7[J]. Proc Natl Acad Sci U S A,2003,100(11):6646-6651.
[16] 黃鮫,易進海,劉玉紅,等.天南星、半夏、白附子中8種核苷成分的含量測定[J].中國實驗方劑學雜志,2013,19(16):59-62.
[17] 尚瑩瑩,胡輝,劉源才.金櫻子配方顆粒提取工藝優化及質量標準、指紋圖譜研究[J].中國藥房,2018,29(14):1922-1927.
[18] 牛曉靜,魯靜,孫廣科,等.淫羊藿總黃酮提取物的HPLC指紋圖譜建立及其中8種成分的含量測定[J].中國藥房,2018,29(24):3376-3380.
[19] 王芳.高效液相色譜在中藥研究中的應用進展[J].基層中藥雜志,2002,16(3):44-46.
[20] 王朋展,相美容,李燦,等. HPLC法同時測定不同來源半夏及其偽品中9種核苷類成分的含量[J].藥物分析雜志,2017,37(2):212-218.
[21] 徐妍,楊華蕊,楊永壽,等.中藥指紋圖譜研究現狀及展望[J].世界最新醫學信息文摘,2018,18(76):91-94.
[22] 胥敏,吳純潔,嚴丹,等.中藥發酵技術傳承與創新的探索[J].中國實驗方劑學雜志,2015,21(23):230-234.
(收稿日期:2020-07-19 修回日期:2020-10-26)
(編輯:陳 宏)

