富血小板血漿對大鼠宮頸糜爛的治療作用及其對炎性因子表達的影響*
張 蘭,溫路生,陳 婧,張小燕,陳燕萍,吳明燕,李佳怡,陳艷惠,陳 慧△
(廈門大學附屬東南醫院:1.婦產科;2.病理科,福建漳州 363000)
宮頸炎是婦科常見疾病,在已婚女性中發病率高[1]。子宮頸主要由結締組織構成,宮頸管黏膜為單層柱狀上皮,抗感染能力較差,易發生感染;子宮頸陰道部由復層鱗狀上皮覆蓋,與陰道鱗狀上皮相延續,陰道為有菌的環境,陰道炎癥均可引起子宮頸陰道部的炎癥[2]。由于陰道炎癥刺激、物理化學因素刺激及機械性刺激等均可造成子宮頸不同程度的損傷,引發宮頸炎。長期的宮頸炎或伴隨人乳頭瘤病毒(HPV)感染可導致宮頸內瘤樣變,進而演化為宮頸癌[3]。因此,宮頸炎的治療十分重要。研究表明,血小板含有大量的生長因子和細胞因子,對炎癥、軟組織愈合產生影響。此外,血小板也釋放許多具有生物活性的蛋白,可以吸引巨噬細胞、間充質干細胞等,不僅促進清除退化、壞死組織,還可以提高組織再生和愈合能力[4]。富血小板血漿(PRP)是血小板濃度為全血濃度2~7倍的血漿,含有豐富的血小板[5]。而血小板內含有許多在軟組織愈合中起決定作用的生長因子與細胞因子,可以保持身體的微環境,在不打破身體微環境平衡的情況下提供豐富的促進愈合的因子。自體PRP具有制作簡單、價格低廉、易獲得、損傷小等特點[6];并且,由于自體PRP消除了免疫反應,無傳播疾病的風險,在臨床中得到越來越廣泛的應用。本研究通過構建大鼠宮頸炎修復模型,探討PRP在宮頸炎修復方面的作用,為臨床應用提供立論依據。
1 材料與方法
1.1 材料
1.1.1實驗動物
60只SD大鼠(雌性,未孕)購自北京維通利華實驗動物技術有限公司,體重(220±20)g。實驗動物設計方案嚴格經過本院倫理委員會審查。將實驗大鼠飼養于動物房,溫度(23±2)℃,濕度50%~60%,光照/黑暗周期為12 h。2周適應環境,正常飲水、進食。
1.1.2主要試劑
苯酚購自天津市登豐化學品有限公司。大鼠白細胞介素(IL)-1β試劑盒、大鼠腫瘤壞死因子α(TNF-α)試劑盒和大鼠IL-6試劑盒均購自南京凱基生物科技有限公司。蘇木素-伊紅(HE)試劑盒購自北京索萊寶生物科技有限公司。RIPA裂解液、二喹啉甲酸(BCA)試劑盒購自美國Abcam公司。兔抗IL-1β抗體、兔抗TNF-α抗體、兔抗IL-6抗體和山羊抗兔IgG抗體購自美國Cell Signaling Technology公司。
1.2 方法
1.2.1大鼠宮頸糜爛模型制備
參照文獻[7]造模:苯酚加蒸餾水、阿拉伯樹膠制成25%膠漿。大鼠造模時,抽取0.15 mL該膠漿進行陰道深部注射,每3天注射1次,共4次。造模期間大鼠喂正常飼料,給予自由飲水。
1.2.2分組及給藥
SD大鼠分為4組:對照組、假手術組、模型組和PRP組,每組15只。模型組和PRP組大鼠按1.2.1進行宮頸糜爛模型制作;假手術組則在同一時間注射等體積的無菌生理鹽水;對照組大鼠不做任何處理。于造模后2 d經陰道注射相應劑量的生理鹽水或PRP溶液,每天給藥1次,連續12 d。對照組:無菌生理鹽水0.15 mL;假手術組:無菌生理鹽水0.15 mL;模型組:無菌生理鹽0.15 mL;PRP組:PRP溶液0.15 mL。參照文獻[8]方法制備PRP:用真空抗凝采血管采集6 mL靜脈血,上下顛倒數次混勻,另采集6 mL靜脈血測定原始血小板濃度作為對照;采用二次離心法制備PRP,先將裝有6 mL靜脈血的A離心管離心10 min,離心后血液分為3層,吸取上部血漿及界面下2 mm的紅細胞轉移致B離心管中,B離心管再次離心15 min,去掉上部含有極少量未沉降血小板的血漿層,剩余血漿及血細胞成分搖勻即PRP制備完成。
1.2.3取材
實驗結束后,大鼠經腹腔注射10%水合氯醛溶液進行麻醉。打開大鼠腹腔,于心尖處取血,并置于1.5 mL EP管中,3 000 r/min離心15 min,吸取上層血清進行后續的ELISA。接著取子宮和子宮頸,由同一實驗人員精確剪取子宮角到子宮頸位置的組織,濾紙吸干血跡,稱重。組織用4%多聚甲醛固定,進行HE染色;另取子宮頸組織放入-80 ℃保存,后續進行Western blot實驗。
1.2.4HE染色
取各組大鼠子宮頸組織,經固定、常規脫水、透明、浸蠟、石蠟包埋,制成5 μm的石蠟切片。切片放入蘇木素染液中5 min,自來水清洗后,置于1%鹽酸乙醇分化數秒,并用流水沖洗;切片放入伊紅染液中染色 3 min,流水稍洗;之后切片置于梯度乙醇(70%、80%、90%、100%)中脫水,各5 min,再放入二甲苯Ⅰ、Ⅱ中透明,分別5 min。將切片取出,用濾紙輕輕拭干切片上殘余的二甲苯,在組織上滴加中性樹膠封片,使用萊卡顯微鏡進行拍攝。
1.2.5ELISA
按1.2.3分離出的各組大鼠血清,按照ELISA試劑盒說明書進行操作,用酶聯儀在450 nm波長處依序測定各孔的吸光度值(A450值),根據A450值所繪制的標準曲線查出血清IL-1β、TNF-α和IL-6表達水平。
1.2.6Western blot
取各組大鼠宮頸組織100 mg,加入1 mL制備好的RIPA裂解液提取蛋白,用BCA法測定總蛋白含量。用12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)凝膠分離蛋白并轉移到PVDF膜上。用含有5%脫脂牛奶的磷酸鹽緩沖液(PBS)封閉膜1 h,然后加入稀釋后的IL-1β、TNF-α、IL-6和β-actin一抗,4 ℃搖床上孵育過夜。TBST洗膜3次,每次10 min,加入對應于一抗種屬來源的辣根過氧化物酶(HRP)標記的二抗,在室溫搖床上孵育1 h,TBST洗膜3次,每次10 min。使用電化學發光(ECL)法化學發光液顯色發光,凝膠成像系統拍照,Image Pro Plus圖像分析系統對蛋白條帶進行灰度值分析。
1.3 統計學處理
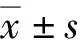
2 結 果
2.1 PRP對宮頸糜爛大鼠行為學的影響
實驗期間,對照組和假手術組大鼠精神良好,飲食正常,陰道口光滑,未見分泌物,且陰道口未見紅腫;模型組大鼠精神狀態萎靡,表現為發抖、少動、豎毛,食欲顯著下降,陰道出現黃色黏稠分泌物,宮頸口紅腫嚴重;與模型組比較,PRP組大鼠的癥狀明顯得到改善,精神狀態好轉,食欲有所增加,陰道分泌物減少,紅腫程度也減輕。在實驗期間,模型組有2只大鼠死亡,PRP組有1只大鼠死亡。
2.2 PRP對宮頸糜爛大鼠宮頸質量和宮頸臟器指數的影響
與對照組和假手術組相比,模型組大鼠宮頸質量和宮頸臟器指數明顯增加(P<0.01);與模型組相比,PRP組大鼠宮頸質量和宮頸臟器指數明顯下降(P<0.05),見表1。
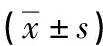
表1 各組大鼠宮頸質量和宮頸臟器指數比較
2.3 PRP對宮頸糜爛大鼠宮頸組織病理變化的影響
HE染色結果表明,對照組和假手術組大鼠宮頸組織未見病理性變化;模型組大鼠宮頸組織出現上皮細胞糜爛、變性、壞死,炎性細胞浸潤;PRP組大鼠宮頸組織病理變化較模型組減輕,上皮細胞糜爛現象得到改善,見圖1。

a:炎性細胞浸潤;b:上皮細胞浸潤;c:壞死;d:鱗狀上皮細胞浸潤;e:上皮糜爛。
2.4 PRP對宮頸糜爛大鼠血清IL-1β、TNF-α及IL-6水平的影響
與對照組和假手術組相比,模型組大鼠血清IL-1β、TNF-α和IL-6水平明顯上升(P<0.01);與模型組相比,PRP組大鼠血清IL-1β、TNF-α和IL-6水平明顯下降(P<0.05),見表2。

表2 各組大鼠血清IL-1β、TNF-α及IL-6水平比較
2.5 PRP對宮頸糜爛大鼠宮頸組織IL-1β、TNF-α、IL-6表達水平的影響
與對照組和假手術組相比,模型組大鼠宮頸組織中IL-1β、TNF-α和IL-6表達水平明顯上調(P<0.01);與模型組相比,PRP組大鼠宮頸組織中IL-1β、TNF-α和IL-6表達水平明顯下調(P<0.05),見圖2、表3。

圖2 各組大鼠宮頸組織中IL-1β、TNF-α及IL-6的表達
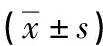
表3 各組大鼠宮頸組織中IL-1β、TNF-α及IL-6表達水平比較
3 討 論
宮頸炎主要由沙眼衣原體和淋病奈瑟菌感染引起,陰道毛滴蟲和HPV感染也與宮頸炎的發病有關[9]。患有宮頸炎癥和HPV感染的婦女罹患高度鱗狀上皮內病變及宮頸癌的風險增加[10-11]。此外,慢性炎癥被認為是包括宮頸癌在內的各種癌癥發展的促成因素。目前,臨床上常采用局部藥物治療或局部物理治療(如激光、冷凍、微波、電熨等)。通過治療使宮頸創面鱗狀上皮化生,達到重現光滑宮頸的目的。但藥物治療療程長,效果不確切,花費高;而物理治療后陰道分泌物增多,甚至出現大量排液,術后1~2周脫痂時出血,創面愈合時間長,治療后在一定的機械刺激或炎癥刺激下易再復發。此外,物理治療療效與醫師的操作水平、治療的深淺度密切相關,并且可引發術后出血、宮頸狹窄、不孕及感染。目前針對宮頸炎臨床上尚無明確的一線治療方案。
研究發現,IL-1β和TNF-α是具有免疫功能的調節因子,參與多種疾病的發生、發展[12]。在宮頸炎中TNF-α可促進炎性細胞的黏附和浸潤,引起組織損傷。在宮頸炎中炎性因子表達上調,如IL-1β和TNF-α表達水平顯著升高。IL-1β和TNF-α的生物學功能重疊,在許多疾病中其表達呈正相關,外周血 TNF-α、IL-1β及IL-6等炎性因子水平明顯升高,機體損傷進一步加重[13]。本研究發現,宮頸糜爛大鼠IL-1β、TNF-α和IL-6水平較健康大鼠升高,說明IL-1β、TNF-α和IL-6的過度表達是引發宮頸糜爛的重要病理環節之一,是宮頸炎發生、發展的病理學基礎。
PRP是由全血樣品制備的含有許多生長因子的血漿。PRP已用于治療多種疾病,包括糖尿病足潰瘍[14]、克羅恩病[15]等。體外研究表明,PRP可以增強多種類型細胞的增殖[16]。本研究發現,PRP能減輕炎性反應,對宮頸炎有一定的治療作用。
綜上所述,PRP對宮頸糜爛有一定治療作用,其機制可能與通過抑制IL-1β、TNF-α和IL-6的表達而減輕炎性反應有關。

