菲和Cd2+單一及復合污染對毛蚶氧化脅迫效應的比較
閻 波, 張 欣, 張 軻, 陳 莉, 田 丹
菲和Cd2+單一及復合污染對毛蚶氧化脅迫效應的比較
閻 波1, 2, 3, 張 欣1, 張 軻1, 陳 莉1, 田 丹1
(1. 天津科技大學 海洋與環境學院, 天津 300457; 2. 天津市海洋資源與化學重點實驗室, 天津 300457; 3. 天津市海洋環境保護與修復技術工程中心, 天津 300457)
采用半靜態染毒實驗研究了菲和Cd2+單一及復合污染下脅迫9 d和清水釋放2 d過程中毛蚶體內活性氧(ROS)、谷胱甘肽(GSH)含量和谷胱甘肽硫轉移酶(GST)活性的變化。結果表明, 菲和Cd2+單獨脅迫能誘導毛蚶體內ROS含量的增加及GSH含量、GST活性的降低, 且隨染毒濃度的增加, 對各指標影響愈明顯, 存在劑量-效應關系。毛蚶體內GSH和GST的變化趨勢具有一致性。菲和Cd2+復合污染對毛蚶體內的氧化脅迫效應整體大于二者單獨污染。在清水釋放階段, 單一及復合污染脅迫組各指標均能恢復至對照組水平。表明毛蚶體內抗氧化系統適合作為監測海洋多環芳烴和重金屬復合污染的生物標志物。
菲; Cd2+; 復合污染; 氧化脅迫; 毛蚶
我國沿海地區的環境污染主要表現為有機物和重金屬污染, 多環芳烴(PAHs)菲和Cd2+作為有機物和重金屬污染的典型代表, 在渤海灣海域的生物體內均有較高濃度的檢出[1-3]。如鄭關超等[4]采用高效液相色譜法分析環渤海地區養殖水產品中PAHs含量, 其中菲的平均含量最高為6.53 μg·kg–1, 檢出率高達88.5%。龐艷華等[5]采用電感耦合等離子體質譜法(ICP-MS)分析大連近岸海域雙殼經濟貝類體內重金屬的含量, 并采用單因子評價模式對重金屬蓄積程度進行評價, 發現部分樣品Cd2+含量超標。已有大量研究表明, 菲和Cd2+污染會對海洋生物產生一系列有害的化學作用, 包括通過增加生物體內活性氧或自由基類物質的濃度[6], 導致機體氧化系統和抗氧化防御系統失衡, 從而使之產生氧化應激反應, 甚至造成顯著的毒性影響[7-8]。目前, 單一污染物或同種污染物在海洋生物體中的富集及毒性機理研究已較為深入[9-10], 但隨著環境毒理學研究的不斷深化, 傳統的作用機制不能用于解釋多種污染物的復合作用, 對于多種污染物的影響研究愈加引起廣泛關注, 閻波等[7]通過室內半靜態雙箱動力學模型研究了菲和Cd2+單一和復合污染條件下在毛蚶體內的富集動力學, 發現在兩種污染物同時暴露時, 毛蚶對菲和Cd2+的吸收富集均有所增強。李定龍等[11]認為四溴雙酚A(TBBPA)和鎘對蚯蚓和斑馬魚的死亡率均表現為協同作用。由此可見, 復合污染有其特殊的毒性機制。并且復合污染模式的研究更能解決實際環境問題, 廣泛地開展這方面的研究是大勢所趨。
毛蚶()是重要的海產經濟貝類, 普遍生活在我國渤海海域潮間帶地區。因其生活在沙質淤泥底部、移動性差、特殊的濾食特性使它們易受污染物的長期影響, 并能有效富集海洋中的污染物, 是一種監測海洋污染物生物有效性的指示生物[12]。而毛蚶作為一種美味的海產品, 其生物安全性與人類健康息息相關。本實驗選用毛蚶為研究對象, 通過半靜態染毒實驗, 觀察不同濃度菲和Cd2+單一污染和復合污染情況下毛蚶體內活性氧簇(Reactive oxygen species, ROS)、谷胱甘肽(Glutathione, GSH)含量和谷胱甘肽硫轉移酶(Glutathione-S-transferase, GST)活性的變化規律。以期為揭示海洋生物暴露于復合污染中而導致的氧化應激毒性提供線索, 并為生態風險評價提供科學依據。
1 材料與方法
1.1 實驗材料
毛蚶購于天津市濱海新區金元寶大型海鮮市場, 在實驗室中用海水晶配制的人工海水(鹽度為26)馴養7 d以上用于染毒實驗。馴養在水族箱(60 cm×30 cm× 35 cm)中進行, 間斷性曝氣充氧, 水溫控制在(18.0 ± 0.5℃), 用虹吸法每日更換一次養殖用水, 并定時投喂角毛藻作為食物來源。馴養期間及時檢查毛蚶的生命狀態, 取出死亡個體。毛蚶死亡標準: 兩殼長久張開、用探針多次刺激無張合反應。馴養結束后選擇個體健康、大小均勻的毛蚶進行正式實驗, 本次實驗選用的毛蚶殼長3±1 cm、殼高2±1 cm、軟組織濕重5.00±1.00 g。
菲(Phenanthrene)為分析純(購于美國 Sigma公司, 純度>98%), 用N, N-二甲基甲酰胺(DMF)溶解, 配制濃度為5 g·L–1的儲備液。重金屬鎘為CdCl2· 2.5 H2O固體, 分析純(購買于天津市風船化學試劑科技有限公司), 配制濃度為50 g·L–1的鎘儲備液。DMF為分析純(購于天津市風船化學試劑科技有限公司), 蛋白質、ROS、GSH和GST測試試劑盒均購于南京建成生物工程研究所。
1.2 實驗方法
1.2.1 半靜態染毒實驗
本實驗分為染毒(9 d)和清水釋放(2 d)兩個階段。染毒階段將配制的菲和Cd2+儲備液分別稀釋成濃度為菲 50 mg·L–1和Cd2+500 mg·L–1的使用液。各染毒實驗組的濃度設置如表1所示, 包括空白對照組和DMF(最大體積比0.01%)對照組各1組, 菲和Cd2+的單一染毒共4組, 菲和Cd2+復合染毒1組。實驗在2 L的玻璃燒杯中進行, 不同染毒組均設置3個平行。實驗期間每24 h更換一次實驗用水(按照設置濃度), 定時定量投喂角毛藻。釋放階段將配制的染毒溶液換成未染毒的人工海水進行2 d的清水恢復實驗。

表1 半靜態染毒實驗設計表
為確定半靜態染毒實驗的本底值以及染毒溶液的工作濃度, 分別對所配制的人工海水及各染毒組溶液中菲和Cd2+的含量進行測定, 其中菲的濃度采用GB/T26411-2010氣相色譜法-質譜法進行測定, Cd2+的含量參照GB17378.4-2007火焰原子吸收分光光度法進行測定。
1.2.2 毛蚶生理指標的測定
在半靜態染毒實驗的第1、3、5、7、9 d和清水恢復階段的第2 d采集毛蚶樣品。從各染毒組隨機取出至少2只毛蚶, 迅速剝除外殼, 取出全部組織, 用生理鹽水(0.86%)除去表層血漬, 瀝干后稱重、剪碎, 移至玻璃勻漿器中, 按質量(g)︰體積(mL)=1︰9的比例加入4℃預冷的生理鹽水, 在冰浴中充分勻漿制備成10%的組織勻漿液。經冷凍離心機在4℃、3500 r·min–1下低溫離心10 min, 取上清液置于–20℃待測。
蛋白質含量、ROS、GSH和GST的測定均參照試劑盒說明書進行。其中總蛋白質含量采用考馬斯亮蘭法進行測定; ROS含量通過加入DCFH-DA(2, 7-dishlorofuorescin diacetate)熒光探針測得, 用各樣品的熒光度值與其蛋白含量的比值表示, 單位為FI·(mg·prot)–1。熒光度值由Synergy 4多功能微孔板檢測儀(美國伯騰儀器有限公司)測定; GSH含量通過采用二硫代二硝基苯甲酸與巰基化合物反應產生的黃色化合物比色測得, 單位為mg·(g·prot)–1; GST活性通過1-氯-2, 4-2N基苯(CDNB)法測得, 以每毫克組織蛋白反應1 min使反應體系中GSH濃度降低1 μmol·L–1的量為一個GST活力單位(U), 單位為U·(mg·prot)–1。吸光度值由752型紫外可見分光光度計(上海佑科儀器儀表有限公司)測定。
1.3 數據分析
實驗測定數據以平均數 ± 標準偏差(Mean ± SD)表示, 采用 IBM SPSS Statistics 25 統計軟件對數據進行統計學分析, 采用單因素方差分析法(One-way ANOVA)和LSD 法對不同染毒組和組間的平均值進行多重比較, 認為<0.05時存在顯著性差異。用Origin 2018軟件對所有統計結果進行繪圖。
2 結果
2.1 各染毒組菲和Cd2+工作濃度測定結果
所配置的人工海水中均未檢出菲和Cd2+污染。各染毒組溶液中菲或Cd2+的工作濃度測定結果見表2。將表中各濃度組菲和Cd2+的測定濃度與設計濃度進行比較, 其回收率均大于80%, 符合質量控制的要求。因此, 我們按照菲和Cd2+的設計濃度來進行后續的分析與討論。
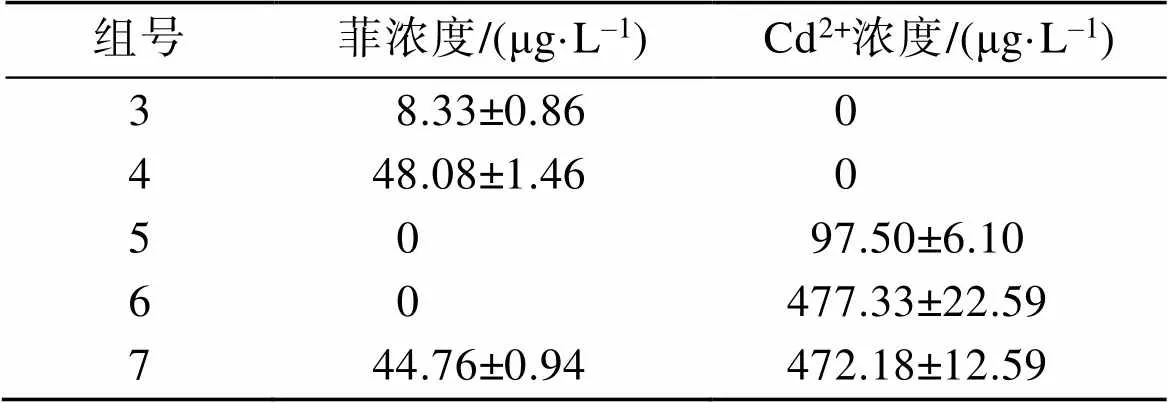
表2 半靜態染毒實驗各組測定濃度
2.2 空白組和DMF組差異性分析
對實驗期間所有采樣時間點空白對照組與DMF對照組毛蚶體內各指標測定結果進行比較, 發現在脅迫實驗和清水釋放實驗結束后, 空白對照組和DMF對照組之間的ROS含量、GSH含量和GST活性均無顯著性差異(>0.05, 表3), 表明實驗中用作助溶劑的DMF加入量對實驗結果沒有影響, 為保證數據的統一性, 因此我們僅采用空白對照組進行后續的統計與分析。
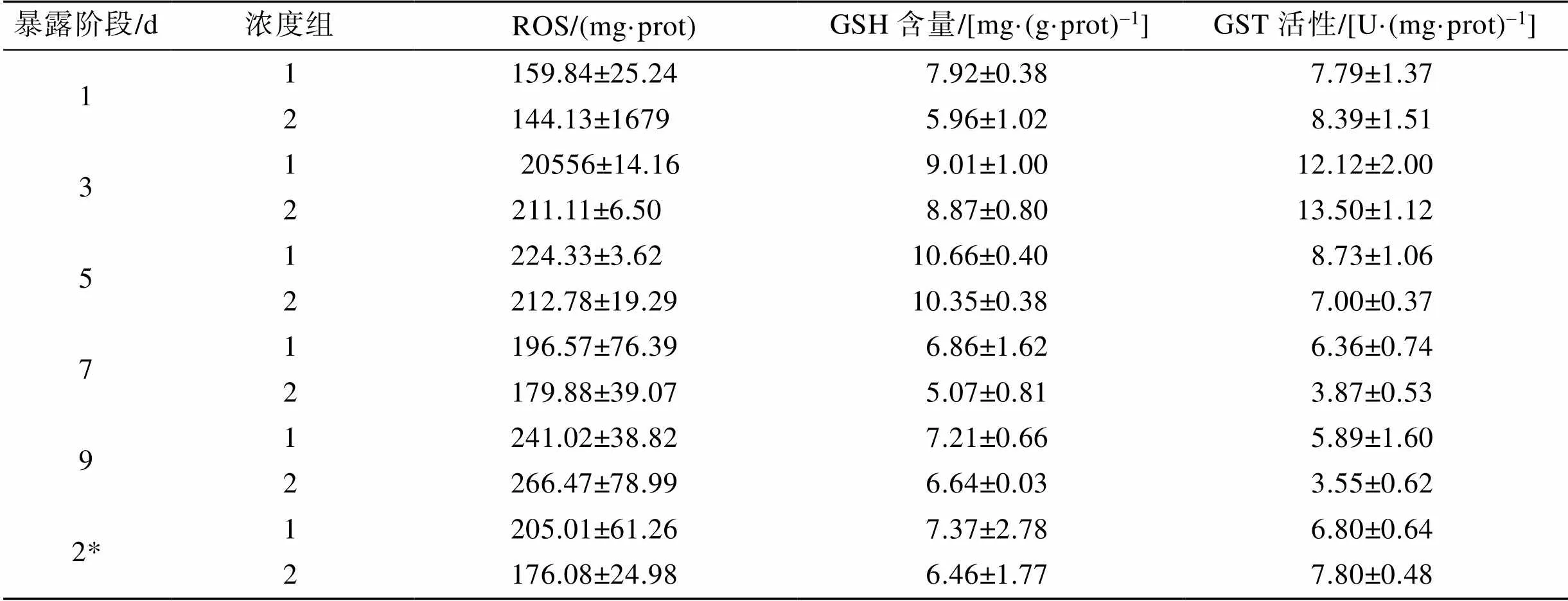
表3 空白組(1)和DMF組(2)毛蚶體內各指標比較
注: 2*代表清水恢復階段第2 d。
2.3 菲和Cd2+對毛蚶ROS含量的影響
菲與Cd2+單一及復合污染下毛蚶體內ROS含量的變化如圖1所示。對照組毛蚶體內ROS含量呈波動變化, 范圍為159.84~241.02 FI·(mg·prot)–1。在菲單獨脅迫下(圖1-a), 除染毒第7 d外, 10 μg·L–1(低)濃度組毛蚶體內ROS含量均高于對照組, 且第1、5 d差異顯著(<0.05), 50 μg·L–1(高)濃度組ROS含量均顯著高于對照組水平(<0.05)。清水釋放階段, 不同濃度組ROS含量均降至對照組水平。在Cd2+單獨脅迫下(圖1-b), 染毒期間, 各濃度組毛蚶體內ROS含量均高于對照組。100 μg·L–1(低)濃度組于染毒第5 d時升至最大值, 高于對照組41.62%。500 μg·L–1(高)濃度組于第1 d時顯著升高(<0.05), 并隨時間的延長ROS含量的增加愈明顯, 第5 d后, ROS含量降低, 雖和對照組相比無顯著性差異, 但從數值上仍高于對照組。清水釋放階段, 不同濃度組ROS含量均與對照組無顯著性差異。在菲和Cd2+復合脅迫下(圖1-c), 復合脅迫組ROS含量變化隨染毒時間的增加而逐漸上升并顯著高于對照組(<0.05), 第5 d時達到最大值, 隨后略有下降直至對照組水平。我們將單一污染物脅迫組視為陽性對照, 比較發現, 除染毒第9 d外, 復合脅迫組ROS含量在數值上均高于菲和Cd2+單獨脅迫組, 但差異性不顯著。清水釋放階段, 單一和復合脅迫組ROS含量均降至低于對照組水平, 且各組之間無顯著性差異。
2.4 菲和Cd2+對毛蚶GSH含量的影響
菲與Cd2+單一及復合污染下毛蚶體內GSH含量的變化如圖2所示。對照組毛蚶體內GSH含量呈波動變化, 范圍為6.86~10.66 mg·(g·prot)–1。在菲單獨脅迫下(圖2-a), 染毒初期, 低濃度組毛蚶體內GSH含量稍低于對照組, 且無顯著性差異(>0.05)。隨染毒時間的延長, GSH含量先升高后降低, 在第9 d時降至最小值, 為對照組的57.65%。高濃度組GSH含量均顯著低于對照組, 且在染毒第3 d時, 下降最為明顯, 僅為對照組的32.24%。清水釋放階段, 各濃度組GSH含量與對照組相比均略有升高但無顯著性差異(>0.05)。在Cd2+單獨脅迫下(圖2-b), 各濃度Cd2+染毒組GSH含量均低于對照組。染毒第7 d時, 低濃度組誘導毛蚶體內GSH含量最低(<0.05), 為對照組的51.30%。高濃度組GSH含量在染毒前5 d均顯著低于對照組(<0.05), 隨后毛蚶體內GSH含量略有升高, 與對照組無顯著性差異。清水釋放階段, 各濃度組毛蚶體內GSH含量與對照組相比無顯著性差異。在菲和Cd2+復合脅迫下(圖2-c), 毛蚶體內GSH含量在染毒初期即受到顯著影響, 顯著低于對照組(<0.05)并持續至染毒期結束。與菲和Cd2+單獨脅迫組相比, 復合脅迫組毛蚶體內GSH含量在第1 d顯著降低(<0.05)。隨染毒時間的延長呈先增加后降低的趨勢, 但與單獨脅迫組無顯著性差異。清水釋放階段, 單一和復合脅迫組毛蚶體內GSH含量均升至對照組水平。
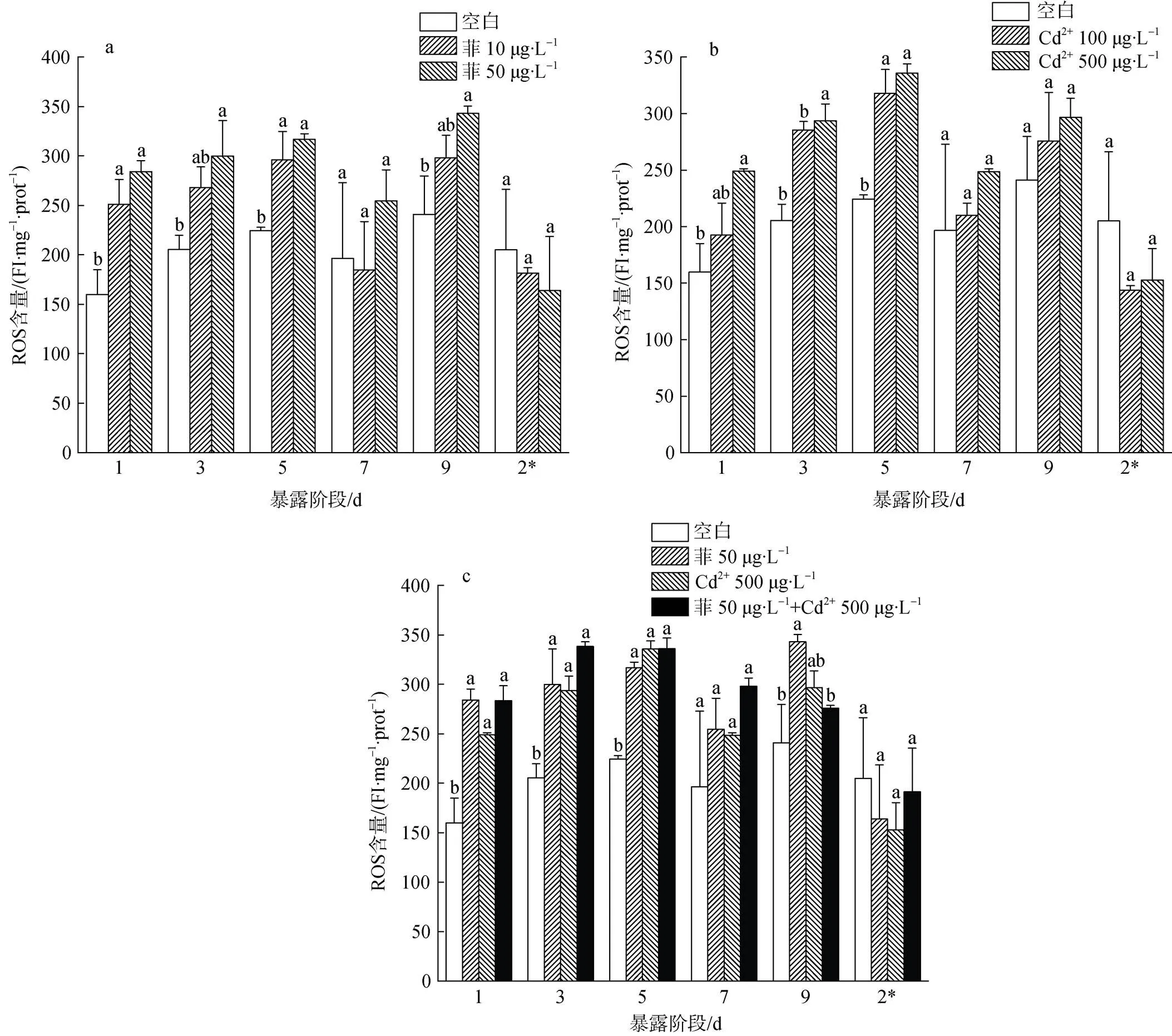
圖 1 菲和Cd2+對毛蚶ROS含量的影響
注: 不同小寫字母為同一脅迫時間內各濃度組間生化指標的多重比較結果(<0.05); 2*代表清水恢復階段第2 d, 下同。
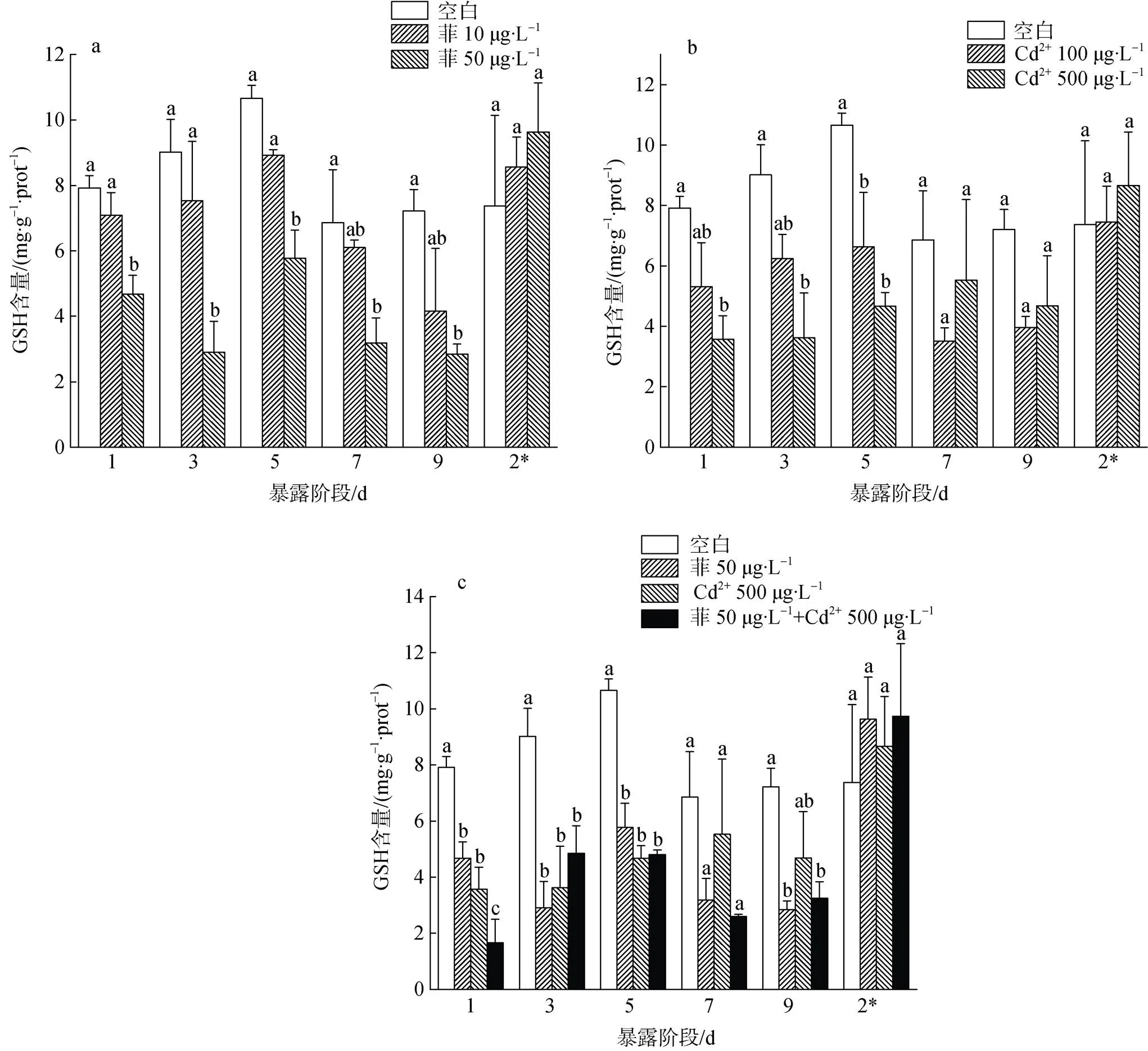
圖2 菲和Cd2+對毛蚶GSH含量的影響
2.5 菲和Cd2+對毛蚶GST活性的影響
菲與Cd2+單一及復合污染下毛蚶體內GST活性的變化如圖3所示。對照組毛蚶體內GST活性呈波動變化, 范圍為5.89~10.62 U·(mg·prot)–1。在菲單獨脅迫下(圖3-a), 低濃度組毛蚶體內GST活性從數值上均低于對照組, 但差異不顯著(>0.05), 只有染毒第7 d差異顯著(<0.05), 為對照組的56.82%。高濃度組GST活性在染毒第3、5、9 d時顯著低于對照組(<0.05), 在染毒末期(9 d)時降至最小值, 僅為對照組的45.80%。清水釋放階段, 各濃度組毛蚶體內GST活性與對照組之間無顯著性差異。在Cd2+單獨脅迫下(圖3-b), 低濃度組僅在染毒初期(1 d)時對毛蚶體內GST活性有明顯影響, 顯著低于對照水平(<0.05)。并隨染毒時間的延長, GST活性呈先增大后降低的趨勢。與對照組相比, 高濃度組毛蚶體內GST活性在染毒第3、7 d時顯著降低(<0.05), 分別為對照組的54.39%和41.82%, 并在第5 d時稍高于對照組。清水釋放階段, 高濃度組毛蚶體內GST活性低于對照水平, 但無顯著性差異。在菲和Cd2+復合脅迫下(圖3-c), 與對照組相比, 復合脅迫組在染毒開始時就對GST活性有顯著影響(<0.05), 并隨染毒時間的延長, 下降愈加顯著, 一直持續至染毒期結束。復合組在染毒第3 d時GST活性顯著低于菲單一脅迫組(<0.05), 在染毒第5、9 d時顯著低于Cd2+單獨脅迫組(<0.05)。清水釋放階段, 單一、復合污染脅迫組與對照組GST活性之間無顯著性差異。

圖 3 菲和Cd2+對毛蚶GST活性的影響
3 討論
當生物體處于多環芳烴、重金屬污染等脅迫環境時, 機體可通過產生活性氧, 如O2–·、H2O2、·OH、NO·等代謝外源傷害, 此過程會伴隨產生由未成對電子構成的自由基, 過量的游離自由基會造成機體的過氧化脅迫, 進而誘發氧化損傷, 甚至造成毒性影響[13-14]。Odzak等[15]研究了金屬對斑馬魚胚胎的毒性, 推測出ROS含量的增加會造成細胞膜的損傷, 引起機體抗氧化酶活性的變化。Kang等[16]發現ROS的含量增加和氧化應激作用有關。因此ROS生成和氧化應激可作為解釋機體受毒性作用的最佳模式[17]。實驗中菲單獨脅迫使毛蚶體內的ROS含量升高, 高濃度組ROS增量整體顯著高于對照組, 且存在劑量-效應關系, 展現了較明顯的毒性影響潛力。呂晏鋒等[18]人進行的不同濃度菲對鯉魚的脅迫實驗也發現ROS增加引起了抗氧化酶活性的變化, 即生物體肝臟組織酶活性表現出低濃度誘導, 高濃度抑制的效應。在不同濃度Cd2+脅迫下, 毛蚶對高濃度Cd2+污染更加敏感, 在染毒初期生物體內ROS含量就已出現顯著增加。一方面可能與濃度設置、生物體的敏感性等多種原因造成有關; 另一方面可能與重金屬污染物對生物體的制毒機理有關, 具有氧化還原性的重金屬可通過Fenton 反應直接產生活性氧自由基, 無中間代謝過程, 從而導致染毒初期ROS含量的明顯增長[19]。在復合脅迫染毒期間, ROS增量在數值上均高于菲或Cd2+單獨脅迫組, 但無顯著性差異。一定程度上表明, 在菲和Cd2+復合染毒脅迫下更加強烈的誘導了毛蚶自身的氧化反應, 但無明顯的協同效應。染毒第9 d時ROS含量明顯降低, 這可能是由于生物體逐漸適應外界刺激, 體內自我調節發揮作用, 損傷有所恢復, 從而達到一種動態平衡的結果。綜上所述, 在本實驗中, 菲和Cd2+單一及復合脅迫均能引發毛蚶體內ROS含量的升高。ROS含量的升高會進一步觸發需氧生物體內的抗氧化防御系統, 來防止活性氧對機體的氧化損傷, 這個系統主要包含一些能夠被應激誘導的酶類, 如超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GPX)、GSH和酚氧化酶(PO)等[20]。
生物體中的水溶性抗氧化劑(如: GSH)、抗氧化酶(如: GST)對外源性毒物具有一定的防御和調節能力。其中GSH是一種低分子的抗氧化和自由基清除劑[21], 可以直接清除ROS[22], 同時也是抗氧化酶GST的底物[23], 其含量的多少常用于衡量機體抗氧化能力的大小[20, 24]。如計勇等[25]分析了復合污染物對鯽魚體內GSH含量的影響, 發現指標變化存在時間-效應關系, 證明GSH對外界污染物的生物影響具有敏感性。已有研究表明, 當生物體暴露于污染物時, 體內自由基增多, 從而消耗GSH, 導致GSH值降低, 如果機體自身調節能力不足導致GSH耗盡時, 會產生中毒效應[26]。GST是谷胱甘肽過氧化物酶(GPX)的一種, 是生物體對有毒物質進行Ⅱ相生物轉化的轉化酶之一[27], 通過消除脂質過氧化物ROOH來降低自由基對機體的破壞作用[20]。污染物質進入生物體后通過Ⅰ相生物轉化反應形成親水性中間產物, 而后通過Ⅱ相代謝酶(如GST酶)進行內源性分子結合, 轉化為低毒代謝產物排出體外[28]。GST作為抗氧化酶不僅能夠清除有機過氧化物, 在肝臟解毒方面也發揮著極其重要的作用[20, 29-30]。由于在肝細胞中分布廣泛, 當機體受到損傷時, GST能很快的被釋放, 其活性的變化常作為解毒能力的敏感指標。如張燕寧等[31]研究了廈門海域石油烴對僧帽牡蠣體內GST活性的影響, 發現在體外染毒情況下牡蠣與指標GST之間相關性顯著, 可通過檢測生物體內GST指標的變化來衡量機體的抗氧化能力。王素敏等[32]在進行體外有機污染物暴露實驗時發現GST對外界脅迫比較敏感, 可作為污染物早期預警的生物標志物。
在本實驗中, 在菲和Cd2+的單獨脅迫下, 毛蚶體內GSH含量和GST活性整體變化趨勢一致, 均出現了不同程度的降低, 這種降低趨勢與ROS的間接作用有關[33], 說明毛蚶在菲或Cd2+的脅迫下大量消耗體內GSH和GST, 從而誘發了機體產生強烈的抗氧化反應。菲和Cd2+高濃度脅迫時, 對毛蚶體內GSH和GST值影響更為明顯。說明隨著污染物濃度的增加, 毛蚶自身調節能力愈發不足, 導致機體氧化脅迫作用增強, 進一步加深毒性影響。另外, GSH含量和GST活性變化趨勢的一致性在一定程度上意味著毛蚶體內GSH主要用作底物誘導GST表達, 而不是用來直接清除ROS, 另一方面也表示毛蚶體內這些非酶抗氧化劑和抗氧化酶被共同調動用于抵抗菲和Cd2+暴露帶來的氧化損傷。我們之前對菲和Cd2+單一及復合脅迫對毛蚶體內SOD、CAT活性和總抗氧化能力(TAOC)水平的影響進行過研究[34-35], 結果表明在污染脅迫條件下, 這些抗氧化指標均不同程度地被誘導, 證明了當毛蚶在菲和Cd2+單一及復合脅迫作用下產生了ROS對機體造成的損傷時, 可通過激活體內抗氧化酶(SOD、CAT)的活性來消除過量的自由基對機體的傷害。用于衡量機體抗氧化系統功能狀況, 既包括酶促系統, 如SOD、CAT等, 又包括非酶促系統, 如GSH等的綜合性指標, TAOC水平的誘導也支持了這一現象。結合本研究結果, 充分說明毛蚶在受到菲和Cd2+單一及復合脅迫后, 在抗氧化劑和多種抗氧化酶上均可表現出明顯的應激反應。清水釋放階段, 這種應激反應有所緩解, 菲和Cd2+單一及復合污染脅迫組各抗氧化指標均能恢復至對照組水平, 這一方面是由于生物體的抗氧化防御系統在發揮功能, 消除了多余的活性氧; 另一方面可能是由于外源污染物菲和Cd2+經代謝逐漸釋放到清水中從而使其毒性作用降低。因此, 毛蚶體內的抗氧化系統對菲和Cd2+污染具有良好的應激反應敏感性。
同時, 本實驗結果表明, 在菲和Cd2+復合污染脅迫作用下, 毛蚶體內GSH含量和GST活性在染毒期間整體低于單獨脅迫組, 我們之前對毛蚶體內SOD和CAT指標的研究結果也表明, 菲和Cd2+復合污染對毛蚶的氧化脅迫作用大于二者單獨脅迫[35]。說明在復合污染條件下, 毛蚶不足以調節外源污染損傷, 導致抗氧化能力下降, 從而使生物體遭受到較為嚴重的毒性影響。此研究結果在非酶氧化劑和多種抗氧化酶方面進一步支持了我們先前的研究成果。
綜上所述, 菲和Cd2+單獨脅迫下, 毛蚶體內ROS含量均高于對照組, 整體呈現出不斷增加趨勢, GSH含量和GST活性均低于對照組, 整體呈現出先增加后降低的趨勢, 且隨著污染物濃度的增加, 對各指標的影響愈明顯, 存在劑量-效應關系。毛蚶體內GSH含量和GST活性整體變化趨勢具有一致性, 在一定程度上意味著GSH作為底物大量參與誘導GST的表達。對比單一及復合污染的結果發現, 菲和Cd2+復合污染增強了二者單獨污染對毛蚶的氧化脅迫效應, 表現出更強的氧化損傷。清水恢復階段結束后, 單一及復合污染脅迫組各指標均能恢復至對照組水平。表明毛蚶體內抗氧化系統適合作為監測海洋多環芳烴和重金屬復合污染的生物標志物。
[1] 王麗平, 雷坤, 喬艷珍. 天津渤海灣近岸海域沉積物中4種常見重金屬的分布及其風險分析[J]. 海洋環境科學, 2017, 36(5): 693-698. Wang Liping, Lei Kun, Qiao Yanzhen. Distribution and ecological risk assessment of four common metals in coastal sediment of Bohai Bay along Tianjin city, China[J]. Marine Environmental Science, 2017, 36(5): 693-698.
[2] 嚴志宇, 劉慧, 孫冰, 等. 渤海海域表層沉積物中的多環芳烴綜述[J]. 海洋開發與管理, 2019, 36(10): 27-29. Yan Zhiyu, Liu Hui, Sun Bing, et al. A summary of polycyclic aromatic hydrocarbons in surface sediments of Bohai Sea[J]. Ocean Development and Management, 2019, 36(10): 27-29.
[3] 隋茜茜, 余金橙, 朱金艷, 等. 秦皇島海域食用貝類重金屬污染情況分析[J]. 食品工業科技, 2020, 41(10): 196-202. Sui Qianqian, Yu Jincheng, Zhu Jinyan, et al. Analysis of heavy metal pollution of edible shellfish in Qinhuangdao[J]. Science and Technology of Food Industry, 2020, 41(10): 196-202.
[4] 鄭關超, 郭萌萌, 趙春霞, 等. 環渤海地區養殖水產品中多環芳烴(PAHs)污染殘留及健康風險評估[J]. 中國漁業質量與標準, 2015, 5(6): 20-26. Zheng Guanchao, Guo Mengmeng, Zhao Chunxia, et al. Residue levels of PAHs in aquaculture products from Bohai Bay and their health risk assessment[J]. Chinese Fishery Quality and Standards, 2015, 5(6): 20-26.
[5] 龐艷華, 隋凱, 王秋艷, 等. 大連近岸海域雙殼貝類重金屬污染調查與評價[J]. 海洋環境科學, 2012, 31(3): 410-413. Pang Yanhua, Sui Kai, Wang Qiuyan, et al. Investigation and assessment on heavy metals in bivalve seashells of Dalian coastline[J]. Marine Environmental Science, 2012, 31(3): 410-413.
[6] 卓藝蓉. 基于雙殼貝類的多環芳烴生物標志物檢測技術的研究[J]. 漁業研究, 2018, 40(4): 268-278. Zhuo Yirong. The study on identification of PAHs biomarkers on the basis of bivalve[J]. Journal of Fisheries Research, 2018, 40(4): 268-278.
[7] 閻波, 譚送琴, 馬曉芳, 等. 菲和鎘單一及復合污染條件下在毛蚶體內的富集動力學研究[J]. 生態毒理學報, 2017, 12(3): 572-578. Yan Bo, Tan Songqin, Ma Xiaofang, et al. Kinetics of bioconcentrations of phenanthrene and cadmium in tissues ofunder single and joint exposures[J]. Asian Journal of Ecotoxicology, 2017, 12(3): 572-578.
[8] 于淑池, 符修正, 王昌昊, 等. 鎘對波紋巴非哈()的急性毒性及組織蓄積性研究[J]. 瓊州學院學報, 2016, 23(2): 35-39. Yu Shuchi, Fu Xiuzheng, Wang Changhao, et al. Cadmium’s acute toxicity and accumulation on[J]. Journal of Qiongzhou University, 2016, 23(2): 35-39.
[9] Sarnowski P, Witeska M. The effects of copper and cadmium in single exposure or co-exposure on growth of common carp (L.) Larvae[J]. Polish Journal of Environmental Studies, 2008, 17(5): 791-796.
[10] Canesi L, Lorusso L C, Ciacci C, et al. Effects of the brominated flame retardant tetrabromobisphenol-A (TBBPA) on cell signaling and function ofhemocytes: Involvement of MAP kinases and protein kinase C[J]. Aquatic Toxicology, 2005, 75(3): 277-287.
[11] 李定龍, 李曉芳, 李敏, 等. 四溴雙酚A和鎘聯合暴露對蚯蚓和斑馬魚毒性作用特征研究[J]. 環境與健康雜志, 2016, 33(7): 577-584. Li Dinglong, Li Xiaofang, Li Min, et al. Joint toxic effect of tetrabromobisphenol A and cadmium onand zebrafish[J]. Journal Environment Health, 2016, 33(7): 577-584.
[12] 賀廣凱. 黃渤海沿岸經濟貝類體中重金屬殘留量水平[J]. 中國環境科學, 1996, 16(2): 96-100. He Guangkai. Levels of heavy metals in molluses from the coastal region of Bohai Sea and Huanghai Sea[J]. China Environmental Science, 1996, 16(2): 96-100.
[13] Yin Y, Jia J, Guo H Y, et al. Pyrene-stimulated reactive oxygen species generation and oxidative damage in Carassius auratus[J]. Journal of Environmental Science and Health Part A-Toxic/Hazardous Substances & Environmental Engineering, 2014, 49(2): 162-170.
[14] Ryu W I, Park Y H, Bae H C, et al. ZnO nanoparticle induces apoptosis by ROS triggered mitochondrial pathway in human keratinocytes[J]. Molecular & Cellular Toxicology, 2014, 10(4): 387-391.
[15] Odzak N, Kistler D, Behra R, et al. Dissolution of metal and metal oxide nanoparticles in aqueous media[J]. Environmental Pollution, 2014, 191: 132-138.
[16] Kang T S, Guan R F, Song Y J, et al. Cytotoxicity of zinc oxide nanoparticles and silver nanoparticles in human epithelial colorectal adenocarcinoma cells[J]. Lwt-Food Science and Technology, 2015, 60(2): 1143-1148.
[17] Kappus H, Sies H. Toxic drug effects associated with oxygen metabolism: Redox cycling and lipid peroxidation[J]. Experientia, 1981, 37(12): 1233-1241.
[18] 呂晏鋒, 趙曉祥, 王俊鋒. 菲脅迫對鯉魚的急性毒性和抗氧化酶響應[J]. 東華大學學報(自然科學版), 2018, 44(2): 309-316. Lv Yanfeng, Zhao Xiaoxiang, Wang Junfeng. Acute toxicity and response of antioxidant enzymes of phenanthrene stress on carp[J]. Journal of Donghua University (Natural Science), 2018, 44(2): 309-316.
[19] Formigari A, Irato P, Santon A. Zinc, antioxidant systems and metallothionein in metal mediated-apoptosis: biochemical and cytochemical aspects[J]. Comparative Biochemistry & Physiology Part C, 2007, 146(4): 443-459.
[20] 高惠瀅, 胡薇. 生物體的抗氧化酶系統概述[J]. 生物學教學, 2018, 43(10): 3-5. Gao Huiying, Hu Wei. An overview of the antioxidant enzyme system in organisms[J]. Biology Teaching, 2018, 43(10): 3-5.
[21] Xiang N, Zhao C F, Diao X P, et al. Dynamic responses of antioxidant enzymes in pearl oyster Pinctada martensii exposed to di(2-ethylhexyl) phthalate (DEHP)[J]. Environmental Toxicology and Pharmacology, 2017, 54: 184-190.
[22] Nardi A, Mincarelli L F, Benedetti M, et al. Indirect effects of climate changes on cadmium bioavailability and biological effects in the Mediterranean mussel Mytilus galloprovincialis[J]. Chemosphere, 2017, 169: 493-502.
[23] Shenai-Tirodkar P S, Gauns M U, Mujawar M W A, et al. Antioxidant responses in gills and digestive gland of oyster(Preston) under lead exposure[J]. Ecotoxicology and Environmental Safety, 2017, 142: 87-94.
[24] Liu H, Weisman D, Ye Y B, et al. An oxidative stress response to polycyclic aromatic hydrocarbon exposure is rapid and complex in[J]. Plant Science, 2009, 176(3): 375-382.
[25] 計勇, 陸光華, 張潔, 等. 太湖復合污染脅迫下生物體抗氧化標志物的響應[J]. 生態環境學報, 2009, 18(5): 1655-1658. Ji Yong, Lu Guanghua, Zhang Jie, et al. Responses of antioxidation biomarkers in muscle microsome ofunder integrated pollution stress of Tai Lake[J]. Ecology and Environmental Sciences, 2009, 18(5): 1655-1658.
[26] 田文靜, 白偉, 趙春祿, 等. 納米ZnO對斑馬魚胚胎抗氧化酶系統的影響[J]. 中國環境科學, 2010, 30(5): 705-709. Tian Wenjing, Bai Wei, Zhao Chunlu, et al. Effects of ZnO nanoparticles on antioxidant enzyme system of zebrafish embryos[J]. China Environmental Science, 2010, 30(5): 705-709.
[27] Vidal-Linan L, Bellas J, Etxebarria N, et al. Glutathione S-transferase, glutathione peroxidase and acetylcholinesterase activities in mussels transplanted to harbour areas[J]. Science of the Total Environment, 2014, 470: 107-116.
[28] Giessing A M B, Mayer L M, Forbes T L. 1-hydroxypy-rene glucuronide as the major aqueous pyrene metabolite in tissue and gut fluid from the marine deposit-feeding polychaete[J]. Environmental Toxicology and Chemistry, 2003, 22(5): 1107-1114.
[29] 方春華, 喬琨, 劉智禹, 等. 海洋生物中抗氧化酶的研究進展[J]. 漁業研究, 2016, 38(4): 331-342. Fang Chunhua, Qiao Kun, Liu Zhiyu, et al. The research progress of antioxidant enzymes in marine organisms[J]. Journal of Fisheries Research, 2016, 38(4): 331-342.
[30] Gadagbui B K M, James M O. Activities of affinity- isolated glutathione S-transferase (GST) from channel catfish whole intestine[J]. Aquatic Toxicology, 2000, 49(1-2): 27-37.
[31] 張燕寧, 張蘭, 毛連綱, 等. 多效唑對斑馬魚體內解毒代謝酶和抗氧化酶活性的影響[J]. 安徽農業科學, 2017, 45(27): 124-127. Zhang Yanning, Zhang Lan, Mao Liangang, et al. Effects of paclobutrazol on metabolic detoxification enzyme and antioxidant enzyme activities in zebrafish ()[J]. Journal of Anhui Agriculture, 2017, 45(27): 124-127.
[32] 王素敏, 王海燕, 韓大雄. 三種持久性有機污染物對羅非魚肝臟抗氧化系統的體外影響[J]. 海洋環境科學, 2013, 32(2): 216-220. Wang Sumin, Wang Haiyan, Han Daxiong. In vitro effects of three persistent organic pollutants on antioxidant defense system inliver[J]. Marine Environmental Science, 2013, 32(2): 216-220.
[33] Ahn J M, Eom H J, Yang X Y, et al. Comparative toxicity of silver nanoparticles on oxidative stress and DNA damage in the nematode,[J]. Chemosphere, 2014, 108: 343-352.
[34] 閻波, 李英, 高楠, 等. 菲-Cd單一與聯合作用對毛蚶的氧化脅迫及損傷[J]. 海洋環境科學, 2015, 34(6): 858-864. Yan Bo, Li Ying, Gao Nan, et al. Single and combined effects of oxidative pressure and damages of phenanthrene and cadmium on[J]. Marine Environmental Science, 2015, 34(6): 858-864.
[35] Yan B, Liu X B, Zhao X G, et al. Single and joint oxidative stress of cadmium and phenanthrene on the Bivalve[J]. Journal of Environmental Science and Health Part a-Toxic/Hazardous Substances & Environmental Engineering, 2020, 55(4): 448-456.
Comparison of single and combined pollution effect of phenanthrene and cadmium on the oxidative pressure of
YAN Bo1, 2, 3, ZHANG Xin1, ZHANG Ke1, CHEN Li1, TIAN Dan1
(1. College of Marine and Environmental Science, Tianjin University of Science & Technology, Tianjin 300457, China; 2. Tianjin Key Lab of Marine Resource and Chemistry, Tianjin 300457, China; 3. Tianjin Marine Environmental Protection and Restoration Technology Engineering Center, Tianjin 300457, China)
We conducted a semi-static infected experiment to investigate the reactive oxygen species (ROS) content, glutathione (GSH) content, and glutathione-S-transferase (GST) activities ofafter being exposed to single and combined pollution of phenanthrene (Phe) and cadmium (Cd). The exposure experiment lasted for nine days in pollution media and for two days in clean seawater. The results showed that single exposure of Phe or Cd lead to an increase in the ROS content of, whereas the GSH content and GST activity followed a decreasing trend for the same. Moreover, the impact on biomarkers became more significant with the exposure concentration, thereby indicating a dose-dependent effect. The overall changing trends of GSH and GST ofremained consistent. Additionally, the oxidative stress of combined effect of Phe and Cd onwas higher than the single effect. Furthermore, these biomarkers ofin different exposure groups returned to the control level after the organisms were transferred to the clean seawater for two days. The study results indicated that the antioxidant defense system ofcan act as a suitable biomarker for indicating the combined pollution of polycyclic aromatic hydrocarbons and heavy metals in the marine ecosystem.
phenanthrene (Phe); cadmium (Cd); combined pollution; oxidative stress;
Jul. 20, 2020
Q178.53
A
1000-3096(2021)01-0044-10
10.11759/hykx20200720006
2020-07-20;
2020-08-21
天津市應用基礎與前沿技術研究計劃資助項目(15JCYBJC23200)
[The Natural Science Foundation of Tianjin, People’s Republic of China as a key basic research development and planning project, No. 15JCYBJC23200]
閻波(1973-), 女, 河南省安陽人, 副教授, 博士, 主要從事環境污染效應研究, 022-60602701, E-mail: yanbo@tust.edu.cn
(本文編輯: 趙衛紅)

