丹荷顆粒治療高脂血癥質(zhì)量標(biāo)志物發(fā)現(xiàn)研究
馬兆臣,陳奎奎,潘琦雪,閆曉寧,劉 潔,蘇汝彬, 朱美霞,張銀環(huán),陽 嬌,李 乾,肖紅斌,4*
(1.北京中醫(yī)藥大學(xué) 中藥學(xué)院,北京 100029;2.北京中醫(yī)藥大學(xué) 中藥分析與轉(zhuǎn)化研究中心,北京 100029; 3.北京中醫(yī)藥大學(xué) 中醫(yī)藥研究院,北京 100029;4.石河子大學(xué) 藥學(xué)院,新疆 石河子 832002)
丹荷方來源于名老中醫(yī)郭維琴臨床經(jīng)驗方,由荷葉、丹參、山楂、虎杖、陳皮、薏苡仁6味藥組成,功效為活血消食、祛濕健脾,臨床用于治療痰瘀互阻型高脂血癥,能夠顯著降低高脂血癥金黃地鼠血清總膽固醇(TC)、甘油三油酸酯(TG)、低密度脂蛋白膽固醇(LDL-C)水平,并顯著升高血清高密度脂蛋白膽固醇(HDL-C)水平[1]。該方目前處于中藥新藥臨床前藥學(xué)研究階段,且已成功制成丹荷顆粒(Danhe granules,DHG)劑,但缺乏相應(yīng)的質(zhì)量控制標(biāo)準(zhǔn)。質(zhì)量控制的根本目的是對中藥有效性的控制,而劉昌孝院士所提出的中藥質(zhì)量標(biāo)志物概念[2],將藥效相關(guān)性作為質(zhì)量標(biāo)志物確定的重要原則并嚴(yán)格控制,已成為規(guī)范中藥質(zhì)量、提高中藥及其制劑質(zhì)量一致性的可行方法。
DHG作為尚在研發(fā)的中藥新藥,有效成分特征及含量穩(wěn)定對其至關(guān)重要,由此確定DHG質(zhì)量標(biāo)志物篩選的四要素為降脂藥效、成分特征、含量可測及穩(wěn)定存在。目前,中藥藥效相關(guān)質(zhì)量標(biāo)志物研究方法的核心在于建立活性成分與藥效、作用機制的關(guān)聯(lián)[3-6]。其中網(wǎng)絡(luò)藥理學(xué)方法通過對復(fù)雜多層次相互作用的各種網(wǎng)絡(luò)的分析[7],可直觀地表明成分與作用機制間的關(guān)系,有助于快速發(fā)現(xiàn)中藥潛在有效性質(zhì)量標(biāo)志物[8-9]。本研究基于網(wǎng)絡(luò)藥理學(xué)方法,通過對成分靶點及疾病基因共有靶點的生物過程、通路富集及網(wǎng)絡(luò)拓撲分析,確定DHG降脂關(guān)鍵靶點及相應(yīng)作用成分;而后建立了油酸(OA)誘導(dǎo)的HepG2脂質(zhì)堆積細胞模型對成分活性進行驗證;最后綜合活性成分在制劑中的含量、穩(wěn)定性、特征性,確定DHG治療高脂血癥的質(zhì)量標(biāo)志物,以期為后續(xù)DHG質(zhì)量標(biāo)準(zhǔn)的建立提供合理的候選質(zhì)控指標(biāo)。
1 實驗部分
1.1 材料、試劑與儀器
人肝癌細胞系(HepG2)購自中國科學(xué)院(上海);DMEM高糖培養(yǎng)基、0.25%胰蛋白酶(含乙二胺四乙酸,EDTA)、0.01 mol/L磷酸鹽緩沖鹽(PBS)、胎牛血清(FBS)均來源于Hylcone(Thermo scientific,美國);青霉素-鏈霉素(Amresco,美國);6孔細胞培養(yǎng)板(Costar,美國);Eppendorf管(Axygen,美國);油酸、二甲基亞砜(DMSO)、油紅O染液、4%多聚甲醛固定液(Sigma,美國);異丙醇(LC-MS級,F(xiàn)isher,美國);甘油三酯(TG)測定試劑盒(南京建成生物工程研究所);Bradford試劑盒、細胞裂解液(碧云天生物技術(shù)有限公司);白藜蘆醇(批號B-002-170426)、柚皮素(批號Y-034-181217)(純度≥98%,成都瑞芬思生物科技有限公司)。
生物安全柜(HFease1800,上海力康醫(yī)療設(shè)備有限公司);3111 CO2培養(yǎng)箱(Thermo,美國);超凈臺(哈爾濱東聯(lián)電子技術(shù)開發(fā)有限公司);細胞培養(yǎng)板(Corning,美國);IX71倒置熒光顯微鏡(Olympus,日本);3-18KS高速冷凍離心機(Sigma,德國);Infinite 200 Pro Nanoquant連續(xù)波長多功能酶標(biāo)儀(Tecan,瑞士)。
1.2 溶液配制
柚皮素、白藜蘆醇用DMSO超聲溶解,配成10 mmol/L的母液,轉(zhuǎn)移至生物安全柜中加基礎(chǔ)培養(yǎng)基稀釋為10 μmol/L的給藥溶液(含0.1% DMSO),過0.22 μm微孔濾膜,待用。取0.056 g氫氧化鉀、10 mL PBS、0.1 g BSA,渦旋混勻后加入31.6 μL油酸,得10 mmol/L油酸溶液,過0.22 μm濾膜后于-20 ℃保存,使用時用基礎(chǔ)培養(yǎng)基稀釋成200 μmol/L的油酸造模液,按照油紅O∶PBS=3∶2混合,過0.22 μm微孔濾膜后即制成油紅O染色液,在2 h內(nèi)使用。
1.3 實驗方法及數(shù)據(jù)處理
1.3.1 DHG體內(nèi)成分收集課題組前期對給藥后SD大鼠血漿、尿液及糞便中成分進行分析,共鑒定出36個原型成分,可能是DHG治療高脂血癥潛在活性成分,并將其用于后續(xù)網(wǎng)絡(luò)藥理學(xué)的研究。
1.3.2 成分靶點及疾病基因預(yù)測采用STITCH數(shù)據(jù)庫(http://stitch.embl.de/)和Swiss target prediction數(shù)據(jù)庫(http://www.swisstargetprediction.ch/)對DHG中成分的作用靶點進行預(yù)測,從STITCH “chemical aliases”文件和“protein chemical links detailed”文件中收集化合物同名成分及相關(guān)靶點,保留與成分結(jié)合得分≥700的靶點;從Swiss target prediction收集概率值≥0.5的靶點;而后將得到的所有靶點導(dǎo)入UniProt數(shù)據(jù)庫,提取其Gene Name和Gene ID。本研究以“Hyperlipidaemia”即高脂血癥為主題詞,基于TTD (http://bidd.nus.edu.sg/bi-dd.databases/ttd/ttd.asp)及Gen-eCards (https://www.genecards.org)數(shù)據(jù)庫收集高脂血癥疾病相關(guān)人源基因。為避免假陽性靶點,剔除TTD中基因類型為“Discontinued”以及GeneCards中相關(guān)得分<10的基因。
1.3.3 共有靶點生物功能與通路富集分析將丹荷顆粒成分作用靶點與高脂血癥疾病基因比對,獲得成分靶點與疾病基因共有靶點,再將共有靶點導(dǎo)入DAVID數(shù)據(jù)庫(https://david.ncifcrf.gov/,Version 6.8),Select identifier設(shè)置為uniprot_accession,限定物種為Homo Sapiens,閾值為P<0.05,對靶點進行GO生物過程分析和KEGG通路分析。
1.3.4 共有靶點交互作用分析“度”(Degree)是衡量網(wǎng)絡(luò)節(jié)點重要性的最直接方法,度值越大的節(jié)點在網(wǎng)絡(luò)中越重要。將共有靶點導(dǎo)入STRING數(shù)據(jù)庫(https://string-db.org/),物種選擇Homo Sapiens,構(gòu)建共有靶點交互作用網(wǎng)絡(luò),將網(wǎng)絡(luò)中各節(jié)點的交互作用參數(shù)導(dǎo)入Cytoscape 3.7.0軟件以繪制交互網(wǎng)絡(luò),并將節(jié)點(node)大小和顏色深淺與度值大小對應(yīng),邊(Edge)的粗細與結(jié)合分?jǐn)?shù)大小對應(yīng)。通過關(guān)鍵節(jié)點分析插件Network Analyzer計算共有靶點在交互作用網(wǎng)絡(luò)中的度值。
1.3.5 成分-共有靶點-疾病網(wǎng)絡(luò)構(gòu)建收集丹荷顆粒成分作用靶點與高脂血癥疾病基因,導(dǎo)入Cytoscape 3.7.0構(gòu)建成分-共有靶點-疾病網(wǎng)絡(luò)。
1.3.6 HepG2細胞培養(yǎng)、造模及給藥HepG2細胞培養(yǎng)于含10%胎牛血清及1%雙抗的DMEM高糖培基中,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)。待細胞生長至約80%時用0.25%胰蛋白酶將其消化并傳代,取對數(shù)生長期細胞進行實驗。將對數(shù)生長期細胞制成細胞懸液,以5×105個/mL接種于6孔板,每孔2 mL細胞懸液。將細胞分為空白對照組(Con)、模型組(OA)、白藜蘆醇給藥組(OA+Res)和柚皮素給藥組(OA+Nar),每組設(shè)置3個復(fù)孔,培養(yǎng)24 h后,空白對照組給予基礎(chǔ)培養(yǎng)基,其余各組用含200 μmol/L油酸的基礎(chǔ)培養(yǎng)基刺激細胞24 h,制成脂質(zhì)堆積模型。而后空白對照組給予含0.1% DMSO的基礎(chǔ)培養(yǎng)基,給藥組棄去造模液,分別加入終濃度為10 μmol/L的含白藜蘆醇、柚皮素基礎(chǔ)培養(yǎng)基,繼續(xù)培養(yǎng)24 h。
1.3.7 油紅O染色及測定經(jīng)含白藜蘆醇、柚皮素基礎(chǔ)培養(yǎng)基培養(yǎng)24 h后,所有組吸棄培養(yǎng)基,PBS洗3次,棄去;用0.4%的多聚甲醛室溫固定20 min,棄去;每孔加入500 μL油紅O染色液避光染色30 min,棄去;每孔加入1 mL 60%異丙醇溶液分化5 s,PBS洗2次,棄去;200×放大倍數(shù)鏡檢拍照;每孔加入500 μL異丙醇室溫孵育10 min,用酶標(biāo)儀測定其510 nm處吸光值。
1.3.8 TG含量測定細胞分組、給藥及處理同“1.3.6”方法。給藥24 h后用預(yù)冷PBS洗滌2次。每孔加入100 μL 2%Tritonx-100裂解液,冰上裂解30 min,裂解好的液體不離心直接測定。參照甘油三酯(TG)測定試劑盒說明書檢測細胞內(nèi)TG含量,計算公式為TG含量(mmol/gprot)=(樣本OD值-空白OD值)/(校準(zhǔn)OD值-空白OD值)×校準(zhǔn)品濃度(2.26 mmol/L) ÷待測樣本蛋白濃度(gprot/L)。

2 結(jié)果與討論
2.1 DHG體內(nèi)成分收集
本研究最初通過TCMSP等中藥成分?jǐn)?shù)據(jù)庫獲取DHG成分,并通過藥代動力學(xué)參數(shù)中的口服生物利用度(OB)確定DHG口服生物利用度較好的成分(OB≥30%),但發(fā)現(xiàn)DHG部分重要降脂活性成分如丹酚酸B[10]、橙皮苷[11]、虎杖苷[12]等的OB分別為3.01%、13.33%、21.44%,生物利用度較差,與本課題組對DHG體內(nèi)成分鑒定結(jié)果不一致。藥物代謝研究認為中藥活性成分可能為原型成分或其代謝產(chǎn)物[13],故基于丹荷顆粒真實存在于體內(nèi)的成分進行網(wǎng)絡(luò)藥理學(xué)分析,以縮小潛在活性成分的范圍。為避免遺漏重要活性成分,采用DHG給藥后血漿、尿液及糞便中原型成分作為網(wǎng)絡(luò)藥理學(xué)研究的成分來源,結(jié)果見表1。

表1 DHG成分庫Table 1 Component library of DHG
表2 DHG降脂作用靶點Table 2 Lipid-lowering targets of DHG
2.2 共有靶點
基于Swiss target prediction和STITCH數(shù)據(jù)庫,分別得到264和179個成分作用靶點,刪除重復(fù)項,得到DHG成分作用靶點268個。基于TTD及GeneCards數(shù)據(jù)庫,分別得到高脂血癥疾病基因23及57個。通過比對分析丹荷顆粒成分靶點以及高脂血癥疾病基因,得到10個共有靶點,這些共有靶點可能是DHG降脂的作用靶點(見表2)。
2.3 共有靶點生物過程與通路富集分析
共有靶點生物過程分析結(jié)果(P<0.01)見圖1,較為顯著的生物過程包括脂質(zhì)代謝過程、類固醇激素介導(dǎo)的信號通路過程以及脂蛋白分解代謝過程,其中LDLR、PPARA、PPARG靶點參與的脂質(zhì)代謝過程可能是DHG治療高脂血癥最重要的生物過程,其他生物過程包括受體生物合成過程的負調(diào)控、甘油三酯隔離的負調(diào)節(jié)、膽固醇儲存負調(diào)節(jié)、脂肪酸氧化的正調(diào)控、低密度脂蛋白顆粒清除率等。共有靶點通路富集結(jié)果(P<0.05)見圖2,PPARA、PPARG參與的PPAR信號通路以及LDLR、ADORA1、ADORA2A參與的cAMP信號通路是最顯著的代謝通路,可能是DHG降脂作用最重要的代謝通路,其他通路包括脂肪細胞脂解的調(diào)控、卵巢類固醇生成、催乳素信號通路等。

圖1 DHG成分生物過程分析Fig.1 Biological process analysis of components in DHG
2.4 共有靶點交互作用分析
共有靶點交互作用網(wǎng)絡(luò)見圖3,該網(wǎng)絡(luò)由10個節(jié)點和31條邊組成。在共有靶點交互作用網(wǎng)絡(luò)中,ESR1、PPARG、PPARA、LDLR、APOB是度值(分別為9、8、7、7、7)最大的5個節(jié)點,是網(wǎng)絡(luò)中的重要靶點。

圖2 DHG成分通路富集分析Fig.2 Pathway enrichment analysis of components in DHG
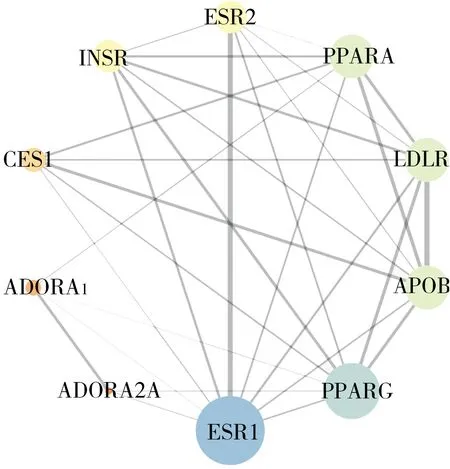
圖3 共有靶點蛋白互作網(wǎng)絡(luò)Fig.3 Protein interaction network with common targets

圖4 DHG成分-共有靶點-疾病網(wǎng)絡(luò)Fig.4 DHG components-common targets-disease network
2.5 關(guān)鍵靶點分析
基于中藥多靶點、多途徑的作用特點,關(guān)鍵靶點的確定需根據(jù)靶點交互作用及共有靶點生物過程、通路富集結(jié)果綜合確定。故本研究進一步結(jié)合重要通路即PPAR、cAMP通路參與靶點(PPARA、PPARG、LDLR、ADORA1、ADORA2A)以及重要代謝過程即脂質(zhì)代謝過程的參與靶點(LDLR、PPARA、PPARG),發(fā)現(xiàn)PPARG、PPARA、LDLR可能是DHG降脂作用的關(guān)鍵靶點,在DHG降脂過程中發(fā)揮著重要作用。此外,本課題組體內(nèi)實驗研究也發(fā)現(xiàn)DHG治療高脂血癥金黃地鼠模型作用機制與上調(diào)LDLR、PPARA的mRNA和蛋白表達水平有關(guān),這在一定程度上證明了本研究的可靠性[1]。
2.6 關(guān)鍵活性成分分析
為了明確作用于關(guān)鍵靶點PPARG、PPARA、LDLR的活性成分,使用Cytoscape軟件構(gòu)建成分-共有靶點-疾病網(wǎng)絡(luò)(圖4),該網(wǎng)絡(luò)包括21個節(jié)點及30條邊,10個節(jié)點是共有靶點,另外10個節(jié)點則是與共有靶點有直接作用關(guān)系的成分。同時發(fā)現(xiàn)白藜蘆醇與柚皮素是作用于關(guān)鍵靶點的成分,可能是DHG降脂作用的關(guān)鍵活性成分。
2.7 體外活性驗證



圖5 白藜蘆醇、柚皮素對HepG2細胞內(nèi)脂質(zhì)堆積影響
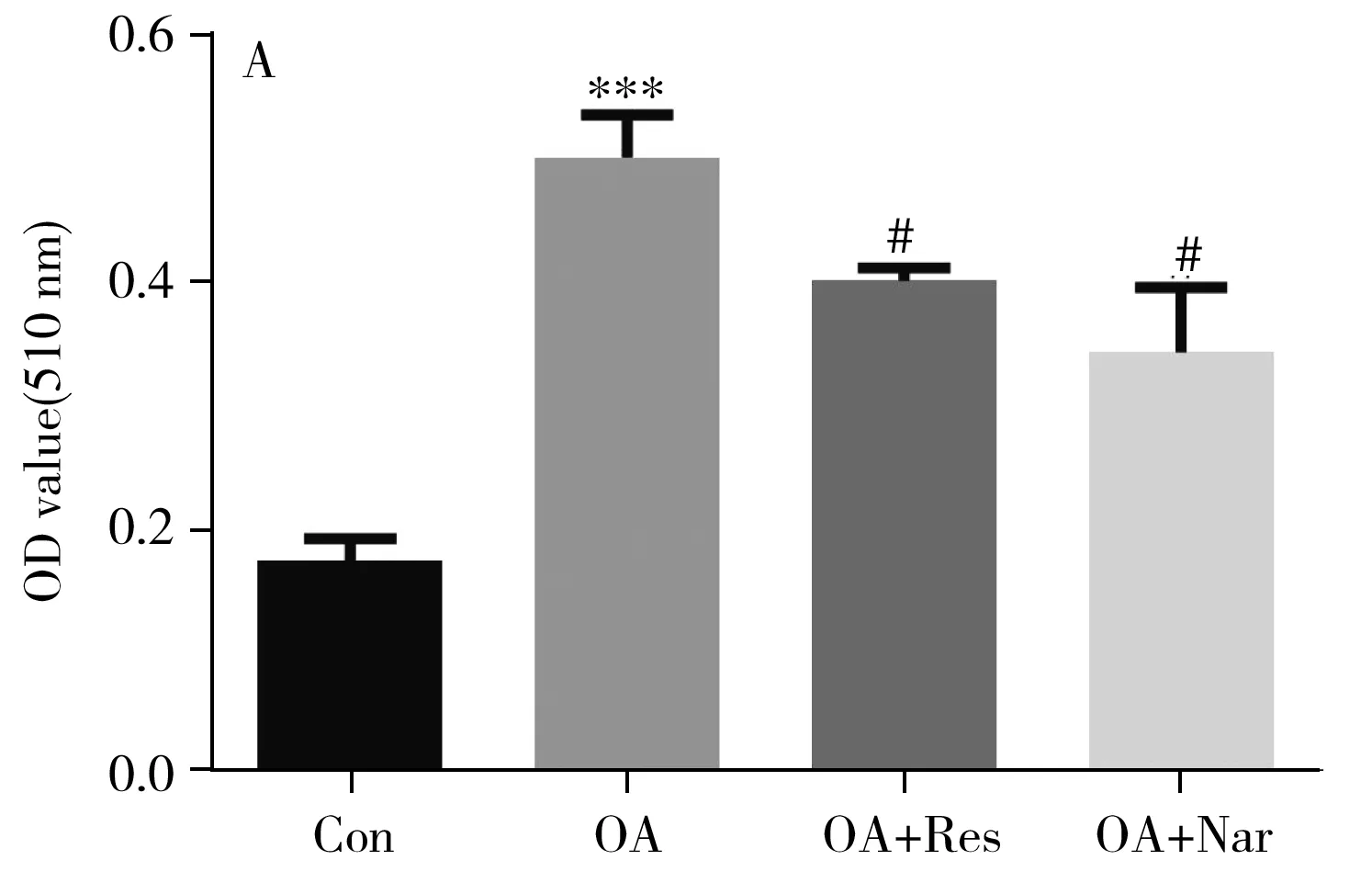
HepG2細胞經(jīng)油酸處理后,其形態(tài)與脂質(zhì)堆積肝細胞相似[14-15],是體外研究脂代謝的理想載體,故本研究采用油酸誘導(dǎo)的HepG2細胞脂質(zhì)堆積模型驗證白藜蘆醇(Res)及柚皮素(Nar)的藥效。油紅O染色結(jié)果(圖5)表明,經(jīng)油酸處理后,模型組細胞外圍輪廓變圓,細胞間距離增大,胞漿內(nèi)顆粒狀脂質(zhì)被染成鮮紅色,并呈戒指環(huán)狀緊密地分布在細胞膜外,說明脂質(zhì)堆積細胞模型建立成功。與模型組相比,10 μmol/L白藜蘆醇及柚皮素均能夠減少HepG2細胞內(nèi)紅色脂質(zhì)含量。油紅O染色定量測定結(jié)果表明,與對照組比較,模型組在510 nm處吸光值升高189.05%;與模型組比較,白藜蘆醇組降低20.01%,柚皮素組降低31.61%,差異具有統(tǒng)計學(xué)意義,說明白藜蘆醇、柚皮素能夠顯著降低HepG2細胞內(nèi)脂質(zhì)含量(圖6A)。為進一步確定白藜蘆醇、柚皮素的降脂效果,對細胞內(nèi)TG含量進行測定(圖6B)。結(jié)果表明,與對照組相比,模型組TG含量升高152.00%;與模型組比較,白藜蘆醇組降低了53.06%,柚皮素組降低了27.89%,差異具有統(tǒng)計學(xué)意義,且白藜蘆醇甚至可以將細胞內(nèi)TG含量恢復(fù)至對照組同等水平,進一步說明白藜蘆醇、柚皮素可顯著降低HepG2細胞內(nèi)脂質(zhì)含量,可能為DHG降脂的關(guān)鍵活性成分。
2.8 質(zhì)量標(biāo)志物的確定
柚皮素和白藜蘆醇在DHG中含量較低;而兩者分別是DHG主要成分柚皮苷和虎杖苷的體內(nèi)代謝產(chǎn)物,柚皮苷、虎杖苷進入體內(nèi)后會在肝藥酶、腸道菌群的作用下被迅速代謝為苷元-柚皮素、白藜蘆醇[16-17]。文獻報道對高脂血癥倉鼠和家兔的研究發(fā)現(xiàn)虎杖苷可顯著降低血清TC、TG和LDL-C水平[18-19],而柚皮苷也可通過增強膽固醇的反向運輸發(fā)揮較好的調(diào)節(jié)血脂的作用[20-21],提示虎杖苷和柚皮苷可能通過原型及其苷元的形式同時發(fā)揮降脂藥效。此外,白藜蘆醇及柚皮素分別為蓼科植物二苯乙烯苷類以及柑橘屬中藥黃酮類生物合成途徑的中心中間體[22-23]。虎杖苷和柚皮苷可分別由白藜蘆醇和柚皮素通過其結(jié)構(gòu)特定羥基位置的糖基化反應(yīng)獲得,而白藜蘆醇在植物中含量極少,主要以虎杖苷的形式存在于虎杖植物中[24];相似的,柚皮苷也是陳皮中主要的柑橘類黃酮[25],因此白藜蘆醇、柚皮素、虎杖苷、柚皮苷可作為DHG特征性成分;與此同時,課題組前期研究發(fā)現(xiàn)柚皮苷及虎杖苷在DHG中的含量分別為(3 085.40±74.30) μg/g及(2 592.40±102.00) μg/g,為DHG的主要成分;同時柚皮苷及虎杖苷在10批DHG制劑中的含量變化較小(90% ≤P≤110%,RSD≤15%),能夠穩(wěn)定存在[26]。因此認為活性成分柚皮素、白藜蘆醇的前體成分柚皮苷、虎杖苷可作為DHG治療高脂血癥的質(zhì)量標(biāo)志物。
3 結(jié) 論
科學(xué)合理的質(zhì)控指標(biāo)對在研新藥DHG至關(guān)重要。本研究在中藥質(zhì)量標(biāo)志物概念的指導(dǎo)下,從成分的有效性、特征性、可測性及穩(wěn)定性綜合研究DHG質(zhì)量標(biāo)志物,最后確定其中與降脂功效相關(guān)、特征明顯、含量豐富、穩(wěn)定存在的成分虎杖苷及柚皮苷為DHG質(zhì)量標(biāo)志物,從而為后續(xù)DHG質(zhì)量標(biāo)準(zhǔn)的建立奠定基礎(chǔ)。

