非肽類孤啡肽受體拮抗劑C-24對大鼠急性心肌缺血后心律失常的影響
陳司坤,解夢莉,韓毅,△,郭政
急性心肌缺血后常出現的嚴重心律失常是導致心源性猝死的重要原因[1]。其中,急性心肌缺血后交感神經過度激活,感覺神經肽和炎性因子產生增多是誘發心房顫動的主要原因之一[2]。孤啡肽(N/OFQ)是一種內源性阿片肽,本課題組前期研究發現急性心肌缺血后N/OFQ分泌增多,其拮抗劑UFP-101可以降低缺血性心律失常的發生率[3]。也有研究發現N/OFQ參與膿毒癥反應的早期階段,UFP-101預處理可使膿毒癥模型大鼠血漿腫瘤壞死因子(TNF)-α和白細胞介素(IL)-1β濃度降低,提示孤啡肽受體拮抗劑可能通過調節心肌組織中炎性因子來影響缺血后心律失常的發生[4]。2006年,Goto等[5]發現了一種新化合物compound-24(C-24)。該化合物對N/OFQ受體(ORL1)有高親和力和選擇性,且很容易穿透血腦屏障,可改善由帕金森病導致的運動障礙[6],但目前鮮見其在心臟組織中的研究。本研究旨在探討N/OFQ拮抗劑C-24對急性心肌缺血后心律失常的影響。
1 材料與方法
1.1 材料
1.1.1 實驗動物清潔級健康雄性SD大鼠50只,6~8周齡,體質量250~280 g,購自山西醫科大學實驗動物中心。動物適應性喂養1周后進行實驗,本研究得到山西醫科大學機構動物護理和使用委員會的批準。
1.1.2 儀器與試劑實驗儀器:AlC-V8小動物呼吸機(上海澳爾科特公司);BL-420F生物信號采集與分析系統(成都泰盟軟件有限公司);酶標儀(美國賽默飛公司)。試劑:C-24(英國Tocris Cookson公司);TNF-α、IL-1β酶聯免疫吸附測定(ELISA)試劑盒(江蘇酶免生物科技公司)。
1.2 方法
1.2.1 C-24濃度梯度設計基于拮抗參數pA2計算C-24的理論最佳有效濃度,pA2指激動劑劑量提高至原濃度2倍時,產生與原濃度相同效應時所需拮抗劑的摩爾濃度的負對數,其 計 算公式 為pA2=-log[I]。研 究 發現C-24的pA2值 為9.12[7],UFP-101的pA2值為7.30[8],本課題組前期研究發現UFP-101減少急性心肌缺血后心律失常發生的最佳有效濃度為1×10-9mol/L[3]。再結合公式pA2=-log[I],計算出C-24理論最佳有效濃度為1.51×10-11mol/L,根據該濃度設計濃度梯度1×10-13、1×10-11、1×10-9mol/L。
1.2.2 實驗分組及大鼠急性心肌缺血模型的建立按照隨機數字表法將50只大鼠分為假手術組(Sham組)、冠脈結扎組(CAO組)和C-24組(C組);根據拮抗劑的濃度梯度,將C組分為3個亞組:即C-Ⅰ組(1×10-13mol/L)、C-Ⅱ組(1×10-11mol/L)、C-Ⅲ組(1×10-9mol/L),每組10只。大鼠稱質量后用質量分數為25%的烏拉坦進行腹腔麻醉(1.2 g/kg),麻醉滿意后將大鼠仰臥位固定于操作臺上,連接生物信號采集處理系統,以Ⅱ導聯連接心電圖,持續監測大鼠心電數據;然后氣管切開并插入氣管導管,連接小動物呼吸機進行機械通氣,呼吸機設置潮氣量8 mL/kg,呼吸頻率70次/min。穩定后自大鼠頸動脈插管至左心室,持續監測大鼠心功能。C組各亞組于結扎前10 min按照1 mL/kg體質量經尾靜脈注射相應濃度C-24,Sham組和CAO組注射等體積生理鹽水。10 min后在左側第4肋間開胸暴露心臟,Sham組只開胸穿線不結扎;CAO組和C組以5-0無損傷縫線于左心耳右緣冠狀動脈左前降支起點下2 mm處進針結扎,可見Ⅱ導聯ST段抬高并逐漸與QRS波融合,心臟前壁逐漸變白,出現心律失常,提示造模成功。冠脈結扎15 min后處死大鼠,取大鼠心肌組織于-80℃冰箱中保存。
1.2.3 各組大鼠心率變異性(HRV)檢測造模過程中動態監測大鼠15 min內的心電信號,使用RM6240生物信號采集處理系統分析HRV指標。HRV時域分析指標包括RR間期標準差(SDNN)、相臨RR間期差的均方根(RMSSD);頻域分析指標包括標準化低頻功率(LFnorm)、標準化高頻功率(HFnorm)及低高頻比值(LF/HF)。
1.2.4 各組大鼠心功能檢測大鼠麻醉且插入氣管導管后,行左心室置管術監測大鼠左心室收縮壓(LVSP)、左心室舒張末壓(LVEDP)、心率(HR)、左心室壓力上升和下降最大變化率(±dp/dtmax)。
1.2.5 大鼠心律失常評分記錄各組大鼠冠脈結扎后15 min內心律失常發生次數并進行評分。心律失常包括以下幾種類型:室性早搏(VEB)、室性心動過速(VT)和心室顫動(VF)。具體評分標準如下[9]:0分,<50個VEB;1分,≥50個VEB;2分,1~5次VT;3分,≥6次VT;4分,1次VF;5分,2~5次VF。
1.2.6 ELISA檢測心肌組織TNF-α和IL-1β水平取-80℃保存的心肌組織,以9 mL/g加入PBS后進行手工研磨,于4℃、2 000 r/min離心20 min,收取上清后按照ELISA試劑盒說明書步驟進行操作,在酶標儀450 nm波長下測定光密度(OD)值并根據標準曲線計算TNF-α和IL-1β水平。
1.3 統計學方法采用SPSS 23.0軟件進行統計分析。正態分布的計量資料采用均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間多重比較采用LSD-t檢驗,檢驗水準α=0.05。非正態分布計量資料采用中位數和四分位數[M(P25,P75)]表示,采用Kruskal-WallisH檢驗,組內多重比較采用Mann-WhitneyU檢驗,并對檢驗水準α'按Bonferroni法進行校正。相關性分析采用Pearson相關。
2 結果
2.1 急性心肌缺血模型建立情況實驗過程中因實驗操作不當死亡2只(Sham組1只,CAO組1只),因麻醉藥物過量死亡1只(C-Ⅱ組),因心律失常死亡3只(CAO組1只,C-Ⅱ組1只,C-Ⅲ組1只),以上均被剔除并重新補充標本。
2.2 各組大鼠冠脈結扎后心律失常變化情況與Sham組比較,CAO組、C-Ⅰ組、C-Ⅱ組和C-Ⅲ組VEB次數明顯增加,CAO組VT+VF的發生次數增加,持續時間延長,心律失常評分升高(P<0.05);C-Ⅰ組VT+VF的發生次數增加,心律失常評分升高(P<0.05)。與CAO組比較,C-Ⅰ組、C-Ⅱ組和C-Ⅲ組VEB發生次數明顯減少(P<0.05),C-Ⅲ組VT+VF發生次數減少,持續時間縮短,心律失常評分明顯下降(P<0.05)。與C-Ⅰ組比較,C-Ⅱ組、C-Ⅲ組VEB發生次數明顯減少(P<0.05),C-Ⅲ組心律失常評分明顯降低(P<0.05)。見表1。
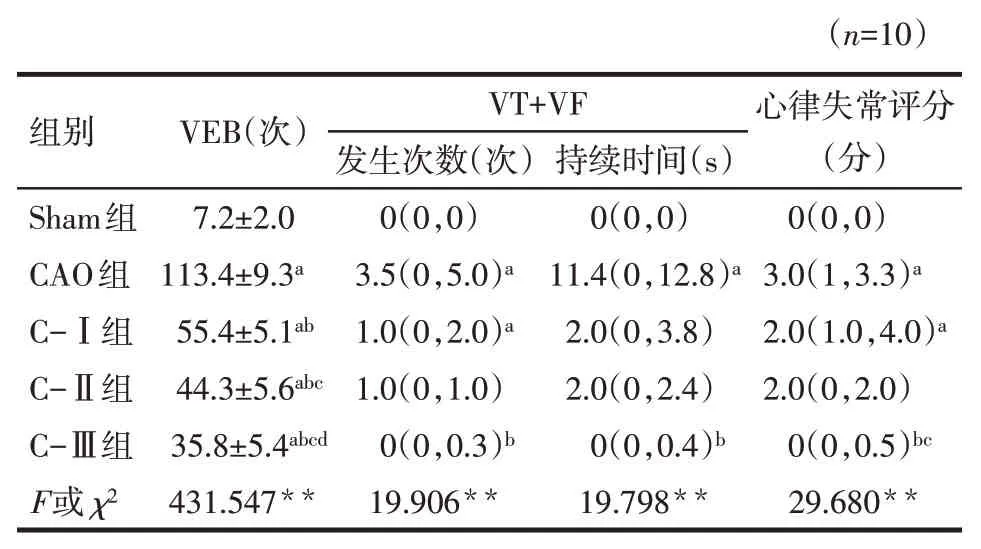
Tab.1 Comparison of cumulative arrhythmia within 15 minutes after coronary occlusion between five groups of rats表1 5組大鼠冠脈閉塞后15 min內累計心律失常發生情況比較
2.3 各組大鼠冠脈結扎后HRV變化情況 與Sham組比較,CAO組、C-Ⅰ組、C-Ⅱ組、C-Ⅲ組SDNN、RMSSD均明顯降低(P<0.05),CAO組LF/HF升高(P<0.05)。與CAO組比較,C-Ⅰ組和C-Ⅱ組RMSSD明顯增高(P<0.05),C-Ⅰ組、C-Ⅱ組、C-Ⅲ組的LF/HF明顯降低(P<0.05)。各組間LFnorm和HFnorm比較差異均無統計學意義(P>0.05)。見表2。
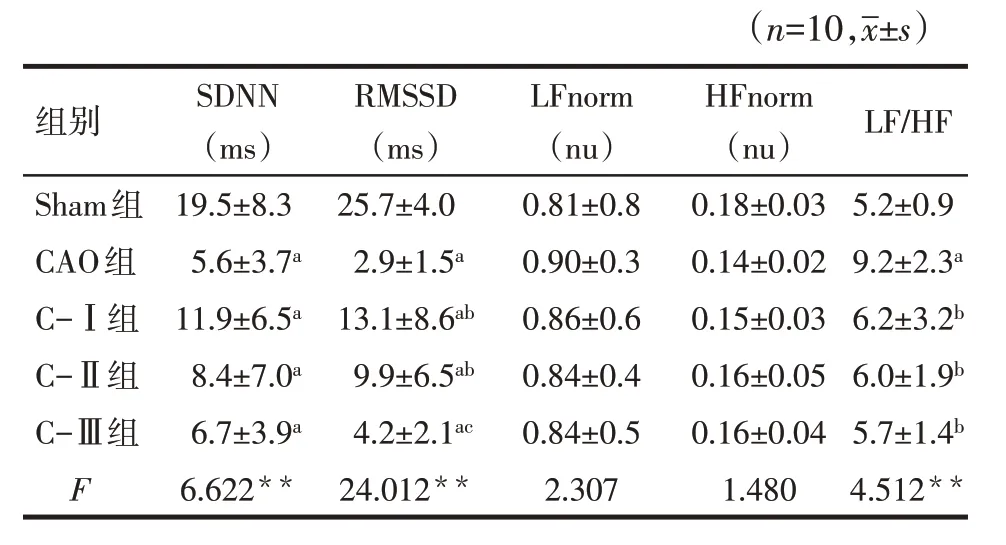
Tab.2 Comparison of HRV within 15 minutes after coronary occlusion between five groups of rats表2 5組大鼠CAO后15 min內HRV比較
2.4 各組大鼠冠脈結扎后心功能指標變化情況5組大鼠LVSP、LVEDP、HR、+dp/dtmax和-dp/dtmax比較差異均無統計學意義(均P>0.05),見表3。
2.5 各組大鼠冠脈結扎后TNF-α和IL-1β變化情況與Sham組比較,CAO組、C-Ⅰ組、C-Ⅱ組和C-Ⅲ組TNF-α和IL-1β水平明顯增加(P<0.05);與CAO組比較,C-Ⅰ組TNF-α和IL-1β水平差異無統計學意義(P>0.05),C-Ⅱ組和C-Ⅲ組則明顯下降(P<0.05)。C-Ⅱ組和C-Ⅲ組TNF-α和IL-1β水平差異無統計學意義(P>0.05)。見表4。

Tab.3 Comparison of various indexes of heart function after coronary artery occlusion in five groups of rats表3 5組大鼠冠脈結扎后心功能各指標的比較
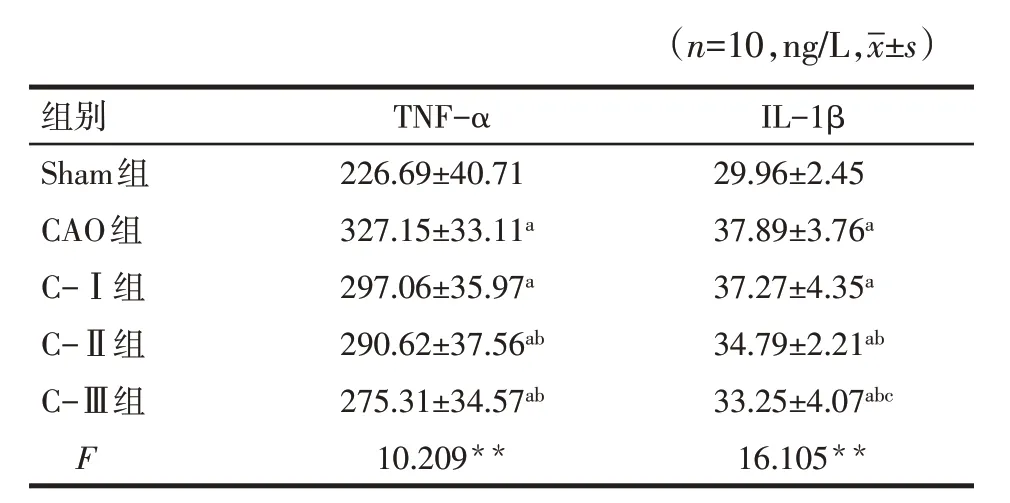
Tab.4 Comparison of inflammatory factors in 15 minutes after coronary occlusion between five groups of rats表4 5組大鼠冠脈閉塞后15 min內炎性因子水平比較
2.6 VEB發生次數和TNF-α、IL-1β水平的相關性TNF-α與IL-1β水平呈正相關(r=0.564,P<0.01)、VEB發生次數與TNF-α、IL-1β呈正相關(r分別為0.620、0.609,均P<0.01),見圖1。
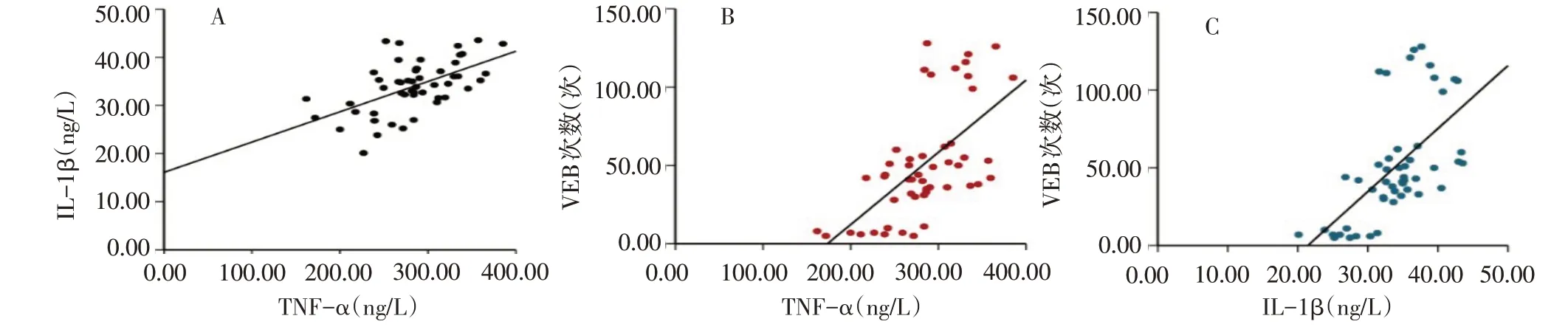
Fig.1 Scatter plot analysis of correlation between the occurrence of VEB and the levels of TNF-αand IL-1β圖1 VEB發生次數和炎性因子TNF-α、IL-1β水平的相關性分析散點圖
3 討論
急性心肌梗死后心律失常是多種因素共同作用的結果,包括兒茶酚胺[10]和感覺神經肽[11]的大量釋放。N/OFQ是感覺神經肽的一種,其在全身多個器官中均有表達,主要分布于中樞神經系統和脊髓等痛覺調節系統[12]。有研究發現在急性心肌梗死后,心臟背根神經節及脊髓N/OFQ表達明顯增多,同時其受體ORL1在急性心肌梗死后心臟表面表達增多[13]。
HRV能客觀地反映交感神經和迷走神經的活性變化及兩者的平衡狀態,本研究結果顯示CAO組冠脈結扎后SDNN、RMSSD均顯著降低,LF/HF比值明顯增高,表明急性心肌梗死后交感神經過度激活;而C-24預處理后LF/HF比值明顯降低,SDNN、RMSSD較CAO組升高,提示C-24可以有效地降低交感神經的活性,進而減少急性心肌缺血后心律失常的發生。本課題組前期研究發現N/OFQ可通過上調β1受體外化影響交感神經的激活[14],提示C-24降低交感神經活性與調節β1受體表達有關,后續實驗將對該機制進一步探究。
炎性因子增多是導致缺血后心律失常發生的原因之一,其中TNF-α可以通過多種途徑影響心肌電生理,延長動作電位時程,減慢心肌細胞復極化,從而產生傳導障礙和異常自律性的增加,導致各種心律失常的發生;同時TNF-α還可誘導內皮細胞產生IL-1、IL-6[2]。IL-1β可以促進炎性因子釋放和炎癥級聯反應的發生,導致心肌電生理異常,產生促缺血性心律失常的作用[15]。TNF-α和IL-1β還能通過協同作用增強梗死后心肌的炎癥反應[16]。本研究中使用C-24預處理后心肌組織中TNF-α和IL-1β水平均明顯降低,相關性分析結果顯示兩者呈正相關,表明C-24可明顯減少急性心肌缺血后心肌組織中炎性因子的產生,對降低缺血后心律失常的發生有積極作用。
本研究通過比較3個濃度C-24對大鼠急性心肌梗死后心律失常發生的影響發現,C-24預處理后VEB次數明顯減少,其中最高濃度組VT和VF發生次數及持續時間顯著減少,心律失常評分顯著降低。相關性分析結果顯示,TNF-α、IL-1β水平與VEB發生次數均呈正相關,提示非肽類孤啡肽受體拮抗劑可以通過降低炎性因子水平進而減少缺血性心律失常的發生。此外,由心功能指標結果可知,C-24對心功能無明顯影響。有研究發現在大鼠星狀神經節神經元中,C-24會阻斷N/OFQ介導的Ca2+電流抑制[17]。此外,在電生理學研究中,C-24還可以阻斷N/OFQ誘導的G蛋白偶聯的內向整流鉀電流[18]。筆者分析C-24導致心律失常發生的原因還可能與其調節鈣離子通道或鉀離子通道有關。后續實驗將對C-24作用于ORL1的具體機制進行研究。

