急性高原病的動物模型研究現狀
霍 妍,趙安鵬,李 雪,李加忠,王 榮
(1. 蘭州大學藥學院,甘肅 蘭州 730000; 2. 中國人民解放軍聯勤保障部隊第940醫院全軍高原醫學重點實驗室,甘肅 蘭州 730050)
地理學所說的高原一般指海拔大于500 m的地區,在醫學上,把海拔大于2 500 m的地區稱作高原。我國海拔大于2 500 m的地區超過國土面積的四分之一,是世界上高原面積最廣的國家。與平原相比,高原環境具有氣壓低、氧分壓低、寒冷、紫外線強、氣候干燥等特點。其中,低氧對機體的功能和代謝產生廣泛的、非特異性的影響,是高原環境影響人體的最重要因素。
人體在短時間內由低海拔地區急進高海拔地區時,由于不適應高原環境所導致的各種病理生理反應稱為急性高原病。急性高原病分為3種:急性高原反應(acute mountain sickness,AMS)、高原肺水腫(high altitude pulmonary edema,HAPE)和高原腦水腫(high altitude cerebral edema,HACE)。AMS是輕微的、自限性的急性高原病,在急進高原的人群中較為常見,癥狀一般在急進數天后減輕或消失[1]。HAPE和HACE是嚴重的急性高原病,發病率低,致死率高,一般無法自愈。
隨著西北經濟的發展和“一帶一路”建設,越來越多的旅游及高原作業人群從平原進入高原地區,急性高原病常常威脅著這些人的活動能力,甚至是生命健康。目前對于急性高原病的預防和治療沒有特效藥物,常用藥物也是療效甚微,緩解急性高原病的方法依然是吸氧和降低海拔,但這并不能從根本上解決急進高原人群作業能力下降等問題。因此,開展急性高原病有效防治藥物的研究非常必要。而這些研究的基礎就是建立復現性好、評價體系健全的急性高原病動物模型。目前,常用的建模方法大多為采用一定的手段模擬高原低氧環境,使動物發生急性高原病癥狀。本文將從建模環境、建模方法和評價指標等幾個方面綜述近年來研究中建立應用的急性高原病的模型,以期為建立更好的急性高原病動物模型,深入研究急性高原病的病防治藥物及發病機制的提供基礎。
1 急性高原病簡介
1.1 急性高原反應AMS常在急進至海拔大于2 500 m的高原數小時后出現,表現為頭痛、厭食癥、惡心、嘔吐、頭暈、疲勞和睡眠障礙等,少數患者會發展為HACE,出現意識水平的改變和共濟失調[2]。急性高原反應的發病率與海拔有密切的關系。在急進至海拔2 500 m的人群中,有10%~25%的人發生AMS,癥狀通常很輕微,對活動幾乎沒有影響。然而,在海拔4 500~5 500 m的急進人群中,有50%~85%會發生AMS,并可能影響活動能力。AMS的發病機制尚不明確,是一種多因素的疾病。急進高原后,低氧條件會促使機體會做出反應,首先就是肺通氣量增加、呼吸頻率加快,其次會使腦血管擴張,顱內壓升高。急性低氧條件還會導致副交感神經活動降低、交感神經活動增強,自主神經系統功能抑制,造成心率、血壓的改變以及胃腸功能的改變[3-4]。低氧導致的一系列生理變化均是導致AMS的因素。目前用來診斷AMS的方法較為主觀,一般用Acute Mountain Sickness-Cerebral評分(AMS-C)和Lake Louise評分(LLS)來判斷是否出現AMS,AMS-C≥0.7或LLS≥3并伴有頭痛,則表明AMS的發生[5]。
1.2 高原肺水腫高原肺水腫(HAPE)是急進高海拔地區時發生的一種非心源性肺水腫,低氧和勞動被確定為HAPE發生的兩個主要因素,其發病率約為1%~2%,多見于海拔大于3 000 m的地區。HAPE起病急,發病快,其癥狀表現為體力喪失、呼吸困難、肺部濕性啰音、發紺、咳嗽、粉紅泡沫痰等[6]。HAPE的發病機制尚不明確,目前認為主要由毛細血管應力衰竭導致,即低氧性肺血管收縮導致肺毛細血管動脈壓不均勻增加,其主要原因可能是丘腦交感神經中樞興奮以及Ca2+通道激活等[7]。HAPE患者基礎肺動脈壓升高,心率升高[8],胸片和CT掃描顯示分布于周圍的斑片狀水腫,并伴有炎癥反應。
1.3 高原腦水腫高原腦水腫(HACE)一般出現在大于3 000 m的地區,發病率較低,致死率高。HACE被認為是AMS的最終階段,其癥狀多表現為頭痛、惡心、嘔吐、意識混亂、共濟失調、昏迷等[2]。AMS向HACE轉化的原因尚不明確,可能是由于血腦屏障破壞、細胞內水腫、靜脈回流障礙等[9],有血管源性水腫和細胞毒性水腫共同存在的可能性[10]。HACE患者的腦部CT和核磁均顯示水腫并伴有多個微出血病灶[11]。
2 急性高原病研究模型
急性高原病動物模型建立的關鍵在于建立高原的低氧環境,主要方法有在高原環境模擬艙內模擬高原低氧環境,建立動物模型,或直接在高原實地建立動物模型。
2.1 建模環境
2.1.1高原環境模擬艙動物模型 建立高原環境模擬艙動物模型即將動物飼養于模擬艙中,以降低艙內氣壓的方式將模擬艙模擬海拔升至所需的高度,氧氣含量、二氧化碳含量、溫度、濕度、光照時間等均可設定,持續一定的天數。
低壓低氧是造成高原疾病的最主要因素,模擬艙可以模擬高原的低氧條件,因此急性高原病的動物模型可在模擬艙中建立。實驗動物高原環境模擬艙分為大型實驗動物模擬艙和小型實驗動物模擬艙。大型高原環境模擬艙分為飼養艙和實驗艙,飼養室可以設置相對較高的海拔(> 4 000 m)用于動物造模,而當實驗者需要對動物進行給藥、取血等處置時,人員先進入實驗艙,考慮到安全或作業能力的因素,實驗艙相對海拔較低(3 000~3 500 m),待飼養艙海拔高度降至實驗艙高度后,兩艙可相通進行實驗。在大型實驗動物模擬艙中進行實驗可避免實驗中直接將模擬海拔降至當地海拔后,富氧條件對實驗產生影響,目前廣泛應用于急性高原病動物模型的建立。小型實驗動物模擬艙亦可以將動物置于相應海拔飼養,但實驗中可控制的環境因素較少,且對動物進行處置時,也只能將動物從艙中取出,置于當地海拔進行操作。但是,這類設備使用方便、操作簡單、成本低,常用于實驗中途不需對動物進行處置的實驗。
高原環境模擬艙可以在平原地區使用,不需實驗人員、實驗動物和實驗儀器進入高原地區,避免長途運輸,較為省時省力,并且模擬艙海拔高度可以自由設定,可以在同一地區模擬不同海拔進行實驗。此外,模擬倉的海拔升降速度、溫度、濕度等環境因素可控,避免了因地區、季節、運輸方式等因素的變化影響實驗重復性,便于實驗條件的復現,目前廣泛應用于急性高原病動物模型的建立。
但是,在急性高原病的實驗研究中,常需在實驗中途對動物進行處置,即使在大型模擬艙內,對動物進行處置時也需將飼養艙模擬海拔降至不影響人類活動的高度,這便不能保證整個實驗過程中動物始終處于穩定的海拔。
2.1.2高原實地動物模型 高原實地動物模型的建立方法為將動物由平原急進高原或由低海拔高原急進至高海拔高原,飼養一定的天數。
高原疾病主要由高原的低氧環境所致,但是在高原實地建立動物模型時,難以避免由于氣候、季節、急進方式等因素引起的誤差,在高原實地建立動物模型的方法尚不常用。因此,在高原環境下建立SPF級動物實驗室以及完善實驗動物急進高原的流程對于在高原實地建立急性高原病動物模型十分重要,現于我國青海玉樹已經建立有全軍高原醫學實驗室和全軍高原環境損傷防治重點實驗室。目前,雖然在高原實地實驗室內建立的急性高原疾病動物模型較少,但已經開展了多項高原藥物代謝動力學的實驗,并取得重大進展。例如,王昌等[12]發現,大鼠由上海(海拔55 m)急進至青海瑪多(海拔4 300 m)后,左氧氟沙星在大鼠體內代謝過程發生明顯變化;李文斌[13]使大鼠由上海(海拔55 m)急進至甘肅瑪曲高原(海拔4 010 m),發現在高原條件下,普萘洛爾的藥代動力學參數發生了顯著變化。
高原實地實驗目前廣泛應用于高原藥物代謝動力學的研究,有望應用于急性高原病動物模型的建立。也可以應用于慢性高原病的研究,并且可以開展人體的高原藥物代謝動力學研究。
2.2 建模方法
2.2.1單純飼養 單純飼養建立動物模型時所需的海拔較高,常在模擬艙中進行,一般將飼養艙模擬海拔設置在6 000~8 000 m,天數不等。需要對動物處置時,模擬海拔一般為3 000~4 000 m,防止海拔過高對實驗人員造成傷害,或過低對所建模型產生影響。Yu等[14]將大鼠暴露在模擬海拔8 000 m的氧艙內,24 h后其腦含水量升高,并發現提前給藥銀杏內酯B能夠顯著降低腦含水量,有潛在的預防HACE的作用(Tab 1)。Huang等[15]在模擬6 000 m海拔的模擬艙內,發現小鼠的腦含水量升高、血腦屏障通透性升高、腦組織切片顯示組織損傷、水迷宮試驗中逃脫潛伏期增長,提示小鼠發生高原腦水腫。Wang等[16]在模擬6 000 m海拔下,測得大鼠缺氧48 h后,腦含水量升高、血清內TNF-α、IL-6水平上升、腦組織切片顯示組織損傷、水迷宮試驗中逃脫潛伏期增長,指示高原腦水腫的發生,并發現給藥乙酰唑胺以及葛根素能夠明顯改善上述指標。Lee等[17]在模擬海拔8 000 m的減壓室內使大鼠暴露9 h,測得大鼠肺含水量升高、肺泡灌洗液內出現蛋白滲漏、肺組織有明顯損傷,證明出現高原肺水腫,預防給藥紅景天提取物可以緩解急性缺氧導致的上述指標的改變。

Tab 1 Modeling of animal model of acute plateau disease
2.2.2跑臺力竭運動 在高原條件下,單純飼養建立急性高原病動物模型在目前的研究中應用十分普遍,但單純飼養所建立的HAPE動物模型成功率低、表征不明顯,且復現性不良。因此,使實驗動物在低壓、低氧環境中進行力竭運動來建立HAPE動物模型的方法被廣泛應用。其次,高原條件下的力竭運動能夠類比人類在高原地區的登山、勞作等活動,使該模型的建立更加契合人類急性高原病的發生過程。力竭運動模型的建立所需海拔較低,表征更明顯。Sheppard等[18]在驗證運動是否會增加HAPE的發病率的實驗中,比較了常氧、常氧運動、低氧、低氧運動對大鼠肺含水量、肺通透性、肺組織形態產生的影響,結果顯示常氧和常氧運動組未出現明顯差異,證明常氧條件下的運動不會導致肺水腫的發生。
建立跑臺力竭運動動物模型,一般在4 000~6 000 m的海拔下,時間多為48 h,使用實驗動物跑臺讓動物進行連續運動,在3 000~4 000 m海拔下對動物進行處置。Zhou等[19]使大鼠在4 500 m的模擬海拔下進行力竭運動,之后將海拔升至6 000 m處,48 h后測得肺含水量上升、肺泡灌洗液蛋白含量升高、血清內細胞因子TNF、IL-1b、IL-6、IL-8水平上升,切片檢查可見肺組織損傷,電鏡顯示超微結構被破壞,指示有高原肺水腫發生,給藥地塞米松或索那肽后,上述損傷能夠得到有效緩解。She等[20]使小鼠在5 000 m的模擬海拔下進行力竭訓練,48 h后測得肺含水量升高、肺泡灌洗液有細胞和蛋白滲漏,組織學分析可見明顯損傷,提示小鼠發生HAPE;并發現大鼠在模擬海拔4 700 m進行力竭訓練后,肺泡毛細血管滲透率也會升高,進一步驗證HAPE的發生,并證明了角質細胞生長因子-2 可以緩解低氧運動造成的肺部損傷,有潛在的治療HAPE的作用[21]。
目前對于HAPE的研究中,通過跑臺力竭運動來建立動物模型的方法使用最多,成功率最高,復現性最好,并且方便可行。建立跑臺力竭運動動物模型所需的海拔相對較低,在模擬艙和高原實地均有實施的可能性。
3 模型評價指標
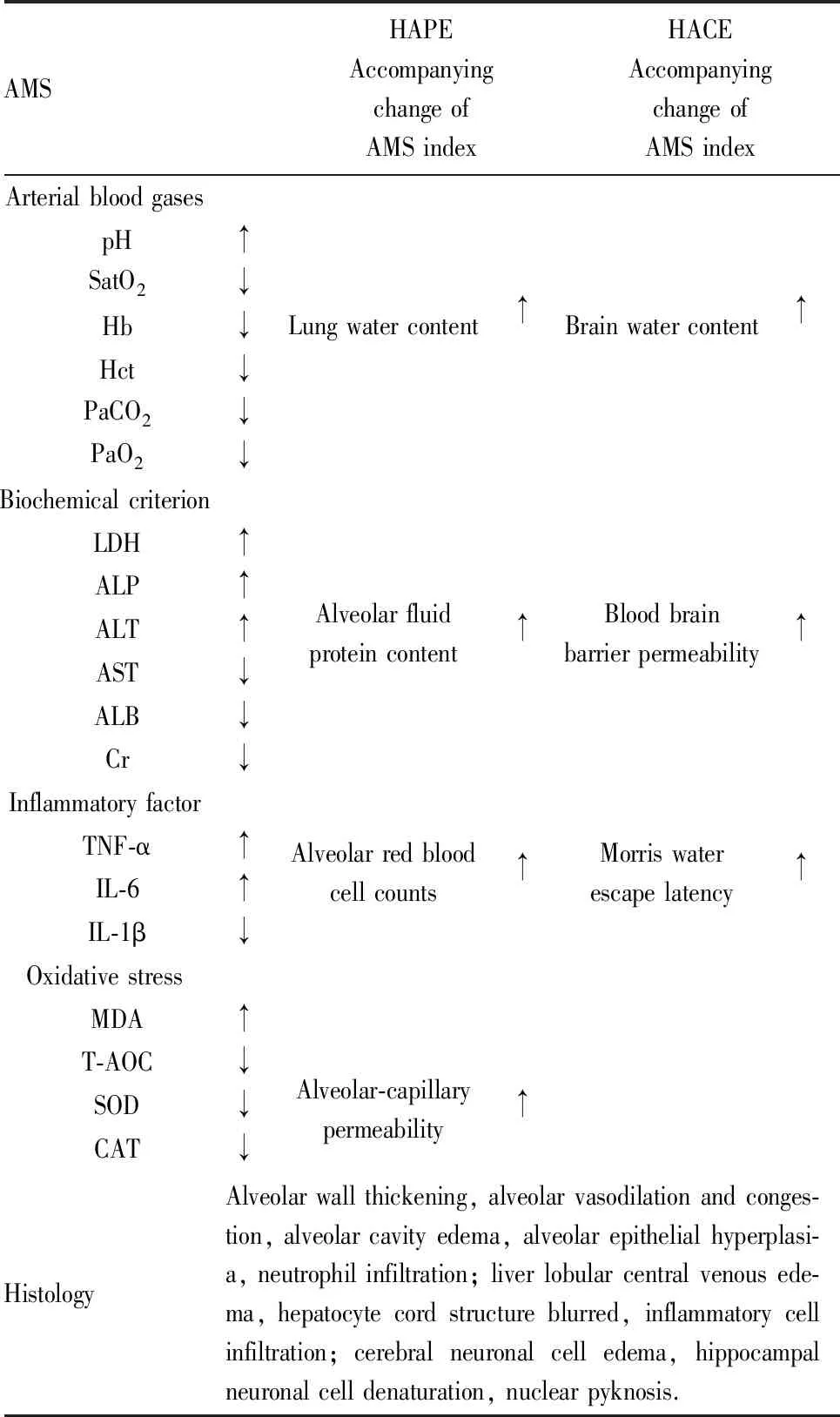
3.1 AMS臨床上AMS的診斷方法為詢問患者的主觀感受,但是在動物實驗中難以準確獲得動物的主觀感受,目前并沒有準確的指示實驗動物發生AMS的辦法。在出現AMS的癥狀時,高原低氧會導致動物血氣及血常規異常、血清生化指標異常、氧化應激損傷和炎癥現象[22-24]等,現有研究中一般以這些指標來評價低氧損傷的程度,間接反映AMS的發生。但到目前為止,并沒有明確的評價指標證實AMS動物模型建立成功。
動物急性暴露于高原低氧條件后,可發現動脈血氣的改變,主要表現為pH降低、血氧飽和度下降等;血常規檢測中可見白細胞、紅細胞及血紅蛋白含量異常等;機體主要組織器官出現輕微或明顯的損傷,氧化應激指標發生改變;血清中生化指標改變,炎癥因子TNF-α、IL-1β、IL-6、IL-8含量上升,指示伴隨炎癥反應發生[25](Tab 2)。但低氧損傷并不等同于出現AMS,AMS動物模型的建立方法有待進一步確立。
3.2 HAPE發生HAPE的動物中除了可以檢測出上述AMS模型檢測指標的變化外,還可檢測出肺含水量升高,肺泡灌洗液(BALF)中總蛋白和白蛋白含量上升且存在細胞滲漏,肺泡毛細管滲透率升高,組織切片可見肺血管充血、肺泡間隔增厚、肺泡腔內有紅細胞和粉紅色蛋白物質。現有模型中多以上述指標的變化來表示HAPE的發生,但與臨床診斷指標并不完全匹配,可增加小動物肺部CT來證明HAPE發生。
3.3 HACE出現HACE的動物也可以檢測出AMS模型檢測指標的變化,另外還會出現腦含水量升高,血腦屏障通透性升高,組織切片可見細胞間隙明顯擴大、皮質血管擴張、神經元萎縮、細胞核呈暗色固縮,水迷宮試驗逃脫潛伏期增長等。小動物腦部CT可用于診斷HACE,但現有研究中鮮有使用。
4 結語
我國高原面積廣大,由于各種原因需要進入高原的人數也日益增多,進行急性高原病的防治研究和基礎研究都十分重要。急性高原病包括急性高原反應、高原肺水腫、高原腦水腫,海拔高度、上升速率、個體易感性都會影響發病率及嚴重程度[26-27]。AMS的發病率較高,但癥狀較輕微,典型癥狀為頭痛,一般不影響活動,多用紅景天或乙酰唑胺預防[28-29]。大多在急進高原后數天可適應,或在降低海拔后自愈,少數會發展為更加嚴重的HACE。急進高原并伴有劇烈運動時,易發生HAPE,HAPE發病率低,但起病急,發病快,多見于海拔3 000 m以上地區,CT檢查可見肺部病變,現臨床多以降低海拔配合硝苯地平治療HAPE。HACE被認為是AMS的最終階段,發病率低,致死率高,見于海拔3 000 m以上地區,CT檢查可見腦部病變,降低海拔加以地塞米松可緩解其癥狀[30]。
Tab 2 Evaluation index of animal model of acute plateau disease
目前對于急性高原病的治療都是以降低海拔、吸氧并輔以藥物治療的方法,單純使用藥物進行預防或治療效果甚微,這給急進高原人群帶來了很大的不變,因此急需開發針對急性高原病的特效藥物。急性高原病主要由高原低壓低氧環境所誘導,但其發病機制尚未明確,對于急性高原病的基礎研究也有待深入。雖然現已有不少成功建立出HAPE和HACE動物模型的案例,但大多指向性不強、復現性不好,對于AMS的動物模型的建立也尚未有結果,這給急性高原病的深入研究帶來很多困難。
雖然在現有研究中,有不少急性高原病動物模型建立并應用于研究中,但仍有一些問題有待深入研究,例如(1)AMS動物模型沒有明確的評價指標;(2)HAPE和HACE的臨床診斷多用CT,而在建立動物模型時并未用CT證明疾病的發生,與臨床診斷方法不完全匹配;(3)現有急性高原病動物模型多在高原環境模擬艙建立,高原地區SPF級實驗室少,在實地建立的案例很少,實地力竭運動的動物模型有待建立。