miRNA-7靶向SP1的3′UTR雙熒光素酶報告基因載體構建及評價①
劉文莉 國 東 劉加霏 王玉珊 張煥虎 宋文剛
(北華大學醫學技術學院,吉林 132013)
SP1屬于SP/KLF(Kruppel-like factor)轉錄因子家族,可通過調節癌基因及抑癌基因、腫瘤細胞凋亡等方式,調控多種腫瘤細胞生長周期相關信號傳導途徑[1]。研究發現SP1與胃癌的發生發展密切相關,在胃癌患者中,SP1高表達患者的生存時間明顯低于弱表達或者低表達的患者,下調SP1的過表達可以抑制胃癌腫瘤的增殖和瘤細胞的形成[2]。
微小RNAs (microRNAs)是真核細胞生物內源性的具有調控功能的非編碼RNA,其成熟體通過堿基互補配對的方式識別靶mRNA,根據互補的程度指導沉默復合體降解靶基因或阻礙mRNA的翻譯[3]。miR-7自2001首次在果蠅中發現以來,在許多癌癥中表達降低,發揮抑癌基因的作用[4]。最近研究發現,miR-7在胃癌組織和胃癌細胞中均顯著下調,已逐漸成為胃癌診斷和治療的靶標[5]。miR-7可通過抑制mTOR (mechanistic target of rapamycin)的表達,增強胃癌細胞對順鉑的敏感性[6];通過抑制上皮生長因子受體和胰島素樣生長因子1受體的表達,抑制胃癌細胞的侵襲和轉移能力[7]。基于上述理論,miR-7與SP1可能存在某種聯系,但目前沒有關于miR-7作用于SP1對胃癌參與調控的相關研究報道。
本研究擬通過構建雙熒光素酶報告質粒及突變質粒,以闡述miR-7調控胃癌細胞SP1表達的分子機制,為研究miRNAs在胃癌中的作用提供新的思路。
1 材料與方法
1.1材料
1.1.1主要試劑 細胞總RNA抽提取試劑盒、質粒抽提試劑盒、通用型DNA純化回收試劑盒購于TIANGEN公司;50 bp DNA ladder、D2000 DNA Marker、1 kb plus DNA ladder、Pro-Light HRP化學發光檢測試劑購于天根生化科技(北京)有限公司;實時熒光定量PCR(qPCR)試劑盒、cDNA合成試劑盒、2×Taq酶、DNA 聚合酶、dNTP、T4連接酶、限制性內切酶XhoⅠ、NotⅠ購于寶日醫生物技術(北京)有限公司;miR-7 mimics、mimics-NC、miR-7 inhibitor購于上海吉瑪制藥技術有限公司;1640 培養基、胎牛血清(fetal bovine serum,FBS)購于TaKaRa公司;Lipofectamine 2000 購于美國Thermo Scientific 公司;BCA蛋白濃度測定試劑盒購于碧云天公司;SP1抗體、GAPDH抗體及二抗均購于武漢三鷹公司;PCR引物合成及測序由北京Thermo Scientific公司完成。大腸埃希菌感受態細胞DH5α及雙熒光素酶報告載體psiCHECK2由威海市立醫院中心實驗室饋贈。
1.1.2細胞株 健康人胃黏膜上皮細胞GES-1細胞株、人胃癌細胞株MKN45購于上海中科院細胞庫。
1.1.3儀器設備 MCO-18AIC 細胞培養箱(Panas-onic,Japan);ChemiDoc XRS+化學發光成像系統、Synergy H4多功能酶標儀、熒光定量PCR儀(Bio-Rad, USA);Nano-200超微量核酸分析儀(奧盛, 廣州)。
1.2方法
1.2.1microRNA-7靶基因預測 利用Targetscan (http://www. targetscan.org/vert_72/)和miRDB (http://mirdb.org/)生物信息學技術相關軟件預測miR-7的靶基因以及miR-7與SP1-3′ UTR 序列配對分析。
1.2.2GES-1細胞的培養和基因組DNA提取 GES-1細胞株培養于1640培養基(含10%胎牛血清+1%的青霉素/鏈霉素雙抗),37℃、5%CO2培養箱。當細胞匯合度為80%時,收集細胞,用細胞基因組快速抽提試劑盒,按照說明書提取細胞基因組DNA,用2%凝膠電泳檢測DNA完整性并用超微量核酸分析儀檢測濃度。
1.2.3PCR 擴增SP1-3′UTR基因片段 從NCBI數據庫中下載人源SP1基因序列(NM_138473.3),應用Prime primer5.0軟件設計SP1-3′UTR特異性引物,在引物的前端加入Xho Ⅰ 和Not Ⅰ 兩個限制性內切酶位點和保護性堿基(表1)。以提取GES-1細胞的基因組DNA為模板,PCR擴增SP1-3′UTR區miR-7結合位點。PCR體系:2×Tap 10 μl,上引物0.5 μl,下引物0.5 μl,模板2 μl,水8 μl。PCR反應條件為:94℃預變性 5 min;95℃變性30 s,58℃退火30 s,72℃延伸15 s,共35個循環;最后72℃延伸5 min。用1.5%的瓊脂糖凝膠電泳鑒定PCR產物。使用凝膠回收試劑盒回收目的片段,用于后續連接反應。
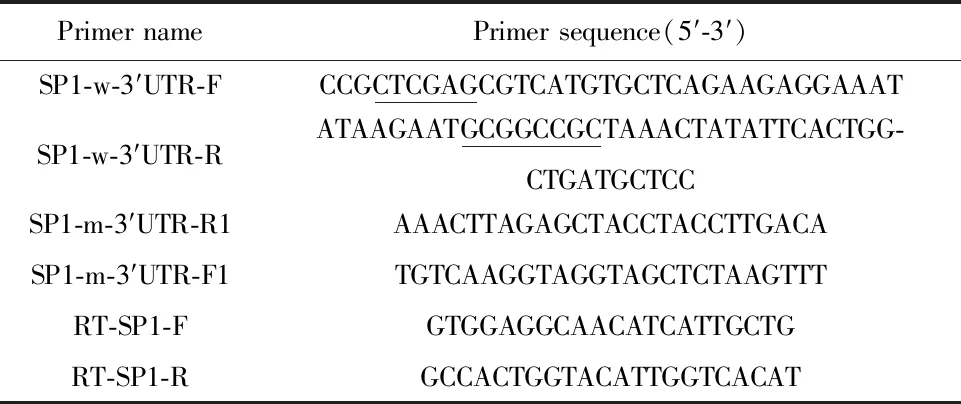
表1 用于擴增SP1及3′UTR特異性引物序列
1.2.4野生型表達載體psiCHECK2-SP1-w-3′UTR的構建及鑒定 將PCR產物純化后采用Xho Ⅰ 和Not Ⅰ 雙酶切37℃過夜。回收酶切片段,插入到熒光素酶報告載體psiCHECK2的對應位點,連接體系如下:3′UTR 7 μl,Xho Ⅰ、Not Ⅰ 雙酶切純化psiCHECK2 1 μl,10×T4 DNA buffer 1 μl,T4連接酶1 μl,水補至10 μl,16℃連接過夜。轉化DH5α感受態細胞,挑取單菌落接種于氨芐抗性的LB液體培養基中培養篩選陽性克隆,按照DNA提取試劑盒說明書步驟,提取psiCHECK2-SP1-w-3′UTR質粒進行Xho Ⅰ、Not Ⅰ 酶切鑒定,將鑒定正確的質粒送去生工生物工程公司(上海)測序。
1.2.5突變型表達載體psiCHECK2-SP1-m-3′UTR的構建及鑒定 以1.2.4中構建的psiCHECK2-SP1-w-3′UTR為模板,分別以SP1-w-3′UTR-F和SP1-m-3′UTR-R1為引物擴增片段F1,SP1-m-3′UTR-F1和SP1-w-3′UTR-R為引物擴增片段F2,再以F1和F2為模板,以SP1-w-3′UTR-F和SP1-w-3′UTR-R為引物,通過融合PCR技術擴增F3片段(對miR-7的結合位點進行了連續4個堿基突變),經回收、酶切和純化后插入到雙熒光素酶報告載體psiCHECK2的對應位點,轉化感受態細胞,篩選陽性克隆,經測序后保存。
1.2.6細胞分組及轉染 將MKN45細胞接種于12孔板中,每孔2×106個細胞,培養過夜,當細胞密度達到70%~80%時,分別將:psiCHECK2-SP1-w-3′UTR和miR-7 mimics、psiCHECK2-SP1-m-3′UTR和miR-7 mimics、psiCHECK2-SP1-w-3′UTR和miR-7 inhibitor、psiCHECK2-SP1-m-3′UTR和miR-7 inhibitor及各自陰性對照mimics-NC,通過Lipofectamine 2000進行瞬時轉染MKN45細胞,37℃培養,6 h后更換細胞培養液,培養48 h后取出,用PBS洗滌3次,每孔加入1 ml總RNA裂解液,置搖床震蕩充分裂解后,離心吸取上清裂解液提取總RNA并測定濃度后,置-80℃凍存備用。
1.2.7雙熒光素酶報告基因活性檢測 轉染48 h后,按雙熒光素酶報告基因檢測試劑盒說明書進行操作,最后利用Synergy H4多功能酶標儀讀取熒光值并計算相對熒光活性。
1.2.8RT-PCR檢測SP1和miR-7的表達變化 提取待分析細胞的總RNA和microRNA后,分別采用逆轉錄試劑盒進行反轉,反轉條件為42℃ 15 min,85℃ 5 min后置-20℃保存備用。按照UltraSYBR Mixture試劑盒說明書進行實驗,采用2-ΔΔCT方法計算目的基因的倍性變化。每個實驗組設3個平行,重復3次實驗并記錄實驗結果。
1.2.9Western blot檢測SP1的表達變化 提取待分析細胞的總蛋白,并用BCA蛋白濃度測定試劑盒測定蛋白濃度。GAPDH作為內參。上樣30 μg蛋白進行電泳,通過濕轉法將蛋白轉到PVDF膜上,5%脫脂奶粉中37℃封閉1 h后添加一抗,4℃孵育過夜,TBST漂洗4次后添加辣根過氧化物酶HRP標記的二抗,室溫孵育1 h后TBST漂洗4次,最后采用Pro-Light HRP化學發光檢測試劑盒顯色,并用ChemiDoc XRS+化學發光成像系統采集圖像。
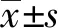
2 結果
2.1microRNA7靶基因預測 使用Targetscan、miRDB和Cytoscape軟件對miR-7的靶基因進行預測。Targetscan的標準是Contest+<-0.4,miRDB的標準是>80。將兩個數據庫的預測結果進行交叉,得到46個目標基因。利用在線數據庫(https://string-db.org/)Cytoscape軟件(version 11.0)進行可視化,建立包括蛋白質和基因在內的眾多生物分子之間的相互作用網絡(圖1A)。發現miR-7與SP1的3′UTR區有潛在結合位點(圖1B)。
2.2熒光素酶報告載體psiCHECK2-SP1-w-3′UTR的鑒定 以提取的GES-1細胞基因組為模板,PCR擴增SP1-3′UTR目的片段,1.5%瓊脂糖凝膠電泳顯示擴增出的片段大小約為220 bp,大小與預期相符(圖2A)。采用凝膠回收試劑盒回收擴增產物與載體psi-CHECK2連接,轉化感受態受體菌DH5a,經氨卞抗性篩選挑取單菌落,經PCR鑒定,挑選鑒定正確的菌落搖菌,抽提質粒,經Xho Ⅰ 和Not Ⅰ 雙酶切后驗證,在220 bp處可見酶切片段,與預期SP1片段大小相符(圖2B)。初步證實目的基因已經插入到質粒載體中。重組質粒測序結果表明,目的基因成功克隆入載體,并且其序列與 GeneBank中公布的一致。
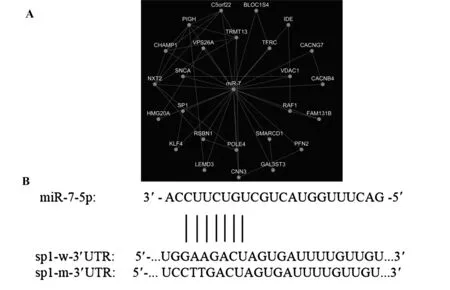
圖1 miR-7靶基因預測網絡圖及與SP1 3′-UTR 序列配對分析Fig.1 miR-7 target gene prediction website and sequence pairing analysis of SP1 3′-UTRNote:A.miR-7 target gene prediction website;B.Sequence pairing analysis of SP1 3′-UTR with miR-7.
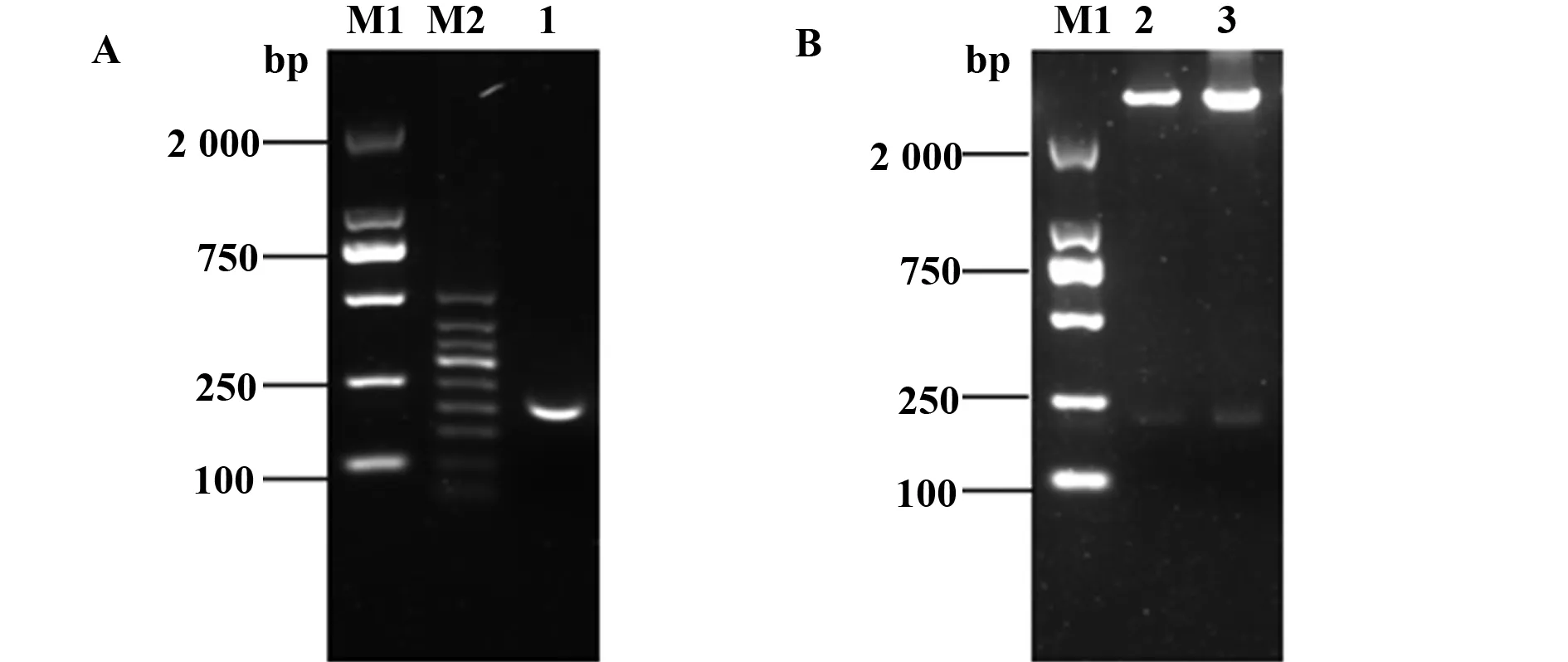
圖2 psiCHECK2-SP1-w-3′UTR的質粒構建及酶切驗證Fig.2 Construction of psiCHECK2-SP1-w-3′UTR and validation by enzyme digestionNote:A.Agar gel electrophoresis of SP1-3′UTR product by PCR;B.Agar gel electrophoresis of constructed wild plasmid verified by enzyme digestion.M1.DL2000 marker;M2.50 bp ladder;1.Target fragment;2,3.Verified by restriction endonuclease with two enzymes.
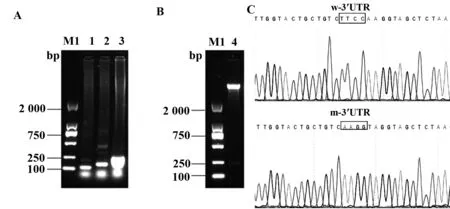
圖3 psiCHECK2-SP1-m3′UTR的質粒構建及鑒定Fig.3 Construction of psiCHECK2-SP1-m3′UTR and validation by enzyme digestionNote:A.Agar gel electrophoresis of SP1-3′UTR product by PCR;B.Agar gel electrophoresis of constructed wild plasmid verified by enzyme digestion;C.Comparison of wild and modified 3′UTR sequences.M1.DL2000 marker;1.Target fragment F1;2.Target fragment F2;3.Fusion fragment;4.Verified by restriction endonuclease with two enzymes.
2.3雙熒光素酶報告質粒psiCHECK2-SP1-m-3′UTR的鑒定 以2.2中構建成功的熒光素酶報告載體psiCHECK2-SP1-w-3′UTR為模板。融合PCR技術依次擴增片段F1、F2和F3(圖3A、B)。經酶切及測序鑒定F3片段含有與miR-7結合的4個堿基突變位點,由TTCC突變為AAGG(圖3C)。
2.4雙熒光素酶報告實驗 雙熒光素酶報告實驗結果顯示,與陰性對照mimics-NC相比,轉染miR-7-5p能顯著降低轉染psiCHECK2-SP1-w-3′UTR的MKN45細胞的相對熒光活性比值(Rluc/Luc)(P<0.001),而對轉染psiCHECK2-SP1-m-3′UTR的MKN45細胞的Rluc/Luc未有明顯改變(P>0.05)(圖4)。
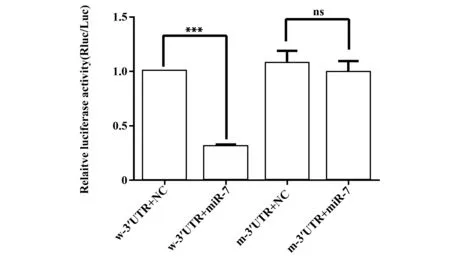
圖4 雙熒光素酶活性分析野生型與突變型psiCHECK2-SP1-3′UTR在胃癌MKN45細胞表達情況Fig.4 Analysis of dual relative luciferase activity of psiCHECK2-SP1-w-3′UTR and psiCHECK2-SP1-m-3′UTR in gastric cancer MKN45 cellsNote:Compared with the w-3′UTR+NC, Rluc/Luc of the w-3′UTR+miR-7,***.P<0.001;Compared with the m-3′UTR+NC,Rluc/Luc of the m-3′UTR+miR-7,ns.P>0.05.
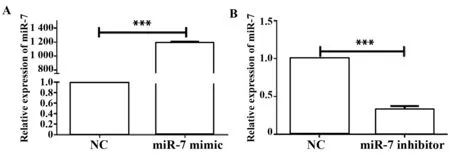
圖5 miR-7模擬物及抑制劑對MKN45細胞中miR-7的表達影響Fig.5 Expression change of miR-7 in miR-7 mimic and inhibitor transfected MKN45 cellsNote:A.Compared with the miR-7-NC,expression of miR-7 in the w-3′UTR+miR-7-mimic,***.P<0.001;B.Compared with the miR-7-NC,expression of miR-7 in the w-3′UTR+miR-7- inhibitor,***.P<0.001.
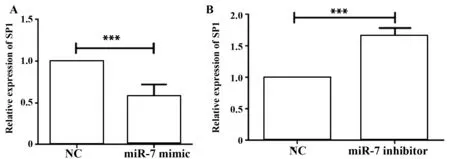
圖6 miR-7模擬物及抑制劑對MKN45細胞SP1-mRNA的表達影響Fig.6 Expression of mRNA-SP1 of miR-7 mimic and inhibitor in gastric cancer MKN45 cellsNote:A.Compared with the miR-7-NC,expression of SP1-mRNA in the w-3′UTR+miR-7-mimic,***.P<0.001;B.Compared with the miR-7-NC,expression of SP1-mRNA in the w-3′UTR+miR-7- inhibitor,***.P<0.001.
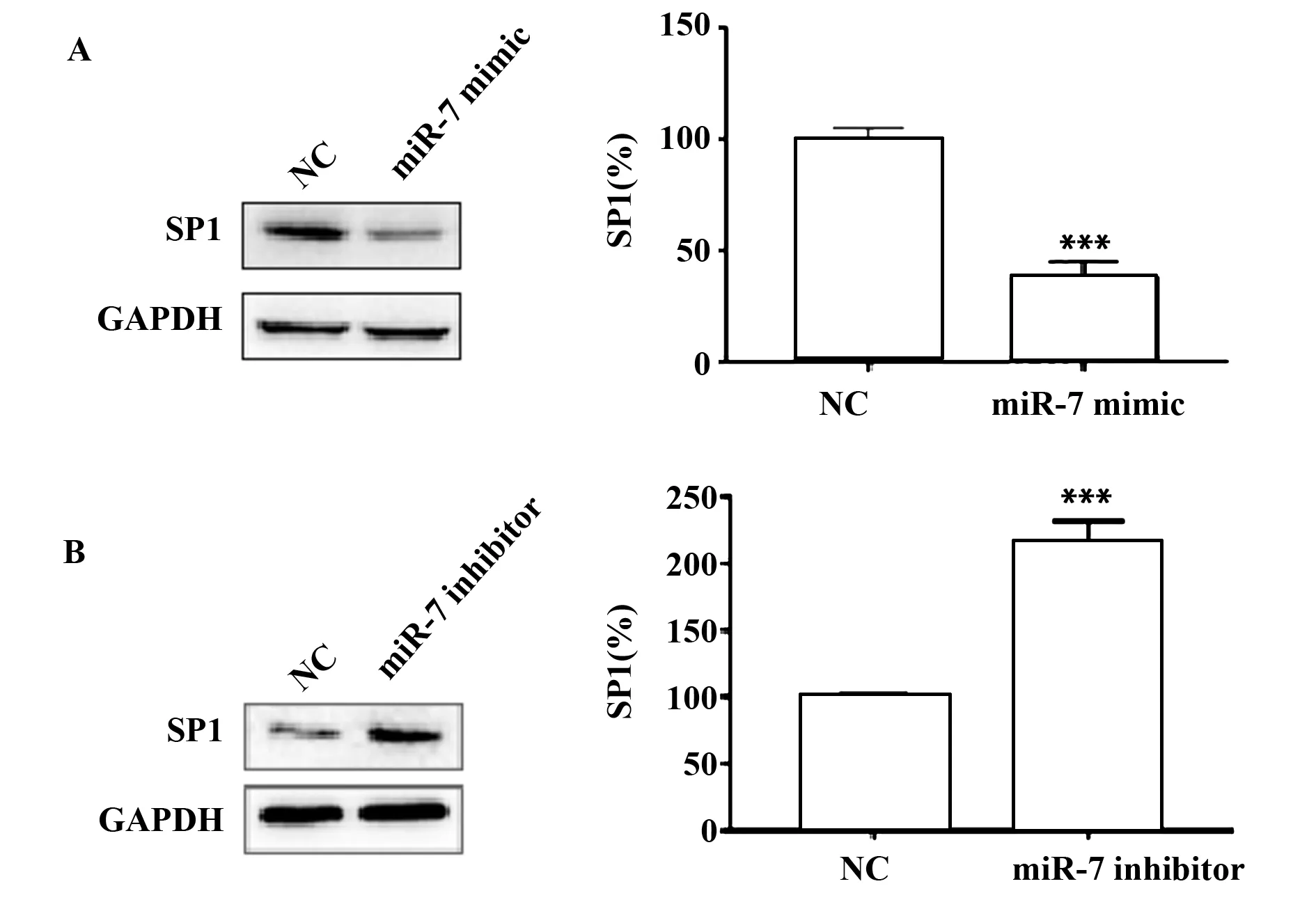
圖7 miR-7模擬物及抑制劑對MKN45細胞中SP1蛋白的表達影響Fig.7 Expression of SP1 protein of miR-7 mimic and inhibitor in gastric cancer MKN45 cellsNote:A.Compared with the miR-7-NC,SP1 protein in the w-3′UTR+miR-7 mimic,***.P<0.001;B.Compared with the miR-7-NC,SP1 protein in the w-3′UTR+miR-7 inhibitor,***.P<0.001.
2.5miR-7在胃癌細胞中負調控SP1的表達 miR-7 mimic及miR-7 inhibitor 轉染胃癌MKN45細胞,經48 h培養提取細胞總RNA、microRNA和總蛋白,分別通過qRT-PCR和Western blot檢測SP1的表達變化。結果發現,與轉染陰性對照相比,轉染miR-7 mimic促使miR-7過表達(圖5A),同時在mRNA水平和蛋白質水平抑制細胞內SP1的表達(P<0.001),而轉染miR-7 inhibitor則抑制內源性miR-7的表達(圖5B),同時促進SP1的表達(P<0.001)(圖6和圖7)。
3 討論
正常情況下,SP1在體內各種細胞中廣泛表達并受機體的嚴格調控,具有高度保守序列,通過直接與啟動子結合調節基因的表達[7],目前SP1已被公認為是促癌蛋白,在調控腫瘤細胞增殖和凋亡過程中發揮重要作用。已在多種腫瘤類型中得到證實,在胃癌、胰腺癌和乳腺癌等癌癥中則表現為高表達,且其表達水平與腫瘤的分級和分期、侵襲和轉移能力及患者的生存期和不良預后密切相關,如同一胃癌患者的胃癌組織中SP1的表達水平顯著高于周圍正常組織,且與腫瘤的浸潤程度呈正相關[8];SP1高表達的胃癌患者的中位生存期顯著低于SP1低表達或不表達的胃癌患者[9]。SP1可以與Smad蛋白形成化合物,從而誘導Smad7的轉錄和過表達,并負向調節TGF-β途徑,從而影響胃癌細胞的生長、分化和凋亡[10]。SP1的異常激活還可以上調腫瘤相關因子和血管生成因子的表達,從而為腫瘤生長提供良好的微環境,并促進胃和胰腺腫瘤的增殖、轉移和血管生成[11]。SP1被血管內皮生長因子的啟動子募集,因其表達上調,促進了血管內皮的增殖、血管生成并增加了血管的通透性,從而促進了腫瘤的生長和轉移。已經發現SP1表達的增加與胃癌患者預后的惡化程度呈正相關[12]。同樣,miR-7發揮抑癌基因的作用,miR-7在胃癌細胞中表達低下,可通過靶向胰島素樣生長因子受體1抑制胃癌細胞的轉移[13]。譚海洋等[14]報道miR-7上調可抑制胃癌細胞增殖,促進細胞凋亡。當microRNA與mRNA存在互補配對時,降解mRNA合成新生多肽鏈,抑制其翻譯,從而調節細胞的增殖、分化、凋亡及腫瘤的形成和轉移等一系列的重要生物學過程[15]。
本實驗通過生物信息學方法預測miR-7的潛在靶基因,依據算法對 miR-7 靶分子的樣本群進行評分,Targetscan的標準是Contest+<-0.4,miRDB的標準是>80,通過基因重組和PCR技術在胃癌細胞中瞬時轉染miR-7,分別從mRNA和蛋白質水平驗證了miR-7對胃癌細胞負調控SP1的表達情況。
在本研究中,對胃癌細胞MKN45共轉染miR-7模擬物和抑制劑,miR-7可以在mRNA和蛋白質水平抑制細胞內SP1的表達,而轉染miR-7抑制劑后則逆轉對SP1的抑制作用。發現miR-7可能是胃癌細胞中負性調控SP1活性的重要反饋調控機制,并初步構建psiCHECK2-SP1 3′UTR熒光素酶報告載體,通過雙熒光素酶報告實驗對miR-7負調控SP1的功能進行驗證,以驗證miR-7通過調控SP1參與胃癌發生發展的潛在機制。
本實驗擴增出長度為220 bp的SP1 3′UTR基因序列,并將其連入熒光素酶報告載體,成功構建了pisCHECK2-SP1 3′UTR表達載體。miR-7可能通過作用于SP1的 3′UTR區域對該基因進行靶向調控,實現對胃癌細胞發生發展的調節。關于miR-7通過調控SP1參與胃癌發展的信號傳導機制,本課題組將會在后續研究中不斷探索。

