胰高血糖素樣肽1受體激動劑在非酒精性脂肪性肝病治療中的作用及相關機制
俞曉菡,王雨露,許笑陽,平 鍵,1b,2,3,趙長青,1b,2,3
1 上海中醫藥大學附屬曙光醫院 a.肝病研究所, b.肝病二科,上海 201203; 2 上海市中醫臨床重點實驗室,上海 201203; 3 肝腎疾病病證教育部重點實驗室,上海 201203
非酒精性脂肪性肝病(NAFLD)是一種無過量飲酒史,以肝細胞脂肪變性和脂質貯積為特征的臨床病理綜合征。隨著對疾病的深入認識,國際專家組建議以代謝相關脂肪性肝病(metabolic associated fatty liver disease, MAFLD)代替現有命名[1]。NAFLD影響了全世界超過25%的普通人群,也是美國進行肝移植的主要指征之一[2-4]。研究表明,NAFLD與代謝綜合征關系密切,由于中國人群調節脂質代謝的基因更易發生非同義突變,NAFLD在中國人群中具有更高的發病風險。在過去10年中,NAFLD發病率從18%急劇增加到29%,增長速度是西方的2倍[5]。NAFLD的發病機制十分復雜,近年“多重打擊”學說逐漸取代經典的“二次打擊”學說以解釋NAFLD的發病機制[6]。NAFLD的發病過程與胰島素抵抗、脂毒性、氧化應激、炎癥反應和肝臟因子等多種因素有關,但在機制間的相互作用以及在NAFLD發生發展中的變化規律有待進一步明確。迄今為止,針對NAFLD尚無公認的藥物療法,因此尋找新治療方案十分迫切。NAFLD是一種代謝紊亂相關的多系統疾病[7],在2型糖尿病(Type 2 diabetes mellitus, T2DM)和肥胖患者中更為常見[8]。鑒于胰高血糖素樣肽1(Glucagon-like peptide-1, GLP-1)受體激動劑已成功用于臨床治療T2DM和肥胖癥[9],故近年來,GLP-1對NAFLD的影響也成為國內外研究的熱點。本文綜述GLP-1受體激動劑在NAFLD中的治療作用及相關機制。
1 胰高血糖素樣肽1(GLP-1)
20世紀初,研究發現正常體質量者和肥胖者在口服葡萄糖后均刺激了胰島素的分泌,稱該作用為腸降血糖素作用。GLP-1被發現是腸降血糖素之一,攝入食物后通過刺激胰島β細胞分泌胰島素克服餐后高血糖癥[10]。GLP-1可以通過與B類家族中結構相似的G蛋白偶聯受體結合,促進其生物學作用,GLP-1是GLP-1受體(GLP-1R)的內源性配體,可激活腺苷酸環化酶提高環磷酸腺苷水平。GLP-1R在人體中分布廣泛[11],近年研究[12]表明,GLP-1R在肝門附近的門靜脈壁上表達,可能位于門靜脈神經末梢。并且,在肝臟中,GLP-1于肝門靜脈循環中被釋放,在門靜脈中達到其最高靜脈內濃度[13]。雖然,未在肝臟中發現大量GLP-1R,但是與其同源的胰高血糖素受體在人肝細胞中大量表達,也介導了GLP-1的肝效應[13]。因此,肝臟也是GLP-1的潛在靶標。GLP-1具有許多促新陳代謝作用,包括葡萄糖依賴性的胰島素分泌刺激,胃排空減少,食物攝取抑制,利尿以及調節嚙齒動物胰島β細胞增殖。并且,還可抑制嚙齒動物和人類的餐后乳糜微粒分泌并降低循環甘油三酯水平[14-15],參與減輕局部或全身炎癥。GLP-1R激動劑已成功用于臨床治療T2DM,其中長效GLP-1R激動劑利拉魯肽[16]是目前臨床T2DM一線用藥之一,幾種基于GLP-1的藥物療法正在臨床治療肥胖癥。
2 GLP-1R激動劑在NAFLD中的臨床研究
2.1 減輕胰島素抵抗 Khoo等[17]將24例NAFLD肥胖患者分為2組分別接受利拉魯肽(3 mg/d)或等量生理鹽水治療26周。治療后,治療組患者總脂肪含量和胰島素抵抗水平均明顯降低;血清ALT、AST、肝脂肪分數和肝硬度也較基線水平顯著改善。分析表明,GLP-1R激動劑可通過降低體質量、肝酶活性和肝臟脂肪分數進而降低患者胰島素抵抗水平。
Armstrong團隊[18]每天用1.8 mg利拉魯肽或等量安慰劑分別治療14例非酒精性脂肪性肝炎(NASH)患者12周。發現利拉魯肽可以提高肝臟胰島素敏感性,改善患者空腹血糖水平;增加全身脂肪組織(尤其是皮下組織)胰島素敏感性,降低NASH中功能異常脂肪組織的脂毒性,加強胰島素抑制脂解的能力。
2.2 調節肝臟脂質代謝 Petit等[19]開展了一項臨床研究,接受6個月1.2 mg/d的利拉魯肽注射治療后,57例NAFLD合并T2DM患者肝臟脂肪含量較基線水平下降了33%,該作用與肝酶活性的改善明顯相關。GLP-1R激動劑誘導的體質量減少也是引起肝脂肪含量降低的重要因素,同時促進了HbA1c和甘油三酯指標的改善。
Armstrong等[18]還發現利拉魯肽降低了脂肪胰島素抵抗指數和INS-1/2-max非酯化脂肪酸,減少了循環中脂毒性代謝和促炎介質的數量,明顯抑制了肝臟脂肪的從頭合成。
Shao等[20]納入60例NAFLD合并T2DM的肥胖癥患者,分別用GLP-1R激動劑艾塞那肽或強化胰島素治療12周后,發現經GLP-1R激動劑可通過降低肥胖患者的體質量而減輕患者肝損傷。此外,肝活檢發現經艾塞那肽治療后,脂肪肝的逆轉率高達93.3%,GLP-1R激動劑有效逆轉了肝細胞脂肪變性。
2.3 改善肝臟組織學 Armstrong等[21]在一項Ⅱ期臨床試驗中,將52例NASH患者按1∶1比例隨機接受1.8 mg/d利拉魯肽或等量生理鹽水注射治療48周,經藥物治療的9例患者消除了NASH且無纖維化惡化,3例T2DM和6例非T2MD患者肝組織學得到改善。與安慰劑相比,經利拉魯肽治療的患者肝纖維化明顯好轉,并且肝細胞脂肪變性和氣球樣變性改善的比例更高。
Eguchi等[22]用0.9 mg/d利拉魯肽治療26例糖耐量異常NASH患者24周后,血清HbA1c水平明顯下降。并在第96周時,對10例患者進行了重復肝活檢,其中6例患者NASH活性評分和Brunt評分顯示組織學炎癥程度減輕。另有研究[17,23]表明,GLP-1R激動劑可明顯降低受試者肝酶、總脂肪量和肝臟硬度。這些結果均提示,GLP-1R激動劑可安全有效的改善肝組織學變化。
3 GLP-1R激動劑影響NAFLD病程進展的實驗研究
3.1 在糖脂代謝中的作用 Rahman等[24]用利拉魯肽(200 μg/kg)治療高脂肪、果糖和膽固醇(fat, fructose, and cholesterol diet,HFCD)飲食喂養的WT型小鼠4周。發現用藥小鼠高血糖癥狀和胰島素敏感性得到了改善。機制研究顯示,利拉魯肽激活了HFCD-WT小鼠中磷酸肌醇依賴激酶、蛋白激酶B和蛋白激酶Cζ,抑制c-Jun氨基末端激酶的激活;同時下調了固醇調節元件結合蛋白(sterol-regulatory element binding proteins,SREBP)-1c和碳水化合物響應元件結合蛋白的表達(圖1)。提示,GLP-1R激動劑通過激活肝細胞胰島素信號通路和抑制葡萄糖代謝主要調控因子改善了葡萄糖代謝。
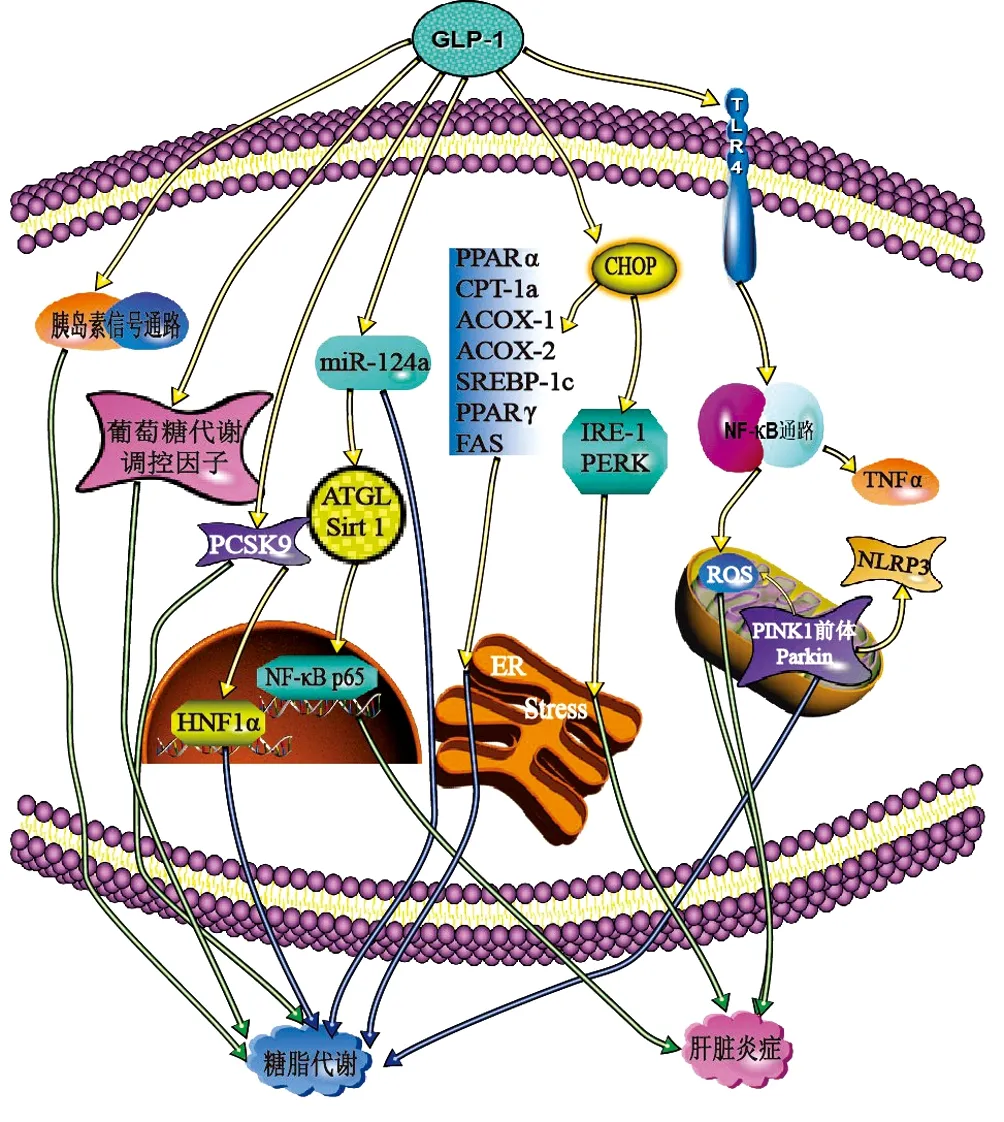
注:PCSK9,前蛋白轉化酶枯草桿菌蛋白酶/kexin9型;HNF1α,肝細胞核因子1;ATGL,脂肪甘油三酯脂肪酶;PPARα,過氧化物酶體增值物激活受體α;CPT-1a,肉堿棕櫚酰轉移酶-1a;ACOX-1,酰基輔酶A氧化酶-1;SREBP-1c,固醇調節元件結合蛋白-1c;FAS,脂肪酸合酶;IRE-1,肌醇需要酶1;PERK, PKR樣內質網激酶;ER,內質網;NLRP3,富含亮氨酸的重復序列含受體的吡啶結構域3。
PCSK9主要由肝臟分泌,是膽固醇穩態的重要調節劑[25]。近年來研究[26-27]表明,PCSK9也與葡萄糖代謝相關。Yang等[28]給7周大的db/db小鼠皮下注射利拉魯肽(200 μg/kg),2次/d,連續7周后,肝細胞內脂滴數量明顯減少,血糖、血脂水平得到改善,并發現血漿PCSK9與空腹血糖、胰島素之間呈正相關,抑制了HNF1α表達。進一步研究表明,利拉魯肽以劑量及時間依賴性方式下調了PCSK9的蛋白質和mRNA水平。并且,用高劑量利拉魯肽處理HepG2細胞24 h后,HNF1α的蛋白質和mRNA的表達均降低。相反,抑制HNF1α的表達時,PCSK9的水平增高(圖1)。結論是在NAFLD中,GLP-1R受體激動劑直接通過PCSK9調節葡萄糖代謝,而其改善脂質代謝的部分作用是通過HNF1α依賴性機制降低PCSK9得以實現。
Fang等[29]給高脂飲食(HFD)的C57雄性小鼠注射利拉魯肽(200 μg/kg)8周后,明顯減輕了HFD-WT小鼠的肝細胞脂肪變性。體外實驗發現,利拉魯肽也降低了棕櫚酸酯(palmitate,PA)培養的HL-7702細胞的細胞內脂質水平。但是,過表達的miR-124a會抵消利拉魯肽減輕細胞內脂質蓄積的功能(圖1)。可知,GLP-1R激動劑可抑制miR-124a,激活自噬以拮抗脂質蓄積。
CCAAT/增強子結合蛋白同源蛋白(homologous protein,CHOP)是內質網應激介導的細胞凋亡的主要轉錄調節因子[30-31]。增加CHOP肝臟表達可以保護肝細胞免脂毒性的影響[32]。Rahman等[24]每天給予HFCD喂養的CHOP基因敲除(CHOP-/-)型和WT型小鼠利拉魯肽(200 μg/kg)或等量生理鹽水治療4周。治療后,2組小鼠的肝臟脂肪變性均有好轉,但WT組小鼠好轉更加明顯,其PPARα,肉堿棕櫚酰轉移酶-1a、酰基輔酶A氧化酶-1和乙酰輔酶A氧化酶-2表達減少;SREBP-1c、PPARγ和脂肪酸合酶的表達水平也明顯下降,說明利拉魯肽可有效抑制WT小鼠新生脂肪的生成和過氧化物酶體的β氧化(圖1)。為進一步研究其作用機制,作者用GLP-1R激動劑Exendin-4和PA處理WT和Chop-/-小鼠原代肝細胞24 h后,比較數據發現Exendin-4可通過CHOP分子抑制新生脂肪的合成。
Yu等[33]用無血清的DMEM或PA聯合脂多糖分別處理人肝癌細胞HepG2細胞,再用不同濃度(0、50、100、200、500 nmol/L)的利拉魯肽作用于HepG2細胞16 h。結果顯示,HepG2細胞的脂肪堆積明顯減輕,并以濃度梯度依賴性方式提高了HepG2細胞活力。他們還發現,利拉魯肽可以增加功能性線粒體含量,改善線粒體共定位,增強線粒體中PTEN誘導蛋白酶1前體和帕金蛋白(Parkin)的表達,并抑制細胞中NLRP3炎性體的活化(圖1)。表明,GLP-1R激動劑可以通過增強線粒體吞噬作用來減少脂質蓄積,限制活性氧的產生,并通過抑制NLRP3炎性小體的激活減少肝細胞的凋亡,以治療NASH。
3.2 對肝臟炎癥反應的抑制作用 ER應激是導致肝臟脂肪變性、氧化應激和細胞凋亡的重要環節,而CHOP蛋白是ER應激介導凋亡的主要轉錄調節器。Rahman等[24]每日給HFCD喂養后出現輕度脂肪性肝炎表現的Chop-/-型和WT型小鼠利拉魯肽(200 μg/kg)或等量生理鹽水治療4周。經治療,2組小鼠肝臟炎癥表現減輕,HFCD-WT小鼠ER應激調節因子PKR樣內質網激酶和肌醇需要酶1活性減弱。但是HFCD-Chop-/-小鼠體內肌醇需要酶1的表達未被抑制(圖1)。可知GLP-1R激動劑還通過CHOP抑制內質網應激以減輕HFCD所誘導的肝損傷,最終改善NASH的癥狀。脂肪甘油三酯脂肪酶(adipose triglyceride lipase, ATGL)是一種肝脂酶,主要通過沉默信息調節因子2相關酶1(silencing information regulator1, Sirt1)激活自噬/脂質吞噬作用來調節肝內脂質分解和脂肪酸氧化[34]。Fang等[29]將HFD干預12周的C57BL/6J雄性小鼠分組后給予腹腔注射利拉魯肽(200 μg/kg)或等量生理鹽水治療8周。經治療后發現,ATGL和Sirt1蛋白水平顯著升高。體外實驗中,利拉魯肽增加了Sirt1的蛋白質水平,降低體外炎癥反應,減少肝細胞核中NF-κB p65的存在。他們還發現,GLP-1可抑制HFD-WT小鼠肝臟和PA處理的人肝細胞中miR-124a的表達,導致ATGL表達增加。各項數據顯示,抑制miR-124a會破壞炎癥細胞因子的表達,促進細胞中ATGL和Sirt1的表達(圖1)。GLP-1R激動劑能有效抑制miR-124a,上調ATGL/Sirt1途徑以減輕NAFLD中的炎癥。
Saad等[35]發現用40 μg/kg(體質量)艾塞那肽治療HFD喂養的Wistar大鼠,能最有效地減輕肝細胞脂肪變性和門靜脈炎癥。研究表明,艾塞那肽降低了肝脂質過氧化物水平,脂肪變性程度,使肝實質再生。同時,顯著下調Toll樣受體4的肝含量,其下游信號通路NF-κB的表達也受到了抑制,其減少了TNFα誘導的細胞凋亡,還調節了線粒體pH值,避免肝細胞發生氧化應激和線粒體功能障礙(圖1)。GLP-1R通過Toll樣受體4抑制NF-κB信號,不僅使促炎基因的表達下調,還改善了線粒體功能,最終減輕了NAFLD炎癥反應。
4 小結
目前,由于NAFLD復雜的發病機制和臨床代謝表現,至今沒有靶向治療藥物。大量臨床和機制研究結果表明,鑒于T2DM與NAFLD的緊密關聯,降糖藥GLP-1R激動劑可能是NAFLD的潛在藥物,其通過激活GLP-1R,提高體內GLP-1水平。GLP-1R激動劑主要在改善胰島素抵抗、調節脂質代謝和抗肝纖維化三個方面發揮治療作用。對GLP-1R激動劑影響NAFLD病程進展的機制研究表明,GLP-1R激動劑可以通過各種機制減少肝細胞凋亡和內質網應激,促進肝臟糖脂代謝,抑制炎癥反應,緩解了肝纖維化進程,預防NAFLD發展。目前,GLP-1R激動劑在NAFLD的臨床研究主要集中在小樣本量的臨床試驗,且對非T2DM的NAFLD臨床療效觀察甚少,以及對GLP-1如何在肝臟中發揮作用的探索不夠深入,故仍需進一步研究,以期為治療NAFLD提供更多依據。
作者貢獻聲明:俞曉菡負責課題設計,資料分析,撰寫論文;王雨露、許笑陽參與收集數據;平鍵、趙長青負責擬定寫作思路,修改論文,指導撰寫文章并最后定稿。

