實(shí)時(shí)熒光定量PCR是檢測(cè)結(jié)直腸癌BRAF V600E突變的理想方法
王叢陽(yáng),郭文文,王家俊,熊 林,金 寧,王 焱
結(jié)直腸癌是消化道常見的惡性腫瘤之一,約有15%發(fā)生BRAF基因突變,而BRAF基因突變約90%為BRAF V600E突變。目前對(duì)BRAF V600E突變的檢測(cè)手段有兩種:免疫組化和分子檢測(cè),分子檢測(cè)目前應(yīng)用較多的是熒光定量PCR技術(shù)。本實(shí)驗(yàn)應(yīng)用免疫組化和實(shí)時(shí)熒光定量PCR(real-time fluorescence quantitative PCR, qRT-PCR)技術(shù)對(duì)結(jié)直腸癌標(biāo)本BRAF V600E突變狀況進(jìn)行檢測(cè),并對(duì)這兩種檢測(cè)方法結(jié)果進(jìn)行分析,以期評(píng)價(jià)這兩種方法在結(jié)直腸癌中的應(yīng)用價(jià)值。
1 材料與方法
1.1 臨床資料收集2018年1月~2019年12月南京醫(yī)科大學(xué)第二附屬醫(yī)院病理科存檔的結(jié)直腸癌標(biāo)本113例,其中男性65例,女性48例,平均年齡69歲。113例結(jié)直腸癌標(biāo)本均同時(shí)行免疫組化和qRT-PCR檢測(cè)BRAF V600E的突變狀況。
1.2 試劑(1)免疫組化試劑:BRAF V600E鼠單克隆抗體(克隆號(hào)VE1)、Opti View DAB免疫組化檢測(cè)試劑盒、蘇木精染液、返藍(lán)染液均購(gòu)自美國(guó)Roche公司。(2)qRT-PCR試劑:核酸提取試劑盒、人類BRAF V600E突變檢測(cè)試劑盒均購(gòu)自廈門艾德生物公司。
1.3 方法
1.3.1免疫組化 手術(shù)標(biāo)本均經(jīng)10%中性福爾馬林固定12~48 h,常規(guī)全自動(dòng)脫水機(jī)脫水,石蠟包埋,經(jīng)全自動(dòng)切片機(jī)3~4 μm厚切片,60 ℃烤片1 h,Ventana全自動(dòng)免疫組化儀上機(jī)檢測(cè)。BRAF V600E檢測(cè)全自動(dòng)免疫組化的設(shè)置流程:脫蠟76 ℃ 16 min;修復(fù)100 ℃ 64 min;一抗孵育37 ℃ 24 min;蘇木精37 ℃ 8 min;返藍(lán)37 ℃ 4 min。全自動(dòng)染色結(jié)束后,將染色后的玻片放在加入洗滌劑的水中清洗,以去除玻片上的油膜,常規(guī)脫水、透明、封片,顯微鏡下觀察。結(jié)果判讀:BRAF V600E蛋白陽(yáng)性細(xì)胞胞質(zhì)呈棕黃色。
1.3.2qRT-PCR (1)DNA提取:經(jīng)顯微鏡下觀察,挑選腫瘤細(xì)胞占比>50%的組織蠟塊,刮取6~8 μm厚組織4~5片至離心管中,二甲苯脫蠟后按照核酸提取試劑盒說(shuō)明書提取基因組DNA,提取的DNA經(jīng)紫外分光光度計(jì)測(cè)定其濃度和純度,以確保OD260/OD280在1.8~2.0之間。檢測(cè)步驟:嚴(yán)格依據(jù)試劑盒要求進(jìn)行上樣檢測(cè),DNA的上樣量為10 ng,每次檢測(cè)均設(shè)置陽(yáng)性質(zhì)控品和陰性對(duì)照,陽(yáng)性質(zhì)控品為BRAF V600E突變合成模板,陰性對(duì)照為純水。PCR的過(guò)程設(shè)置為3個(gè)階段:95 ℃ 5 min,1個(gè)循環(huán);95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s,15個(gè)循環(huán);93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s,31個(gè)循環(huán),在第三個(gè)階段60 ℃時(shí)開始收集突變FAM信號(hào)和內(nèi)控HEX信號(hào)。突變判讀:首先觀察樣品的內(nèi)控HEX信號(hào)應(yīng)有明顯的擴(kuò)增曲線,且Ct值在13~21之間,以確定PCR擴(kuò)增反應(yīng)成功。如突變FAM信號(hào)無(wú)明顯的擴(kuò)增曲線或其Ct值≥28,則判讀為BRAF V600E突變陰性;如突變FAM信號(hào)Ct值<28,則判讀為BRAF V600E突變陽(yáng)性。
1.3.3測(cè)序 將提取的DNA瓊脂糖凝膠電泳割膠純化后進(jìn)行測(cè)序,測(cè)序用上游引物序列5′-CTT CATAATGCTTGCTCTG-3′,下游引物序列5′-GTA ACTCAGCAGCATCTCAG-3′。
2 結(jié)果
2.1 結(jié)直腸癌中BRAF V600E的表達(dá)免疫組化結(jié)果顯示,113例結(jié)直腸癌中19例為BRAF V600E陽(yáng)性,陽(yáng)性細(xì)胞胞質(zhì)呈不同程度的棕黃色著色(圖1)。
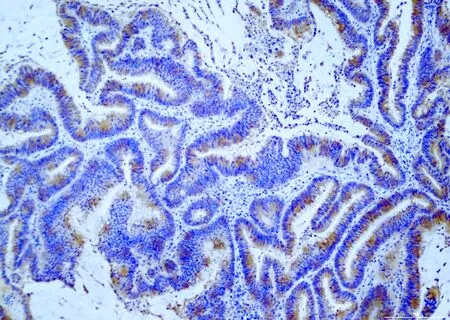
圖1 BRAF V600E在結(jié)直腸癌中呈陽(yáng)性,EnVision法
2.2 結(jié)直腸癌中BRAF V600E突變情況qRT-PCR檢測(cè)結(jié)果顯示,113例結(jié)直腸癌中BRAF V600E突變陽(yáng)性7例,突變樣本FAM信號(hào)Ct值均<28(圖2)。
2.3 測(cè)序結(jié)果檢測(cè)chr7:140753213-140753458共246 bp,雙向測(cè)序結(jié)果經(jīng)軟件分析和人工審查確認(rèn)突變情況(圖3),突變陽(yáng)性者7例。
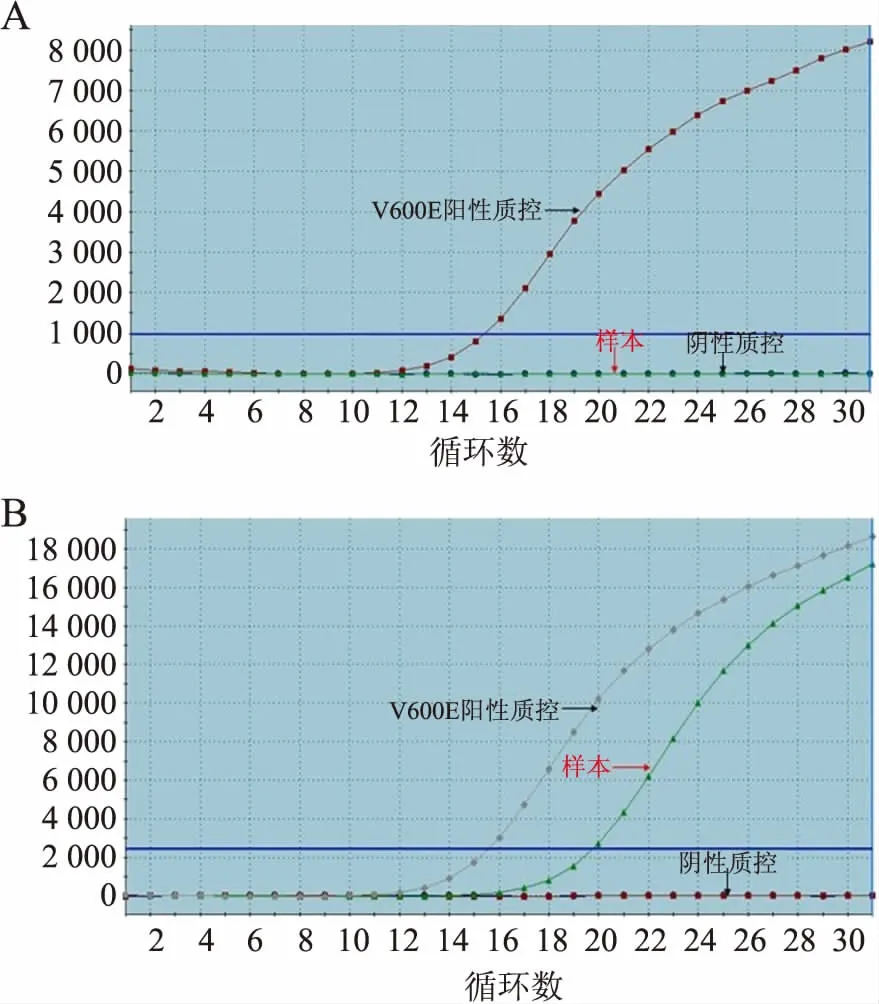
圖2 qRT-PCR檢測(cè):A.BRAF V600E突變陰性擴(kuò)增;B.BRAF V600E突變陽(yáng)性擴(kuò)增
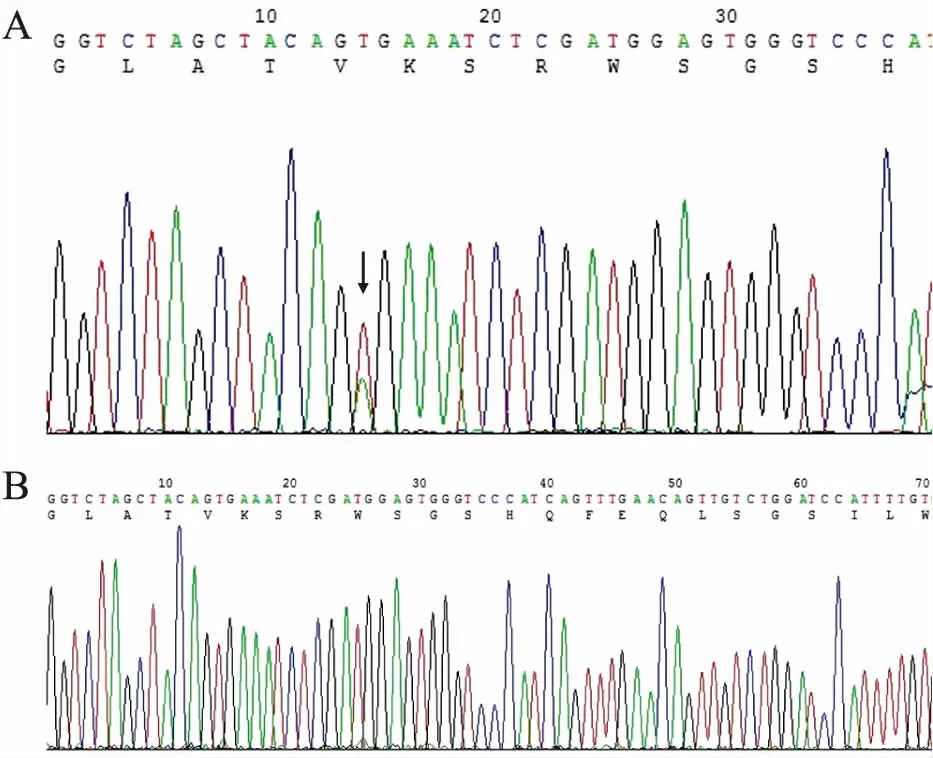
圖3 結(jié)直腸癌BRAF V600E的測(cè)序結(jié)果:A.BRAF V600E突變陽(yáng)性;B.BRAF V600E突變陰性
2.4 免疫組化和qRT-PCR結(jié)果113例結(jié)直腸癌標(biāo)本同時(shí)應(yīng)用免疫組化和qRT-PCR技術(shù)進(jìn)行BRAF V600E檢測(cè),其中免疫組化檢測(cè)BRAF V600E蛋白表達(dá)結(jié)果為不確定12例,陰性82例,陽(yáng)性19例。不確定診斷例數(shù)占10.62%(12/113),其中1例經(jīng)qRT-PCR檢測(cè)為BRAF V600E突變,11例檢測(cè)為未突變;免疫組化陰性檢出率為72.57%(82/113),免疫組化陽(yáng)性檢出率為16.81%(19/113),其中有6例陽(yáng)性病例經(jīng)qRT-PCR檢測(cè)為BRAF V600E突變,13例檢測(cè)為未突變。在113例結(jié)直腸癌標(biāo)本中,qRT-PCR檢測(cè)BRAF V600E突變合計(jì)7例,未突變106例,無(wú)不確定例數(shù)。qRT-PCR陰性檢出率為93.8%(106/113),陽(yáng)性檢出率為6.19%(7/113)(表1)。
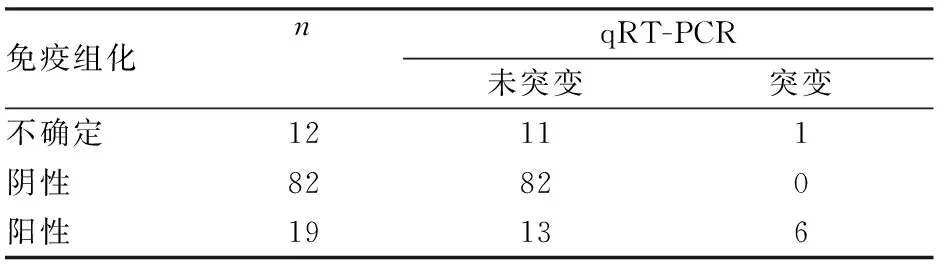
表1 免疫組化和qRT-PCR檢測(cè)113例結(jié)直腸癌標(biāo)本BRAF V600E結(jié)果
2.5 免疫組化和qRT-PCR檢測(cè)結(jié)果比較以測(cè)序?yàn)榻饦?biāo)準(zhǔn),對(duì)113例結(jié)直腸癌標(biāo)本同時(shí)進(jìn)行測(cè)序,免疫組化檢測(cè)12例不確定診斷病例中,經(jīng)測(cè)序檢測(cè)BRAF V600E突變1例,未突變11例,測(cè)序結(jié)果與qRT-PCR結(jié)果一致;免疫組化檢測(cè)82例陰性標(biāo)本中,經(jīng)測(cè)序檢測(cè)結(jié)果均為未突變,與qRT-PCR結(jié)果一致;免疫組化檢測(cè)19例陽(yáng)性標(biāo)本中,經(jīng)測(cè)序檢測(cè)13例為BRAF V600E未突變,6例為BRAF V600E突變,測(cè)序結(jié)果與qRT-PCR結(jié)果一致。qRT-PCR檢測(cè)同測(cè)序檢測(cè)結(jié)果的一致性為100%,免疫組化陰性結(jié)果同qRT-PCR、測(cè)序結(jié)果的一致性為100%,免疫組化陽(yáng)性結(jié)果同qRT-PCR、測(cè)序結(jié)果的一致性為31.57%(6/19)(表2)。

表2 免疫組化和qRT-PCR檢測(cè)BRAF V600E結(jié)果比較
2.6 免疫組化、qRT-PCR檢測(cè)BRAF V600E應(yīng)用價(jià)值比較以測(cè)序?yàn)榻饦?biāo)準(zhǔn),對(duì)113例結(jié)直腸癌標(biāo)本的免疫組化BRAF V600E蛋白表達(dá)結(jié)果進(jìn)行統(tǒng)計(jì),免疫組化的靈敏度、特異度、陽(yáng)性預(yù)測(cè)值、陰性預(yù)測(cè)值、假陰性率、假陽(yáng)性率、準(zhǔn)確率分別是100%、86.32%、31.58%、100%、0、13.68%、87.13%;qRT-PCR檢測(cè)的靈敏度、特異度、陽(yáng)性預(yù)測(cè)值、陰性預(yù)測(cè)值、假陰性率、假陽(yáng)性率、準(zhǔn)確率分別是100%、100%、100%、100%、0、0、100%(表3)。采用配對(duì)資料χ2檢驗(yàn)比較免疫組化和qRT-PCR兩種方法檢測(cè)結(jié)直腸癌標(biāo)本BRAF V600E突變陰陽(yáng)性的差別,兩者差異有顯著性(χ2=22.17,P<0.000 01,表4)。

表3 以測(cè)序?yàn)榻饦?biāo)準(zhǔn),免疫組化和qRT-PCR檢測(cè)BRAF V600E應(yīng)用價(jià)值比較

表4 免疫組化和qRT-PCR檢測(cè)101例結(jié)直腸癌標(biāo)本BRAF V600E突變陰陽(yáng)性結(jié)果
3 討論
BRAF V600E突變發(fā)生于第600號(hào)密碼子,位于第1 799位的胸腺嘧啶突變?yōu)橄汆堰?T突變?yōu)锳),致使纈氨酸由谷氨酸替代(V600E),該突變通過(guò)激活MAPK信號(hào)通路,對(duì)腫瘤的發(fā)生、發(fā)展有重要影響[1]。有研究顯示,BRAF V600E突變型結(jié)直腸癌患者可以從一線強(qiáng)化療聯(lián)合貝伐珠單抗中獲益[2-3],應(yīng)用BRAF抑制劑可提高BRAF V600E突變型結(jié)直腸癌患者對(duì)抗表皮生長(zhǎng)因子受體(epithelial growth factor receptor, EGFR)單克隆抗體的敏感性[4]。有學(xué)者通過(guò)RNA干擾技術(shù)抑制BRAF基因,發(fā)現(xiàn)BRAF V600E突變型結(jié)直腸癌患者其癌細(xì)胞生長(zhǎng)明顯被抑制,腫瘤細(xì)胞的凋亡也增加[5],這從另一方面證明除外EGFR抑制劑,BRAF V600E突變型是分子靶向藥物更好的治療對(duì)象,突變型相對(duì)于野生型而言,可能對(duì)靶向藥物治療有更高的敏感性[5-7]。另外有文獻(xiàn)報(bào)道BRAF V600E突變與微衛(wèi)星不穩(wěn)定(microsatellite instability, MSI)密切相關(guān),因此,BRAF V600E突變型結(jié)直腸癌患者可從免疫抑制治療中獲益[8-9]。目前BRAF V600E的突變狀態(tài)是鑒別Lynch綜合征最有效的手段,BRAF V600E突變可排除Lynch綜合征,提示為散發(fā)型結(jié)直腸癌,無(wú)BRAF V600E突變則提示Lynch綜合征的可能[10-11]。有研究表明BRAF V600E突變與預(yù)后不良明顯相關(guān)(P<0.001),提示BRAF V600E突變結(jié)直腸癌患者有更低的總體生存期[12-13]。了解BRAF V600E的突變狀態(tài),有利于對(duì)結(jié)直腸癌患者進(jìn)行用藥指導(dǎo)、鑒別診斷和預(yù)后管理。
本組中113例結(jié)直腸癌標(biāo)本同時(shí)行免疫組化和qRT-PCR檢測(cè)BRAF V600E突變,其中免疫組化陰性檢出率為72.57%,明顯低于qRT-PCR(93.8%)。免疫組化檢測(cè)陽(yáng)性率為16.81%,qRT-PCR檢測(cè)陽(yáng)性率為6.19%,這與以往報(bào)道結(jié)果較一致(5%~15%)[14-15]。本組免疫組化檢測(cè)的19例陽(yáng)性標(biāo)本中,經(jīng)測(cè)序證實(shí),僅6例存在BRAF V600E突變,其余13例為假陽(yáng)性;而qRT-PCR檢測(cè)陽(yáng)性病例,經(jīng)測(cè)序證實(shí)均為BRAF V600E突變。與qRT-PCR檢測(cè)相比,免疫組化檢測(cè)存在較高的假陽(yáng)性。另外,免疫組化應(yīng)用于BRAF V600E檢測(cè)在診斷中存在較高的不確定病例(10.62%),而應(yīng)用qRT-PCR無(wú)不確定診斷病例。通過(guò)本實(shí)驗(yàn)結(jié)果對(duì)比分析,應(yīng)用免疫組化和qRT-PCR這兩種技術(shù)檢測(cè)BRAF V600E,qRT-PCR較免疫組化在特異度、陽(yáng)性預(yù)測(cè)值、準(zhǔn)確率方面存在明顯的優(yōu)勢(shì),且qRT-PCR檢測(cè)假陽(yáng)性率也明顯低于免疫組化。經(jīng)過(guò)配對(duì)χ2檢驗(yàn),兩種檢測(cè)方法差異有顯著性(P<0.000 01)。但由于本組病例數(shù)的局限,所取得的數(shù)據(jù)有待進(jìn)一步完善,結(jié)果還待增加樣本例數(shù)進(jìn)一步證明。
qRT-PCR技術(shù)是一種在PCR反應(yīng)體系中加入熒光基團(tuán),通過(guò)熒光信號(hào)的累積實(shí)時(shí)監(jiān)測(cè)整個(gè)PCR進(jìn)程,最后通過(guò)標(biāo)準(zhǔn)曲線對(duì)未知模板進(jìn)行定量分析的方法。每次產(chǎn)物擴(kuò)增都有對(duì)應(yīng)的熒光信號(hào)產(chǎn)生,兩者形成線性關(guān)系,通過(guò)熒光信號(hào)的采集可直接對(duì)產(chǎn)物進(jìn)行定量,因此,此方法準(zhǔn)確性高,敏感度達(dá)1%[16-17]。另外,qRT-PCR是利用靶向引物和熒光探針進(jìn)行雙重控制,且全封閉單管擴(kuò)增,無(wú)擴(kuò)增后的處理操作,降低了擴(kuò)增產(chǎn)物的污染,從而有效降低假陽(yáng)性的發(fā)生。同時(shí)檢測(cè)設(shè)立了陰性、陽(yáng)性的內(nèi)外對(duì)照,可有效避免假陰性、假陽(yáng)性現(xiàn)象[18-19]。但qRT-PCR技術(shù)對(duì)操作人員技術(shù)要求較高,需要經(jīng)過(guò)專門的PCR培訓(xùn)及擁有相關(guān)的分子生物學(xué)知識(shí),實(shí)驗(yàn)條件也更嚴(yán)格,需要在標(biāo)準(zhǔn)的PCR實(shí)驗(yàn)室才能進(jìn)行相關(guān)檢測(cè)。目前利用qRT-PCR技術(shù)檢測(cè)BRAF V600E突變?cè)诖筢t(yī)院實(shí)施較普遍,而基層醫(yī)院因?yàn)闂l件限制,對(duì)BRAF V600E的檢測(cè)多采用免疫組化技術(shù)。
免疫組化檢測(cè)結(jié)直腸癌中BRAF V600E的表達(dá),其敏感度、特異度、陰性預(yù)測(cè)值、假陰性率分別為100%、86.32%、100%、0,免疫組化的實(shí)驗(yàn)條件要求相對(duì)簡(jiǎn)單,省時(shí),而且價(jià)格相對(duì)低廉,對(duì)樣本的要求相比較不嚴(yán)格,操作也較容易,對(duì)于一般條件的醫(yī)院如果做好質(zhì)控,可以作為BRAF V600E突變狀態(tài)的初篩。但由于腫瘤的異質(zhì)性,在腫瘤內(nèi)部及同一患者不同部位的腫瘤其蛋白表達(dá)存在差異,還存在非BRAF V600E蛋白的表達(dá),BRAF基因其他部位的突變,抗體本身含有某些成分與人體發(fā)生的交叉反應(yīng),以及免疫組化操作過(guò)程中抗體濃度過(guò)高、過(guò)度修復(fù)、顯色時(shí)間過(guò)長(zhǎng)、漂洗不嚴(yán)格等因素,均可導(dǎo)致假陽(yáng)性的發(fā)生。另外,有些標(biāo)本免疫組化結(jié)果介于陰性和陽(yáng)性之間,這可能與標(biāo)本自身含有BRAF V600E蛋白水平較低,或抗體靈敏度低,以及免疫組化操作過(guò)程不規(guī)范有關(guān),導(dǎo)致判讀不能確定。因此,免疫組化由于自身技術(shù)的限制和操作原因,導(dǎo)致在結(jié)直腸癌BRAF V600E檢測(cè)中假陽(yáng)性和不確定病例較高。經(jīng)本組實(shí)驗(yàn)比較發(fā)現(xiàn),qRT-PCR技術(shù)發(fā)生假陽(yáng)性現(xiàn)象明顯低于免疫組化,且其特異性和準(zhǔn)確率明顯高于免疫組化,qRT-PCR技術(shù)檢測(cè)結(jié)直腸癌BRAF V600E基因突變優(yōu)于免疫組化。因此qRT-PCR技術(shù)是目前結(jié)直腸癌標(biāo)本檢測(cè)BRAF V600E突變的理想方法。

