PUMA對高脂飲食小鼠LPS誘導的急性腎損傷和凋亡的影響
廖豪峰?龐夢雅?張政?葛緬
【摘要】 目的 探討p53上調凋亡調控因子(PUMA)是否參與調節高脂飲食(HFD)所致糖尿病小鼠脂多糖(LPS)誘導的急性腎損傷。方法 將24只小鼠隨機均分為普食(Chow)組與HFD組,分別以普通飼料或者高脂飲食喂養12周,飲食干預結束后分別再分為LPS組與Con組,LPS組小鼠腹腔注射LPS 10 mg/kg制備膿毒癥急性腎損傷模型,Con組給予等體積磷酸鹽緩沖液腹腔注射,24 h后檢測小鼠腎病理損傷、血清肌酐、血尿素氮、PUMA蛋白和Caspase-3蛋白表達水平以及腎臟凋亡情況。結果 與Chow組相比,HFD組小鼠體質量增加、隨機血糖升高(P均< 0.05),產生胰島素抵抗。與Con組相比,LPS組血清肌酐和血尿素氮升高(P均< 0.05),出現腎上皮細胞形態異常、上皮細胞壞死和炎癥浸潤等病理損傷,原位末端轉移酶標記技術染色顯示腎組織出現大量凋亡細胞,PUMA蛋白水平及Caspase-3蛋白表達增高(P均< 0.05)。與Chow+LPS組相比,HFD+LPS組上述表現更為明顯(P均< 0.05)。結論 HFD通過上調PUMA表達,促進了LPS誘導的小鼠急性腎損傷以及凋亡。
【關鍵詞】 p53上調凋亡調控因子;高脂飲食;糖尿病;脂多糖;急性腎損傷
Effect of PUMA on LPS-induced acute kidney injury and apoptosis in high-fat diet-fed mice Liao Haofeng, Pang Mengya, Zhang Zheng, Ge Mian. Department of Anesthesiology, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Ge Mian, E-mail: gemiansums@ 163. com
【Abstract】 Objective To investigate whether p53 upregulated modulator of apoptosis (PUMA) participates in regulating the acute kidney injury induced by lipopolysaccharide (LPS) in high-fat diet (HFD)-fed mice. Methods Twenty-four mice were randomly divided into the Chow and HFD groups, and fed with regular chow or HFD for 12 weeks, respectively. Subsequently, the animals were further divided into the control and LPS groups. Mice in the LPS group were injected with LPS 10 mg/kg intraperitoneally to establish the mouse models of acute kidney injury, whereas an equivalent amount of PBS was administered in the control group. The expression levels of serum creatinine, urea nitrogen, PUMA protein and Caspase-3 protein were detected and the pathological kidney injury and apoptosis were observed 24 h later. Results Compared with the Chow group, mice in the HFD group had significantly higher body weight (P < 0.05), elevated random blood glucose (P < 0.05) and insulin resistance. Compared with the control group, the serum levels of creatinine and urea nitrogen of mice in the LPS group were significantly increased (both P < 0.05), and presented with obvious pathological damages, such as morphological abnormality of renal epithelial cells, epithelial cell necrosis and inflammatory infiltration. Meanwhile, in situ terminal deoxynucleotidyl transferase revealed a large quantity of apoptotic cells and higher PUMA protein and Caspase-3 protein levels were observed in the renal tissues of mice in the LPS group (both P < 0.05). Compared with the Chow+LPS group, the findings above in the HFD + LPS group were more pronounced (all P < 0.05). Conclusion HFD can aggravate LPS-induced acute kidney injury and apoptosis probably by up-regulating the expression level of PUMA.
【Key words】 p53 upregulated modulator of apoptosis(PUMA);High-fat diet;Diabetes mellitus;
Lipopolysaccharide;Acute kidney injury
近年來,由于超重和肥胖率的上升以及體育活動的減少,我國的2型糖尿病發病率迅速上升,已經成為公共衛生的主要挑戰[1-2]。多項研究表明,肥胖以及2型糖尿病患者在臨床及圍術期中發生感染性并發癥的風險更高,這可能導致膿毒癥發生率增高以及ICU膿毒癥相關患者的病死率增加[3-5]。膿毒癥是宿主對感染的反應失調導致的危及生命的器官功能障礙[6]。腎臟是膿毒癥發展過程中最容易受損的器官[4-5, 7]。膿毒癥相關急性腎損傷(S-AKI)在ICU較為常見,同時AKI會導致膿毒癥患者病死率增高。與ICU其他損傷相比,S-AKI病死率更高[8-9]。此外,有研究表明糖尿病是術后感染、S-AKI的獨立危險因素[10-11]。因此,關注糖尿病患者的S-AKI成為急需解決的臨床問題,然而目前研究并不多。
既往研究顯示,多種因素參與了S-AKI的發病機制,比如炎癥損傷、氧化應激、凋亡等,其中凋亡被證明起了重要作用[12-13]。p53上調凋亡調控因子(PUMA)是近年發現的一種具有促凋亡作用的p53靶基因,既往研究發現其與缺血再灌注、腫瘤及膿毒血癥等病理生理過程有密切聯系[14-15]。然而PUMA與2型糖尿病關系研究較少,其是否參與糖尿病患者S-AKI的發生發展目前仍未清楚。本實驗旨在探討PUMA誘導的凋亡與糖尿病膿毒癥小鼠AKI的聯系,從而進一步尋找糖尿病患者S-AKI的防治方法。
材料與方法
一、材 料
24只6~8周齡雄性SPF級C57BL/6小鼠購自南京大學模式動物研究中心,體質量19 ~ 23 g,飼養于中山大學附屬第三醫院實驗動物中心,飼養期間保持動物房室溫25℃、相對濕度60%及12 h人工日光燈管照射,小鼠自由飲水和進食。普通飼料及高脂飼料分別購自中山大學實驗動物中心及美國Research Diets公司,Optium Xceed 血糖儀購自美國Abbott Diabetes Care公司,4%甲醛緩沖溶液購自美國Sigma-Aldrich公司,蘇木素染色液及伊紅染液購自武漢塞維爾公司,蛋白酶抑制劑、乙二胺四乙酸、RIPA 蛋白裂解液、BCA 蛋白濃度測定試劑盒購自美國 Thermo Scientific 公司,PUMA及Caspase-3抗體購自英國Abcam公司,原位末端轉移酶標記技術(TUNEL)試劑盒購自美國Roche公司,DAB顯色劑購自丹麥DAKO公司。本動物實驗經中山大學動物倫理委員會批準(批準號:IACUC-F3-161002)。
二、方 法
1. 模型制備與造模
待小鼠適應環境1周后,采用隨機數表法分成普食(Chow)組和高脂飲食(HFD)組,每組各12只小鼠,分別給予普通嚙齒動物飼料(熱量百分比為:70%碳水化合物、10%脂肪、20%蛋白質)和高脂肪飼料(熱量百分比為:20%碳水化合物、60%脂肪、20%蛋白質)喂養。每2周評估體質量和每日食物攝入量,飲食干預12周后進行OGTT和胰島素耐受性試驗(IPITT),利用GraphPad Prism 8軟件計算OGTT及IPITT曲線的曲線下面積(AUC)。飲食干預結束后,分別再分為對照組(Con組)和LPS干預組(LPS組)。LPS組給予LPS 10 mg/kg腹腔注射制備小鼠S-AKI模型,Con組給予等體積磷酸鹽緩沖液(PBS)腹腔注射。注射后24 h給予安樂死,通過眼球取血和收集腎組織標本進行進一步檢測。
2. HE染色
取小鼠新鮮腎臟組織去除包膜,長軸方向對切。經4%多聚甲醛固定過夜,石蠟包埋切片。常規行HE染色,放大200倍,光學顯微鏡下觀察并拍攝圖像。
3. 蛋白免疫印跡法
取腎臟組織30 mg于200 μl預冷含蛋白酶抑制劑的RIPA裂解液中提取總蛋白,BCA法測定蛋白濃度。取40 μg樣品蛋白于10%分離膠和5%濃縮膠行十二烷基硫酸鈉-聚丙烯酰氨凝膠電泳(SDS-PAGE)、轉膜、脫脂奶粉封閉1 h,加入1∶200兔抗PUMA或者Caspase-3抗體4℃過夜孵育。次日TBS、TBST交替洗膜后加入1∶10 000 紅外熒光染料標記的二抗,室溫孵育1 h。TBS、TBST 交替洗膜,Odyssey雙色紅外激光成像系統曝光,Image-Pro Plus軟件灰度分析,用目的蛋白灰度值/內參灰度值表示目的蛋白相對表達水平。
4. TUNEL檢測及凋亡指數計算
取石蠟包埋的小鼠腎組織切片,根據Roche公司的TACS TdT原位細胞凋亡檢測試劑盒產品說明書進行操作,檢測腎臟組織凋亡細胞,DAB顯色后細胞核呈棕褐色為陽性反應。每張切片隨機選取20個視野(放大400倍),于光學顯微鏡下觀察并采集圖像計數,利用Image J軟件定量陽性標記的細胞;計算陽性細胞數和腎臟細胞總數,凋亡指數=陽性細胞數/腎臟細胞總數×100%。
三、統計學處理
使用SPSS 22.0分析所有數據。使用Kolmogorov- Smirnov檢驗數據的正態性,Levene檢驗用于檢驗方差齊性。符合正態分布的計量資料以表示,2組間比較用獨立樣本t檢驗,重復測量資料使用重復測量方差分析分析交互效應、主效應或單獨效應;析因設計資料使用析因設計方差分析。α= 0.05。
結 果
一、12周HFD飲食對小鼠體質量、血糖和胰島素的影響
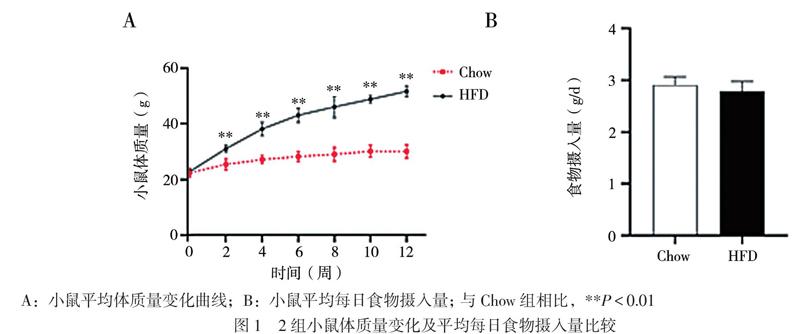
1. 12周HFD飲食對小鼠體質量的影響
小鼠平均體質量變化曲線提示飲食干預與時間之間存在交互作用(F = 102.885,P < 0.001)。與Chow組小鼠相比,HFD組的小鼠在飲食干預2周開始出現體質量增加(t2周 = 6.275,P < 0.001;t4周= 10.200,P < 0.001;t6周 = 12.560,P < 0.001;t8周 = 9.846,P < 0.001;t10周 = 19.830,P < 0.001;t12周 = 18.370,P < 0.001),該現象這一直持續到12周,見圖1A。各組小鼠平均每日食物攝入量在組間比較差異無統計學意義(t = 1.304,P = 0.217),見圖1B。
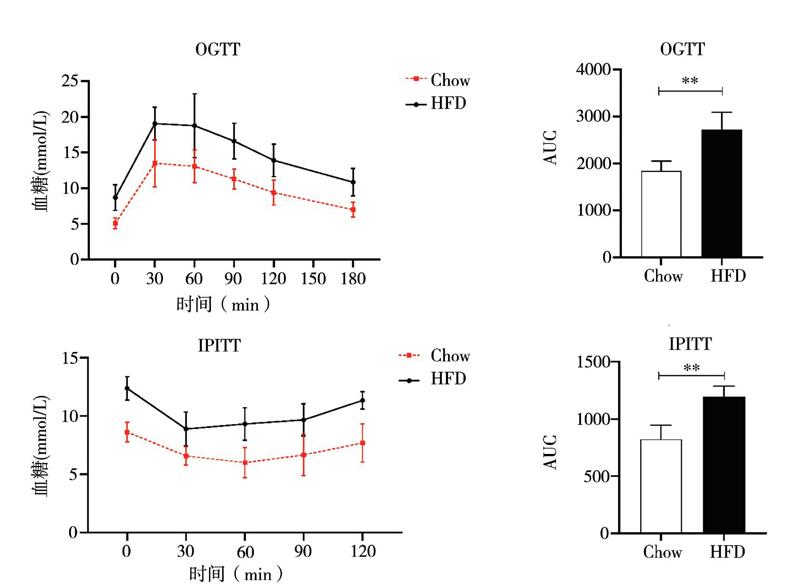
2. 12周HFD對小鼠血糖和胰島素的影響
OGTT與時間效應之間不存在交互作用(F = 0.803,P = 0.552);時間主效應(F = 57.831,P < 0.001)和處理主效應(F = 28.829,P < 0.001)有統計學意義。HFD組小鼠在測試的各個時間點血糖水平均高于Chow組,同時AUC升高[(2714±378)mm2 vs.(1844±210)mm2,t = 5.319,P = 0.002)],表明HFD飲食干預后小鼠的葡萄糖耐受性變差,見圖2A、B。此外,IPITT與時間之間不存在交互作用(F = 1.060,P = 0.386);時間主效應(F = 19.690,P < 0.001)和處理主效應(F = 47.536, P < 0.001)有統計學意義; HFD組小鼠在測試的各個時間點血糖水平均高于Chow組, HFD組小鼠AUC也較Chow組增加[(1193±94)mm2 vs.(823±122)mm2,t = 6.335,P < 0.001],表明HFD飲食干預后小鼠對胰島素治療的反應性變差,見圖2C、D。上述數據表明HFD組小鼠符合2型糖尿病的特征。
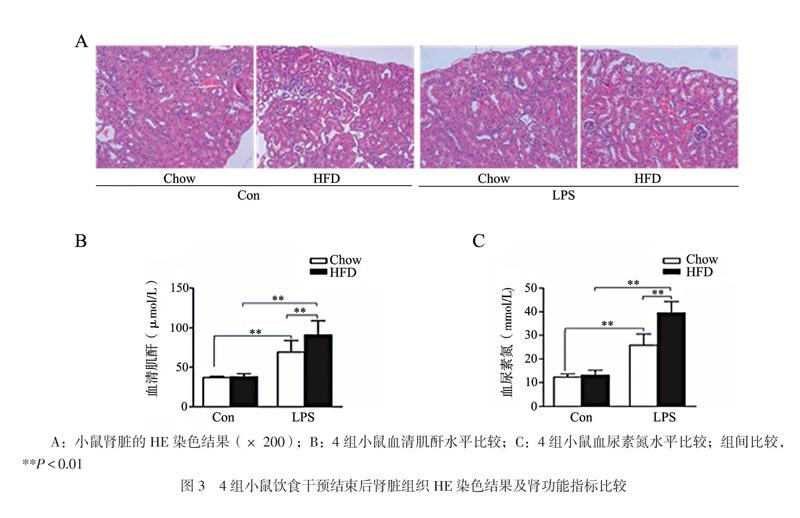
二、HFD對LPS導致AKI的影響
HE染色顯示,Chow+Con組小鼠腎小球及腎小管結構正常;HFD+Con組可見腎小管區域空泡,腎小球囊腔擴大;經LPS腹腔注射的Chow+LPS組與HFD+LPS組小鼠可見腎上皮細胞變平失去正常形態,上皮細胞壞死和炎癥浸潤,部分腎上皮細胞核染色部分甚至完全缺失,同時腎小管腔出現中重度膨脹。其中,HFD飲食干預組小鼠腎病理損傷更為明顯,見圖3A。析因設計方差分析結果表明,飲食因素與LPS處理間的交互作用無統計學意義(血清肌酐F = 1.534,P = 0.244;血尿素氮F = 3.038,P = 0.112);與各自對照組相比,LPS干預后的小鼠血清肌酐和血尿素氮均升高(LPS因素的主效應檢驗P均< 0.001)。HFD+LPS組血清肌酐和血尿素氮均高于Chow+LPS組(血清肌酐t = 5.430,P = 0.006;血尿素氮t = 4.881,P = 0.003),見圖3B、C。上述提示LPS對于小鼠腎組織結構及腎功能有不同程度的損傷,在HFD組損傷表現得更為明顯。
三、HFD對LPS干預后腎組織PUMA蛋白水平的影響
使用蛋白免疫印跡法研究了不同組小鼠間PUMA表達水平存在差異。析因設計方差分析結果表明,飲食因素與LPS處理間的交互作用有統計學意義(F = 7.594,P = 0.025),與對照組相比,LPS干預后的小鼠腎臟PUMA蛋白表達均升高(飲食因素固定時,LPS單獨效應P < 0.001);而與Chow+LPS組相比,HFD會明顯加劇LPS導致的PUMA蛋白水平增加(LPS干預時,HFD的單獨效應P < 0.001),見圖4。
四、HFD加劇LPS導致的細胞凋亡
TUNEL染色顯示,Chow組小鼠腎臟組織未見細胞凋亡;而LPS處理后小鼠腎組織尤其是腎小管部分可見大量凋亡細胞。析因設計方差分析結果表明,飲食因素與LPS處理間的交互作用有統計學意義(F = 19.779,P < 0.001)并且HFD+LPS組小鼠較Chow+LPS 組凋亡細胞數量增加(HFD的單獨效應P < 0.001),見圖5。
五、HFD加劇LPS導致的腎組織Caspase-3蛋白水平增加
析因設計方差分析結果表明,飲食因素與LPS處理間的交互作用有統計學意義(F = 13.644,P = 0.006)。與Chow+Con組相比,LPS干預后的Chow+LPS組小鼠腎組織Caspase-3表達水平升高(LPS的單獨效應P < 0.001);與Chow+LPS組相比,HFD+LPS組小鼠腎組織Caspase-3表達水平亦升高(HFD的單獨效應P < 0.001),見圖6。
討 論
肥胖與糖尿病的預防和管理將成為我國面臨的一項重大挑戰,二者關系密切并且會增加患者圍術期感染性并發癥的風險以及病死率。本研究通過HFD喂養C57BL/6J雄性小鼠構建2型糖尿病模型,隨后給予LPS干預誘導S-AK,初步探討HFD對LPS誘導的小鼠S-AKI的影響[16-18]。結果顯示,經LPS干預的小鼠均表現出AKI癥狀,而HFD喂養的小鼠腎組織損傷比普通飼料喂養的小鼠更為嚴重,表現為腎臟結構破壞、血清肌酐和血尿素氮升高,同時腎小管及其他腎組織細胞凋亡數量增多、PUMA和Caspase-3表達升高。
目前肥胖與糖尿病已成為我國的重要衛生問題。一項全國調查表明,2010年中國20 ~ 59歲成年人的超重(23.0 kg/m2≤ BMI < 27.5 kg/m2)患病率高達40.7%,而2014年肥胖(BMI ≥27.5 kg/m2)患病率為12.9%[19]。另一項于2015至2017年由滕衛平教授團隊進行的全國性橫斷面研究顯示,中國成年居民的糖尿病患病率為12.8%,糖尿病前期患病率高達35.2%[1]。飲食引起的肥胖正是代謝并發癥(如胰島素抵抗、2型糖尿病和心血管疾病)的主要危險因素[20]。此外,研究表明肥胖和2型糖尿病不僅會增加患者感染的風險,還是S-AKI的獨立危險因素,但目前的治療手段仍非常有限[3-5]。高脂喂養會導致小鼠肥胖,由于胰島的補償不足,進一步導致高胰島素血癥和葡萄糖穩態改變[16]。因此,該模型被認為能準確地模擬人類生理狀態[21]。本研究顯示,12周HFD喂養的小鼠體質量較普通飼料喂養小鼠增長更快且胰島素耐量、葡萄糖耐量降低,表明在C57BL/6小鼠上成功構建了HFD誘導的糖尿病模型并可將其作為合適的模型進行研究。
LPS作為革蘭陰性細菌的外膜成分,是敗血癥的主要刺激因子,可通過刺激細胞釋放大量的炎癥細胞因子和自由基誘發炎癥級聯反應[22]。在S-AKI 的發病機制中起重要作用[23]。腎臟是由LPS引起膿毒癥中最脆弱的靶器官之一,高達60%的膿毒癥患者患有AKI[7]。同時Hsu等[11]證實糖尿病是S-AKI的獨立危險因素。既往研究表明,腎功能迅速下降為AKI臨床特征,包括腎小球濾過率下降、尿量減少以及血清肌酐水平升高等[24]。本研究結果與其一致,LPS干預后小鼠的血清肌酐和血尿素氮水平明顯升高,腎病理損傷加重,而且HFD喂養小鼠腎損傷更為明顯,證明2型糖尿病會加重S-AKI。
[9] Zhi DY, Lin J, Zhuang HZ, Dong L, Ji XJ, Guo DC, Yang XW, Liu S, Yue Z, Yu SJ, Duan ML. Acute kidney injury in critically ill patients with sepsis: clinical characteristics and outcomes. J Invest Surg, 2019, 32(8):689-696.
[10] Plaeke P, De Man JG, Coenen S, Jorens PG, De Winter BY, Hubens G. Clinical-and surgery-specific risk factors for post-operative sepsis: a systematic review and meta-analysis of over 30 million patients. Surg Today, 2020, 50(5):427-439.
[11] Hsu YC, Hsu CW. Septic acute kidney injury patients in emergency department: the risk factors and its correlation to serum lactate. Am J Emerg Med, 2019, 37(2):204-208.
[12] Agarwal A, Dong Z, Harris R, Murray P, Parikh SM, Rosner MH, Kellum JA, Ronco C; Acute Dialysis Quality Initiative XIII Working Group. Cellular and molecular mechanisms of AKI. J Am Soc Nephrol, 2016, 27(5):1288-1299.
[13] Du J, Jiang S, Hu Z, Tang S, Sun Y, He J, Li Z, Yi B, Wang J, Zhang H, Li YC. Vitamin D receptor activation protects against lipopolysaccharide-induced acute kidney injury through suppression of tubular cell apoptosis. Am J Physiol Renal Physiol, 2019, 316(5):F1068-F1077.
[14] Yang J, Zhao X, Tang M, Li L, Lei Y, Cheng P, Guo W, Zheng Y, Wang W, Luo N, Peng Y, Tong A, Wei Y, Nie C, Yuan Z. The role of ROS and subsequent DNA-damage response in PUMA-induced apoptosis of ovarian cancer cells. Oncotarget, 2017, 8(14):23492-23506.
[15] Nakano K, Vousden KH. PUMA, a novel proapoptotic gene, is induced by p53. Mol Cell, 2001, 7(3):683-694.
[16] Winzell MS, Ahrén B. The high-fat diet-fed mouse: a model for studying mechanisms and treatment of impaired glucose tolerance and type 2 diabetes. Diabetes, 2004, 53(Suppl 3):S215-S219.
[17] 梁日英,符暢,梁華,徐芬,王美君,蔡夢茵.利拉魯肽抑制ERS改善高脂飲食誘導的DN腎損害.新醫學,2019,50(11):826-831.
[18] Doi K, Leelahavanichkul A, Yuen PS, Star RA. Animal models of sepsis and sepsis-induced kidney injury. J Clin Invest, 2009, 119(10):2868-2878.
[19] Tian Y, Jiang C, Wang M, Cai R, Zhang Y, He Z, Wang H, Wu D, Wang F, Liu X, He Z, An P, Wang M, Tang Q, Yang Y, Zhao J, Lv S, Zhou W, Yu B, Lan J, Yang X, Zhang L, Tian H, Gu Z, Song Y, Huang T, McNaughton LR. BMI, leisure-time physical activity, and physical fitness in adults in China: results from a series of national surveys, 2000-14. Lancet Diabetes Endocrinol, 2016, 4(6):487-497.
[20] Després JP, Lemieux I. Abdominal obesity and metabolic syndrome. Nature, 2006, 444(7121):881-887.
[21] Heydemann A. An overview of murine high fat diet as a model for type 2 diabetes mellitus. J Diabetes Res, 2016, 2016:2902351.
[22] Aziz M, Jacob A, Yang WL, Matsuda A, Wang P. Current trends in inflammatory and immunomodulatory mediators in sepsis. J Leukoc Biol, 2013, 93(3):329-342.
[23] Stasi A, Intini A, Divella C, Franzin R, Montemurno E, Grandaliano G, Ronco C, Fiaccadori E, Pertosa GB, Gesualdo L, Castellano G. Emerging role of lipopolysaccharide binding protein in sepsis-induced acute kidney injury. Nephrol Dial Transplant, 2017, 32(1):24-31.
[24] Thomas ME, Blaine C, Dawnay A, Devonald MA, Ftouh S, Laing C, Latchem S, Lewington A, Milford DV, Ostermann M. The definition of acute kidney injury and its use in practice. Kidney Int, 2015, 87(1):62-73.
[25] Vogelstein B, Lane D, Levine AJ. Surfing the p53 network. Nature, 2000, 408(6810):307-310.
[26] Wali JA, Rondas D, McKenzie MD, Zhao Y, Elkerbout L, Fynch S, Gurzov EN, Akira S, Mathieu C, Kay TW, Overbergh L, Strasser A, Thomas HE. The proapoptotic BH3-only proteins Bim and Puma are downstream of endoplasmic reticulum and mitochondrial oxidative stress in pancreatic islets in response to glucotoxicity. Cell Death Dis, 2014, 5(3):e1124.
(收稿日期:2020-06-20)
(本文編輯:林燕薇)

