煙草NTBZIPO38的克隆、鑒定及表達模式分析
趙澤玉 李志遠 孫晉浩 李東微 解敏敏 陳明麗 龔達平
摘要:堿性亮氨酸拉鏈(bZIP)轉錄因子是植物中數量最多、最具有多樣性的基因家族之一,對植物生長發育及脅迫響應具有重要作用。為探究煙草中bZIP轉錄因子的生物學功能,本研究在煙草K326中克隆得到一個bZP轉錄因子基因Vtbzipo38,并對其保守結構域進行分析,利用qRT-PCR技術檢測了該基因的表達模式,進一步結合亞細胞定位及轉錄激活試驗對其功能進行了初步鑒定。結果表明,NTBZIPO38含有典型的bZP結構域,亞細胞定位于細胞核中并具有轉錄激活活性。表達模式分析表明,NIBZIPO38在根中表達量最高(p《0.001),并在鹽、干旱、冷、熱、脫落酸(ABA)等非生物脅迫下都有明顯的表達量變化,在ABA處理下尤其明顯(p《0.001)。因此,作為bZP家族中的一員,NTBZIPO38轉錄因子可能在煙草根系發育、ABA響應與非生物脅迫中扮演著重要的角色。
關鍵詞:bZIP;煙草;轉錄因子;ABA;非生物脅迫
轉錄因子(Transcription Factor,TF)是指能夠特異性結合啟動子順式作用元件,對靶基因轉錄具有促進或抑制作用的DNA結合蛋白叫,對植物生長發育起著非常重要的作用。bZIP轉錄因子是植物中最大的基因家族之一,它由一個高度保守的DNA結合域(N-X7-RK-X9)和保守度較低的亮氨酸拉鏈區組成,其中亮氨酸拉鏈區是bZIP轉錄因子的功能結構域,調節多種脅迫響應,例如光脅迫響應、病原體防御等。
隨著生物信息學和基因組測序技術的發展,bZIP轉錄因子成為了研究的熱點。目前,已在擬南芥中鑒定到78個bZIP轉錄因子,玉米中有125個bZIP轉錄因子,油菜中有247個bZP轉錄因子。擬南芥78個bZIP從進化關系上分為13個亞家族(A-M),同一亞家族具有相似的保守結構域與類似的功能,其中D亞族參與兩個不同的生物進程:病原體防御和植物發育。目前對煙草bZP家族鑒定有所報道,但對其功能研究卻相對較少。
煙草是茄科的一種重要經濟作物,由外界環境引起的生物和非生物脅迫對煙草品質及產量有重要影。研究煙草中bZP轉錄因子的保守結構域、進化關系、亞細胞定位和多種非生物脅迫下表達分析等具有重要意義。因此,本研究通過比較基因組學的方法對煙草bZIP家族的基因進行功能鑒定分析,為探究煙草bZIP轉錄因子的抗脅迫機制打下基礎。
1材料與方法
1.1試劑和材料處理
試驗材料:普通煙草K326。載體:PEASY-BluntZero載體,pCHF3-GFP,pbridge載體。菌株:農桿菌GV3101菌株,酵母AH109菌株。材料處理K326種子經消毒處理播種在裝有滅菌土壤的花盆中,在幼苗長至6片真葉時,更換為MS液體培養液,培養5d左右后,對其進行脅迫和激素處理①將幼苗分別轉移至50mmol/LNACI溶液和ABA溶液中進行鹽處理與激素處理,處理1、3、6h后分別整株取樣,以處理0h煙苗作為對照;②將幼苗分別轉移至4℃與37℃培養箱中進行處理,處理1、3、6h后分別整株取樣,以處理0h煙苗作為對照;③將幼苗轉移至吸水濾紙上進行干旱處理,在1、3、6h的時間點分別整株取樣,以處理0h煙苗作為對照。每個處理每次取3株生長狀態近似的整株煙苗。待煙草生長至現蕾期,釆集植株的根莖、下部葉、中部葉、上部葉、腋芽、花的組織樣品,每個組織取3次重復,在液氮中迅速冷凍后放置于-80℃冰箱中保存。
1.2生物信息學分析
以番茄Solyc05g009660.2.1(S/BZIP38)的蛋白序列為種子序列,在煙草參考基因組K326中進行Blastp序列比對,得到候選基因(NCBI上登錄號XM_016595381.1)。利用EXPASY中的Protparam工具(https:/web.expasy.org/protparam)預測候選基因編碼的蛋白氨基酸序列的分子量、等電點等基本理化性質;在PLANTTFDB(http:/planttfdb.cbi.pku.edu.cn)下載擬南芥和番茄的bZIP轉錄因子序列并進行多重比對分析,使用MEGA-X軟件中的鄰接法(Neighbor-.Joining,NJ)(1000Bootstrap)構建系統進化樹,并通過MEME(http:/meme-suite.org/)分析其保守結構域。
1.3NTBZIP基因的克隆
將煙草在研缽中用液氮研磨為粉末,按照RNA提取試劑盒操作步驟提取植物總RNA并將其反轉錄為cDNA。依據候選基因CDS序列設計特異性引物進行PCR擴增,上游引物:5-ATGCAAGCTTTCAAAGCAGCA-3',下游引物:5-CTAGAGTTGGTCCTGGGGC-3'。對符合大小的片段進行膠回收并與1LPEASY-BLUNT/連接轉化至大腸桿菌中,用含有卡那霉素的LB平板進行篩選,將陽性克隆送至華大基因進行測序,測序正確的亞克隆載體命名為Blunt-NTBZIP038。
1.4亞細胞定位分析
以構建完成的亞克隆載體Bunt-Ntbz/PO38為模板,使用同源重組的方法將Ntbzipo38基因連接到pCHF3-cGFP亞細胞定位的載體上,轉化大腸桿菌感受態T1,涂布到含有卡那霉素的LB平板上進行篩選,挑選陽性單克隆進行菌液PCR和測序驗證,提取測序正確的重組質粒并轉化到農桿菌GV3101中,經菌液PCR鑒定后將陽性農杄菌注射到煙草葉片的背部,培養72h后,取下葉片,在激光共聚焦顯微鏡下觀察GFP信號。
1.5轉錄激活試驗
以構建完成的亞克隆載體Blunt-NTBZIPO38為模板,使用同源重組的方法將Vtbzipo38基因連接到pbridge載體ECORI位點中轉化大腸桿菌感受態T1,涂布到含有卡那霉素的LB平板上進行篩選,挑選陽性單克隆進行菌液PCR和測序驗證,提取測序正確的重組質粒與對照pbridge空載分別轉入酵母AH109菌株感受態中,在SD)-Ip營養缺陷培養基上生長,30℃培養48h,篩選陽性克隆轉移至顯色培養基SD/-TrpX-gal上倒置避光培養直至顯色。
1.6表達模式分析
以煙草26STRNA基因作為管家基因,根據NTBZIPO38編碼序列設計定量引物,Ntbzipo38上游引物為:5-AGCTGCGCCTACTTGT!-3,下游引物為:5-CACCTTCCGCAGGAGTCTI-3。總反應體系為20L,反應步驟:95℃30s;95℃5s,60℃34s,循環40次。具體步驟參考7500芡光定量儀說明書,最后根據2AC法計算基因的相對表達量。
2結果
2.1NTBZIPO38轉錄因子的系統進化和保守結構域分析
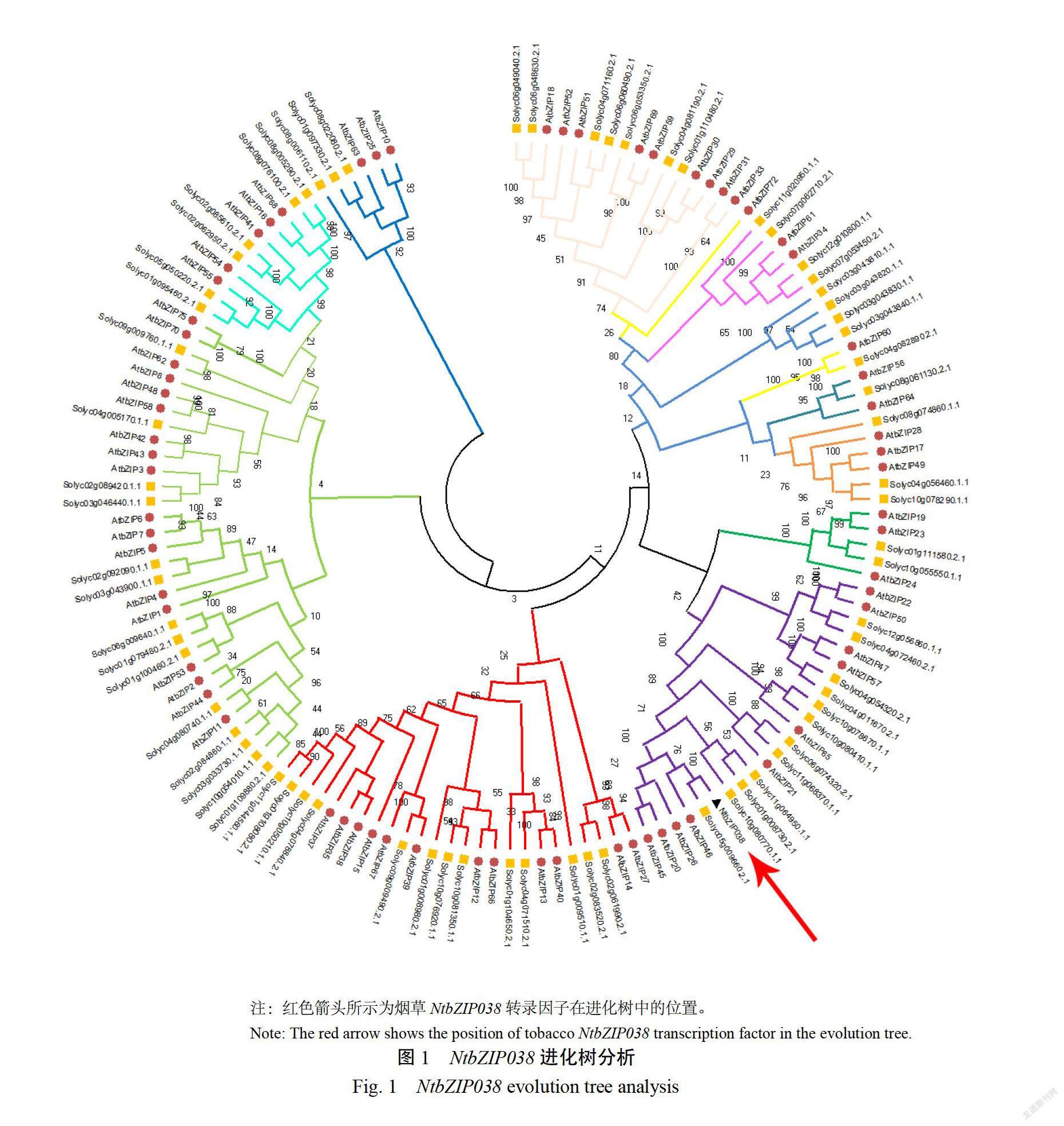
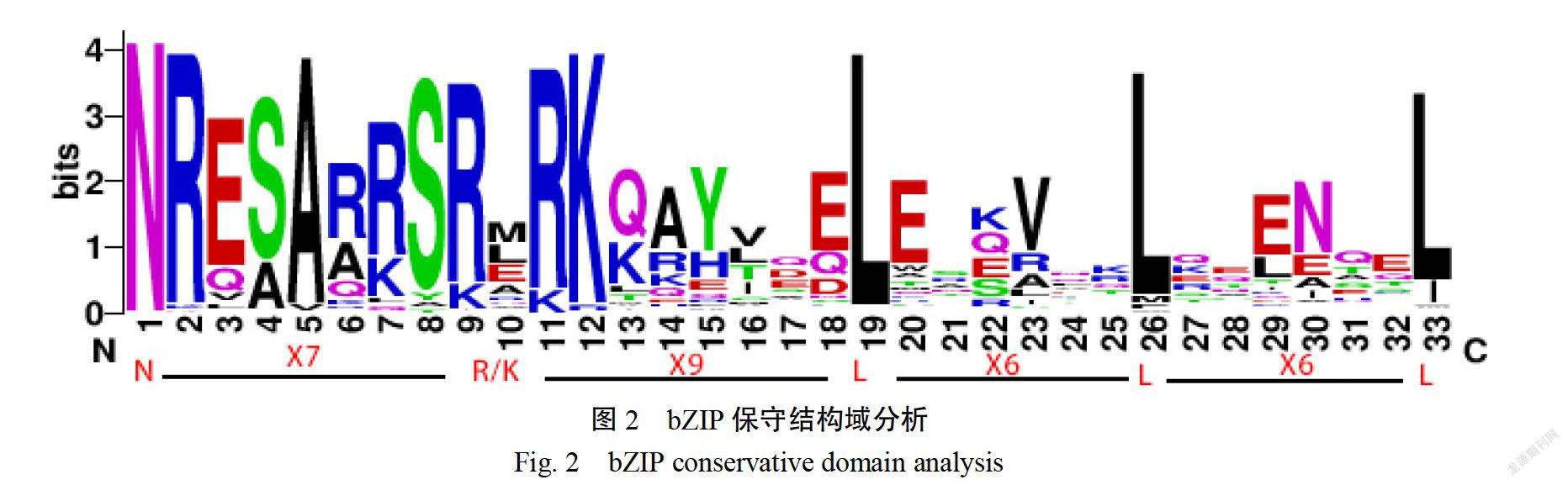
利用擬南芥、番茄中已被鑒定的bZIP轉錄因子與MbZPの38進行多序列比對,用MEGA-X軟件構建系統進化樹,分析其親緣關系。系統進化分析表明(圖1),煙草Ntbzipo38與擬南芥Atbzip46、番茄Solyd5g0096602.1聚在一起,同屬于D亞族。保守結構域MEME分析表明(圖2),NTBZIPO38含有一個高度保守的DN識別結構域(N-X7-RK)及亮氨酸拉鏈區(-X9-L-X6-L-X6-L),可能參與植物防御反應或植物發育。
2.2Ntbzipl38基因全長的克隆及理化性質分析
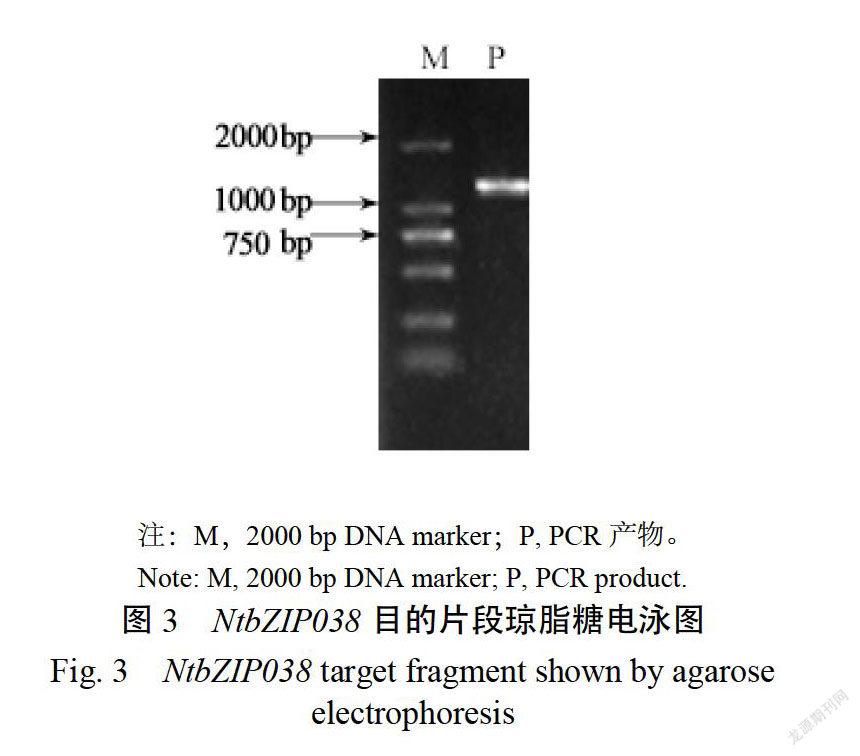
以普通煙草K326的cDNA為模板進行PCR擴增,目的條帶大小約為1400bp(圖3),將其命名為NTBZIPO38。將目的片段回收純化后連接至peasy-Blunt克隆載體進行序列測定。測序結果顯示NTBZIPO38的CDS序列全長為1464bp,編碼487個氨基酸。NTBZIPO38的蛋白序列含有完整的bZIP結構域,是一個典型的bZP家族蛋白。利用Protparam工具分析Ntbzipo38的理化性質,該蛋白的相對分子質量為53.38kDa,理論等電點為6.73。
2.3NTBZIPO38轉錄因子的亞細胞定位分析
將構建完成的35S-NTBZIPの38-GFP融合表達載體轉化到農桿菌GV311中,以35GFP為空白對照,利用瞬時表達的方法注射到煙草葉片中,利用激光共聚焦顯微鏡觀察NTBZIPO38的亞細胞定位。利用DAPI染色指示細胞核,結果如圖4所示,融合Ntbzipo38的GFP信號只能在細胞核中觀察到,而空載的GFP信號則遍布整個細胞,證明NTBZIPO38是一個核定位蛋白。
2.4NTBZIPO38轉錄因子的轉錄激活分析
為了進一步驗證MbZP38的轉錄活性,將GAL4BD-NTBZIP038載體轉化至酵母AH109菌株中,以GAIL4BD空載為對照,經SD-ITp平板上篩選后轉至顯色培養基(SD/-Ip/X-gal)上進行轉錄激活驗證。從圖5可以看出,含有Ntbzipo38的GAIL4BD-NbZPの38融合表達載體與空載GAL4BD均能夠在SD/-Ip上生長,而只有GAL4BD-NTBZIPO38融合表達載體オ能夠啟動報告基因表達進而顯示藍色,說明NTBZIPO38具有轉錄激活活性。
2.5NTBZIPO38轉錄因子的表達模式分析
對煙草6個不同組織(根、莖、葉、花、芽、蕾)的Vtbzipl38表達量進行實時熒光定量PCR檢測(圖6),結果表明,Ntbzipの38在煙草的根、莖、葉、花、芽、花蕾組織中均有表達且在花蕾(FB)和根(R)中的表達量顯著高于其他組織。
試驗結果表明,Ntbzipo38的表達受多種脅迫的誘導。如圖7所示,在鹽脅迫的條件下,NTBZIPO38基因的表達量在處理1h達到最高(10.5倍),與對照0h相比差異極顯著(p-0.001),隨后表達量逐漸下降。NTBZIPの38在ABA處理條件下的表達模式與鹽脅迫類似,均在1h達到最高(13.3倍),處理6h后表達量為對照的4.6倍。而在干旱脅迫下,NbZP38基因在處理3h時達到最高,其他處理時間的表達量略高于對照。NTBZIP38在高溫脅迫條件下與在4℃冷脅迫條件下表達模式相反,高溫脅迫下的Ntbzip038表達顯著下調,而冷脅迫下NTBZIPO38表達高于對照,且在6h時達到最高,但差異幅度變化不明顯(p-0.05)。NTBZIPO38的表達受多種脅迫的誘導,且在ABA處理條件下變化最大,表明Vtbzip038可能調控ABA合成代謝通路。
3討論
bZP轉錄因子在植物發育、代謝和各種脅迫反應中起著重要作用。已有研究證實,在植物生長、衰老、損傷、花發育及種子成熟等生理生化過程都有bZP轉錄因子的參與。例如,擬南芥中AbZP9和ATBZIP46被證明參與了調控葉片、維管發育1分生組織與花器官的形成,Atbzip34和Atbzip46與其他bZIP成員互作調控植物發育叫。本研究對煙草NTBZIP38轉錄因子與擬南芥番茄bZIP家族進行進化分析,Ntbzipo38與Atbzip46同屬D亞家族,且有高度相似性,推測Ntbzipo38可能主要在花與根的組織中表達。對NTBZIPO38根、莖、葉、花、芽、花蕾部位進行表達分析發現,其在根中的相對表達量最高,其次是花蕾,這與我們的猜測基本一致,Ntbzip038與Atbzip46高度同源使其具有了相似的功能,但對于其在花與根中的調節機制有待進一步研究。
植物在整個生長發育過程中,經常會遭受非生物脅迫,例如干旱、高溫、低溫等,這些非生物脅迫對植物生長發育有著直接的影響,因此植物也形成了各種反饋調節機制來適應生存環境的變化。目前對bZP轉錄因子的研究主要集中在逆境脅迫下的調控機制和功能上。研究表明,轉OSBZIP72基因水稻抗旱性明顯比野生型水稻強,過表達水稻中的DSBZIP7基因也有類似的功能。PEG模擬的干旱脅迫下,綠豆中的bZIP52表達量顯著上調,表明bZIP52可能參與植株的干旱脅迫響應。玉米中的Zmbzip60和ZMBZIP72在擬南芥中過表達也能提高其對干旱和高鹽的耐受力。我們對煙草在鹽、干旱、溫度脅迫下的定量處理表明,NTBZIPO38轉錄因子對干?、鹽、低溫表現為正調控,對高溫表現為負調控。但在番茄中同屬D亞家族的SIBZIP382在低溫高溫脅迫下均表現為正調控,這可能是不同物種在進化過程中出現了功能分化所導致的。
植物的抗逆調節離不開植物激素的作用。研究表明,植物在非生物脅迫下的抗逆調節機制通常依賴于ABA途徑2。ABA是植物響應脅迫的激素之一,ABA應答主要是結合與ABA代謝相關基因啟動子保守的ABRE順式作用元件。CHOI2等首次從擬南芥克隆了bZIP家族A亞家族的轉錄因子Atbzip35,主要參與調控干早、高鹽、ABA、氧化脅迫和高溫脅迫。同時,擬南芥中的AmPP2(12通過ABA信號途徑來提高抗旱能力。轉玉米基因ZMBZIP72的擬南芥植株對干旱脅迫和鹽脅迫抗性增強,同時對ABA和滲透脅迫的敏感性也增強。在茄科中,番茄SIAREB轉錄因子能結合ABRE元件響應ABA信號,提高抗旱性2。本研究中NTBZIPO38轉錄因子受ABA處理后表達量在1h之內高達13.3倍,與對照有極顯著的差異,表明NTBZIPO38轉錄因子可能參與了ABA代謝通路的調控。
4結論
本研究利用比較基因組學的方法在煙草中克隆到一個bZIP轉錄因子NbZP038。對NTBZIPO38轉錄因子分析表明其含有典型的bZIP結構域,并將NTBZIPO38定位在細胞核,驗證了NTBZIPO38具有轉錄激活活性。表達分析發現NTBZIPO38在煙草的根、莖、葉、花、芽、花蕾組織中均有表達,且在根中的表達量顯著高于其他組織。在鹽脅迫ABA處理、干旱和溫度脅迫下均有明顯的表達量變化,且在ABA處理下表達量變化最大,表明NTBZIPO38轉錄因子參與調控ABA通路并且在鹽、干早、低溫等非生物脅迫過程中發揮著重要作用。本研究初步探討了煙草bZIP家族bZP38轉錄因子的功能,下一步應對其非生物脅迫下的調控機制進行研究。
參考文獻
[1]閆寧,張洪博.煙草重要基因篇:10.煙草轉錄因子基因[J].中國煙草科學,2015,36(4):117-120
[2] NIJHAWAN A, JAIN M, TYAGI A K, et al. Genomic survey and gene expression analysis of the basic leucine zipper transcriptionfactor family in rice]. Plant Physiology, 2008, 146(2): 333-350
[3] CENGIZ B M, VAHAP E, MORTAZA H, et al. Genome-wide analysis of the BZIP transcription factors in cucumber. Plos One,2014,9(4):e96014-28
[4] STRACKE R, FAVORY JJ, GRUBER H, et al. The Arabidopsis bzip transcription factor HY5 regulates expression of thePFG1/MYB12 gene in response to light and ultraviolet-b radiation[J]Plant Cell Environment, 2010, 33(1): 42
[5] ALVES M, DADALTO S, GONALVES A, et al. Plant BZIP transcription factors responsive to pathogens: a review[J]International Journal of Molecular Sciences, 2013, 14(4): 7815-78285
[6] YAN Z, DAIXIANG X, LEDONG J, et al. Genome-wide identification and structural analysis of BZIP transcription factorgenes in Brassica napus [J]. Genes, 2017, 8(1): 288
[7] WOLFGANG DL, SNOEK B L, BEREND S, et al. The Arabidopsis BZIP transcription factor family-an update J]. Current Opinion in Plant Biology, 2018, 45: 36-49
[8] XIANG C, MIAO Z H, LAM E Dna-binding properties, genomic organization and expression pattern of TGA6 TGA family of BZIP transcription factors in Arabidopsis thaliana Plant Molecular Biology, 1997, 34(3): 403-415
[9]張蕊,基于煙草全基因組重注釋的堿性亮氨酸拉鏈鑒定與功能分析[D]泰安:山東農業大學,2020
[10]任昂彥,孔英珍.普通煙草ERF轉錄因子亞家族成員鑒定及表達模式分析.中國煙草科學,2017,38(1):15-22
[11] DEPPMANN C D, ALVANIA R S, TAPAROWSKY E J Cross-species annotation of basic leucine zipper factor interactions Insight into the evolution of closed interaction networks![J]Molecular Biology and Evolution, 2006, 23(8): 1480-1492
[12] CHUANG C F, RUNNING M P, WILLIAMS R W, et al. The PERIANTHIA gene encodes a bzip protein involved in thedetermination of floral organ number in Arabidopsis thaliana [J]Genes Dev,1999,13(3):334-344
[13] MAIER A T, SANDRA S S, SARAH-LENA O, et al. The BZIP transcription factor PERIANTHIA: A multifunctional hub formeristem control. Frontiers in Plant Science, 2011, 2: 79
[14] SHEN H, CAO K, WANG X. A conserved proline residue in the leucine zipper region of Atbzip34 and Atbzip6l in Arabidopsisthaliana interferes with the formation of homodimer [J]. Biochemicaland Biophysical Research Communications, 2007, 362(2): 425-430
[15] YANG J Y, ZHENG W, TIAN Y, et al. Effects of various mixed salt-alkaline stresses on growth, photosynthesis, and photosyntheticpigment concentrations of Medicago ruthenica seedings Photosynthetica, 2011, 49(2): 275-284
[16] LU GJ, GAO C X, ZHENG X N, et al. Identification of Osbzip72 as a positive regulator of ABA response and drought tolerance inrice [J]. Planta,2009,229(3):605-615
[17] CITAO L, BIGANG M, SHUJUN O, et al. Correction to: OSBZIP71 a bzip transcription factor, confers salinity and drought tolerance inrice [J]. Plant Molecular Biology, 2018, 97(2): 467-468
[18] WANG L, ZHU J, LI X, et al. Salt and drought stress and ABA responses related to BZIP genes from T. radiata and T angularis [J]Gene.2018.651:152-160
[19] YING S, ZHANG D F, FU J, et al. Cloning and characterization of a maize BZIP transcription factor, Zmbzip72, confers drought and salttolerance in transgenic Arabidopsis [J]. Planta, 2012, 235(2)253-266
[20]潘陽露.番茄轉錄因子SIBZIP38響應干旱和高鹽脅迫的功能研究[D].重慶:西南大學,2018.
[21]馬斯琦,劉萬峰,呂林,等.煙草中脫落酸的相關研究進展.中國煙草科學,2020,41(1):94-100
[22] UNO Y, FURIHATA T, ABE H, et al. Arabidopsis basic leucine zipper transcription factors involved in an abscisic acid-dependentsignal transduction pathway under drought and high-salinityconditions [J] Proceedings of the National Academy of Sciences ofthe United States of America, 2000, 97(21): 11632-11637
[23] FUJITA Y, FUJITA M, SHINOZAKI K, et al. Aba-mediated transcriptional regulation in response to osmotic stress in plants [J]Journal of Plant Research, 2011, 124(4): 509-5252
[24] CHOI H, HONG J, HA J, et al. ABIS, a family of Aba-responsive element binding factors J]. The Journal of Biological Chemistry,2000,275(3):1723-1730
[25] FUJITA Y, FUJITA M, SATOCH R. AREB is a transcriptional activator of novel Abre-dependent ABA signaling that enhancesdrought stress tolerance in Arabidopsis [J]. Plant Cell, 2005, 173470-3488
[26] HSIEH T, LI C, SU R, et al. A tomato BZIP transcription factor, SIAREB, is involved in water deficit and salt stress response [J]Planta,2010,231(6):1459-1473

