苦郎樹組培快繁技術研究
劉德浩,陳智濤,鄧仿東,王少東,舒夏竺,黃競中,廖文莉
(惠州市林業科學研究所,廣東惠州 516001)
苦郎樹(Clerodendrum inerme)為馬鞭草科(Verbenaceae)大青屬攀援狀灌木,直立或平臥,高可達2 m,自然分布于熱帶和亞熱帶的海岸、河灘和潮汐地,在園林綠化中是很有價值的地被植物或樹籬植物,也是沿海防護林的優良樹種[1-4]。苦郎樹的枝和葉入藥可用于治療跌打損傷、血瘀腫痛、瘡癬疥癩和濕疹瘙癢等,根部能分離出具有鎮痛和抗菌作用的糖酐酯[5-7];也是一種常用的苦味補藥。其臨水生長,種子收集困難。本研究對苦郎樹的莖段組織培養技術開展研究,以期建立苦郎樹完整的離體快繁技術體系,為其規模化育苗提供技術支撐。
1 材料與方法
1.1 試驗材料
試驗材料來源于惠州市惠東縣鐵涌鎮野外收集的3年生苦郎樹種子實生苗,選取當年新抽出的半木質化枝條作為外植體材料[8]。
1.2 試驗方法
1.2.1 外植體滅菌
選取生長健壯且長勢良好的苦郎樹實生苗枝條,去除葉片后帶回實驗室進行預處理。首先將選取的苦郎樹枝條修剪成10 cm長的莖段,放在流水下沖洗2 h,然后放入超聲波清洗機中用0.2%滅菌凈清洗20 min,最后用無菌水沖洗5 次,備用。在超凈工作臺上,以75%酒精和0.1%氯化汞HgCl2作為消毒劑進行不同消毒處理,之后用無菌水沖洗5次,將滅菌后的外植體接種至MS培養基中。共12個處理,每處理接種10 個莖段,3 次重復。接種20 天后統計污染率和萌發率。
1.2.2 基本培養基的篩選
在合適的滅菌處理基礎上,將滅菌后的苦郎樹莖段分別接種至MS、1/2 MS 和1/4 MS 培養基中,每5天統計1次外植體褐化率,篩選出適宜外植體生長的基本培養基。
1.2.3 初代培養
在基本培養基上,進行不同濃度6-BA(0.5、1.0和1.5 mg/L)、NAA(0.05、0.10 和0.15 mg/L)和IBA(0.5、1.0和1.5 mg/L)的正交試驗,探究不同類型和濃度的植物生長調節物質對苦郎樹叢生芽誘導的影響。共9個處理,每處理10瓶,每瓶接種3個莖段。
1.2.4 繼代培養
在1/2 MS 培養基上,進行不同濃度6-BA(0.5、1.0、1.5 和2.0 mg/L)和NAA(0.05、0.10和0.15 mg/L)的激素處理。共12個處理,每處理10瓶,每瓶接種3個莖段。接種30天后統計增殖倍數,并觀察生長情況。
1.2.5 生根培養
切取生長健壯的芽苗接種至生根培養基中。以1/2 MS為基本培養基,添加不同濃度的NAA(0、0.05、0.10、0.15 和0.20 mg/L)。共5 個處理,每處理10 瓶,每瓶接種3個芽苗。接種30天后統計生根情況。
1.2.6 培養條件
初代培養、繼代培養和生根培養的培養基均附加25 g/L 蔗糖和6 g/L 瓊脂粉,并調節pH 值為5.8。培養溫度為25 ℃,光照強度為2 000 lx,光照時間為每天12 h。
1.2.7 煉苗與移栽
完成生根培養后,選取生長健壯的生根植株,在蔭棚內煉苗10 天。洗凈幼苗根部的培養基后移栽至預先進行了消毒處理的珍珠巖、泥炭土和沙子(2∶2∶1)混合基質中。30天后統計幼苗成活率。
1.3 數據處理
污染率=(污染數/接種數)×100%
萌發率=(產生愈傷組織數/接種數)×100%
誘導率=(未污染外植體產生愈傷組織數/未污染外植體總數)×100%
采用Excel 2007 和SPSS 21.0 軟件進行數據統計分析,采用Duncan,s 新復極差法進行差異顯著性檢驗。
2 結果與分析
2.1 不同消毒方法對外植體滅菌效果的影響
隨著75%酒精和0.1% HgCl2處理時間的增加,苦郎樹外植體污染率逐漸下降(表1)。酒精處理30 和60 s 的外植體污染率均顯著低于未經酒精處理的外植體(P<0.05),0.1% HgCl2處理7 min 的平均萌發率最高。最佳滅菌方式為處理6(75%酒精處 理30 s 和0.1% HgCl2處 理7 min),污染率為16.67%,萌發率為73.33%。

表1 不同消毒處理對苦郎樹外植體的影響Tab.1 Effects of different disinfection treatments on explants of C.inerme
2.2 基本培養基的篩選
1/2 MS 培養基中外植體的褐化率明顯低于MS和1/4 MS 培養基,對愈傷組織的誘導率(76.67%)顯著高于其他兩種培養基(P<0.05)(表2)。將外植體接種至1/2 MS 培養基的第12 天能觀察到側芽萌發。因此,選用1/2 MS 培養基作為外植體側芽誘導的基本培養基。

表2 基本培養基的篩選Tab.2 Screening of basic medium
2.3 初代培養
以1/2 MS 為基本培養基,進行不同濃度6-AB、NAA 和IBA 處理(表3)。結果表明,處理6 的平均叢生芽數為3.52 個,平均芽長為2.12 cm,平均葉片數為5.26 片,誘導率為90.00%,所有指標均表現最好。因此,選擇處理6 為苦郎樹適宜的初代培養基,即1/2 MS+1.0 mg/L 6-BA+0.15 mg/L NAA+0.5 mg/L IBA。

表3 生長調節物質對苦郎樹外植體叢生芽形成的影響Tab.3 Effects of growth regulators on cluster bud formation in explants of C.inerme
2.4 繼代培養
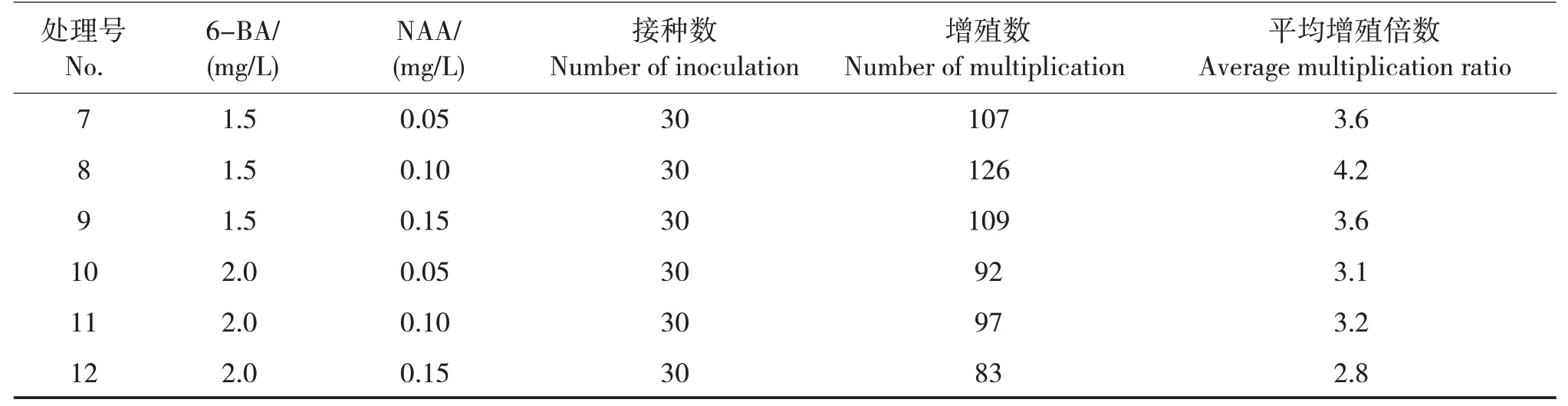
將初代誘導出的叢芽接種到增殖培養基中,添加不同濃度的6-BA 和NAA 進行繼代培養。結果表明,12 個處理的增殖倍數為2.9 ~4.2(表4)。處理8的增殖倍數最高(4.2),繼代培養出的小芽生長健壯且莖粗壯。因此,選擇處理8為苦郎樹適宜的繼代培養基,即1/2 MS+1.5 mg/L 6-BA+0.10 mg/L NAA。

表4 不同激素處理對苦郎樹萌芽增殖的影響Tab.4 Effects of different hormone treatments on multiplication of C.inerme
續表4 Continued
2.5 生根培養
隨著NAA 濃度的增加,苦郎樹小芽的生根率呈先增加后下降的趨勢(表5)。處理3 的平均根數最多,平均生根率最高。其他處理均不適宜煉苗移栽。因此,選擇處理3為苦郎樹適宜的生根培養基,即1/2 MS+0.10 mg/L NAA,平均根數為3.50條,平均生根率為93.33%,且根系粗壯。

表5 不同激素處理對苦郎樹生根的影響Tab.5 Effects of different hormone treatments on rooting of C.inerme
2.6 煉苗與移栽
選擇生長健壯、根系發達且粗壯的植株置于蔭棚內煉苗,逐步打開瓶蓋,在瓶苗逐漸適應外界生長環境后,移栽至預先進行了消毒處理的珍珠巖、泥炭土和沙子(2∶2∶1)混合基質中(圖1G)。30 天后的移栽成活率為100%,且植株生長良好,須根數量有所增加。

圖1 苦郎樹組織培養與移栽Fig.1 Tissue culture and transplanting of C.inerme
3 結論與討論
苦郎樹莖段外植體用75%酒精處理30 s 和0.1% HgCl2處理7 min,能有效滅菌;最佳誘導培養基為1/2 MS + 1.0 mg/L 6-BA + 0.15 mg/L NAA +0.5 mg/L IBA,最佳繼代培養基為1/2 MS + 1.5 mg/L 6-BA+0.10 mg/L NAA,最佳生根培養基為1/2 MS+0.10 mg/L NAA,生長健壯的植株移栽至珍珠巖、泥炭土和沙子(2∶2∶1)混合基質中長勢良好。
建立植物離體快繁體系的前提是能獲得有活力的無菌材料。植物離體培養中的污染源一方面來自于組培過程中的不規范操作,另一方面來自植物的內生菌。組培過程中人為因素造成的污染目前已得到有效控制,但植物內生菌的污染難以徹底清除[9-10]。本試驗結果表明,在消毒滅菌過程中,酒精和HgCl2相結合的滅菌處理效果好,由于酒精具有較強的滲透性,容易對外植體的活性造成不可逆傷害,所以在滅菌過程中需嚴格控制酒精的滅菌時間。
由于植物內源激素無法滿足離體組織增殖和生根的需要,因此在組織培養過程中,需要添加適宜的外源植物生長調節物質,這是促進愈傷組織形成、芽的分化以及不定根形成的重要手段之一[11]。NAA和6-BA 對苦郎樹叢芽生長作用顯著,但高濃度6-BA容易導致苦郎樹的外植體褐化嚴重并抑制側芽形成。本試驗建立了苦郎樹離體培養體系,對苦郎樹種質資源的保存以及規模化育苗具有重要意義。

