外源添加乙偶姻對釀酒酵母產2,3-丁二醇及其菌株的影響
張 弛,呂雨澤,鄧利廷,孫 健,葛菁萍
(1黑龍江大學農業微生物技術教育部工程研究中心,哈爾濱 150500;2微生物黑龍江省高校重點實驗室/黑龍江大學生命科學學院,哈爾濱 150080)
0 引言
2,3-丁二醇(2,3-BD)是一種應用化合物,被作為一種重要的化工原料,并且2,3-BD被航天、能源以及食品等多個領域廣泛應用[1]。通常人們利用微生物以石油為底物的方式進行生產2,3-BD被廣受歡迎,然而,現如今2,3-BD的生產含有不足之處:一是產量較低,二是2,3-BD的結構十分特殊,利用化學法合成2,3-BD的成本很高,所以不能用于工業化大規模生產[2]。近年來利用生物法來生產2,3-BD等產品受到人們的關注,同時在國內外其研究與發展速度飛快[3],優勢在于其成本低廉,工藝技術簡單,同時具有降低污染,保護環境的作用[4-5]。
在大自然中,有許多常見的菌種可以用來生產2,3-BD,包括克雷伯氏菌屬(Klebisellasp.)[6-7]、芽孢桿菌屬(Bacillussp.)[8-9]以及酵母菌屬(Saccharomycessp.)[10]等。不幸的是,克雷伯氏菌屬和芽孢桿菌屬等被歸類為II類致病微生物,容易造成具有危害性的工業生產[11-12]。相比之下,釀酒酵母已經被作為安全性較高的微生物,且具有2,3-BD生產能力[13-14]。這使得研究學者們將釀酒酵母作為生產2,3-BD的焦點。
但是,野生型釀酒酵母本身產生2,3-BD的能力有限,如果不加以人為干涉的話,還不具備進行大規模生產的潛力。因此人們從改造釀酒酵母代謝途徑的角度出發,試圖通過阻斷其支路代謝途徑[15]、過表達關鍵酶基因的方式[16],來提高2,3-BD的產量。在釀酒酵母細胞中,2,3-BD的合成途徑其一是通過丙酮酸在丙酮酸脫羧酶(pyruvate decarboxylase/PDC)的作用下生成乙醛,乙醛在PDC催化下生成乙偶姻,最終乙偶姻在2,3-丁二醇脫氫酶(2,3-butanediol dehydrogenase/BDH)作用下生成2,3-BD。所以,乙偶姻成為2,3-BD合成途徑中重要的前體物質[17-18]。本課題組前期已經嘗試對丙酮酸脫羧酶1和丙酮酸脫羧酶5基因進行了敲除,導致2,3-BD的產量明顯提升。那么,外源添加適當濃度的物質乙偶姻后,是否會繼續提高2,3-BD的產量以及菌株的生長?本研究將利用上述的兩種突變株以及S.cerevisiaeW5和S.cerevisiaeW141原始菌株對此問題進行探究。
1 材料與方法
1.1 菌株與培養基
1.1.1 試驗菌株S.cerevisiaeW5和S.cerevisiaeW141,由黑龍江大學微生物重點實驗室保藏。S.cerevisiaeW5-Δpdc1/Δpdc5,經過前期構建,其中W5-Δpdc1和W5-Δpdc5分別是敲除了丙酮酸脫羧酶1和丙酮酸脫羧酶5的基因工程菌株。
1.1.2 培養基 YPD液體培養基:蛋白胨20 g/L,酵母提取物10 g/L,葡萄糖20 g/L,pH自然,108°C高壓滅菌20 min;葡萄糖單碳源發酵培養基(g/L):葡萄糖80 g/L,YNB 3.4 g/L,蛋白胨 20 g/L,K2HPO43 g/L,KH2PO411.8 g/L,(NH4)2SO410 g/L,pH自然,108°C高壓滅菌20 min。
1.2 方法
1.2.1OD值與細胞干重二者關系確定 將培養至對數期的4株菌株,接種到培養基中培養12 h,30°C,140 r/min,在600 nm處吸光度下,測定吸光值。根據吸光值,進行梯度稀釋,將菌液稀釋成6個不同的濃度,進行離心后,棄上清,加入適量無菌水,在再行離心處理,將樣品放入烘箱中烘干稱重。
1.2.2 乙偶姻最適添加量的確定 將培養至對數期的S.cerevisiaeW5/W5-Δpdc1/W5-Δpdc5/W141菌株,進行接種培養,外源添加0、2、4、6、8、10、12、14 g/L乙偶姻至培養基中培養84 h,30°C,140 r/min,每12 h取樣,測定pH值、細胞干重(Dry Cell Weight,DCW),利用高效液相色譜法(HPLC)對葡萄糖的消耗量、2,3-丁二醇產量以及乙偶姻剩余量進行檢測,進一步確定添加乙偶姻的最適量。
2 結果與分析
2.1 外源添加乙偶姻方案的確立及候選菌株的確定
通過對S.cerevisiaeW5/W5-Δpdc1/W5-Δpdc5/W141乙偶姻產量和BDH酶活進行檢測(圖1),發現S.cerevisiaeW5-Δpdc5的乙偶姻積累量和BDH酶活性均明星呈現先增加后降低的趨勢,并且在發酵60 h時達到最大值,此時的乙偶姻積累量為0.626±0.04 g/L,BDH酶活性為0.0257±0.003 U/mg。然而,原始菌株S.cerevisiaeW5的乙偶姻產量為0.110±0.02 g/L,BDH酶活性為0.0099±0.001 U/mg,同時S.cerevisiaeW5-Δpdc5的乙偶姻產量是野生菌株S.cerevisiaeW141產量(0.282±0.02 g/L)的2.2倍,BDH酶活性兩者一致。另外,研究發現S.cerevisiaeW5-Δpdc1的乙偶姻積累量呈現先上升后下降再上升的微弱趨勢,在發酵24 h時積累量最大為0.129±0.01 g/L;BDH酶活性同樣在24 h時達到最大值為0.0122±0.001 U/mg;同原始菌株S.cerevisiaeW5相比,乙偶姻積累量提高了17.3%,BDH酶活提高了23.2%,差異明顯。然而,野生菌株S.cerevisiaeW141的乙偶姻產量和BDH酶活性均高于S.cerevisiaeW5-Δpdc1。綜上所述,從乙偶姻產量和BDH酶活性隨發酵時間變化的趨勢可以看出,乙偶姻的量直接影響了BDH酶的活性,同時間接影響了2,3-BD的產量,最終研究確定外源添加乙偶姻的方案。
以上數據表明:第一,S.cerevisiaeW5-Δpdc1/Δpdc5的2,3-BD產量較比原始菌株S.cerevisiaeW5的都有所提高,并且乙偶姻的積累量也會提高,同時促進了BDH酶的活性;第二,通過對S.cerevisiaeW141和S.cerevisiaeW5-Δpdc1/Δpdc5的比較發現 ,S.cerevisiaeW141自身對乙偶姻的積累和BDH酶活性的作用,都是其作為2,3-BD出發菌株主要的優勢。綜上所述,針對于S.cerevisiaeW5/W141的優勢和S.cerevisiaeW5-Δpdc1/Δpdc5的不足之處,研究確定使用S.cerevisiaeW5/W141共同作為本實驗生產2,3-BD的出發菌株。
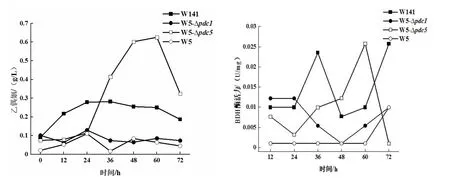
圖1 乙偶姻產量和BDH酶活檢測結果
2.2 OD值與細胞干重關系曲線
利用OD600nm值來測定菌體生物量,按照1.2.1的方法。根據OD600nm值與DCW具體關系分別為公式(1)~(2),結果證明,S.cerevisiaeW5/W141菌株OD600nm值和細胞干重成正比例關系。
2.3 乙偶姻最適添加量的確定
將菌株接種到發酵培養基中,外源添加0、2、4、6、8、10 g/L和0、2、4、6、8、10、12、14 g/L乙偶姻,30°C,140 r/min振蕩培養72 h,每隔12 h取樣,葡萄糖消耗情況(圖2)、2,3-BD產量和乙偶姻剩余量隨發酵時間的變化情況(圖3)。
由圖2可以看出,外源添加不同濃度的乙偶姻對S.cerevisiaeW141/W5,在代謝過程中,葡萄糖隨著發酵時間的增加,而逐漸被消耗,則在24 h左右,葡萄糖均基本耗盡。
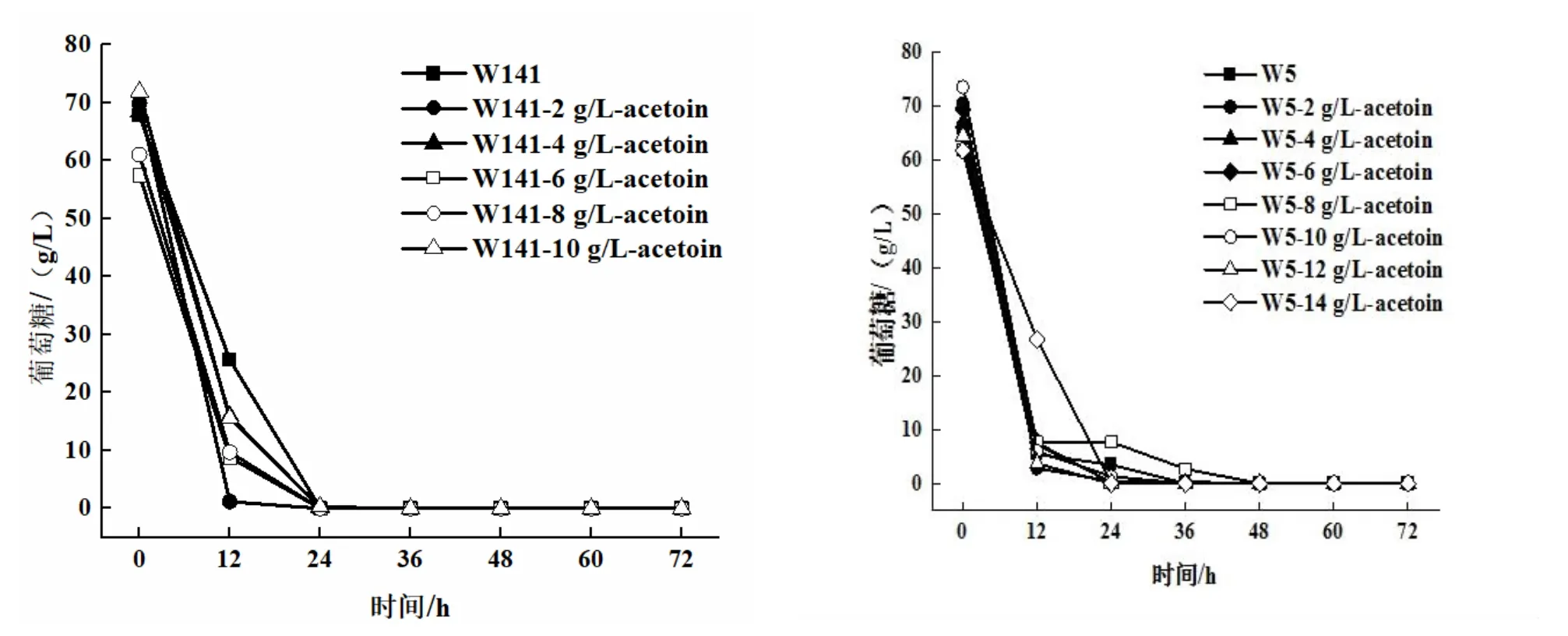
圖2 S.cerevisiae W5/W141的葡萄糖消耗量隨發酵時間變化的關系曲線
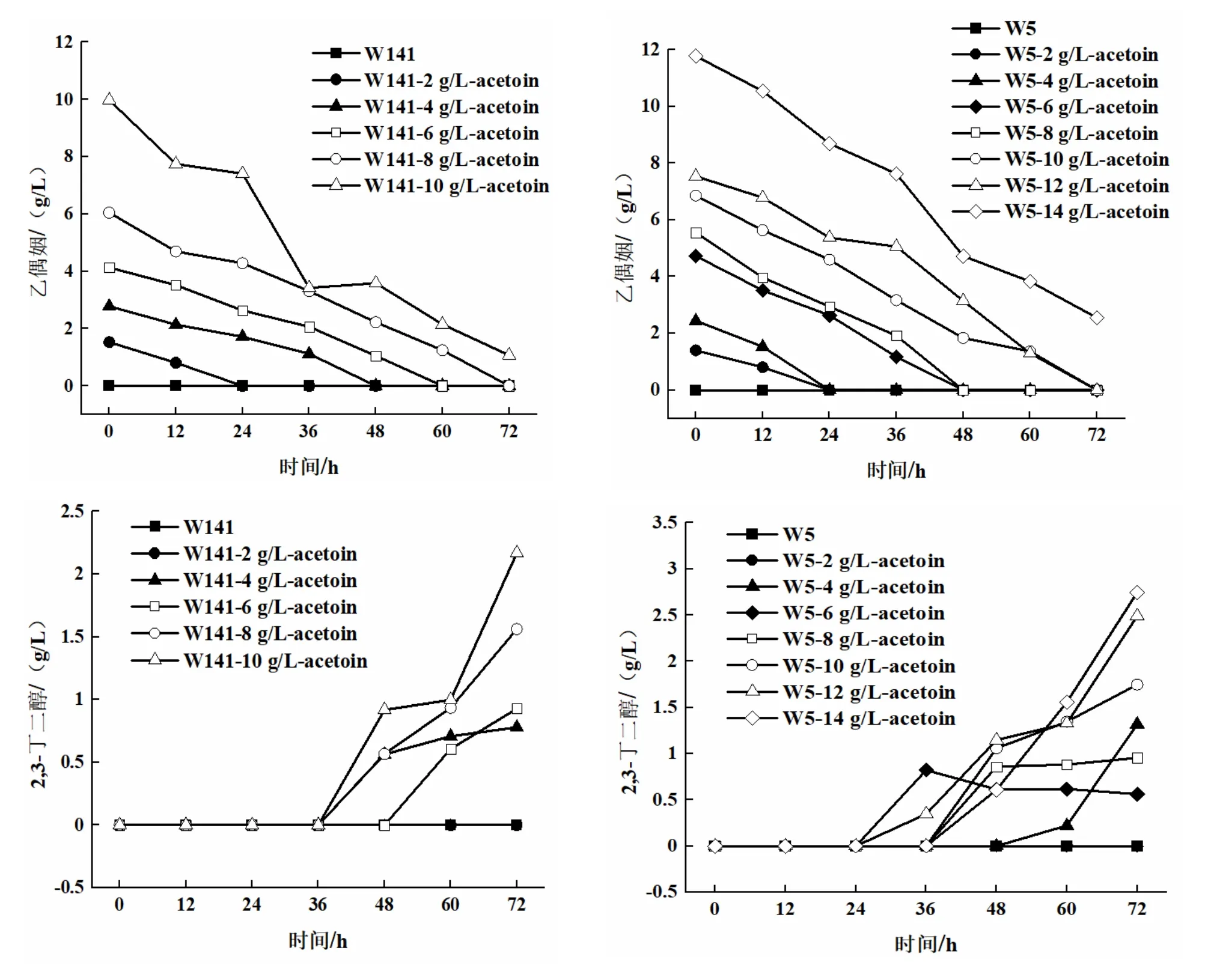
圖3 S.cerevisiae W5/W141的乙偶姻剩余量和2,3-丁二醇產量隨發酵時間變化的關系曲線
由圖3可以看出,外源添加不同濃度的乙偶姻對S.cerevisiaeW5/W141來說,2,3-BD的產量隨著乙偶姻添加量的增加而不斷提高。對于S.cerevisiaeW141而言,當外源添加8 g/L乙偶姻時,2,3-BD的產量達到1.56±0.04 g/L(72 h),乙偶姻在72 h時消耗完全;當外源添加10 g/L乙偶姻時,2,3-BD的產量達到2.17±0.01 g/L(72 h),但乙偶姻并沒有完全被消耗,72 h時積累了1.07±0.01 g/L。對于S.cerevisiaeW5而言,當外源添加12 g/L乙偶姻時,2,3-BD的產量達到2.49±0.02 g/L(72 h);當外源添加14 g/L乙偶姻時,2,3-BD的產量達到2.75±0.03 g/L(72 h),但乙偶姻仍然沒有完全被消耗,72 h時積累了2.55±0.04 g/L。因此,從乙偶姻積累量上考慮,向S.cerevisiaeW5/W141分別添加12 g/L和8 g/L乙偶姻更適合作為后續試驗的最適添加濃度。
2.4 乙偶姻對菌體活性的影響,通過菌體活性輔助說明代謝流向改變的菌體作用
2.4.1S.cerevisiaeW141外源添加8 g/L乙偶姻對的菌體活性的影響 運用細胞活性染色試劑PI對S.cerevisiaeW141/W141-8 g/L菌體進行單染色。將不同時間段的熒光效果利用流式細胞儀對其檢測,FCM圖譜進行熒光差異比較(圖4)。通過對橫坐標(PI單染色)與縱坐標(側向角散射)的對比來對菌體活性情況進行分析(圖5)。
從圖中可知,隨著發酵時間的延長PI染色比例有所提高,并且所有數據都相對集中,S.cerevisiaeW141/W141-8 g/L的變化趨勢大致相同,均在60 h時達到最大分別為1.3%和1.9%,然而,對于流式細胞儀每次所收集的一萬個細胞而言,整體細胞活性幾乎沒有受到影響。
2.4.2S.cerevisiaeW5外源添加12 g/L乙偶姻對的菌體活性的影響 運用細胞活性染色試劑PI對S.cerevisiaeW5/W5-12 g/L菌體進行單染色。將不同時間段的熒光效果利用流式細胞儀對其檢測,FCM圖譜進行熒光差異比較(圖6)。通過對比從而分析菌體活性情況(圖7)。
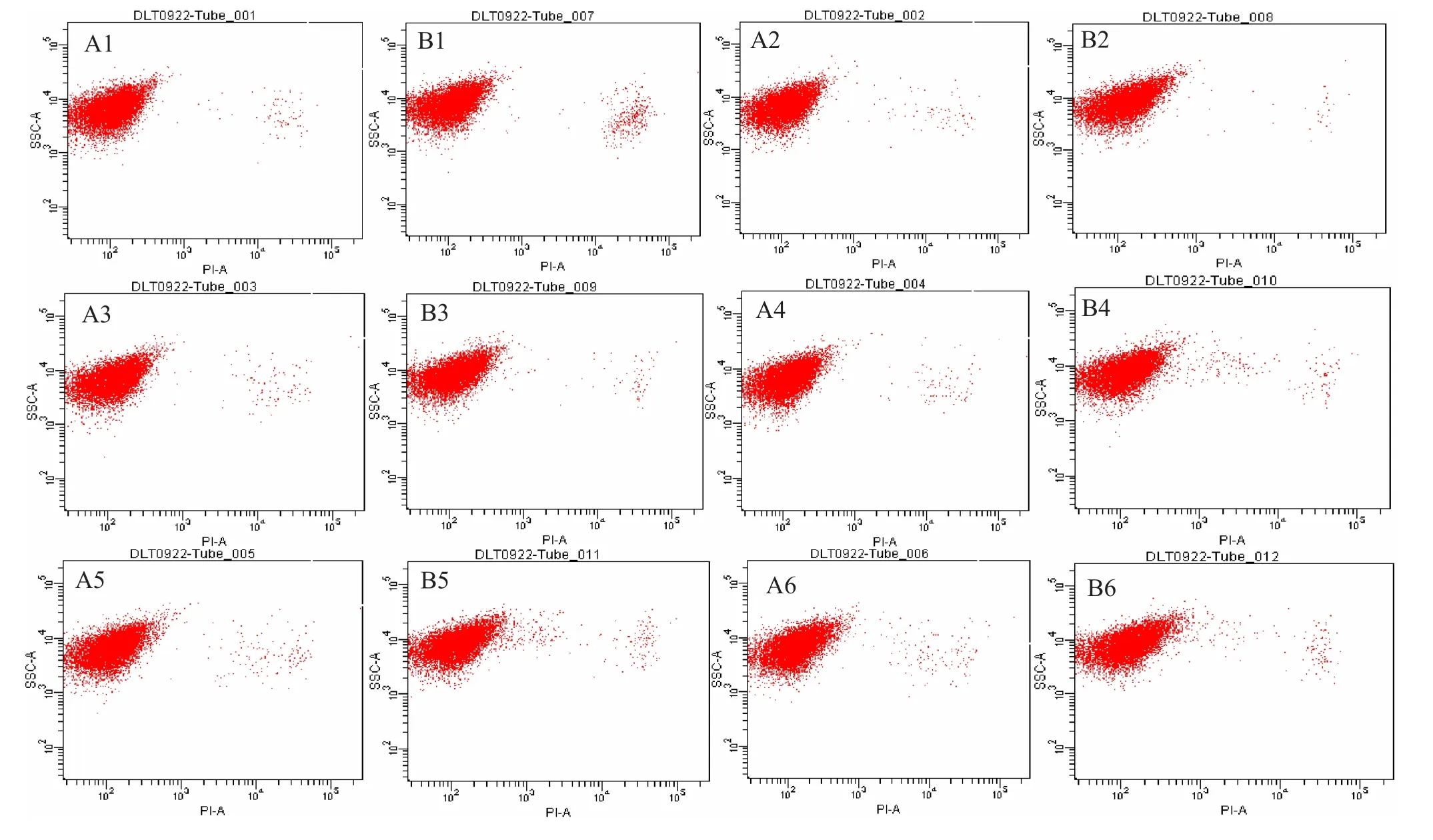
圖4 不同時間段流式細胞術檢測結果
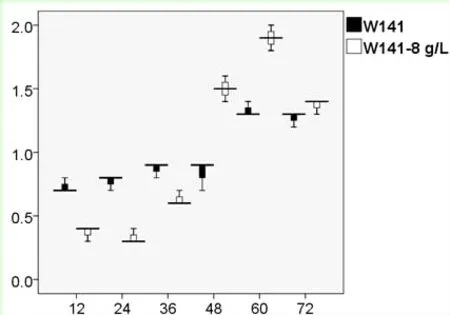
圖5 流式細胞術檢測結果
從圖中可知,隨著發酵時間的延長PI染色比例呈現先上升后下降再上升的趨勢,所有數據都不太集中,與S.cerevisiaeW141/W141-8 g/L的變化趨勢大致相同,均在24 h時達到最大分為0.6%和0.9%。
2.5 電鏡觀察菌體形態
將處理后的樣品通過掃描電鏡觀察菌體外貌形態(圖8)。可以看出,當S.cerevisiaeW141/W5在外源添加適量乙偶姻后,菌體表面圓滑平整,整體飽滿,無明顯變化。
3 結論與討論
本研究前期通過嘗試對丙酮酸脫羧酶的基因pdc1和pdc5進行敲除,在外源添加乙偶姻后,最終導致2,3-BD的產量不高。Yu等[19]敲除S.cerevisiae中的adh1、adh3和adh5基因后進行分批發酵,2,3-BD的產量達到2.29 g/L,與野生型S.cerevisiae相比,乙醇的產量降低31.25%,而2,3-BD的葡萄糖轉化率顯著提高,為0.113 g/g。但弊端是Δadh1、Δadh3、Δadh5會積累大量的毒性物質乙醛,且還會生成一定量的乙醇[20]。而前期試驗結果2,3-BD的產量不高,可能是因為敲除了中心代謝的關鍵酶,所以,當2,3-BD代謝流增強時,菌株產能卻減少了。因為在釀酒酵母中,乙醛和丙酮酸轉化成乙偶姻過程中,丙酮酸脫羧酶在其中起關鍵作用,所以當丙酮酸脫羧酶基因被敲除后,導致關鍵酶的酶活降低,使乙醛和丙酮酸無法更多地轉化成乙偶姻,最終導致菌株產2,3-BD的能力下降[21]。所以在2,3-BD合成過程中,關鍵酶起著至關重要的作用。
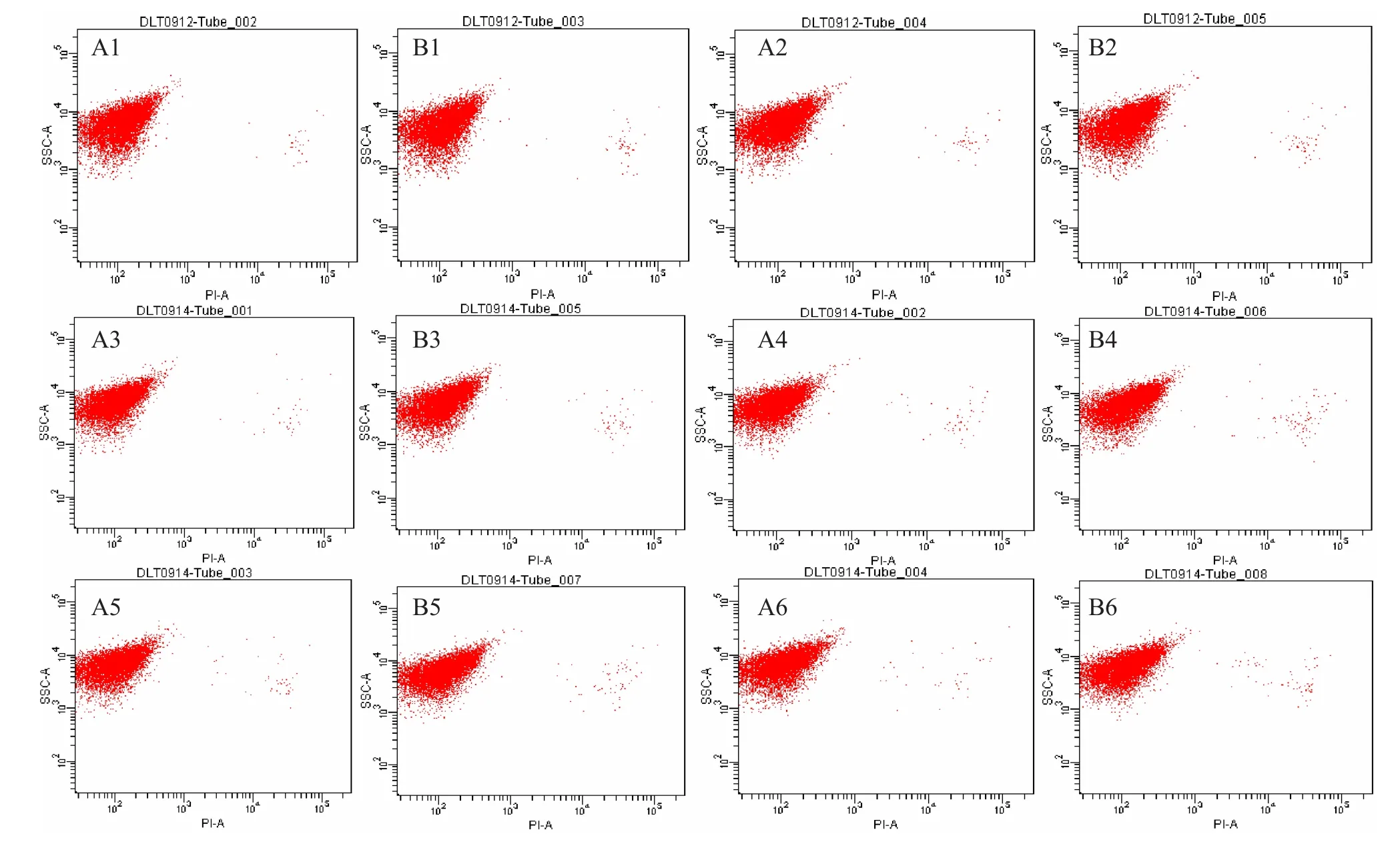
圖6 不同時間段流式細胞術檢測結果
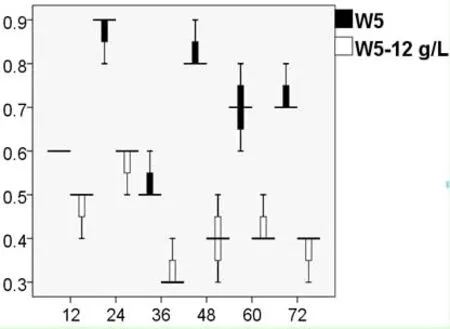
圖7 流式細胞術檢測結果
通過釀酒酵母代謝路徑可知,乙醇、甘油和2,3-BD的合成途徑成為酵母菌代謝的三個主要支路[22]。因此,外源添加適當乙偶姻后促使2,3-BD產量增加的同時,必定減少了乙醇或甘油合成過程中的碳源分配,這可能是因為添加適當乙偶姻后,促進了關鍵基因的表達,從而使2,3-BD的產量有所提高,由于乙偶姻和2,3-BD之間的反應是可逆的[23],所以當2,3-BD產量增加的同時也使丙酮酸到2,3-BD途徑中相關酶的活性增加,所以,碳源在乙醇和甘油合成途徑中減少的情況下,會導致最終的產量下降。同時,乙偶姻和2,3-BD的轉化與NAD+與NADH之間的轉化具有偶聯關系[24]。Ehsani等[25]提出了增加供氧的策略,在敲除ilv2基因并過表達als、aldc和bdh1基因的S.cerevisiae中增加溶氧量,甘油積累減少的同時,葡萄糖合成2,3-BD的理論產量比厭氧條件下高20%。這說明通過改變溶氧調節氧化還原平衡對于生產2,3-BD具有重要意義。Kawai S等[26]將2-丁酮作為外源添加電子受體,使NADH的含量降低,使甘油的產量下降,但2,3-BD的產量明顯提高。Kim S等[27]發現NADH氧化酶可以將NADH氧化成NAD+,為了降低NADH的濃度,在過表達als、aldc和bdh1的基因的S.cerevisiae過程菌株中外源表達乳酸乳球菌(Lactococcus lactis)中的NADH氧化酶,從而將甘油代謝流向2,3-BD,最終使2,3-BD的產量提高了23.8%。所以乙偶姻在被BDH催化生成2,3-BD的同時,也會受到NAD+與NADH含量的影響[28]。
圖8 電鏡觀察結果
本研究將S.cerevisiaeW5/W5-Δpdc1/W5-Δpdc5/W141四株菌株進行試驗對比,挑選出S.cerevisiaeW5/W141最適合作為出發菌株來生產2,3-BD,發現S.cerevisiaeW5和S.cerevisiaeW141外源添加乙偶姻的最適濃度為12 g/L和8 g/L,且當S.cerevisiaeW5最適添加量為12 g/L乙偶姻,且72 h時,2,3-BD的產量最大達到2.49±0.02 g/L,并且乙偶姻在發酵結束前消耗完全;S.cerevisiaeW141最適添加量為8 g/L乙偶姻,且72 h時,2,3-BD的產量最大達到1.56±0.04 g/L。當外源添加適量乙偶姻后,2,3-BD的產量之所以會提高,是因為在整個代謝過程中,乙偶姻與2,3-BD二者處于同一條代謝流中,且乙偶姻作為生產2,3-BD重要的前體物質,當乙偶姻的濃度升高時,同時也會伴隨著最終產物的增加[29]。Brackman G等[30]利用異源過表達枯草芽孢桿菌的關鍵基因acoA和acoB,來增強乙醛轉化為乙偶姻的能力,構建菌株進行分批補料發酵,最終2,3-BD的產量得到提升。Kim S等[31]在S.cerevisiae菌株的基礎上,異源過表達B.subtilis中的alsS和alsD基因和內源bdh1基因后進行分批補料發酵,2,3-BD產量達到了29.1 g/L。理論上講,在抑制乙醇代謝流向并過表達2,3-BD合成途徑后,菌株可以利用葡萄糖經丙酮酸、α-乙酰乳酸、乙偶姻合成2,3-BD,或經丙酮酸和乙醛轉化成乙偶姻,最終合成2,3-BD。因此,說明在代謝過程中,前體物質的增加對產物的產量具有一定促進作用。所以,本研究還可以做進一步的優化。通過代謝過程手段使工程菌株具備利用廉價原料(木質纖維素和藻類)來合成2,3-BD,從而提高生產2,3-BD的能力,但是,該方法是否會影響菌株正常生長,這些都是今后需要去研究的。綜上所述,本研究中選用S.cerevisiaeW5/W141作為出發菌株,通過外源添加適量乙偶姻,使2,3-BD產量得到了一定的提升,從而解決了單一釀酒酵母發酵2,3-BD產量低的問題,也為微生物高產2,3-BD開辟了新的空間。

