自噬在大鼠腦缺血再灌注損傷中的作用及機制研究
陳運轉 呂愛紅 王軍杰 辛 凱 趙 曼△
1)鄭州人民醫院,河南 鄭州 450000 2)河南中醫藥大學第三附屬醫院,河南 鄭州 450000
研究報道缺血性腦血管疾病占腦卒中的80%[1],嚴重危害人類健康。大腦缺血后,如果腦組織壞死前閉塞的腦血管再通,會導致腦神經損傷進一步加重,即腦缺血再灌注損傷,這是多種腦血管疾病的重要病理生理基礎。腦缺血后不可避免地發生缺血再灌注損傷,腦缺血再灌注損傷的確切機制尚未完全闡明,目前研究表明氧化應激、炎癥、凋亡在其中起非常重要的作用[2-5]。自噬(autophagy)指細胞內的溶酶體降解自身損壞的細胞器和其他無用的大分子過程,對于維持缺氧、營養缺乏等壓力條件下的細胞穩態和生存具有至關重要的作用[6-7]。最近的研究顯示自噬可能參與對腦缺血/再灌注后的神經元損傷,其不僅可以通過經典的溶酶體途徑清除受損的細胞器和生物大分子,而且可以通過影響凋亡和壞死的發生、發展調控神經元死亡[8]。微血管病變和血栓形成所致的腦神經損傷是狼瘡腦病的主要病理基礎,有研究發現自噬障礙與狼瘡腦病的發生有關。然而,目前對腦缺血再灌注損傷中自噬現象的研究尚不深入。腦缺血再灌注損傷后,自噬如何激活以及自噬參與腦神經損傷的作用機制尚未明確。因此,本實驗旨在通過研究自噬在腦缺血再灌注中發揮的作用,以期進一步了解自噬在神經細胞損傷中的機制,為將來通過調控細胞自噬治療狼瘡腦病提供理論依據。
1 材料與方法
1.1實驗動物健康雄性SD大鼠(n=108),鼠齡3~4個月,體質量220~250 g(北京華阜康公司)。
1.2主要試劑3-甲基腺嘌呤(美國Sigma公司),10%水合氯醛(北京化工三廠),2,3,5-氯化三苯基四氮唑(TTC)(北京中杉金橋生物技術有限公司)。
1.3動物分組及模型制作
1.3.1 動物分組:選用健康SD大鼠(n=108),隨機分為3組各36只:①假手術組;②對照組;③3-MA組,然后根據再灌注時間(6 h、12 h和24 h)將各組再隨機分為3個亞組各12只。假手術組:手術分離右側頸總動脈;對照組:腦缺血再灌注損傷模型建立前30 min,左側側腦室注射0.9%氯化鈉注射液0.6 μL;3-MA組:腦缺血再灌注損傷模型建立前30 min,左側側腦室注射3-MA溶液0.6 μL(約合600 nmoL)。
1.3.2 建立模型:參照以往實驗方法并改良,建立腦缺血再灌注動物動物模型:①10%水合氯醛(3.0 mL/kg)腹腔注射麻醉;②麻醉后將大鼠固定在操作臺上,取仰臥位;③頸部正中縱行切開長約3.0 cm的皮膚,游離皮下組織;④游離右側頸總動脈,并向頭部游離,自頸總動脈分叉處向遠端分離頸外動脈和頸內動脈;⑤動脈夾夾閉頸內動脈;頸總動脈末端處剪一小口,向近端牽拉頸總動脈殘端結扎線,將頸總動脈末端和頸內動脈方向一致,將線栓處理端置入,留線適當結扎;⑦取下動脈夾,向遠端插入線栓,插入深度18~20 mm;⑧結扎頸總動脈殘端插線處,固定線栓,將結扎絲線剪斷;皮膚外保留線栓尾端10 mm,逐層縫合;⑨2 h后,大鼠麻醉狀態下向近端牽拉線栓使血供恢復,并剪斷線栓尾端。
1.4模型成功的判定假手術組大鼠術后未見神經功能缺失,對照組和3-MA組大鼠經過手術后可見,栓塞對側的大鼠肢體出現行走異常或活動性功能障礙,嚴重的出現昏迷,據此證實大鼠局灶性腦缺血再灌注損傷模型制作成功。
1.4.1 神經行為學評分:采用Longa 5[9]分法,根據實驗分組在相應時點對大鼠神經行為學進行評分。評分標準:0分:無神經功能缺失癥狀;1分:提尾懸空后不能伸展左側前爪;2分:行走向左側轉圈;3分:行走困難,并向左側傾倒;4分:不能自發行走或昏迷。評分1~3分大鼠納入研究。
1.4.2 TTC染色:根據實驗分組在相應時點,10%水合氯醛以劑量4.0 mL/kg注射于大鼠腹腔,麻醉滿意后處死。取出腦組織,將小腦、腦干低位切除出來,冷凍在-20 ℃冰箱 min,冠狀位,由前向后將腦組織切成5片,快速放入2%TTC溶液中,在37 ℃恒溫干燥箱中避光染色30 min(中間翻轉幾次,均勻、充分染色),最后將腦組織切片用4%多聚甲醛溶液固定,24 h后拍照,正常腦組織與TTC反應呈紅色,腦梗死組織呈蒼白色。TTC圖像分析系統測定梗死面積與腦片面積百分比值。
1.4.3 腦組織含水量:根據實驗分組在相應時點,10%水合氯醛麻醉后斷頭處死。快速取出腦組織,將嗅球、小腦、腦干分離出來,分離后的腦組織沿中線分為左右半球,將右側大腦半球放在精密電子天平,稱重為腦組織濕質量。后置于電熱恒溫(70 ℃)干燥箱,72 h后恒質量(連續兩次腦組織稱質量差<0.001 g),稱重為腦組織干質量。根據Elliot公式,計算出各組大鼠腦組織干濕質量百分比。Elliot公式:腦組織含水量%=(濕質量-干質量)/濕質量×100%。
1.4.4 透射電子顯微鏡:①電鏡標本制作:根據實驗分組在相應時點,10%水合氯醛麻醉后斷頭處死。快速取出腦組織,在冰上將右側海馬組織分離出來,后將其切割成體積約1 mm3的組織塊,預冷2.5%戊二醛溶液,將組織塊迅速放入其中,4 ℃冰箱保存,完成預固定。②電鏡切片制備流程及染色:漂洗→后固定→脫水→浸透→包埋→切片及染色→攝片(透射電子顯微鏡觀察海馬神經細胞)。

2 結果
2.1神經行為學評分依據Longa 5分法,對大鼠神經行為學進行評分。假手術組大鼠相應時點未出現神經功能缺失癥狀,對照組和3-MA組大鼠相應時點出現神經功能缺失癥狀,如行走向左側畫圈、向左側傾倒、偏癱、追尾現象、前爪抓力下降、后肢向后移位、爬行困難等。對照組和3-MA組大鼠相應時點Longa評分與假手術組組間比較差異均有統計學意義(P<0.05)。對照組和3-MA組大鼠相應時點Longa評分組間比較差異均有統計學意義(P<0.05)。見表1。
2.2TTC染色假手術組大鼠相應時點腦組織未見梗死灶,呈紅色,均勻一致。對照組和3-MA組大鼠相應時點左側腦組織呈紅色,均勻一致,未見梗死灶,右側腦組織見邊界清楚、面積不等的呈蒼白色的梗死灶。對照組和3-MA組大鼠相應時點腦梗死體積百分比與假手術組組間比較差異均有統計學意義(P<0.05)。對照組和3-MA組大鼠相應時點腦梗死面積百分比組間比較差異均有統計學意義(P<0.05)。見表2、圖1。
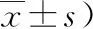
表1 各組大鼠Longa評分結果 (分,
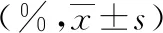
表2 各組大鼠腦梗死面積百分比結果
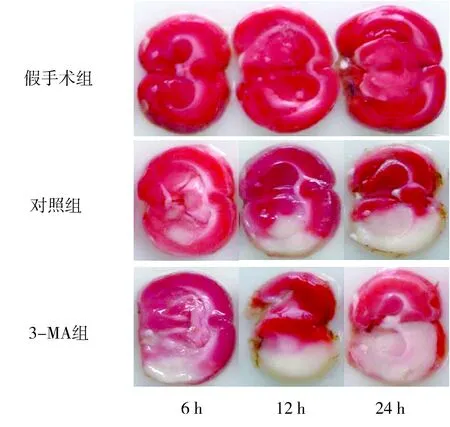
圖1 各組大鼠TTC染色觀察Figure 1 TTC staining observation of rats in each group
2.3腦組織含水量假手術組大鼠相應時點腦組織含水量大致保持恒定,對照組和3-MA組大鼠腦組織含水量隨著時間的推移而升高。對照組和3-MA組大鼠相應時點腦組織含水量與假手術組組間比較差異均有統計學意義(P<0.05)。對照組和3-MA組大鼠相應時點腦組織含水量組間比較差異均有統計學意義(P<0.05)。見表3。
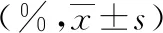
表3 各組大鼠腦組織含水量結果
2.4透射電子顯微鏡假手術組大鼠相應時點海馬神經細胞中細胞器(線粒體、高爾基體)結構完整,細胞核膜完整,細胞核內染色質均勻分布,未見細胞自噬現象。對照組大鼠在6 h時海馬神經細胞內見線粒體腫脹,內質網破壞,部分嵴斷裂,可見少量初級、次級溶酶體,可見少量自噬溶酶體,可以觀察到略有固縮凝集的細胞核染色質;在12 h、24 h時對照組大鼠的海馬神經細胞內見明顯腫脹的線粒體,且出現空泡樣線粒體,內質網破壞較前更加嚴重,嵴斷裂更加明顯,各級溶酶體數量較前增多,出現空泡狀自噬溶酶體,同時可以觀察到大鼠海馬神經細胞出現細胞凋亡時的形態改變,細胞核染色質附著于細胞核膜下,呈半月狀或結節狀團塊,細胞核膜破裂。見圖2。

圖2 各組大鼠透射電子顯微鏡觀察(×12 000)Figure 2 Transmission electron microscope observation of rats in each group (×12 000)
3 討論
腦是機體最重要的器官之一,其重量雖然僅占人體質量的2%~3%,但其所需血流量卻占心輸出量的20%,血供非常豐富,因此腦組織對血流灌注依賴性非常強。腦缺血再灌注時腦組織非常依賴的微循環發生障礙、細胞代謝紊亂,一系列病理生理改變相繼發生,最終導致大腦出現形態結構損傷性改變、功能障礙等[10-11]。實驗研究表明鼠頸動脈被阻斷后腦膜內微血管收縮顯著,有些微血管周圍能夠見到滲出,通過再灌流,腦膜缺血的情況雖然得到部分改變,但仍然不能達到阻斷前水平[12]。腦對缺氧高度敏感,且神經細胞高度依賴葡萄糖酵解提供能量,故長時間腦缺血勢必將導致缺血區域神經細胞水腫、電活動停止、功能障礙,細胞自噬和細胞凋亡被激活,神經細胞甚至極有可能會發生不可逆的損傷。
對于腦缺血再灌注損傷,以往研究的其病理機制主要集中在線粒體損傷、氧自由基損傷、興奮性氨基酸的細胞毒性作用、炎癥反應、神經細胞內鈣離子超載以及凋亡基因激活等方面[13],如腦缺血再灌注損傷后產生的大量自由基,會破壞線粒體結構和功能,導致一些酶活性丟失,從而引發一系列的病理過程。自噬廣泛存在于真核細胞內,是一種溶酶體依賴的降解過程,屬高度保守的生理機制,與細胞分化、存活和維持內環境的穩態密切相關[14-15]。近年來,越來越多的研究表明自噬參與了腦缺血再灌注損傷的發生發展過程[16-18]。腦缺血再灌注損傷可以誘導自噬現象的發生[19-20]。當腦組織缺血、缺氧后,組織內發生能量代謝障礙、大量的氧自由基產生堆積、興奮性氨基酸的釋放及內質網應激等,這些因素都可誘導自噬的發生。
然而自噬在缺血再灌注損傷過程中到底起著保護還是損傷的作用一直是有爭議的[21-23]。近年來的研究更多顯示,在腦缺血再灌注損失中自噬的激活可以起到保護神經元、減輕缺血性損傷的作用。自噬發揮神經細胞保護作用[24],機制可能包括以下幾方面:(1)細胞內耗能產物降解,內環境穩態維持,細胞死亡延遲;(2)受損線粒體降解,細胞凋亡抑制[25];(3)神經突觸降解,能量提供[26]。PENG等[27]在神經元的原代培養試驗中發現,線粒體融合蛋白Mitofusin-2可以通過促進自噬的發生顯著改善腦缺血再灌注損傷。CARLONI等[28]研究發現,新生大鼠缺血缺氧后可以在短時間內觀察到自噬的激活,當用自噬抑制劑三甲基腺嘌呤或渥曼霉素后,新生大鼠損傷加重;相反,當應用自噬激動劑雷帕霉素后可以使新生大鼠的腦損傷程度減輕。研究顯示,在大鼠局灶性腦缺血再灌注模型中再灌注階段可以觀察到自噬的激活,從而起到對神經元的保護作用,不論是用自噬抑制劑3-MA還是敲除自噬相關基因Atg7基因都會增加細胞色素C的釋放和細胞凋亡的發生,從而對加重神經元的損害[25]。CAI等[29]研究也發現,甘氨酸對缺氧缺血性腦損傷保護作用,可能是通過AMPK途徑調節線粒體自噬進而實現的。上述研究均表明自噬在腦缺血再灌注過程中是具有保護作用的。
本研究中假手術組大鼠相應時點腦組織未見梗死灶,對照組和3-MA組大鼠左側腦組織未見梗死灶,右側腦組織見邊界清楚、面積不等呈蒼白色的梗死灶。對照組和3-MA組大鼠相應時點梗死灶面積占比比較差異均有統計學意義。HE染色見假手術組大鼠相應時點海馬神經細胞形態完整,呈層狀分布;3-MA組大鼠海馬神經細胞出現不同程度消失,海馬神經細胞正常結構大部分破壞;較3-MA組,對照組大鼠相應時點海馬神經細胞雖然也消失,但大部分海馬神經細胞正常結構尚存在。本研究可見腦缺血再灌注可致神經細胞損傷,細胞出現自噬現象,表現為大鼠神經功能缺失,缺血側腦組織見梗死灶,梗死灶內海馬神經細胞受損。
本研究表明,腦缺血再灌注損傷中3-MA作為自噬的抑制劑可致神經元損傷加重,自噬的激活可能發揮神經保護作用。缺血再灌注可致神經細胞損傷,細胞出現自噬現象,表現為大鼠神經功能缺失,缺血側腦組織見梗死灶,梗死灶內海馬神經細胞受損,細胞內自噬溶酶體顯著增多;在腦缺血再灌注損傷中抑制細胞自噬可致神經元損傷加重,自噬的激活可能對神經細胞發揮保護作用。

