外排泵抑制劑CCCP對不同耐藥機制介導的沙門菌黏菌素耐藥性的逆轉作用
崔小蝶,易開放,楊影影,賀丹丹,吳 華,苑 麗,胡功政
(河南農業大學 動物醫學院,河南 鄭州 450046)
沙門菌是一種人畜共患病原菌,給我國養殖業造成了巨大威脅。黏菌素(Colistin,COL)是治療動物革蘭氏陰性桿菌感染包括沙門菌病的常用有效藥物。但隨著其廣泛使用,沙門菌對其耐藥性也日益嚴重,給臨床治療帶來了巨大的挑戰。目前,已闡明的細菌對黏菌素耐藥的機制主要有2種[1-2]:一是染色體介導的2個雙組分信號轉導系統(TCS)PhoPQ和PmrAB(包括2個調控元件MgrB和PmrD)。PmrAB和PhoPQ中的基因發生突變,可使其下游的pmrC、pmrH等脂多糖(LPS)修飾相關基因的表達量上升,進而使細菌的類脂A發生4-氨基-4-脫氧-L-阿拉伯糖(Ara4N)或磷酸乙醇胺(pENT)修飾,使細菌表面的負電荷減少,降低了細菌對陽離子多肽黏菌素的吸附而產生耐藥[3]。mgrB基因的缺失、變異、插入或截斷失活,可引起PhoPQ系統的上調,進而導致下游pmrHFIJKLM基因表達的上調,最后導致對黏菌素耐藥[4-5]。二是質粒介導的黏菌素耐藥基因mcr。2015年,我國首次在動物源大腸埃希菌中發現了質粒介導的黏菌素耐藥基因mcr-1[6]。隨后,7個新的質粒介導的黏菌素耐藥基因mcr2—mcr8也陸續在中國或歐洲國家被發現[7]。
細菌外排泵對藥物的外排作用是細菌對多種抗生素耐藥的重要機制之一。許多外排泵可以降低細菌對抗菌藥物的敏感性,如MexXY-OprM和AcrAB-TolC[8-9]。外排泵抑制劑(Efflux pump inhibitors,EPIs)可通過不同的機制失活或抑制AcrAB-TolC等外排泵的功能。已發現的EPIs有多種,氰氯苯腙(CCCP)是一種抑制質子轉運的解偶聯劑,可以阻斷主動外排系統能量來源,使藥物在細菌體內的蓄積量增加,恢復細菌對藥物的敏感性[10]。已證明CCCP對氟喹諾酮類、四環素類等抗菌藥物的抗菌作用有增強作用[11]。近年的研究表明,CCCP能逆轉肺炎克雷伯菌、大腸桿菌等對黏菌素的耐藥性[12-14],但對動物源沙門菌黏菌素耐藥性的影響尚未見報道。為此,觀察CCCP對不同耐藥機制的沙門菌分離菌株黏菌素耐藥性的逆轉作用,為尋找控制耐黏菌素沙門菌感染的聯合用藥措施提供理論依據。
1 材料和方法
1.1 材料
1.1.1 菌株 供試菌株:2018—2019年從河南省部分養殖場的疑似沙門菌病的病死雞肝臟樣品分離到58株沙門菌,從中隨機選擇8株黏菌素耐藥沙門菌為受試菌株。全基因組測序對照菌鼠傷寒沙門菌標準株(CVCC?541)購自中國獸藥監察所;質控菌株為大腸埃希菌ATCC?25922,購自中國普通微生物菌種保存中心。
1.1.2 主要試劑和藥品 主要培養基LB肉湯、LB瓊脂、SS瓊脂、MHB肉湯培養基等均購于青島海博生物技術有限公司。瓊脂糖(Takara公司,Japan)、2×EsTaqMasterMix(北京康為世紀生物技術有限公司)、50×TAE(北京索萊寶生物科技有限公司)、熒光染料溴化乙錠(上海生工生物技術服務有限公司)。細菌基因組DNA提取試劑盒(DP302)購于天根生化科技(北京)有限公司。CCCP(含量≥97%)購于美國Sigma公司。黏菌素(效價23 988 u/mg)購于河北圣雪大成唐山制藥有限責任公司。
1.2 試驗方法
1.2.1 供試菌株分離 將221份病料分別均勻涂布于SS培養基上,37 ℃培養16~18 h,挑取單個菌落接種于LB肉湯,放于水浴恒溫振蕩器12 h,再次接種于SS培養基,如此反復直至SS培養基上均為純黑色的單個菌落。挑取單個的黑色菌落接種于5 mL的LB肉湯中,放置于37 ℃搖床中180 r/min振蕩培養,16~18 h后取出備用。
1.2.2 供試菌株鑒定 將分離到的菌株采用裂解法提取基因組DNA。參考文獻[15-16]的引物及反應條件,分別進行沙門氏菌侵襲基因invA和16S rRNA的PCR擴增鑒定。取PCR反應產物1%瓊脂糖凝膠電泳,溴化乙錠染色,凝膠系統下觀察結果。PCR產物送上海生工生物技術服務有限公司進行測序分析。PCR陽性菌株同時進行基質輔助激光解吸電離飛行時間質譜(MALDI-TOF/MS)鑒定。引物由上海生工生物技術服務有限公司合成。
1.2.3 供試藥液的配制及保存 用分析天平稱取黏菌素,用漩渦振蕩儀進行振蕩混勻制備質量濃度為5 120 mg/L抗菌藥物原液。用二甲基亞砜(DMSO)制備5 000 mg/L質量濃度的CCCP原液。采用0.22 μm的濾膜進行過濾除菌,儲存于4 ℃以備后續使用。
1.2.4 CCCP對沙門菌黏菌素耐藥性的逆轉作用 用微量肉湯稀釋法[17]測定黏菌素及其添加外排泵抑制劑CCCP(終質量濃度為5 mg/L)對隨機選擇的8株黏菌素耐藥沙門分離株的最小抑菌濃度(MIC)。以MHB肉湯、MHB肉湯+菌株、MHB肉湯+菌株+5 mg/LCCCP為對照。質控菌株為大腸埃希菌ATCC25922。重復操作3次,藥敏結果判斷依據CLSI標準[17]:黏菌素MIC≥4 mg/L為耐藥,黏菌素MIC 2~4 mg/L為中介,黏菌素MIC<2 mg/L為敏感。
1.2.5 黏菌素的耐藥機制
1.2.5.1 質粒介導的黏菌素耐藥基因mcr的檢測 以隨機選擇的8株黏菌素耐藥沙門菌基因組DNA為模板,參考文獻[7,18]的引物及反應條件進行PCR反應和測序分析,檢測質粒介導的黏菌素耐藥基因mcr1—mcr8。同時進行8株沙門菌的全基因組測序:用基因組DNA提取試劑盒提取8株細菌的基因組DNA,操作步驟按照天根生化科技(北京)有限公司的提取試劑盒說明書方法進行。提取的基因組DNA送安諾優達基因科技(北京)有限公司進行測序,采用二代測序平臺Illumina Hiseq X Ten進行全基因組測序分析。使用FastQC進行測序質控,SPAdes進行序列的拼接組裝,RAST(http://rast.nmpdr.org)進行基因預測及功能注釋。對上述2種測序結果中的mcr序列與NCBI數據庫中的mcr序列進行比對與分析。
1.2.5.2 染色體介導的耐藥機制分析 據上述測序結果,基于基因組學序列分析的方法,先將NCBI數據庫中收錄的鼠傷寒沙門菌標準株(CVCC?541)完整測序序列下載,并構建本地數據庫。再將雙組份信號轉導系統PhoPQ和PmrAB相關基因序列作為咨詢序列,與上述構建好的本地數據庫進行比對分析。同時參照NCBI數據庫中已提交的基因序列合成引物,PCR擴增phoP、phoQ、pmrA、pmrB、mgrB、pmrD和pmrC全基因序列,引物序列見表1。PCR產物送上海生工生物技術服務有限公司進行測序分析。

表1 PhoPQ和PmrAB雙組份相關基因的引物序列
2 結果與分析
2.1 菌株的分離與鑒定
221份病死雞肝臟樣品中有58份在SS培養基上長出半透明或不透明以及黑色的圓形菌落;58份樣品的侵襲基因invA(圖1)和16S rRNA中,有32份可以擴增出與陽性對照片段大小一樣的特異性條帶。PCR產物測序結果利用DNA Star軟件與NCBI數據庫中的序列進行比對,確定為沙門菌invA和16S rRNA基因序列。MALDI-TOF-MS鑒定結果經軟件分析后,與數據庫中的沙門菌同源性達到98%以上。由以上結果可以判斷,58份疑似樣品分離的菌株中有32株為沙門菌。
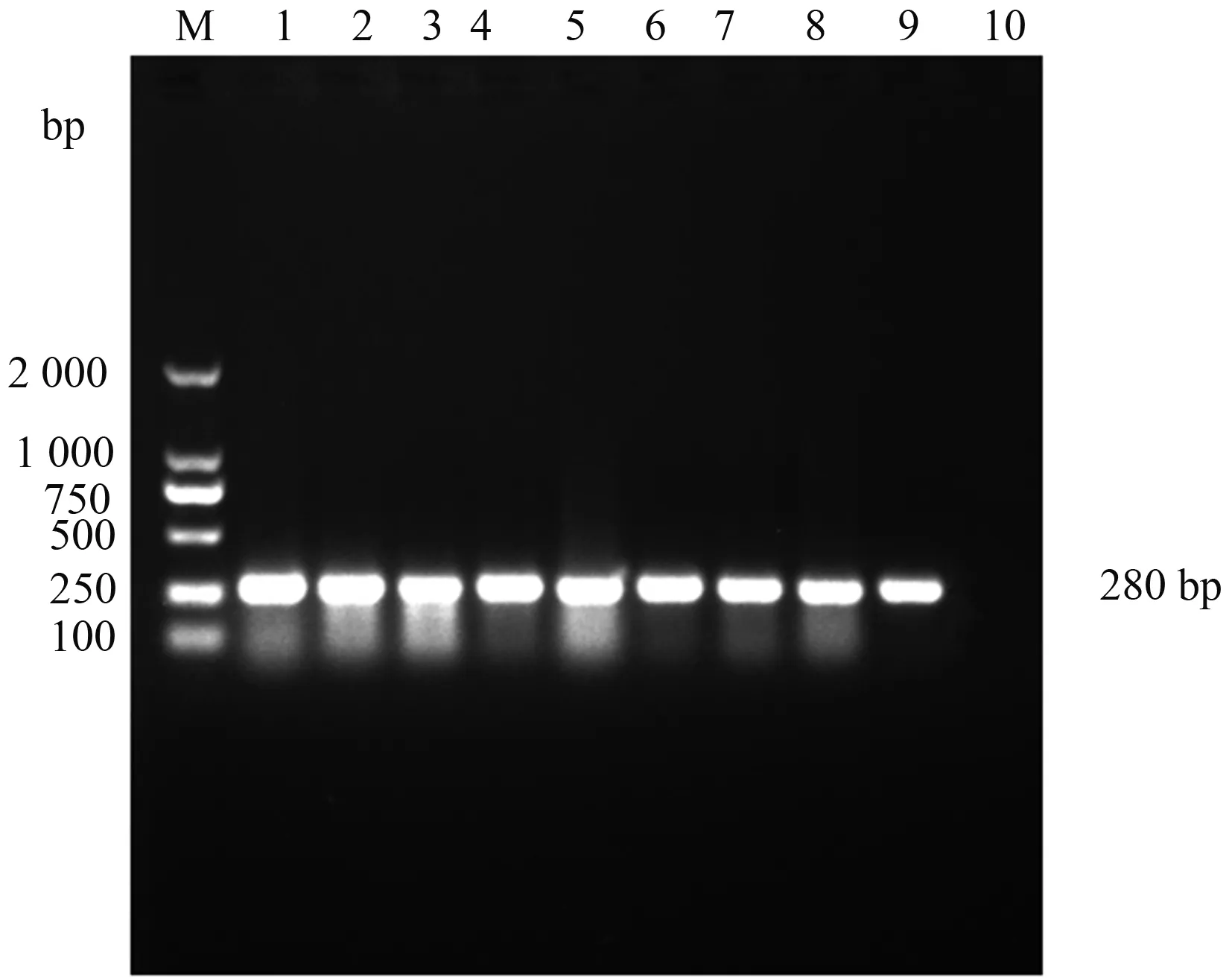
M:DNA Marker 2 000;1—8:菌株樣品;9:陽性對照;10:陰性對照
2.2 CCCP對分離沙門菌菌株黏菌素耐藥性的逆轉作用
藥敏結果表明,32株沙門菌中共有19株對黏菌素耐藥,隨機挑選8株耐藥菌進一步觀察了CCCP與黏菌素聯用的MIC(表2)。8株沙門分離株的編號為SH01—08。從表2可以看出,黏菌素對質控菌 ATCC?25922的MIC在CLSI規定的范圍內。加入外排泵抑制劑CCCP后,9株細菌對黏菌素的敏感性明顯增強,CCCP增強了黏菌素的抗菌活性,降低了黏菌素對不同耐藥機制菌株(mcr-1陽性、PhoPQ和PmrAB相關基因的突變)的MIC。4株mcr-1陽性菌株的MIC平均降低了1/832,4株mcr-1陰性菌株的MIC平均降低了1/1 920。CCCP能逆轉所有菌株對黏菌素的耐藥性,黏菌素耐藥率由100%降低到了0。對照試驗表明,CCCP在5 mg/L質量濃度下對細菌沒有抑制作用。

表2 分離沙門菌菌株加入CCCP前后的黏菌素MIC
2.3 黏菌素的耐藥機制
在8株隨機選擇的黏菌素耐藥沙門菌中,如圖2所示,有4株沙門菌可見與mcr-1陽性對照一致的309 bp的擴增片段,未擴增到其他亞型的黏菌素耐藥基因mcr2—mcr8。全基因組二代測序檢測mcr1—mcr8結果與PCR擴增結果一致。對測序結果序列進行比對和分析,結果顯示,所檢測的mcr-1序列與NCBI數據庫中的沙門菌mcr-1序列(GenBank:MN873698)同源性達到99%以上,確定為mcr-1陽性菌株。
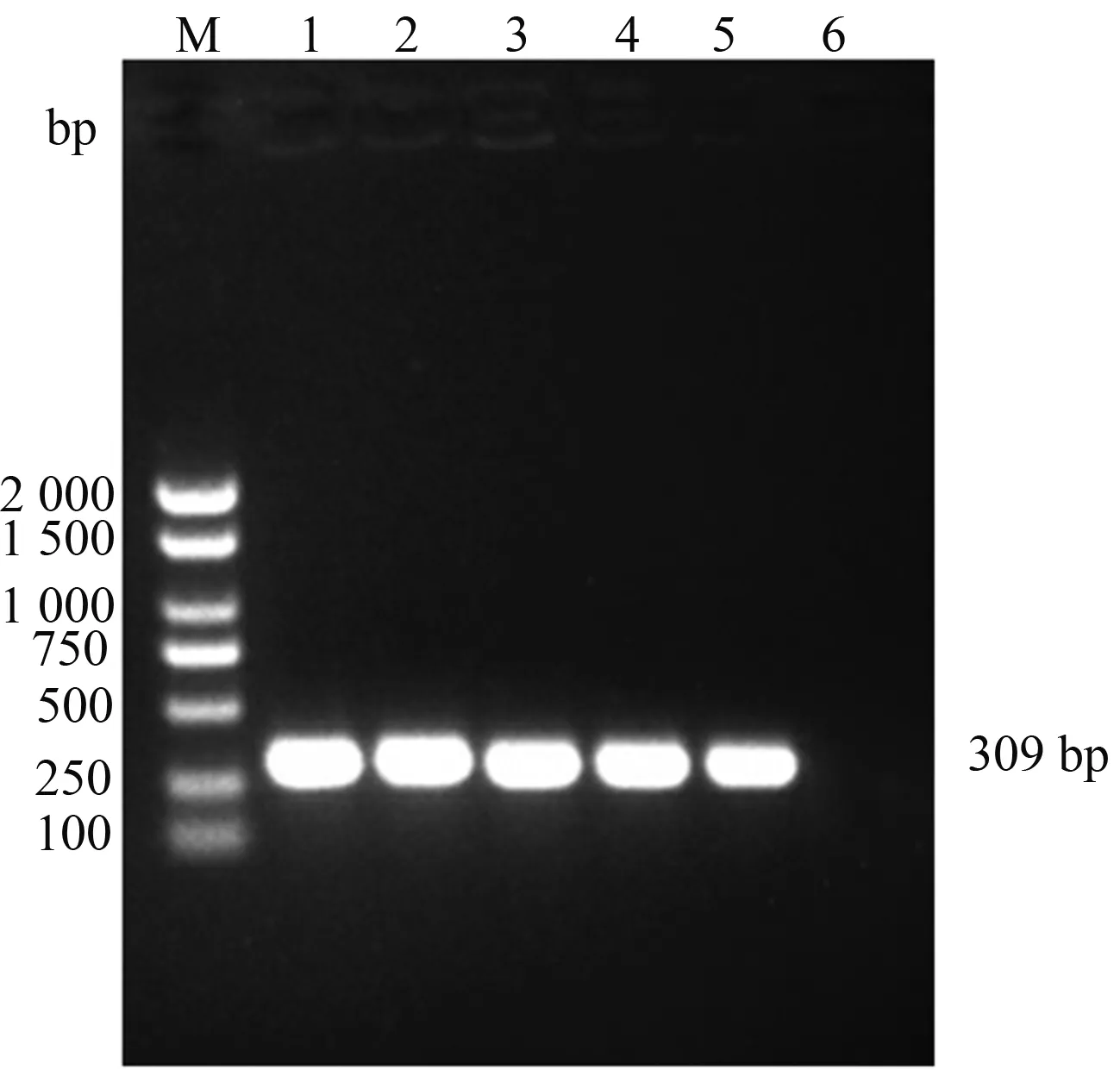
M:DNA Marker 2 000;1—4:菌株樣品;5:陽性對照;6:陰性對照
8株沙門菌全基因組二代測序檢測mcr-1與雙組份信號轉導系統PhoPQ和PmrAB相關基因編碼的氨基酸突變見表3。mcr-1陽性菌株SH04,同時存在mgrB基因編碼的氨基酸Y31D突變。與鼠傷寒沙門菌標準株(CVCC?541)比較,4株mcr-1陰性菌株中,菌株SH02的pmrB蛋白有2處氨基酸突變,分別是R248P和E292K;mgrB蛋白提前1個色氨酸(W)終止翻譯。菌株SH03的pmrC蛋白有4處氨基酸突變:L77P、A159V、G232S、E415Q。菌株SH05的mgrB蛋白提前1個色氨酸(W)終止翻譯;同時pmrC蛋白的突變與菌株SH02相同。菌株SH07的mgrB蛋白有2處氨基酸突變:F44L、I58F。未發現phoP、phoQ、pmrA和pmrD中的氨基酸變異。PCR測序結果與全基因組二代測序結果一致。

表3 分離菌株全基因組測序中部分耐藥基因編碼的氨基酸突變結果
3 結論與討論
本研究表明,黏菌素對8株耐黏菌素的沙門菌分離菌株的MIC介于4~32 mg/L,黏菌素聯合CCCP后,與單藥相比MIC明顯下降(下降了1/4 096~1/256)。CCCP增強了耐藥菌對黏菌素的敏感性,逆轉了所有沙門菌的黏菌素耐藥性。黏菌素的耐藥機制結果顯示,8株耐黏菌素分離菌有4株為mcr-1陽性,其中,菌株SH04同時存在雙組份信號轉導系統PhoPQ和PmrAB相關基因突變(mgrB變異);其余4株均為PhoPQ和PmrAB相關基因突變菌株。藥敏試驗結果表明,CCCP對不同耐藥機制的沙門菌的黏菌素MIC的影響并無差異,對8株沙門菌黏菌素耐藥性均有逆轉作用。CCCP作為外排泵抑制劑時的質量濃度一般在10~20 mg/L[11-13],而本研究中10~20 mg/L的CCCP質量濃度對于沙門菌有抑制作用,故本試驗選用質量濃度為5 mg/L,發現該質量濃度下CCCP本身對沙門菌沒有抑制作用。可見,CCCP對黏菌素抗菌增強作用并不是由于其本身的抗菌活性,而是由于其抑制外排泵而發揮逆轉耐藥性的作用。
細菌的主動外排系統是細菌產生多重耐藥的重要機制。外排泵系統已經被報道在黏菌素耐藥中能夠發揮作用,如大腸桿菌中的AcrAB-TolC[19]和銅綠假單胞菌中的MexXY-OprM[8]。EPIs已經用于評估外排泵系統的上調對黏菌素抗性的作用。EPI對粘菌素抗性的影響因EPI類型而異。PABN和1-(1-萘甲基)-哌嗪(NMP)是被認為與AcrB作用位點中的藥物競爭起作用的EPI[20],但是未能恢復對黏菌素耐藥的革蘭氏陰性菌的黏菌素敏感性[14,21]。然而,非特異性的EPIs CCCP和2,4-二硝基苯酚(DNP)在恢復黏菌素敏感性方面表現出良好的活性[14,21]。有研究表明,外排泵抑制劑CCCP能顯著降低黏菌素對多種革蘭氏陰性菌的MIC[13]。由于CCCP作用于外排泵的能量源-質子動力,并能調節膜內其他蛋白質的活性,因此很難確定CCCP發揮降低黏菌素抗性的機制。黏菌素是通過破壞陰性菌帶負電荷的外膜而降低細胞膜穩定性,使細胞內重要物質外流產生殺菌作用[22]。因此,CCCP增強黏菌素抗菌活性并不是通過常規的降低細胞內藥物外排、增加細胞內濃度達到的,而是通過其他間接的機制來增加細菌對黏菌素敏感性。NI等[14]報道,CCCP對黏菌素活性的影響可能是由于細胞膜上負電荷的再生引起。PARK等[21]發現,CCCP引起的ATP生成減少可能是這些細胞中黏菌素活性增加的原因。為了更好地解釋這一機制的復雜作用原理,需要進一步研究外排泵抑制黏菌素抗性的機制,特別是通過描述外排泵基因及其在不同耐藥機制的耐藥菌株中的表達。
本研究結果表明,CCCP對不同耐藥機制的耐黏菌素沙門菌的黏菌素MIC的影響并無差異,說明CCCP是一種增強黏菌素活性的廣譜增效劑。將抗生素與增強其活性的增效劑結合,是解決抗生素耐藥和耐藥菌感染的重要策略。合理聯合用藥對于增強療效、擴大抗菌譜、減少用量、降低或避免不良反應、減少或延緩耐藥菌株的產生都具有重要意義。本研究發現,CCCP能廣譜逆轉分離菌黏菌素的耐藥性,但CCCP由于安全性問題,尚不能臨床應用。由于抑制外排泵能有效逆轉黏菌素耐藥性,故選用外排泵抑制劑與黏菌素聯合,是增強后者抗菌活性的有效措施,尋找新的有效且更安全的外排泵抑制劑,對克服黏菌素的耐藥性以及研制復方制劑、開發新型抗菌劑具有重要意義。

