大花金挖耳培養細胞總黃酮提取工藝及抑菌活性研究
李玉平,龔 寧
1.西北農林科技大學生命科學學院,陜西 楊凌712100
2.青海大學新農村發展研究院,青海 西寧810016
3.西北農林科技大學陜西省生物農藥工程技術研究中心,陜西 楊凌712100
4.西北農林科技大學化學與藥學院,陜西 楊凌712100
大花金挖耳Carpesium macrocephalumFranch.et Sav.細胞培養物總黃酮提取工藝及其胞內物抑菌活性研究在農業生產和醫療保健中具有重要的意義。大花金挖耳系菊科(Compositae)天名精屬多年生草本植物[1]。國內外學者從該植物中分離鑒定得到黃酮類、萜類、香豆素等化合物近百種[2,3],該植物具有抗腫瘤、殺蟲等醫用功效[3,4],隨著植物源農藥研究的興起[5-8],大花金挖耳的抑菌、除草和殺蟲等活性[9-11]得到了初步研究。筆者前期研究了大花金挖耳細胞培養黃酮[12]等農藥活性物質的培養條件。目前,有關其細胞培養物總黃酮提取工藝及細胞培養物抑菌活性尚無報道。基于超聲波輔助提取技術具有提取速度快、不改變生物活性物質、工藝可行等優點[13-15],本文研究了不同干燥方式、溶劑、粉碎度和固液比等因素對大花金挖耳細胞培養物總黃酮提取的影響,進而采用超聲波聯合搖床振蕩提取得到總黃酮的提取工藝,并初步測試了細胞培養物對供試8 種病原真菌的抑菌活性,為大花金挖耳細胞培養抑菌活性物質的提取奠定了基礎。
1 材料與方法
1.1 材料、試劑與儀器
1.1.1 供試菌種 番茄灰霉病菌(Botrytis cinerea)、番茄早疫病菌(Alternaria solani)、辣椒疫霉病菌(Phytophthora capsici)、南瓜枯萎病菌(Fusarium bulbigenum)、西瓜枯萎病菌(Fusarium oxysporiumf.sp.niveum)、蘋果炭疽病菌(Glomerella cingulata)、小麥紋枯病菌(Rhizoctonia cerealis)、煙草赤星病菌(Alternaria longipes)。供試菌種由西北農林科技大學無公害農藥研究服務中心提供。
1.1.2 試劑 蘆丁標準品(質量分數≥95%,中國藥品生物制品檢定所);萘乙酸(NAA)、6-芐氨基嘌呤(6-BA)(美國Sigma 公司);B5 和N T 培養基中添加的蔗糖、肌醇、鹽酸硫胺素(VB1)、鹽酸吡哆醇以及各種無機鹽試劑均為分析純;丙酮、乙醇、氯仿、石油醚均為分析純。
1.1.3 儀器與設備MCFD5508 型冷凍干燥機(美國SIM 公司);CR22G 高速冷凍離心機(HITACHI);JY92-2D 超聲波細胞粉碎機(寧波新芝生物科技股份有限公司);ES-315Tomy High-pressure steam sterilizer(Tomy KOGYO CO.LTD.Nerima Tokyo.Japan);BP-190S 電子天平(Sartorius 公司);PHS-25型酸度計(上海雷磁儀器廠);ZRD-5030 全自動鼓風干燥箱(上海智誠分析儀器制造有限公司);HZT2 雙層振蕩器(哈爾濱市東聯電子技術開發有限公司);UV1102 紫外/可見分光光度計(上海天美科學儀器有限公司)。
1.2 試驗方法
1.2.1 懸浮細胞培養方法 大花金挖耳懸浮細胞系[12]培養于NT+1.0 mg/L NAA+0.2 mg/L 6-BA+蔗糖40 g/L 中。培養條件為:pH 5.8(滅菌前)、搖床轉速120 r/min、溫度25±2℃、光照強度1500~2000 Ix、光照12 h/d,收集培養20 d 的褐化細胞作為供試材料。
1.2.2 大花金挖耳培養細胞的胞內外黃酮含量的比較 在NT+1.0 mg/L NAA 0.2 mg/L 6-BA 液體培養基中(培養條件同上),接鮮重細胞40 g/L 于其中,培養20 d 后,分別收集培養細胞和過濾液,細胞在烘箱中60 ℃烘(12 h)至恒重,濾液經5000 r/min 離心10 min 后,取上清液風干,將烘干的細胞和風干的濾液分別粉碎過60 目篩,丙酮振蕩提取四次,每次24 h,合并提取液,減壓濃縮,用30%乙醇定容,測定提取液中黃酮含量(mg/mL),計算樣品(細胞培養物)中黃酮含量(%)[12]。
1.2.3 干燥方式、溶劑、粉碎度、固液比和提取次數對細胞培養物中總黃酮提取效果的影響 試驗設計如下:①收集懸浮培養20 d 的褐化細胞,抽濾后稱取鮮重細胞10 份,5 份60 ℃下烘至恒重,另5 份在-40 ℃下真空冷凍(10 Pa 條件下干燥12 h)至恒重,將烘干和凍干的細胞分別粉碎過60 目篩,丙酮振蕩提取;②取適量烘干粉碎的細胞,以l:10 固液比(g/mL)分別加入丙酮、乙醇、氯仿、石油醚:丙酮體積比(7.5:1)、石油醚:氯仿體積比(1:1)等5 種溶劑振蕩提取;③取適量烘干粉碎的細胞,分別對過20、40、60 目篩的等量樣品丙酮振蕩提取;④對過60 目篩的粉碎樣品,設計固液比(g/mL)分別為1:5、1:10、1:15、1:20,丙酮振蕩提取。“①、②”中設計的試驗均提取四次,每次24 h,合并提取液,減壓濃縮,用30%乙醇定容,測定總黃酮得率,考察干燥方式和溶劑對培養細胞黃酮提取效果的影響;“③、④”中設計的試驗分別提取1、2、3、4 次,每次24 h,分別合并提取液,減壓濃縮,用30%乙醇定容,測定總黃酮得率,考察粉碎粒度、固液比和提取次數對培養細胞黃酮提取效果(黃酮得率)的影響。黃酮得率(%)=X×V/N×M×10-1,式中X為提取液中總黃酮含量(mg/mL),V為提取液定容體積(mL),N為提取前樣品質量(g),M為稀釋倍數。
1.2.4 超聲波聯合搖床振蕩提取細胞培養物總黃酮的正交試驗 收集懸浮培養20 d 的褐化細胞,烘干粉碎,過60 目篩,分別稱取樣品12 份,每份10 g,用丙酮做溶劑,固液比1:10,按表1 正交L9(34)試驗設計進行提取。先搖床振蕩(A 因素)分別提取6、12、18 h,過濾,分別收集濾液,得到第一次提取液;再采用超聲波提取濾渣(丙酮做溶劑,固液比1:10),超聲時間(B 因素)分別為10、30、60 min,超聲功率(C 因素)分別為200、400、600 W,按表1 試驗設計第二次提取,得到第二次提取液,分別合并各處理的第1、2 次提取液,減壓濃縮,30%乙醇定容,測定總黃酮得率。考察超聲波聯合搖床振蕩提取對大花金挖耳細胞培養物中總黃酮提取效果的影響。

表1 超聲波輔助提取正交實驗設計Table 1 Orthogonal design of ultrasonic-assisted extraction experiment
1.2.5 驗證試驗 在以上試驗的基礎上,收集懸浮培養20 d 的褐化細胞,烘干粉碎過60 目篩,以丙酮做溶劑,固液比1:10,搖床振蕩提取3 次,每次24 h,為對照(CK)。超聲波(600 W)提取60 min 后,收集第一次提取液,濾渣以搖床振蕩提取第二次(丙酮做溶劑,固液比1:10),提取時間設為:6、12、18、24 h,驗證超聲波聯合搖床振蕩提取細胞培養物總黃酮的正交試驗結果。
1.2.6 大花金挖耳細胞培養物抑制菌絲生長試驗 收集懸浮培養20 d 的褐化細胞,烘干粉碎過60 目篩,乙醇提取,減壓濃縮成浸膏,取適量丙酮溶解(超聲波促溶),定容至50 mg/mL。采用菌絲生長速率法[16]測定供試藥液對供試病原菌菌絲生長的抑制作用,用丙酮處理作對照。用十字交叉法測量供試真菌菌落生長直徑,取其平均值。根據公式(1)和(2)計算菌絲生長抑制率:

1.3 數據分析
以上試驗重復3 次,使用DPS 數據處理系統進行毒力回歸方程計算,并對總黃酮含量等所得試驗數據進行單因素方差鄧肯式分析(P=0.05)。
2 結果與分析
2.1 大花金挖耳培養細胞胞內外黃酮含量變化
從圖1 可以看出,大花金挖耳懸浮培養細胞內的黃酮含量為1.22%、發酵液黃酮含量為0.13%,胞內黃酮含量顯著高于胞外(發酵液),胞內黃酮含量是胞外的21.22 倍(P<0.05)。
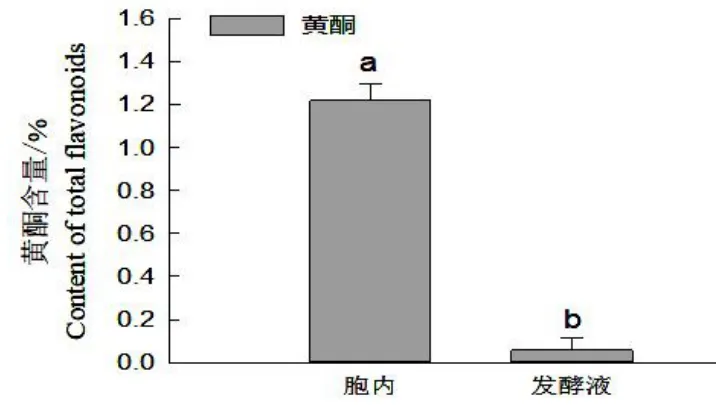
圖1 胞內外黃酮含量比較Fig.1 Comparison of extracellular and intracellular flavonoids content

圖2 不同干燥方法對干鮮重比和細胞培養物總黃酮的提取效果Fig.2 Effects of different drying methods on rate of DW/FW and extracting total flavonoids from cultural materials
2.2 干燥方式對培養細胞黃酮提取的影響
如圖2 所示,真空冷凍和烘干方法對大花金挖耳懸浮培養細胞的干重/鮮重比分別5.41%、5.75%;真空冷凍和烘干方法對細胞總黃酮的得率分別達到1.04%、1.22%,烘干較凍干所得的干重/鮮重比及總黃酮得率稍高,但均不顯著(P<0.05)。
2.3 不同溶劑對培養細胞黃酮提取的影響
圖3 表明,丙酮(I)、無水乙醇(Ⅱ)、氯仿(Ⅲ)、石油醚:丙酮(Ⅳ)、石油醚:氯仿(V)等5 種不同溶劑對懸浮培養細胞總黃酮的提取效果顯著不同。以無水乙醇、丙酮提取效果最為顯著,細胞總黃酮得率為1.22%,是其他溶劑提取細胞培養物得率的1.59~2.01 倍(P<0.05)。
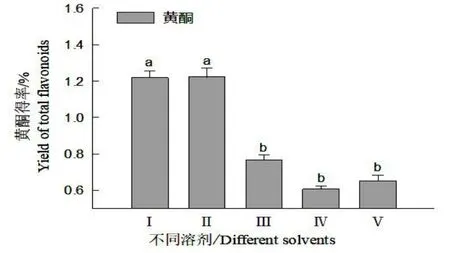
圖3 不同溶劑對細胞培養物總黃酮的提取效果Fig.3 Effects of different solvents on extraction of total flavonoids from cultural materials
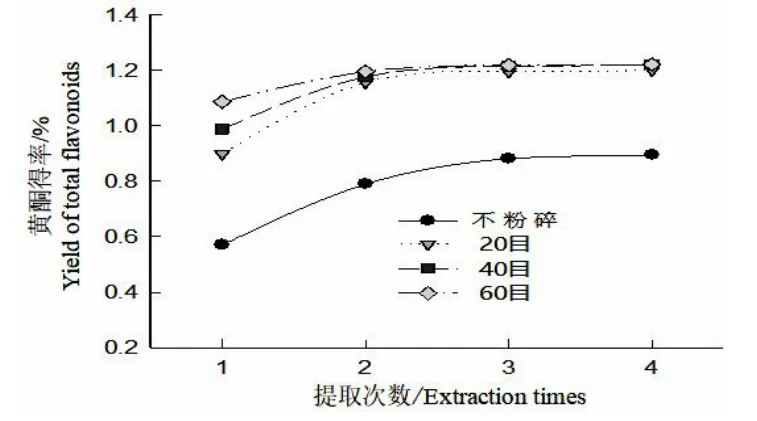
圖4 樣品粒度對細胞培養物總黃酮的提取效果Fig.4 Effects of sample powder size on extraction of total flavonoids from cultural materials
2.4 粉碎粒度對培養細胞黃酮提取的影響
由圖4 可知,在搖床振蕩提取次數一定的條件下,隨樣品粉碎度的增加,培養物總黃酮的得率逐漸增大,與沒有粉碎的細胞培養物相比,過20~60 目的細胞培養物的總黃酮得率高;在樣品粉碎粒度一定的情況下,隨搖床振蕩總提取次數的增加,黃酮得率逐漸增加,搖床振蕩提取3~4 次、樣品粒度40~60 目時對培養物黃酮提取較為適宜。
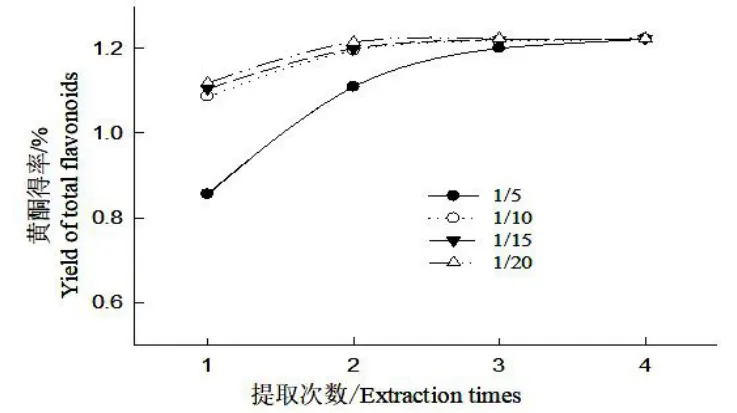
圖5 固液比對細胞培養物總黃酮的提取效果Fig.5 Effects of solid-to-liquid ratio on extraction of total flavonoids from cultural materials
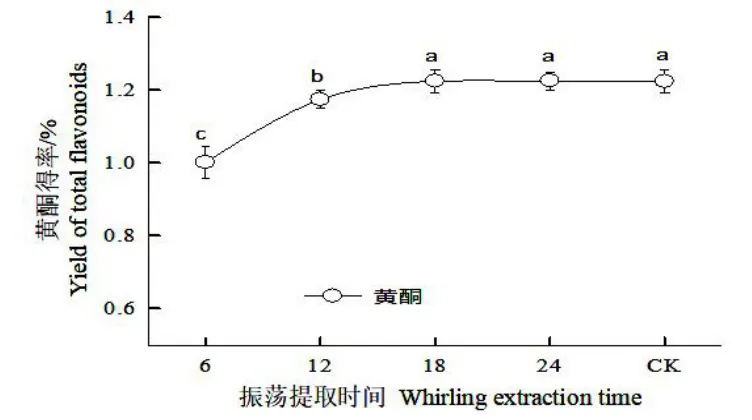
圖6 超聲波聯合振蕩對細胞培養物總黃酮的提取效果Fig.6 Effects of ultrasonic combined whirling on extraction of total flavonoids from cultural materials
2.5 固液比對培養細胞黃酮提取的影響
由圖5 可知,在搖床振蕩提取次數一定的條件下,隨固液比從1:5 到1:20 的遞變,培養物總黃酮得率逐漸增大,1:10、1:15、1:20 固液比對細胞培養物的得率比較接近;在樣品固液比一定的情況下,隨搖床振蕩總提取次數的增加,黃酮得率不斷增加,當固液比1:10~1:15,搖床振蕩提取3~4 次,黃酮得率增加到最高值1.22%。
2.6 超聲波聯合振蕩提取對細胞培養物總黃酮提取的正交試驗效果

表2 試驗方案及分析結果Table 2 The plan and results of the test
表2、3 表明:搖床振蕩提取時間、超聲提取時間和超聲波功率都對大花金挖耳細胞培養物中總黃酮的提取產生了顯著的影響。正交試驗發現搖床振蕩時間(A)、超聲波提取時間(B)和超聲波功率(C)三因素對細胞培養物提取效果有明顯差異,依次為A>B>C,最佳組合是A3B3C3,即搖床振蕩提取18 h 后,濾渣在超聲波功率600 W 時,再超聲提取60 min,效果最好。
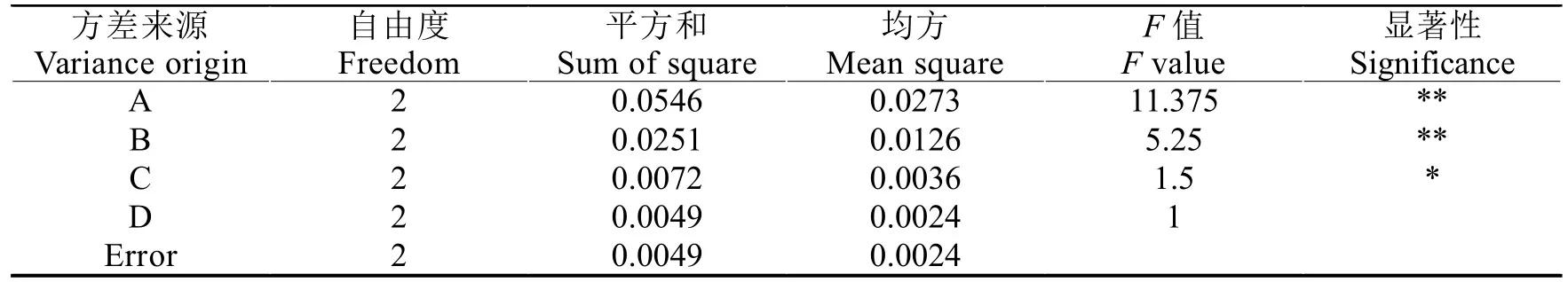
表3 方差分析表Table 3 The table of variance analysis
2.7 超聲波聯合搖床振蕩提取細胞黃酮正交試驗的驗證
從“2.6”可知,正交試驗的最佳組合并未出現在正交試驗組中,需要進行驗證,驗證試驗(圖6)表明,超聲波(600 W、60 min)提取后的濾渣再經搖床振蕩提取,合并超聲波提取液和搖床振蕩提取液,檢測發現,隨搖床振蕩提取時間的延長,總黃酮得率顯著增大,搖床提取18~24 h 時,總黃酮得率最高達1.22%,并保持穩定,與對照達到同樣效果。可見超聲提取(功率600 W、60 min)1次后,再搖床振蕩提取(18 h)1 次,即可完成胞內黃酮的提取。
2.8 大花金挖耳細胞培養物對8 種病原真菌的抑菌效果
表4 可見,大花金挖耳懸浮培養細胞的乙醇提取物對供試8 種供試病原菌生長均有不同程度的抑制作用,但對不同病原菌抑制效果存在較大差別。在藥液濃度50 mg/mL 時,抑制率達到50%以上的供試病原菌有辣椒疫霉病菌、蘋果炭疽病菌和小麥紋枯病菌等3 種病原真菌。
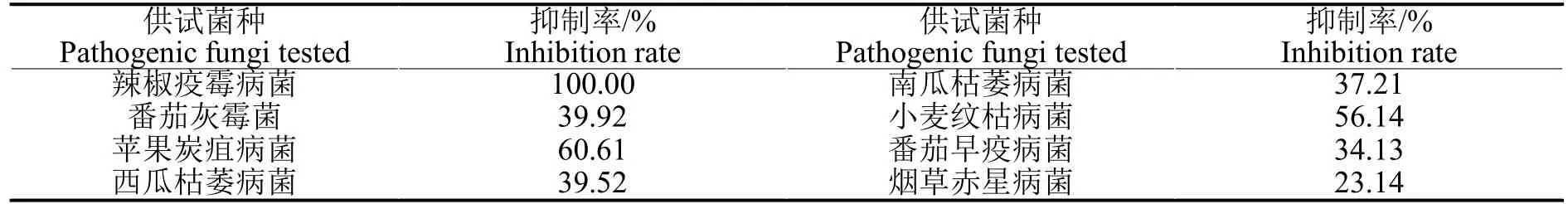
表4 大花金挖耳細胞提取物對8 種病原菌菌絲生長的抑制作用(3 d)Table 4 Inhibition rate of ethanol extracts from C.macrocephalum cell cultures against fungal mycelial growth of eight pathogenic fungi(3 d)
3 討論
植物中黃酮類化合物的合成主要在細胞質中合成,在不同的膜系統間進行轉運,并最后貯存于液泡中[17]。本研究通過對培養細胞及其培養液(發酵液)黃酮含量的檢測,發現大花金挖耳細胞生物合成的黃酮主要集中在細胞中,培養液中只有微量黃酮,可能與培養細胞后期衰亡破碎有關,造成少量黃酮類化合物進入培養液。
研究表明高溫條件下長時間干燥處理會使黃酮含量減少,但短時間的高溫處理對黃酮含量影響較小[18]。本研究采取-40 ℃真空冷凍和60 ℃烘干兩種方法對收集的褐化細胞進行處理,發現烘干較真空冷凍干燥對細胞總黃酮的得率及干重/鮮重比有不顯著的提高。這與烘干所用的溫度高、干燥快,能有效抑制相關酶的活性,減少其作用時間,使得總黃酮得率較凍干處理的高有關,這與郭澤美等[18]干燥處理葡萄皮及趙宇慧等[19]干燥處理枸杞粉的結果相似。
研究中發現丙酮、無水乙醇、氯仿、石油醚:丙酮、石油醚:氯仿等5 種不同溶劑對培養細胞總黃酮的得率不同。以無水乙醇、丙酮提取效果最為顯著,本試驗后期選擇了提取培養物活性物質時,提出雜質較少的丙酮作為溶劑。另外,本試驗發現,當固液比大到一定程度時,有效成分已經基本釋出完全,再增大固液比,雜質增加,濃縮工作量加大,造成回收溶劑的浪費,因此固液比應控制在1:10~1:15 左右。
傳統的振蕩提取方法[20]是通過振蕩的方式使萃取劑與被提取的物質反復接觸,最終被萃取物溶解到萃取劑中,再進行純化和濃縮處理,獲得目標物。振蕩提取步驟較簡單,成本低,缺點是耗時。超聲波提取[21]可以破壞植物細胞壁,加速有效成分的溶解和提取,具有提取均勻、時間短、簡單易行等優點,不過高頻超聲波長時間提取也可能破壞物質結構,雜質相對較多。本研究采用搖床振蕩聯合超聲波提取大花金挖耳細胞培養物活性成分,方法簡單,成本低,耗時短,溶劑用量少,該提取工藝為具有抗炎、抗氧化、抗癌、殺菌等廣泛活性作用的黃酮提取提供了新的選擇。
菊科植物的黃酮類、內酯類、萜類等化合物均有抑菌活性[22,23]。本研究中大花金挖耳懸浮培養細胞的粗提物對供試的8 種病原菌表現出了不同的抑菌作用,當供試藥液濃度為50 mg/mL 時,供試病原菌菌絲生長抑制率達到50%以上的有辣椒疫霉病菌、蘋果炭疽病菌和小麥紋枯病菌等3 種病原菌,這說明:供試菌種菌絲生長抑制率與大花金挖耳細胞培養物中生物合成的黃酮等活性物質密切有關,且供試菌種對藥液的敏感性不同。其中辣椒疫霉病菌屬于鞭毛菌亞門的卵菌,其他分屬于子囊菌亞門、擔子菌亞門和半知菌亞門的真菌[24],鑒于植物病害中最多的是真菌病害,且近3 萬種之多[25],下一步研究需以辣椒疫霉病菌、蘋果炭疽病菌和小麥紋枯病菌等作為細胞培養活性物質分離純化的活性追蹤菌種,進一步分離純化大花金挖耳細胞培養物活性物質,探明其抑菌機理,為大規模細胞培養抑菌活性物質奠定了基礎。
4 結論
大花金挖耳懸浮細胞生物合成的黃酮類化合物主要集中胞內。在室溫下,細胞懸浮培養活性物質的最佳提取條件是:以丙酮為溶劑、樣品粒度40~60 目、固液比1:10~1:15(g/mL),超聲輔助提取(功率600 W、60 min)1 次后,再接搖床振蕩提取(18 h)1 次,總黃酮得率可達1.22%,該方法操作簡單、節省溶劑、環保、耗時短。大花金挖耳細胞培養物具有抑菌活性,本研究為大花金挖耳細胞培養抑菌活性物質的提取分離提供了實驗數據。

