低溫脅迫下乙酸葉醇酯對(duì)茶樹耐寒性生理生化的影響
張續(xù)周 李金秋 陳雪津 王雯 李芳 馬媛春 房婉萍 朱旭君

摘要:綠葉揮發(fā)物(GLVs)作為植物揮發(fā)物中的一類化合物,由C18和C16不飽和脂肪酸經(jīng)酶催化分解形成的C6和C9醛、醇及其相應(yīng)酯類組成。其中,乙酸葉醇酯是一種主要的GLVs,以Z-3-己烯醛和Z-3-己烯醇經(jīng)酶作用合成。為了解乙酸葉醇酯在茶樹耐寒性狀中的作用,以一年生茶樹品種中茶108為材料,使用乙酸葉醇酯后短時(shí)低溫(4 ℃,1.5 h)和低溫過夜(4 ℃,16 h)處理茶苗,測(cè)定茶樹冷誘導(dǎo)基因表達(dá)和茶樹生理生化特性指標(biāo)。結(jié)果發(fā)現(xiàn),乙酸葉醇酯在短時(shí)低溫處理時(shí)可以提高冷誘導(dǎo)基因CsICE1、CsICE2、CsCBF1-CsCBF5的表達(dá);在過夜低溫處理時(shí)提高冷誘導(dǎo)基因CsRD1、CsRD2的表達(dá);短時(shí)低溫和過夜低溫處理均能分別顯著提高茶樹過氧化物酶(POD)、過氧化氫酶(CAT)的酶活性,從而緩解低溫脅迫對(duì)茶樹的傷害。此外,乙酸葉醇酯還誘導(dǎo)自身合成途徑關(guān)鍵酶基因CsADH1、CsADH3和CsLOX3的表達(dá),進(jìn)一步增強(qiáng)茶樹耐寒能力。
關(guān)鍵詞:茶樹;綠葉揮發(fā)物;乙酸葉醇酯;低溫脅迫;耐寒性
中圖分類號(hào):S571.101 文獻(xiàn)標(biāo)志碼: A
文章編號(hào):1002-1302(2021)24-0127-06
收稿日期:2021-08-23
基金項(xiàng)目:國(guó)家自然科學(xué)基金(編號(hào):31800588);青島農(nóng)業(yè)大學(xué)科研啟動(dòng)基金(編號(hào):1118025);山東省良種工程子課題(編號(hào):2321401);青島職業(yè)技術(shù)學(xué)院重點(diǎn)研發(fā)專項(xiàng)(編號(hào):2020ZDYF09);北茶技藝技能傳承創(chuàng)新平臺(tái)資助。
作者簡(jiǎn)介:張續(xù)周(1972—),男,山東菏澤人,碩士,副教授,主要從事茶樹育種與生物技術(shù)研究。E-mail:jiaonancha@126.com。
通信作者:朱旭君,博士,副教授,研究方向?yàn)椴铇溆N與栽培。E-mail:zhuxujun@njau.edu.cn。
低溫是茶樹生長(zhǎng)發(fā)育中遭受的主要非生物脅迫之一,限制了茶樹的生長(zhǎng)發(fā)育[1]。低溫會(huì)影響細(xì)胞膜流動(dòng)性,破壞細(xì)胞骨架,影響自由基產(chǎn)生和清除系統(tǒng)的平衡以及引起酶活性的改變等[2-4]。此外,低溫還會(huì)引起茶樹中兒茶素、維生素和氨基酸等品質(zhì)成分的變化[5]。茶樹受到低溫脅迫時(shí),會(huì)發(fā)生一系列反應(yīng)以提高自身對(duì)低溫的抵抗能力,這種現(xiàn)象稱為冷馴化[5]。冷馴化過程涉及大量的生理生化變化,其中包括冷誘導(dǎo)基因的表達(dá),調(diào)節(jié)滲透物質(zhì)的生成和抗氧化酶系統(tǒng)的作用等途徑。
某些冷誘導(dǎo)基因在低溫脅迫中的作用已經(jīng)明確[6-8],如ICE(inducer of CBF expression)在收到冷脅迫信號(hào)后,與CBF(C-repeat binding factor)啟動(dòng)子結(jié)合誘導(dǎo)CBF基因表達(dá)[9],CBF識(shí)別CRT/DRE順式作用元件調(diào)控下游COR(cold regulate)基因的轉(zhuǎn)錄,編碼親水性多肽增強(qiáng)細(xì)胞脂膜穩(wěn)定性從而提高植物抗寒性[10]。其中,COR基因是一類在低溫下可以快速表達(dá)的植物抗寒基因,也可以稱為L(zhǎng)TI(low temperature induced)、KIN(cold induced)、RD(response to dehydration)、ERD(early dehydration induced)基因[11]。
綠葉揮發(fā)物(green leaf volatiles,簡(jiǎn)稱GLVs)是植物揮發(fā)物中的一類化合物,包括C16和C18不飽和酶和異構(gòu)酶等作用下生成相應(yīng)的醇和酯類[12-13]。脂氧合酶(lipoxygenase,簡(jiǎn)稱LOX)和氫過氧化物裂解酶(hydroperoxide yase,簡(jiǎn)稱HPL)作為脂氫過氧化物裂解酶催化形成C6和C9醛,進(jìn)一步通過脂質(zhì)代謝途徑合成GLVs[12-15]。同時(shí),GLVs含量也對(duì)合成酶具有反饋調(diào)節(jié)作用,如外源施用順-3-己烯醇能在24 h內(nèi)顯著誘導(dǎo)茶樹LOX和ADH基因的表達(dá)[16]。GLVs在植物遭受機(jī)械損傷,草食性昆蟲蟲害,病原菌感染[15]時(shí)發(fā)揮防御作用;干旱、高溫、低溫[13]、強(qiáng)光和重金屬等非生物脅迫[17-19]也會(huì)促進(jìn)GLVs的釋放。此外,外源施用生長(zhǎng)素和赤霉素也會(huì)誘導(dǎo)甜瓜CmLOX09基因的表達(dá)[20]。外源Z-3-己烯醇可以通過反向調(diào)節(jié)自身合成關(guān)鍵酶基因LOXs、ADHs的表達(dá),誘導(dǎo)DREB-2A和RDs基因表達(dá)并通過提高抗氧化酶活性等途徑提高茶樹對(duì)干旱脅迫的抗性[18]。乙酸葉醇酯是一種主要的綠葉揮發(fā)物,Z-3-己烯醛和Z-3-己烯醇(Z-3-HAC)經(jīng)乙醇脫氫酶(alcohol dehydrogenase,簡(jiǎn)稱ADH)和酰基轉(zhuǎn)移酶(acyltransferase,AAT)作用最終生成乙酸葉醇酯,乙酸葉醇酯在茶樹中的作用研究還未曾見。
本研究通過外源使用乙酸葉醇酯,測(cè)定低溫處理后茶苗相關(guān)的生理特性指標(biāo)和冷誘導(dǎo)基因表達(dá)情況,初步明確了乙酸葉醇酯在茶樹抗寒性中的作用,為進(jìn)一步深入研究乙酸葉醇酯在茶樹低溫脅迫中的作用機(jī)制提供參考。
1 材料與方法
1.1 試驗(yàn)材料
供試材料茶樹品種中茶108為一年生扦插茶苗,購(gòu)于南京雅潤(rùn)茶業(yè)有限公司。于2019年在南京農(nóng)業(yè)大學(xué)茶學(xué)實(shí)驗(yàn)室進(jìn)行試驗(yàn)處理。茶苗處理前在人工氣候箱中培養(yǎng)2個(gè)星期,培養(yǎng)條件為光照 16 h(25 ℃)/黑暗8 h(20 ℃),光照度3 600 lx,相對(duì)濕度60%~70%。
1.2 試驗(yàn)方法
T1(短時(shí)低溫處理):乙酸葉醇酯(溶劑為二氯甲烷)處理1.5 h,4 ℃低溫處理1.5 h;CK1(短時(shí)低溫對(duì)照):二氯甲烷處理1.5 h,室溫放置3 h,4 ℃低溫處理1.5 h。T2(低溫過夜處理):乙酸葉醇酯(溶劑為二氯甲烷)處理1.5 h,室溫放置0.5 h,4 ℃低溫處理16 h;CK2(低溫過夜對(duì)照):二氯甲烷處理1.5 h,室溫放置0.5 h,4 ℃低溫處理16 h。取第1、2葉放入液氮速凍,-80 ℃保存。
1.3 測(cè)定指標(biāo)及方法
參照酸性茚三酮顯色法測(cè)定游離脯氨酸含量;采用超氧化物歧化酶(SOD)試劑盒、過氧化物酶(POD)試劑盒和過氧化氫酶(CAT)試劑盒測(cè)定相應(yīng)酶活性,試劑盒均購(gòu)于南京建成生物工程研究所有限公司;高效液相色譜法GB/T 8313—2008測(cè)定茶葉中兒茶素各組分含量。
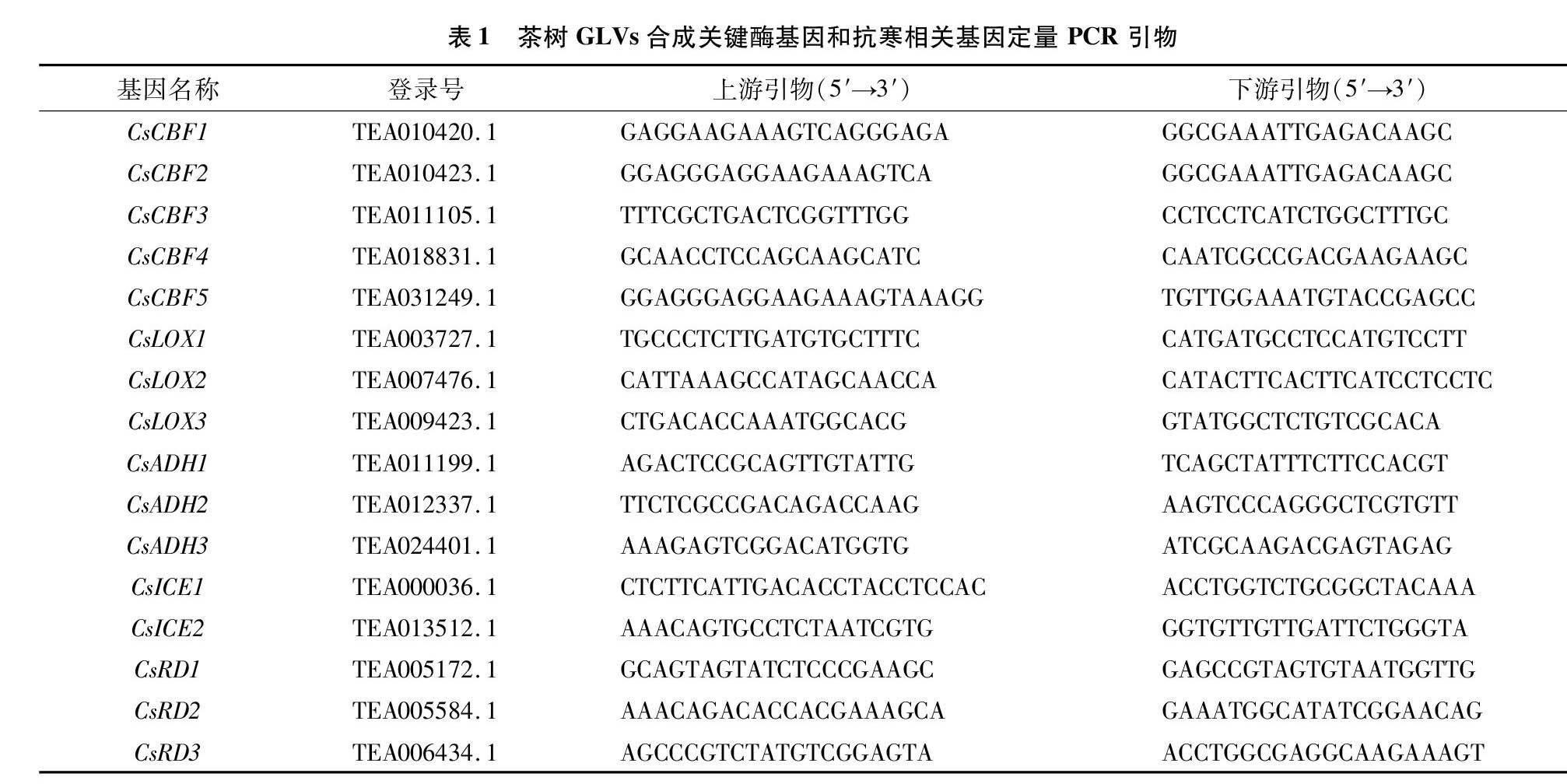
葉片總RNA使用艾德萊 RN5301 EASYspin Plus 多糖多酚/復(fù)雜植物RNA快速提取試劑盒提取。RNA 反轉(zhuǎn)錄使用PrimeScriptTM RT Reagent Kit with gDNA Eraser(日本 TaKaRa 生物公司)試劑盒進(jìn)行。利用qRT-PCR反應(yīng)測(cè)定茶樹GLVs合成相關(guān)基因CsADH和CsLOX,以及抗寒相關(guān)基因CsICE、CsCBF和CsRD的相對(duì)表達(dá)量。基于茶樹基因組數(shù)據(jù)庫(kù)(http://tpia.teaplant.org/index.html)獲得茶樹相關(guān)基因序列,利用Primer5設(shè)計(jì)特異性引物(表1)。qRT-PCR反應(yīng)試驗(yàn)使用SYBR Green PCR master mix試劑盒(日本TaKaRa生物公司),儀器使用Bio-Rad IQ5實(shí)時(shí)熒光定量?jī)x(Bio-Rad,USA),內(nèi)參基因?yàn)棣?actin。定量反應(yīng)程序?yàn)?5 ℃預(yù)變性30 s;95 ℃ 5 s,60 ℃ 30 s,40個(gè)循環(huán)[21]。每個(gè)處理試驗(yàn)重復(fù)3次,基因相對(duì)表達(dá)量分析采用2ΔΔCT法計(jì)算。
1.4 數(shù)據(jù)分析
試驗(yàn)數(shù)據(jù)使用Excel 2010和SPSS Statistic 20.0軟件對(duì)數(shù)據(jù)進(jìn)行分析,方差分析多重比較采用Duncan’s新復(fù)極差法,P<0.05表示差異顯著。采用Graphpad Prism 5作圖。
2 結(jié)果與分析
2.1 低溫脅迫下乙酸葉醇酯對(duì)茶樹GLVs合成相關(guān)基因表達(dá)的影響
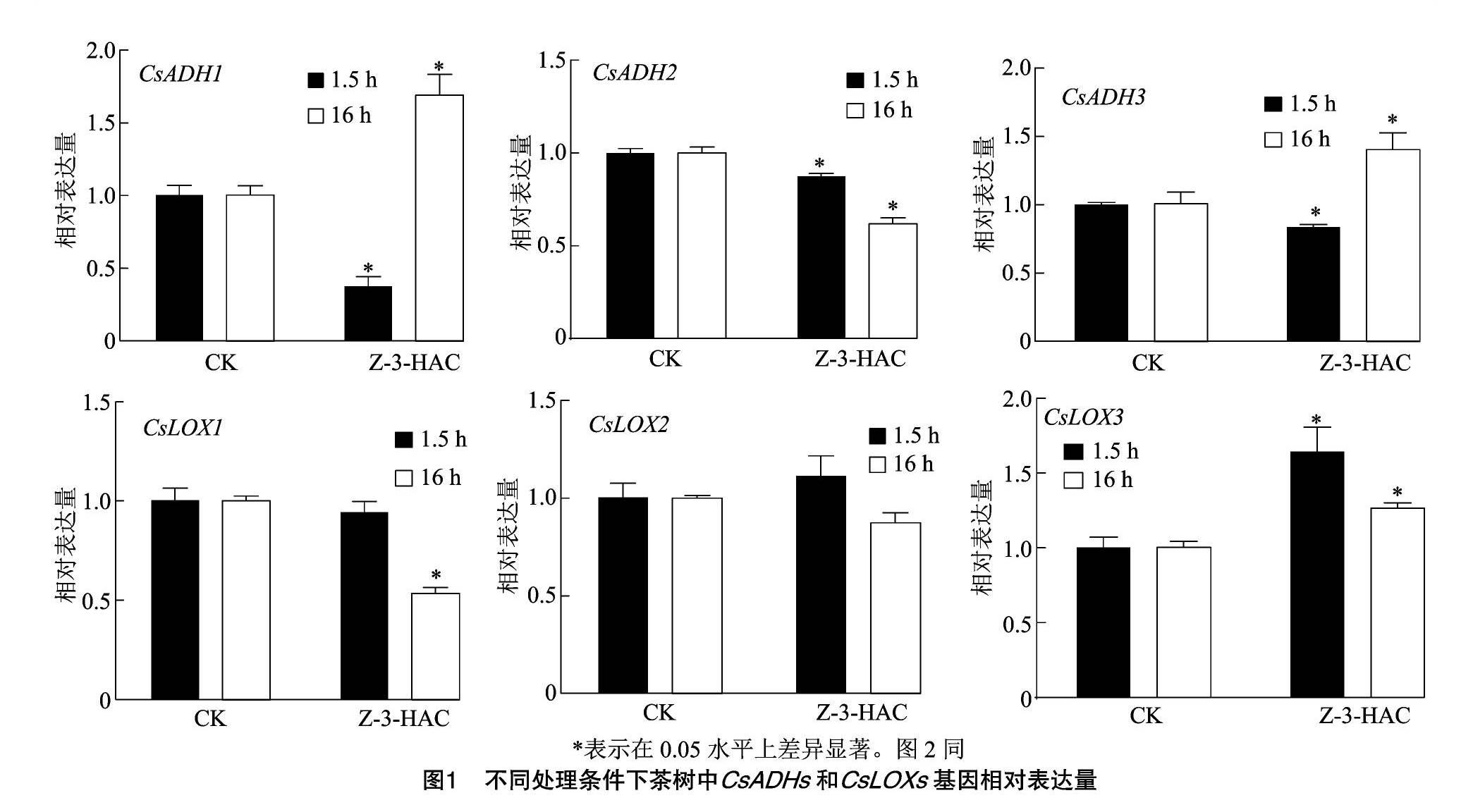
茶樹中GLVs主要來源于亞麻酸降解途徑,該途徑中的關(guān)鍵酶為L(zhǎng)OX、HPL和ADH。外源Z-3-己烯醇能在24 h內(nèi)顯著誘導(dǎo)茶樹LOXs、ADHs部分基因積累,對(duì)HPL無明顯效果[18]。為了解低溫環(huán)境下外源施用乙酸葉醇酯對(duì)GLVs合成途徑關(guān)鍵酶基因的影響,測(cè)定CsADH1、CsADH2、CsADH3和CsLOX1、CsLOX2、CsLOX3的表達(dá)情況,結(jié)果(圖1)表明,短時(shí)低溫(4 ℃,1.5 h)下外源乙酸葉醇酯顯著提高了CsLOX3積累量(P<0.05),顯著抑制了CsADH1、CsADH2、CsADH3的表達(dá)。 低溫過夜處理(4 ℃,16 h)中外源乙酸葉醇酯處理使CsADH1、CsADH3和CsLOX3表達(dá)量顯著增加,CsADH2和CsLOX1表達(dá)量顯著降低。
2.2 低溫脅迫下乙酸葉醇酯對(duì)茶樹耐寒相關(guān)基因表達(dá)的影響
茶樹在低溫脅迫下,一些冷誘導(dǎo)基因表達(dá)會(huì)上調(diào),CsICE和CsCBF是低溫信號(hào)傳遞中的重要元件,能夠感受上游信號(hào)并將低溫信號(hào)向下游傳遞[22-24]。為明確外源施用乙酸葉醇酯對(duì)低溫脅迫下冷誘導(dǎo)基因表達(dá)的影響,測(cè)定了CsICEs、CsCBFs和CsRDs部分基因的表達(dá)情況(圖2)。短時(shí)低溫處理(4 ℃,1.5 h)中外源乙酸葉醇酯顯著提高了CsICE1、CsICE2和CsCBF1~CsCBF5的表達(dá)量;CsRD1-CsRD3表達(dá)降低。 低溫過夜處理(4 ℃,16 h)中, 外源乙酸葉醇酯處理使CsICE1、CsRD1 和CsRD2積累增加,顯著降低了CsCBF1~CsCBF5和 CsRD2的表達(dá)量,對(duì)CsICE2無顯著影響。
2.3 低溫脅迫下乙酸葉醇酯對(duì)茶樹生理指標(biāo)的影響
2.3.1 茶樹保護(hù)酶活性 茶樹在受到低溫脅迫時(shí)
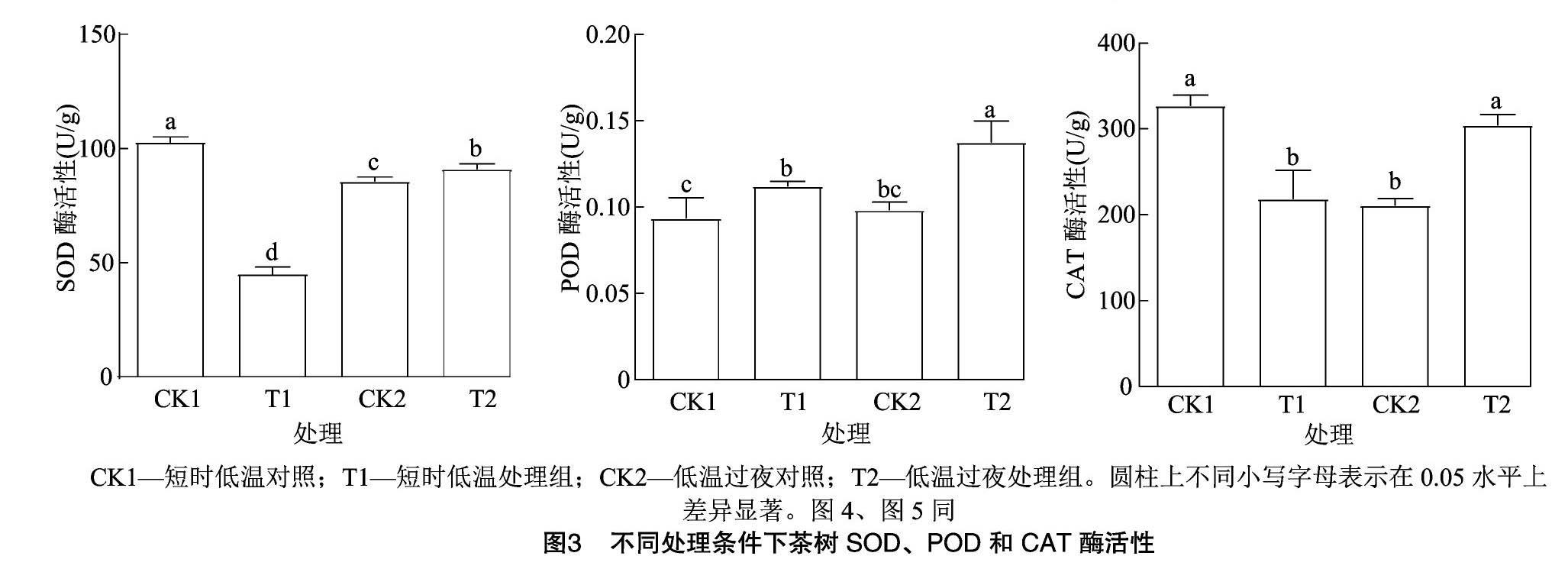
產(chǎn)生大量活性氧會(huì)使膜脂發(fā)生脂質(zhì)過氧化反應(yīng),為保護(hù)細(xì)胞免受傷害,抗氧化酶系統(tǒng)被激活。通過測(cè)定茶樹抗氧化酶系統(tǒng)中重要的氧化酶SOD、POD和CAT活性,發(fā)現(xiàn)外源乙酸葉醇酯使POD活性在短時(shí)低溫(T1)和低溫過夜處理(T2)時(shí)均增加;SOD和CAT活性在施用乙酸葉醇酯后低溫過夜處理時(shí)表達(dá)量增加,但在未施用乙酸葉醇酯的短時(shí)低溫處理中表達(dá)量更高(圖3)。
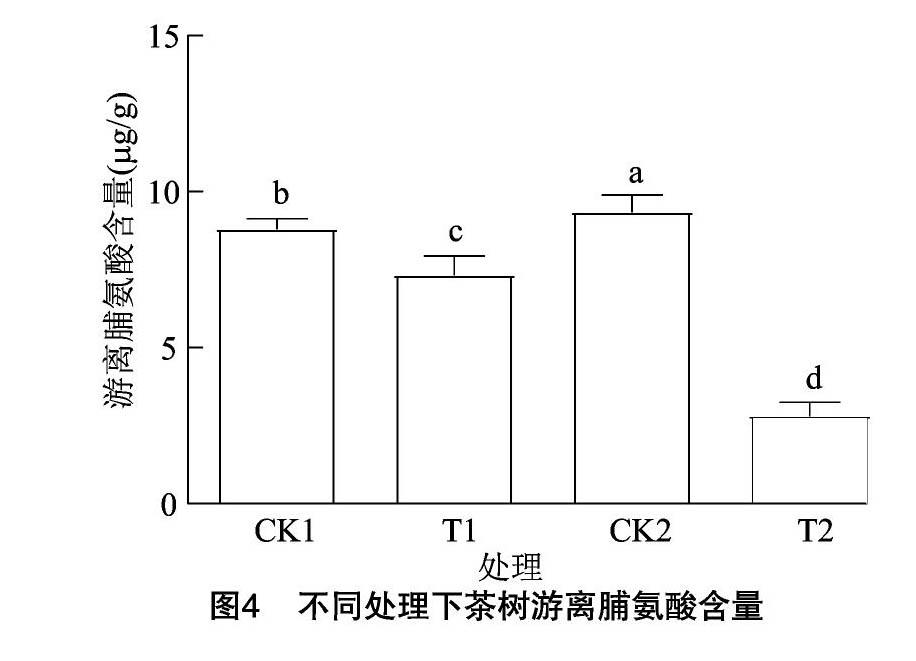
2.3.2 茶樹游離脯氨酸含量 脯氨酸是植物細(xì)胞抗寒的主要滲透調(diào)節(jié)物質(zhì)之一,在低溫脅迫下,游離脯氨酸含量會(huì)增加,以增加細(xì)胞液濃度,增強(qiáng)細(xì)胞保水能力,從而增強(qiáng)細(xì)胞耐寒性[2]。外源乙酸葉醇酯使短時(shí)低溫(T1)和過夜低溫處理(T2)中茶樹葉片游離脯氨酸含量均降低,分別降低了16.76%和69.68%(圖4)。
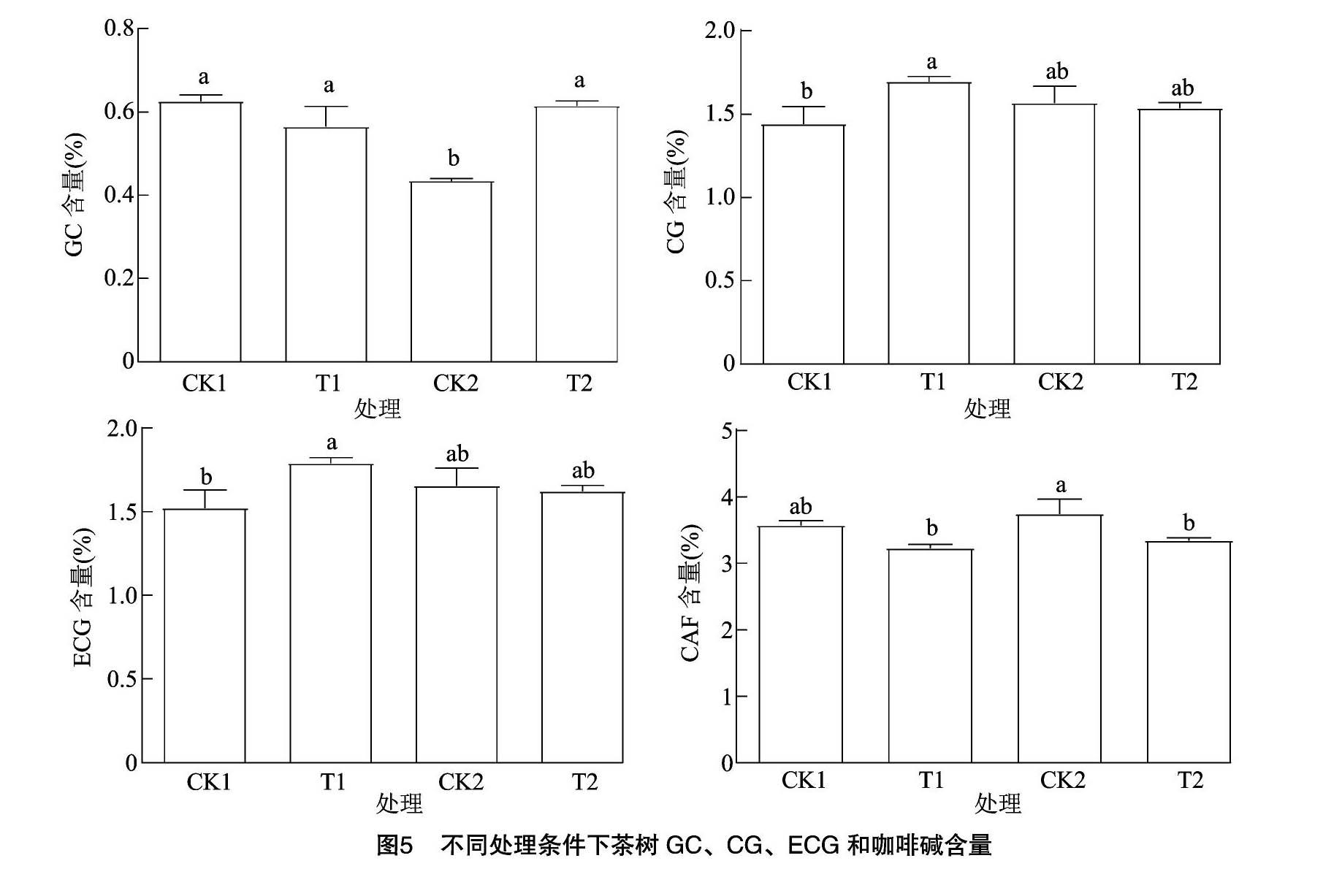
2.3.3 茶樹葉片中兒茶素和咖啡堿含量 低溫脅迫會(huì)影響茶樹葉片中理化成分的合成,進(jìn)而影響茶葉的品質(zhì),本試驗(yàn)測(cè)定了茶葉中主要兒茶素單體成分和咖啡堿含量(圖5),施用外源乙酸葉醇酯,茶樹葉片中GC的含量在低溫過夜處理(T2)相對(duì)更高,茶樹葉片中ECG和CG在短時(shí)低溫處理時(shí)(T1)含量均增加。外源乙酸葉醇酯處理在茶樹短時(shí)和過夜低溫處理時(shí),咖啡堿含量均明顯減少。
3 討論與結(jié)論
植物正常生長(zhǎng)情況下體內(nèi)只存在極少量的綠葉揮發(fā)物,在受到機(jī)械損傷、低溫、干旱和蟲害等外界脅迫時(shí),能迅速釋放大量綠葉揮發(fā)物來抵抗外界脅迫[25]。本試驗(yàn)在低溫脅迫前使用乙酸葉醇酯進(jìn)行處理,通過研究短時(shí)低溫處理和過夜低溫處理中茶樹葉片LOXs、ADHs部分基因和冷脅迫誘導(dǎo)基因ICEs、CBFs和CORs家族部分成員的表達(dá)情況,發(fā)現(xiàn)乙酸葉醇酯能在短時(shí)低溫處理時(shí)顯著誘導(dǎo)CsLOX3的表達(dá);過夜低溫處理時(shí)CsADH1和CsADH3的相對(duì)表達(dá)量也增加。GLVs可以通過反向調(diào)節(jié)自身合成途徑關(guān)鍵酶基因的表達(dá),促進(jìn)綠葉揮發(fā)物和茉莉酸等激素的合成,進(jìn)一步增強(qiáng)茶樹抗性[16]。乙酸葉醇酯使短時(shí)低溫處理時(shí)CsICE1、CsICE2、CsCBF1、CsCBF5基因的表達(dá)被誘導(dǎo);低溫過夜處理時(shí),CsRD1和CsRD2基因的表達(dá)量增加,而CsCBF1~CsCBF5基因的表達(dá)量降低。這可能與CBF基因和RD基因響應(yīng)冷脅迫順序有關(guān),CBF在低溫信號(hào)轉(zhuǎn)導(dǎo)過程中位于上游環(huán)節(jié),響應(yīng)冷脅迫迅速;RD基因在下游環(huán)節(jié),響應(yīng)冷脅迫時(shí)間較長(zhǎng)[26-27]。CBF基因轉(zhuǎn)錄產(chǎn)物在低溫脅迫下15 min后迅速積累,2 h含量達(dá)到最高水平后逐漸下降,而COR(RD)基因轉(zhuǎn)錄產(chǎn)物才開始積累[10]。
SOD、POD和CAT是細(xì)胞抗氧化酶的重要組成部分,能夠在植物受到非生物脅迫時(shí)清除細(xì)胞內(nèi)的自由氧,維持植物體內(nèi)的活性氧代謝平衡,緩解自由氧對(duì)細(xì)胞的傷害[28]。本試驗(yàn)中外源乙酸葉醇酯的施用顯著提高了低溫過夜處理下茶樹葉片SOD、POD和CAT的酶活性。此外,外源乙酸葉醇酯的施用還會(huì)影響茶樹葉片的理化成分,增加了低溫脅迫下茶樹體內(nèi)GC、ECG和CG的含量,降低了咖啡堿含量。
本試驗(yàn)結(jié)果表明,乙酸葉醇酯在短時(shí)低溫(4 ℃,1.5 h)和低溫過夜處理(4 ℃,16 h)中可通過提高自身合成基因CsADH1、CsADH3和CsLOX3的表達(dá)量;促進(jìn)冷誘導(dǎo)基因CsICE1、CsICE2、CsCBF1~CsCBF5、CsRD1和CsRD2按冷信號(hào)傳導(dǎo)順序表達(dá);增強(qiáng)SOD、POD和CAT酶活性等方式提高茶樹的抗寒性。
參考文獻(xiàn):
[1]尹皓嬋,李莉莉,宋宛霖,等. 茶樹抗寒機(jī)理及其應(yīng)用的研究進(jìn)展[J]. 安徽農(nóng)業(yè)科學(xué),2019,47(4):22-25.
[2]時(shí) 慧,王 玉,周克福,等. 低溫脅迫下茶樹葉片活性氧代謝及滲透調(diào)節(jié)物質(zhì)含量的變化規(guī)律[J]. 山東農(nóng)業(yè)科學(xué),2012,44(7):22-25.
[3]郝心愿,王 璐,曾建明,等. 低溫凍害對(duì)茶樹生理的影響及應(yīng)對(duì)技術(shù)[J]. 中國(guó)茶葉,2020,42(5):13-16.
[4]林鄭和,鐘秋生,游小妹,等. 低溫脅迫對(duì)茶樹抗氧化酶活性的影響[J]. 茶葉科學(xué),2018,38(4):363-371.
[5]李葉云,龐 磊,陳啟文,等. 低溫脅迫對(duì)茶樹葉片生理特性的影響[J]. 西北農(nóng)林科技大學(xué)學(xué)報(bào)(自然科學(xué)版),2012,40(4):134-138,145.
[6]王 郁. 茶樹低溫應(yīng)答相關(guān)轉(zhuǎn)錄因子CsICE1和CsCBF1的研究[D]. 合肥:安徽農(nóng)業(yè)大學(xué),2011:37-42.
[7]Gong Z Z,Xiong L M,Shi H Z,et al. Plant abiotic stress response and nutrient use efficiency[J]. Science China(Life Sciences),2020,63(5):635-674.
[8]Yin Y,Ma Q P,Zhu Z X,et al. Functional analysis of CsCBF3 transcription factor in tea plant (Camellia sinensis) under cold stress[J]. Plant Growth Regulation,2016,80(3):335-343.
[9]Wang P J,Chen X J,Guo Y C,et al. Identification of CBF transcription factors in tea plants and a survey of potential CBF target genes under low temperature[J]. International Journal of Molecular Sciences,2019,20(20):5137.
[10]劉東曉. 茶樹CsCBF2轉(zhuǎn)基因煙草的非生物脅迫耐受性分析[D]. 信陽(yáng):信陽(yáng)師范學(xué)院,2017.
[11]黃永會(huì),劉永翔,朱 英,等. COR基因在植物抗寒基因工程中的作用[J]. 貴州農(nóng)業(yè)科學(xué),2014,42(12):37-42.
[12]陳書霞,陳 巧,王聰穎,等. 綠葉揮發(fā)物代謝調(diào)控及分子機(jī)理研究進(jìn)展[J]. 中國(guó)農(nóng)業(yè)科學(xué),2012,45(8):1545-1557.
[13]Bai J H,Baldwin E A,Imahori Y,et al. Chilling and heating may regulate C6 volatile aroma production by different mechanisms in tomato (Solanum lycopersicum) fruit[J]. Postharvest Biology and Technology,2011,60(2):111-120.
[14]謝鑫鑫,林碧英,林忠平.綠葉揮發(fā)物合成相關(guān)基因及其生理生態(tài)功能[J]. 亞熱帶農(nóng)業(yè)研究,2014,10(4):279-284.
[15]Sun H F,Li Z Y,Wu B,et al. Review of recent advances on the production and eco-physiological roles of green leaf volatiles[J]. Chinese Journal of Plant Ecology,2013,37(3):268-275.
[16]Hu S L,Chen Q H,Guo F,et al. (Z)-3-Hexen-1-ol accumulation enhances hyperosmotic stress tolerance in Camellia sinensis[J]. Plant Molecular Biology,2020,103(3):287-302.
[17]Wang L,Baldwin E,Luo W,et al. Key tomato volatile compounds during postharvest ripening in response to chilling and pre-chilling heat treatments[J]. Postharvest Biology and Technology,2019,154:11-20.
[18]胡雙玲.綠葉揮發(fā)物和組蛋白H3K4甲基化在茶樹干旱脅迫響應(yīng)中的功能研究[D]. 武漢:華中農(nóng)業(yè)大學(xué),2019:37.
[19]Yamauchi Y,Matsuda A,Matsuura N,et al. Transcriptome analysis of Arabidopsis thaliana treated with green leaf volatiles:possible role of green leaf volatiles as self-made damage-associated molecular patterns[J]. Journal of Pesticide Science,2018,43(3):207-213.
[20]Ju L J,Zhang C,Liao J J,et al. An oriental melon 9-lipoxygenase gene CmLOX09 response to stresses,hormones,and signal substances[J]. Journal of Zhejiang University.Science.B,2018,19(8):596-609.
[21]Shen J Z,Zou Z W,Xing H Q,et al. Genome-wide analysis reveals stress and hormone responsive patterns of JAZ family genes in Camellia sinensis[J]. International Journal of Molecular Sciences,2020,21(7):2433.
[22]朱小佩.茶樹CBF基因的克隆與功能分析[D]. 信陽(yáng):信陽(yáng)師范學(xué)院,2011:44.
[23]尹 盈.茶樹低溫脅迫轉(zhuǎn)錄因子CsICE和CsCBF的亞細(xì)胞定位、表達(dá)分析及功能驗(yàn)證[D]. 南京:南京農(nóng)業(yè)大學(xué),2013:73.
[24]Wang Y,Jiang C J,Li Y Y,et al. CsICE1 and CsCBF1:two transcription factors involved in cold responses in Camellia sinensis[J]. Plant Cell Reports,2012,31(1):27-34.
[25]王智煜,李迎迎,胡雅倩,等. 四分體期低溫脅迫對(duì)2個(gè)小麥品種幼穗結(jié)實(shí)率及生理特性的影響[J]. 江蘇農(nóng)業(yè)科學(xué),2019,47(10):114-116.
[26]Chinnusamy V,Ohta M,Kanrar S,et al. ICE1:a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J]. Genes & Development,2003,17(8):1043-1054.
[27]Zhao C Z,Lang Z B,Zhu J K.Cold responsive gene transcription becomes more complex[J]. Trends in Plant Science,2015,20(8):466-468.
[28]Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930.

