陸地棉CNGC全基因組鑒定及表達分析
劉文豪 田琴 余渝 王旭文 馬麒 司愛君 孔憲輝
摘要:環狀核苷酸門控通道(CNGC)基因家族是非選擇性陽離子通道基因家族之一,在與植物發育和環境脅迫等有關的生理生化過程中起著至關重要的作用,但是目前尚無陸地棉CNGC基因家族的全基因組鑒定和分析。基于已知的擬南芥CNGC基因家族成員序列信息,以生物信息學方法分析陸地棉基因組中CNGC家族成員的理化性質、系統發育、染色體定位和差異表達情況。結果表明,共鑒定出33個GhCNGC基因,它們不均勻地分布在A、D染色體亞組上,其中15個基因分布在A染色體亞組上,18個基因分布在D染色體亞組上。系統發育分析結果表明,GhCNGC基因家族被分為4個主要組,由于在進化過程中不均等地擴增,Ⅳ組又分為Ⅳa和Ⅳb組。同組陸地棉、擬南芥的CNGC基因顯示出相似的保守基序和基因結構,尤其是同源性越近,相似度越高。GhCNGC基因的表達譜以組織特異性模式表達,多數基因在根、葉中的表達量較高。研究結果使人們增加了對陸地棉和其他植物中CNGC基因家族的了解。
關鍵詞:CNGC;基因家族;全基因組;陸地棉;染色體定位;差異表達
中圖分類號:S562.01 文獻標志碼: A
文章編號:1002-1302(2021)24-0049-07
收稿日期:2021-05-10
基金項目:新疆生產建設兵團科技攻關項目(編號:2016AC027);新疆生產建設兵團重點領域創新團隊建設計劃(編號:2017CB011)。
作者簡介:劉文豪(1992—),男,安徽界首人,碩士,助理研究員,主要從事棉花分子育種研究。E-mail:whylwh2016@163.com。
通信作者:孔憲輝,碩士,研究員,主要從事棉花育種研究。E-mail:xjkxh920@163.com。
植物中的Ca2+通過鈣離子傳導通道進行信號轉導是一種重要的信號轉導機制。信號轉導有助于植物生長發育、病原體防御及植物對激素、光和鹽脅迫的反應[1]。環狀核苷酸門控通道(CNGC)是可滲透Ca2+的陽離子轉運通道,調節植物生長并應對生物和非生物脅迫。CNGC位于細胞質膜或核膜,由Ca2+/鈣調蛋白(CaM)和環狀單磷酸核苷酸(cNMPs)等二級信使從細胞內部控制[2]。在植物中,CNGC由6個跨膜(TM)域和介于第5、第6個TM域之間的1個孔區域組成。環狀核苷酸結合結構域(CNBD)是一個高度保守的區域,并有1個磷酸鹽結合盒(PBC)和1個鉸鏈區。CNGC通過直接結合環狀核苷酸而被激活,當鈣調蛋白(CaM)結合到CaM結合域時會被抑制[3]。目前,生物信息學工具已在水稻[4]、玉米[5]、擬南芥[6]、甘藍[7]、白菜[8]、番茄[9]中用于識別CNGC基因家族成員。
之前的研究發現,CNGC是植物發育的關鍵組成部分。目前,大多數CNGC已通過遺傳學方法得到表征,并且它們已顯示出與植物生理、分子功能有關的重要作用,例如信號通路、植物發育和對環境脅迫的響應中涉及的多個生理過程。擬南芥環核苷酸門控通道2(AtCNGC2)參與擬南芥表皮細胞中茉莉酸(JA)誘導的質外體Ca2+流入[10],AtCNGC4可滲透K+、Na+,并被環磷酸鳥苷(cGMP)、環磷酸腺苷(cAMP)激活[11],AtCNGC7、AtCNGC8基因對雄性生殖力的作用至關重要[12],AtCNGC16、AtCNGC18基因可參與花粉發育[13],AtCNGC6、AtCNGC19、AtCNGC20基因參與了非生物脅迫反應[14]。
近年來,人們對植物中的CNGC基因家族進行了研究,然而,關于陸地棉(Gossypium hirsutum Linn.)CNGC(GhCNGC)基因家族的系統鑒定、起源和功能的研究卻很少。本研究利用陸地棉全基因組序列信息、擬南芥CNGC家族的研究信息及綜合生物信息學分析技術對陸地棉中CNGC進行全基因組鑒定來完成每個CNGC基因家族成員的深入分析,包括對編碼蛋白的生理、生化特性分析。此外,本研究還分析了CNGC家族成員的表達方式,以闡明其對生物、非生物脅迫響應的機制,并鑒定出可能對育種有用的新基因。
1 材料與方法
1.1 陸地棉CNGC基因家族成員的篩選鑒定
陸地棉TM-1的基因組數據來自南京農業大學Cotton Research Institute網站 (http://mascotton.njau.edu.cn/),試驗時間為2020年8月,試驗地點為新疆維吾爾自治區石河子市新疆農墾科學院棉花研究所。以擬南芥CNGC基因家族成員的身份標志(ID)為探針在陸地棉TM-1基因組注釋文件中查找陸地棉CNGC家族ID,用虛擬機Bio-Linux 80運行HMM-Search搜索結構域,并提取目標基因序列。
1.2 陸地棉CNGC基因家族的理化性質分析
通過ExPASY-ProtParam在線網站(https://web.expasy.org/protparam)對陸地棉CNGC蛋白家族氨基酸序列的分子式、總原子數、親水性平均值、分子質量、蛋白不穩定系數等進行預測分析。通過SOPMA在線網站(https://npsa-prabi.ibcp.fr)分析陸地棉CNGC蛋白家族的二級結構。
1.3 陸地棉CNGC基因家族進化樹的構建
將陸地棉、擬南芥的CNGC蛋白序列以fasta格式保存在1個文件中,用默認參數運行MEGA 7.0軟件的ClustalW命令,進行序列對齊,采用鄰接法(neighbor-joining,NJ)進行系統發育重建,以自舉法(bootstrap method)進行系統發育計算,引導復制次數為1 000次,輸出格式為Newick,通過Evolview在線網站(https://www.evolgenius.info/evolview/)進行進化樹的編輯。
1.4 陸地棉CNGC基因家族染色體的定位及結構分析
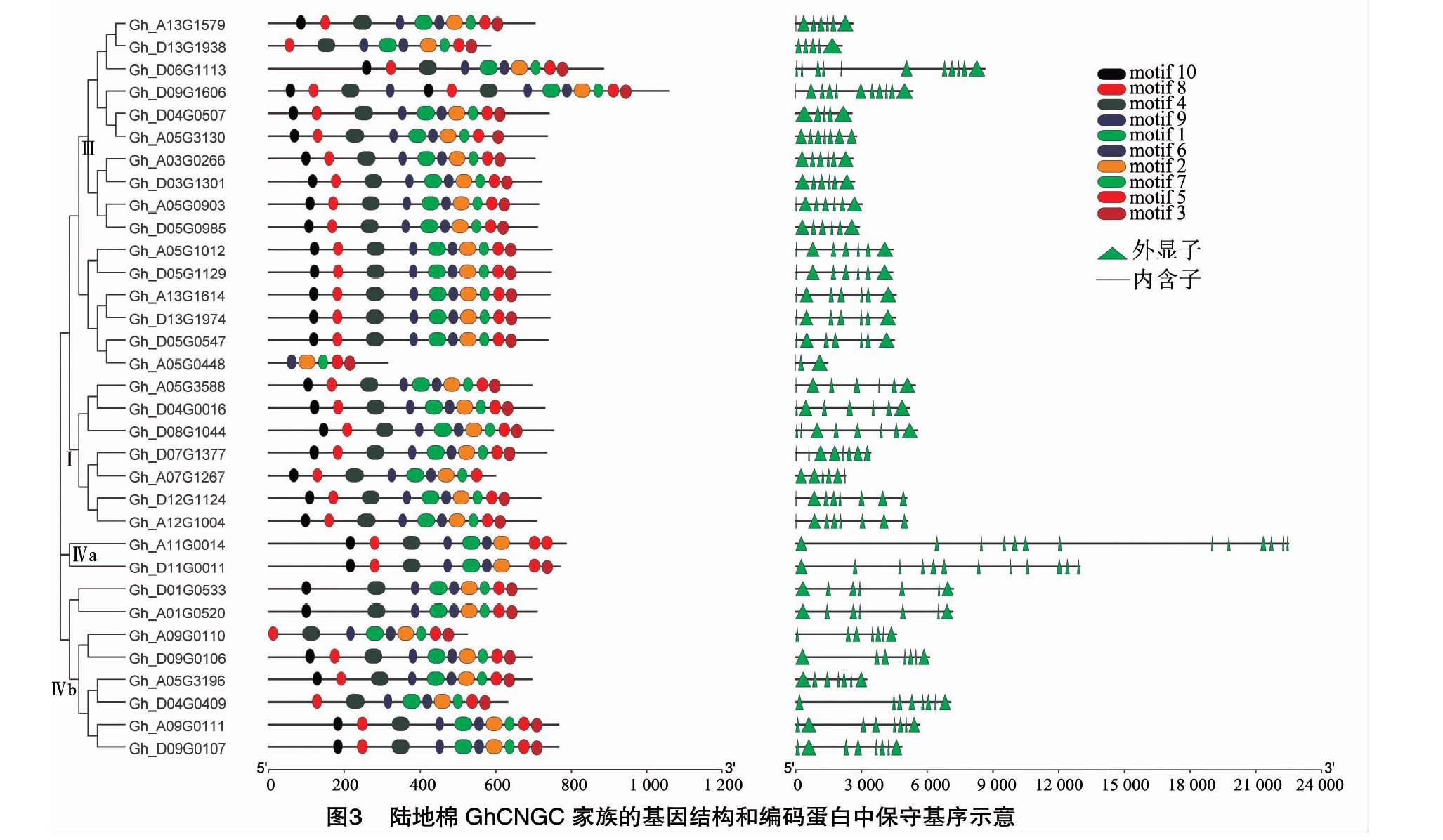
根據陸地棉基因組數據庫中CNGC基因家族成員在染色體上的區域分布和染色體長度,通過Map Gene 2 Chrom在線網站(http://mg2c.iask.in/mg2c_v2.1/)繪制染色體分布圖。通過MEME在線網站(http://meme-suite.org/)進行motif分析,搜索得到motif的總數為10個。用本地軟件TBtools將CNGC基因家族進化樹、MEME分析圖和基因結構圖進行合并分析。
1.5 陸地棉CNGC基因家族的差異表達分析
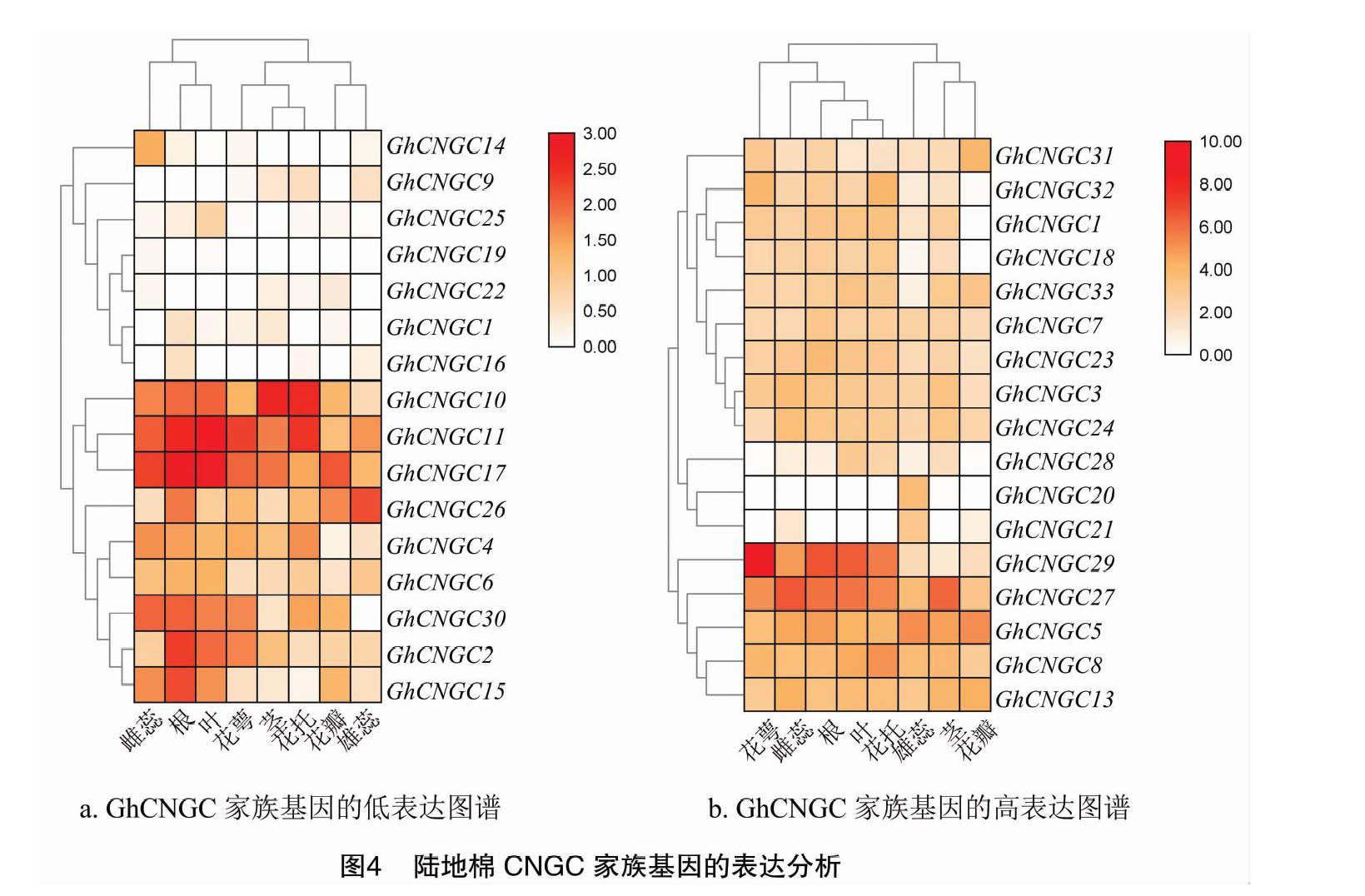
從美國國家生物信息中心(NCBI)數據庫中下載TM-1標準系陸地棉轉錄組數據包PRJNA248163,以FPKM值作為參數,將FPKM值低于8的分為一組,高于8的分為另一組。用TB-tools軟件進行基因表達圖譜的繪制。
2 結果與分析
2.1 陸地棉CNGC基因家族的鑒定分析
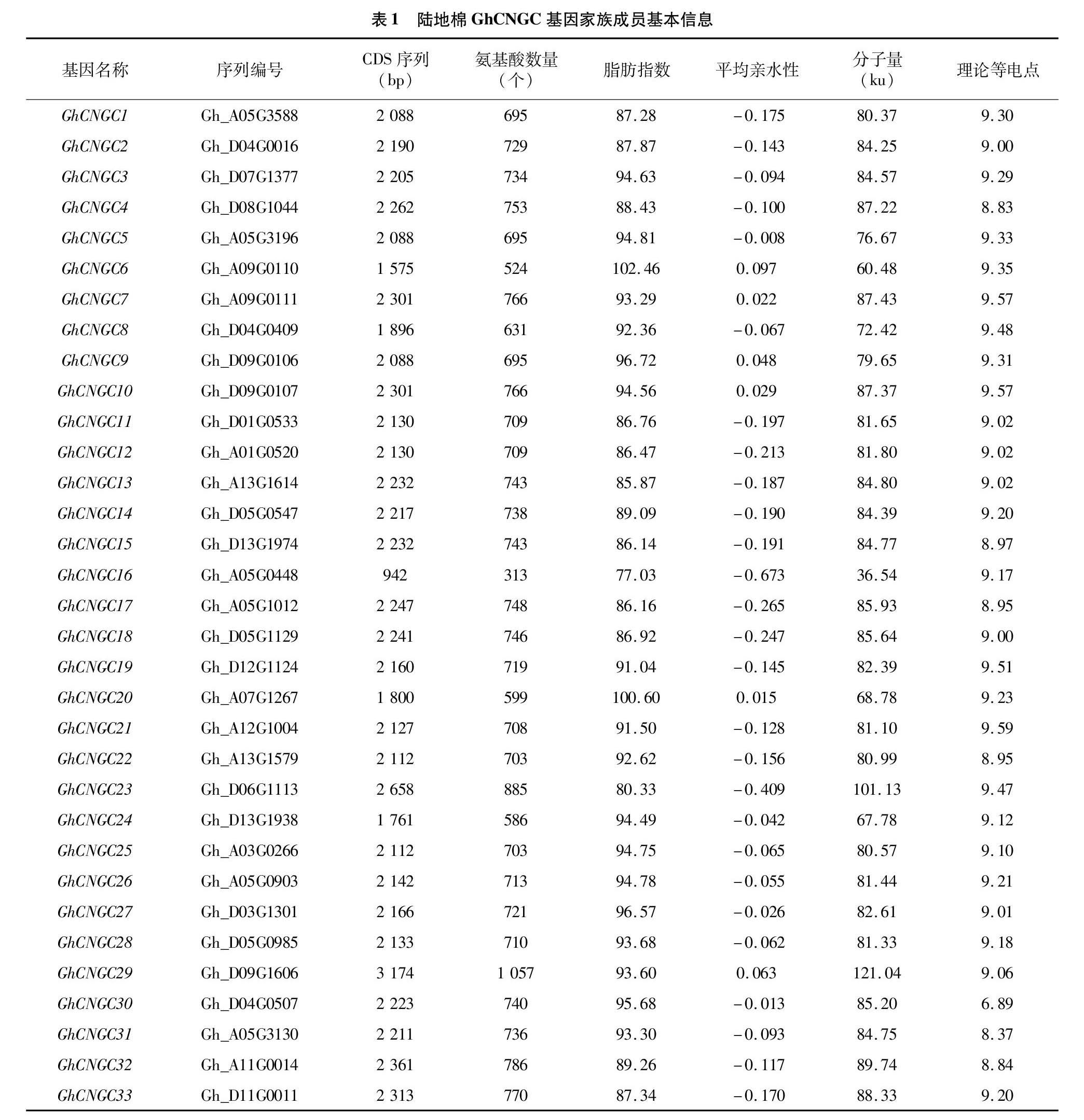
以已知的20個擬南芥CNGC基因家族成員的蛋白序列作為參考序列,在陸地棉標準系TM-1全基因組數據庫中進行比對篩選,最終獲得33個環狀核苷酸門控通道(CNGC)基因家族成員。由表1可以看出,陸地棉環狀核苷酸門控通道基因家族成員基因編碼區(CDS)序列全長為942~3 174 bp,編碼氨基酸313~1 057個,脂肪指數為77.03~102.46,平均親水性為-0.673~0.097,都屬于親水性蛋白;氨基酸殘基分子量為36.54~121.04 ku,理論等電點為689~9.59。
2.2 陸地棉CNGC基因家族的二級結構預測及蛋白的穩定性分析
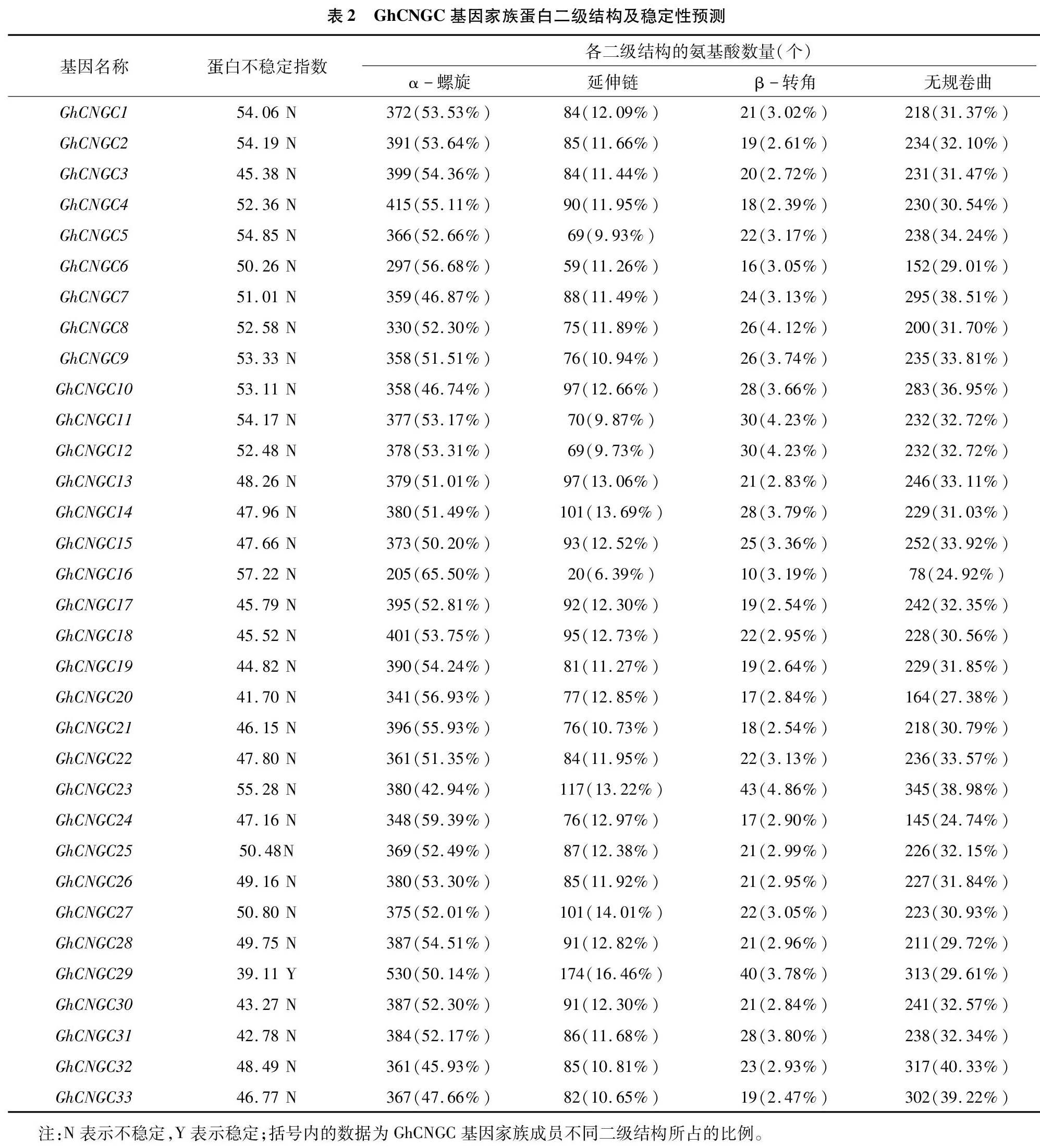
由表2可以看出,陸地棉CNGC基因家族成員的二級結構均由α-螺旋、延伸鏈、β-轉角、無規卷曲4種結構組成,并且α-螺旋和無規卷曲是主要組成部分,所占比例最大。延伸鏈、β-轉角包含的氨基酸殘基數少,在二級結構中所占比例較小。根據蛋白不穩定指數統計結果發現,該家族成員的蛋白不穩定指數為39.11~57.22,僅GhCNGC29為穩定蛋白(穩定指數<40),其余的32個家族成員均為不穩定蛋白。
2.3 擬南芥與陸地棉CNGC基因家族的系統發育分析
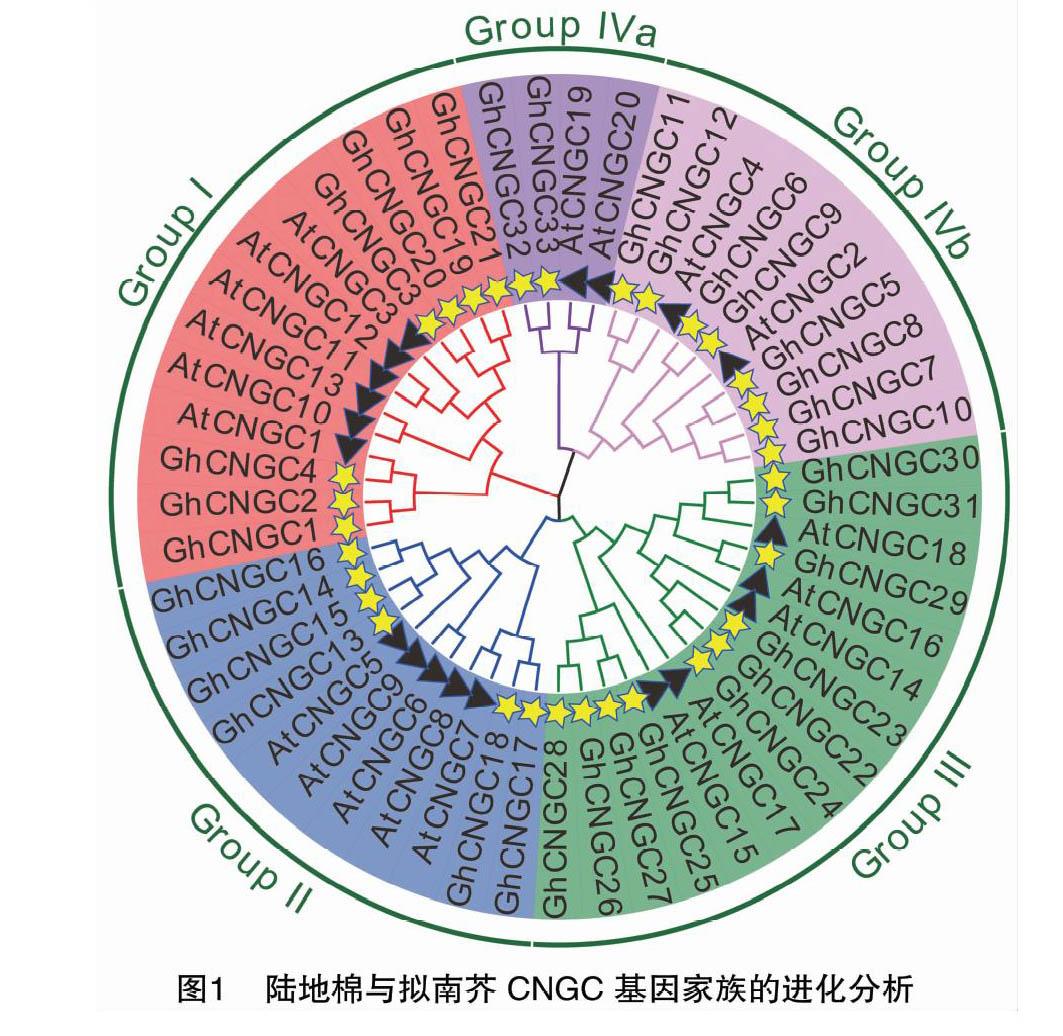
本研究從陸地棉標準系TM-1基因組數據庫中篩選得到33個GhCNGC基因,根據這些基因在染色體上的分布情況,將這些基因命名為GhCNGC1~GhCNGC33。依據擬南芥AtCNGC基因家族的系統發育關系,將GhCNGC基因家族的33個成員與AtCNGC基因家族的20個成員的蛋白序列構建成系統進化樹。由圖1可以看出,GhCNGC基因家族成員的聚類情況與擬南芥相似,分為4個組群,分別為Group I、Group Ⅱ、Group Ⅲ、Group Ⅳ,其中Group Ⅳ又分為Group Ⅳ a和Group Ⅳ b。Group I含有13個成員,包括7個GhCNGC(GhCNGC1、GhCNGC2、GhCNGC3、GhCNGC4、GhCNGC19、GhCNGC20、GhCNGC21)和6個AtCNGC(AtCNGC1、AtCNGC3、AtCNGC10、AtCNGC11、AtCNGC12、AtCNGC13);Group Ⅱ含有6個GhCNGC(GhCNGC13、GhCNGC14、GhCNGC15、GhCNGC16、GhCNGC17、GhCNGC18)和5個AtCNGC(AtCNGC5、AtCNGC6、AtCNGC7、AtCNGC8、AtCNGC9);Group Ⅲ含有10個GhCNGC (GhCNGC22、GhCNGC23、GhCNGC24、GhCNGC25、GhCNGC26、GhCNGC27、GhCNGC28、 GhCNGC29、 GhCNGC30、GhCNGC31)和5個AtCNGC(AtCNGC14、AtCNGC15、AtCNGC16、AtCNGC17、AtCNGC18);Group Ⅳa含有2個GhCNGC(GhCNGC32、GhCNGC33)和2個AtCNGC(AtCNGC19、AtCNGC20);Group Ⅳb含有8個GhCNGC(GhCNGC5、GhCNGC6、GhCNGC7、GhCNGC8、GhCNGC9、GhCNGC10、GhCNGC11、GhCNGC12)和2個AtCNGC(AtCNGC2、AtCNGC4)。
2.4 陸地棉CNGC家族成員的染色體定位
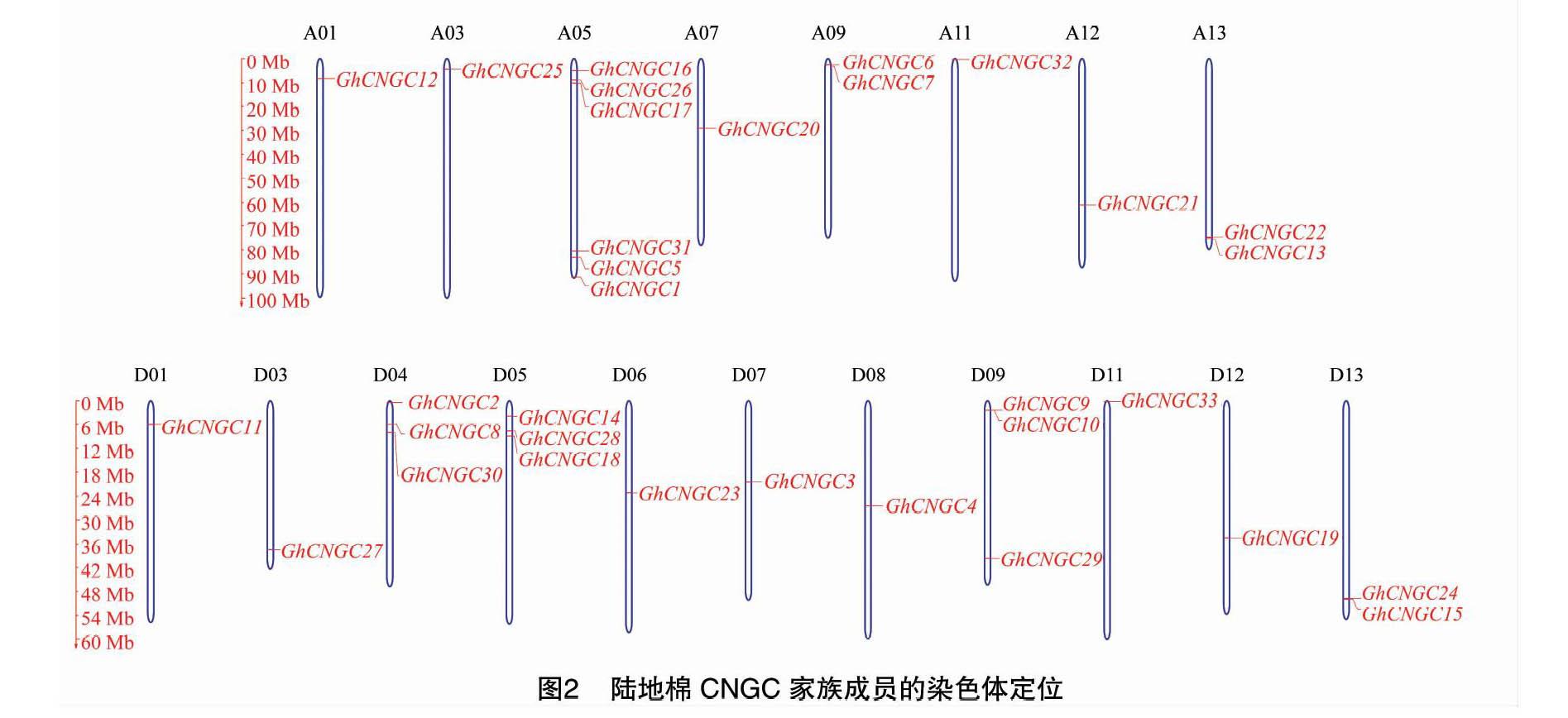
根據陸地棉標準系TM-1的基因組數據庫資源,通過網站MapGene2Chrom進行在線GhCNGC家族成員的染色體定位分析[15]。將GhCNGC家族的33個成員定位在19條染色體上,并繪制該家族的基因圖譜。結果(圖2)顯示,分布在D基因組亞組的基因最多,有18個,而這18個基因主要分布在染色體的兩端,分布在上端的基因比分布在下端的基因多,分布在中間部位的基因僅有3個。分布在A基因組亞組的基因相對較少,有15個,這15個基因依然主要分布在染色體的兩端。分布在D04、D05、D09和A05染色體上的基因最多,分別為3、3、3、6個,而其他染色體上僅分布1~2個該家族基因成員。
2.5 陸地棉CNGC的系統進化和基因結構分析
通過MEME在線網站[16]及TB-tools軟件[17]分析GhCNGC家族成員的保守基序、內含子和外顯子的數量及分布。由圖3可以看出,同一亞家族成員分布在同一進化分支上,與圖1中的進化分析結果相同。分析motif的數量及位置發現,同一組成員的motif數量基本相同,且分布的位置較接近,在不同組之間存在差異。該家族33個成員中的24個成員均含有10個motif,8個成員的motif數量為9個,1個成員的motif數量為5個。而motif數量為9個的成員大多分布在Ⅳ組,可能由于Ⅳ組與其他3組的親緣關系較遠。有趣的是,Ⅱ組中的GhCNGC16僅有5個motif基序。從在內含子與外顯子的分布情況看出,多數同一組成員的內含子及外顯子數量較為接近,I組7個成員外顯子數為6~8個;Ⅱ組6個成員的外顯子數量為3~7個,除GhCNGC之外,均為7個外顯子;Ⅲ組的外顯子數量為5~11個;Ⅳ組的外顯子數量為7~13個, 但是Ⅳ a的2個成員的外顯子數量分別為12、13個,Ⅳ b的成員中,5個外顯子數量為7個,3個外顯子數量為8個。而且同一組成員的外顯子、內含子分布情況類似,差異顯著性小,表明了進化的保守性。不同組之間的差異較為顯著,尤其是Ⅳ組的成員之間及其與其他組相比較差異較大。
2.6 陸地棉CNGC家族成員表達分析
從NCBI網站下載陸地棉TM-1的PRJNA248163數據資源,分析GhCNGC家族基因的表達模式,選取根、莖、葉、雄蕊、雌蕊、花托、花萼和花瓣等8個組織進行預測。圖4-a中16個基因的表達量較低,圖4-b中17個基因的表達量較高。不同GhCNGC家族基因在不同組織中的表達量存在差異,GhCNGC10在莖、花托中的表達量高,GhCNGC11在根、葉、花托中的表達量高,GhCNGC17在莖中的表達量高,GhCNGC26在雄蕊中的表達量高,GhCNGC29在花萼中的表達量高,GhCNGC27在雌蕊中的表達量高。GhCNGC2、GhCNGC11、GhCNGC15、GhCNGC17、GhCNGC26和GhCNGC30在根中的表達量相對較高。由此可見,GhCNGC10、GhCNGC11、GhCNGC27、GhCNGC29可能參與陸地棉的生殖過程,GhCNGC17、GhCNGC2、GhCNGC15可能參與到陸地棉的營養生長過程,而GhCNGC10、GhCNGC11、GhCNGC17、GhCNGC29等基因在多個組織中的表達量均較高,可能這些基因具有一因多效的特點。
3 討論
環核苷酸門控通道是配體門控、鈣離子滲透的二價陽離子選擇性通道,在非生物脅迫信號傳導相關的信號傳導過程中具有重要的生物學功能。本研究基于電生理和異源表達分析,用正向遺傳方法明確了擬南芥中的AtCNGC2、AtCNGC4、AtCNGC11和AtCNGC12參與了植物免疫過程[18]。據報道,其生物學作用在防御反應、發育和離子體內平衡方面具有重要作用。目前,棗樹[19]、水稻[20]、梨[2]、煙草[21]、小麥[22]等植物的CNGC蛋白均有相應研究。雖然CNGC在植物生存及對環境的脅迫響應中起著關鍵作用,但人們對陸地棉中CNGC家族所扮演的角色和功能知之甚少。陸地棉是全球重要的經濟作物,本研究在陸地棉TM-1全基因組數據庫[23]中篩選鑒定獲得33個GhCNGC蛋白。通過分析確定33個GhCNGC蛋白的生理生化特征,陸地棉環狀核苷酸門控通道基因家族成員CDS序列全長為942~3 174 bp,編碼的氨基酸數量為313~1 057個。脂肪指數為77.03~102.46,平均親水性為-0.673~0.097,都屬于親水性蛋白。理論等電點為6.89~9.59,且等電點、蛋白質電荷對于溶解度,亞細胞定位和相互作用非常重要,這取決于直系同源物之間的插入和缺失及有機體的生態[24]。根據蛋白不穩定指數統計結果可知,該家族成員的蛋白不穩定指數為39.11~57.22,僅GhCNGC29為穩定蛋白(穩定指數<40),其余32個家族成員均為不穩定蛋白。陸地棉是四倍體,具有A、D 2個亞基因組,染色體定位分析發現,這33個GhCNGC蛋白有15個存在于A亞基因組上,18個存在于D亞基因組上。由系統發育分析結果可知,GhCNGC家族成員分為I、Ⅱ、Ⅲ、Ⅳ等4個組,第Ⅳ組又分為Ⅳ a、Ⅳ b 2個亞組,與擬南芥CNGC家族分類相似[25]。這些數據表明,基因在進化過程中發生了分離。不同分組中包含的家族成員數量不同,可能由于在基因家族進化過程中,基因復制、基因丟失扮演著重要角色,從而創造新的基因和不同的功能[26],以優化植物的適應性。分析基因差異表達圖譜發現,GhCNGC10、GhCNGC11、GhCNGC27、GhCNGC29在花托、花萼、雌蕊中表現出差異表達,表明它們可能參與到陸地棉的生殖過程中。而GhCNGC10、GhCNGC11、GhCNGC17、GhCNGC29等基因在多個組織中均有較高表達量,可能由于這些基因參與了多個代謝通路。
本研究以生物信息學和比較基因組學方法,分析了關于結構域,外顯子-內含子結構以及系統進化樹和表達分析的全面信息。已知植物CNGC對多種非生物刺激起著關鍵作用,包括冷脅迫、鹽脅迫、激素應答、發育和光信號傳導等[27],這些信息可以用于分析蛋白質相互作用網絡,可為改善陸地棉的抗逆性、分子育種、纖維品質等提供重要參考。
4 結論
綜上所述,本研究通過生物信息學手段從陸地棉基因組中全面鑒定出33個CNGC基因,分別位于A、D亞基因組中的CNGC家族中,分別有15、18個成員。本研究還分析了系統發育、保守基序和外顯子等,以轉錄組數據為基礎分析了該家族成員在不同組織中的差異性表達。總體來看,對陸地棉基因組中GhCNGC基因家族的分析對植物CNGC功能研究提供了綜合概述,并為進一步闡明GhCNGC基因家族基因間相互作用的機制提供了前景。
參考文獻:
[1]DeFalco T A,Marshall C B,Munro K,et al. Multiple calmodulin-binding sites positively and negatively regulate Arabidopsis CYCLIC NUCLEOTIDE-GATED CHANNEL12[J]. Plant Cell,2016,28(7):1738-1751.
[2]Chen J Q,Yin H,Gu J P,et al. Genomic characterization,phylogenetic comparison and differential expression of the cyclic nucleotide-gated channels gene family in pear (Pyrus bretchneideri Rehd.)[J]. Genomics,2015,105(1):39-52.
[3]Zelman A K,Dawe A,Berkowitz G A. Identification of cyclic nucleotide gated channels using regular expressions[J]. Methods in Molecular Biology,2013,1016:207-224.
[4]Nawaz Z,Kakar K U,Saand M A,et al. Cyclic nucleotide-gated ion channel gene family in rice,identification,characterization and experimental analysis of expression response to plant hormones,biotic and abiotic stresses[J]. BMC Genomics,2014,15(1):853.
[5]Hao L D,Qiao X L. Genome-wide identification and analysis of the CNGC gene family in maize[J]. Peer J,2018,6:e5816.
[6]Moon J Y,Belloeil C,Ianna M L,et al. Arabidopsis CNGC family members contribute to heavy metal ion uptake in plants[J]. International Journal of Molecular Sciences,2019,20(2):413.
[7]Kakar K U,Nawaz Z,Kakar K,et al. Comprehensive genomic analysis of the CNGC gene family in Brassica oleracea:novel insights into synteny,structures,and transcript profiles[J]. BMC Genomics,2017,18(1):869.
[8]Li Q Q,Yang S Q,Ren J,et al. Genome-wide identification and functional analysis of the cyclic nucleotide-gated channel gene family in Chinese cabbage[J]. 3 Biotech,2019,9(3):114.
[9]Saand M A,Xu Y P,Munyampundu J P,et al. Phylogeny and evolution of plant cyclic nucleotide-gated ion channel (CNGC) gene family and functional analyses of tomato CNGCs[J]. DNA Research,2015,22(6):471-483.
[10]Lu M,Zhang Y Y,Tang S K,et al. AtCNGC2 is involved in jasmonic acid-induced calcium mobilization[J]. Journal of Experimental Botany,2016,67(3):809-819.
[11]Ali R,Ma W,Lemtiri-Chlieh F,et al. Death don’t have no mercy and neither does calcium:Arabidopsis CYCLIC NUCLEOTIDE GATED CHANNEL2 and innate immunity[J]. Plant Cell,2007,19(3):1081-1095.
[12]Tunc-Ozdemir M,Rato C,Brown E,et al. Cyclic nucleotide gated channels 7 and 8 are essential for male reproductive fertility[J]. PLoS One,2013,8(2):e55277.
[13]Tunc-Ozdemir M,Tang C,Ishka M R,et al. A cyclic nucleotide-gated channel (CNGC16) in pollen is critical for stress tolerance in pollen reproductive development[J]. Plant Physiology,2013,161(2):1010-1020.
[14]Gao F,Han X W,Wu J H,et al. A heat-activated calcium-permeable channel-Arabidopsis cyclic nucleotide-gated ion channel 6-is involved in heat shock responses[J]. Plant Journal,2012,70(6):1056-1069.
[15]晁江濤,孔英珍,王 倩,等. MapGene2Chrom基于Perl和SVG語言繪制基因物理圖譜[J]. 遺傳,2015,35(1):91-97.
[16]Bailey T L,Boden M,Buske F A,et al. MEME SUITE:tools for motif discovery and searching[J]. Nucleic Acids Research,2009,37:202-208.
[17]Chen C J,Chen H,Zhang Y,et al. TBtools:an integrative Toolkit developed for interactive analyses of big biological data[J]. Molecular Plant,2020,13(8):1194-1202.
[18]Moeder W,Urquhart W,Ung H,et al. The role of cyclic nucleotide-gated ion channels in plant immunity[J]. Molecular Plant,2011,4(3):442-452.
[19]Wang L X,Li M,Liu Z G,et al. Genome-wide identification of CNGC genes in Chinese jujube (Ziziphus jujuba Mill.) and ZjCNGC2 mediated signalling cascades in response to cold stress[J]. BMC Genomics,2020,21(1):191.
[20]Cui Y M,Lu S,Li Z,et al. CYCLIC NUCLEOTIDE-GATED ION CHANNELs 14 and 16 promote tolerance to heat and chilling in rice[J]. Plant Physiology,2020,183(4):1794-1808.
[21]Nawaz Z,Kakar K U,Ullah R,et al. Genome-wide identification,evolution and expression analysis of cyclic nucleotide-gated channels in tobacco (Nicotiana tabacum L.)[J]. Genomics,2019,111(2):142-158.
[22]Guo J,Islam M A,Lin H C,et al. Genome-wide identification of cyclic nucleotide-gated ion channel gene family in wheat and functional analyses of TaCNGC14 and TaCNGC16[J]. Front Plant Sci,2018,9:18.
[23]Zhang T Z,Hu Y,Jiang W K,et al. Sequencing of allotetraploid cotton (Gossypium hirsutum L. acc. TM-1) provides a resource for fiber improvement[J]. Nature Biotechnology,2015,33(5):531-537.
[24]Khaldi N,Shields D C. Shift in the isoelectric-point of milk proteins as a consequence of adaptive divergence between the milks of mammalian species[J]. Biol Direct,2011,6:40.
[25]Mser P,Thomine S,Schroeder J I,et al. Phylogenetic relationships within cation transporter families of Arabidopsis[J]. Plant Physiology,2001,126(4):1646-1667.
[26]Chauve C,Doyon J P,El-Mabrouk N. Gene family evolution by duplication,speciation,and loss[J]. Journal of Computational Biology,2008,15(8):1043-1062.
[27]Fu Y P,Duan X Y,Tang C L,et al. TaADF7,an actin-depolymerizing factor,contributes to wheat resistance against Puccinia striiformis f. sp. tritici[J]. Plant J,2014,78(1):16-30.

