夾心ELISA法測定基因重組球蟲表達異源蛋白的水平
羅伏兵, 徐發榮, 王慧強, 馬志軍, 湯新明, 劉賢勇, 索 勛, 劉曉冬
(1.北京市動物疫病預防控制中心, 北京大興102629 ; 2.中國農業大學動物醫學院, 北京海淀100193)
艾美耳球蟲(Eimeria)基因組約60 Mbp,可編碼8 000~9 000個蛋白,組分復雜[1]。分析異源抗原在基因重組球蟲混合組分中所占比重是優化抗原表達水平的基礎。常規蛋白定量方法主要是基于蛋白分子間化學鍵或氨基酸特性等建立的檢測蛋白總量的方法,而無法滿足檢測混合蛋白組分中某一特定/單一蛋白的含量。免疫學檢測方法利用抗原抗體特異性的結合反應能夠準確檢出復雜組分中特定蛋白抗原或抗體,并能實現定量或半定量檢測的目的。ELISA是最常用的免疫學檢測方法之一,具有操作簡便、靈敏度高等優勢。本試驗以表達熒光蛋白的基因重組球蟲為模型,利用熒光蛋白特異性的抗體,建立檢測基因重組球蟲可溶性蛋白中熒光蛋白含量的夾心ELISA方法,為評估基因重組球蟲表達異源抗原的含量和優化其作為疫苗載體的研究提供了科學依據; 同時也為其他類型疫苗載體或相關研究提供借鑒。
1 材料與方法
1.1 蟲株與試劑 本文所用野生球蟲株、基因重組球蟲株EtM2e[2]和EtER[3],均由中國農業大學動物醫學院國家動物原蟲實驗室保存與擴繁。兔源黃色熒光蛋白多克隆抗體(Rabbit polyclonal to GFP,Proteintech)、鼠源黃色熒光蛋白單克隆抗體(Mouse monoclonal to GFP,Beyotime)、HRP標記的羊抗鼠IgG二抗(Proteintech)及BCA蛋白定量試劑盒均為商品化試劑。黃色熒光蛋白對照品系經原核表達、純化產物,并測定濃度。
1.2 基因重組球蟲蛋白提取 球蟲可溶性蛋白的提取方法依據參考文獻[4]進行。簡言之,取新鮮收取并純化后的EtM2e和EtER球蟲株5.0×107個孢子化卵囊,經液氮研磨后,加入適量蛋白裂解液,離心取上清即得球蟲可溶性蛋白,BCA法(按照說明書操作)測定球蟲蛋白濃度后,置于-20 ℃保存備用。
1.3 包被抗體濃度優化 ELISA方法及所用試劑配制等依據參考文獻[4]。簡言之,以兔源黃色熒光蛋白多克隆抗體為包被抗體,分別經1∶5、1∶10、1∶20、1∶40、1∶80、1∶160、1∶320、1∶640、1∶1 280稀釋后,每孔100 μL加入ELISA板中,4 ℃過夜包被。以5%脫脂乳、37 ℃封閉2 h。每孔加入100 μL原核表達的黃色熒光蛋白(2 μg/mL),37 ℃反應1 h;同時設置空白對照組。每孔加入100 μl鼠源黃色熒光蛋白單克隆抗體100 μL(1∶1 000稀釋),37 ℃反應1 h。每孔加入100 μL HRP標記的羊抗鼠IgG二抗100 μL(1∶5 000稀釋),37 ℃反應1 h后加入TMB顯色5 min。終止反應后測定OD450和OD630的吸光度值。以達到最大吸光度值的最大抗體稀釋倍數確定包被濃度。
1.4 檢測抗體濃度優化 以1.3確定的抗體包被濃度進行包被,封閉后每孔加入100 μL原核表達的黃色熒光蛋白(2 μg/mL),37 ℃反應1 h;同時設置空白對照組。每孔加入100 μL鼠源黃色熒光蛋白單克隆抗體100 μL(1∶500、1∶1 000、1∶2 000、1∶4 000、 1∶8 000、1∶16 000、1∶32 000、1∶64 000稀釋),37 ℃反應1 h。其他操作同1.3,確定檢測抗體濃度。
1.5 檢測基因重組黃色熒光蛋白體系的建立與優化 以1.3確定的抗體包被濃度進行包被,封閉后每孔加入100 μL原核表達的黃色熒光蛋白(0、0.001 9、0.003 9、0.007 8、0.015 6、0.031 2、0.062 5、0.125、0.25、0.5、1.0、2.0 μg/mL),37 ℃反應1 h;同時設置空白對照組。每孔加入100 μL鼠源黃色熒光蛋白單克隆抗體100 μL(1.4確定的檢測抗體濃度),37 ℃反應1 h。其他操作同1.3,檢測不同濃度的重組黃色熒光蛋白與吸光度值之間的線性關系。
1.6 球蟲可溶性蛋白中黃色熒光蛋白含量測定 以1.3和1.4確定的包被抗體與檢測抗體濃度,加入已知總濃度的基因重組球蟲可溶性蛋白,同時設置不同濃度原核表達的黃色熒光蛋白繪制標準曲線,以野生型球蟲可溶性蛋白作為對照,按照1.3反應條件進行檢測。以不同濃度原核表達的黃色熒光蛋白及其對應的OD450值繪制標準曲線,并得到吸光度值與蛋白濃度的線性方程。根據基因重組球蟲蛋白孔的吸光度值和線性方程推算球蟲可溶性蛋白中黃色熒光蛋白的濃度,進而確定其表達水平。
1.7 數據處理與分析 所有數據均使用Microsoft Excel(2016)軟件進行處理與分析,部分圖片采用GraphPad Prism 7.0軟件生成。
2 結果
2.1 夾心ELISA方法的建立 為了建立有效的檢測混合組分中特定/單一蛋白含量的夾心ELISA方法,本文以黃色熒光蛋白為檢測對象,對包被抗體的濃度、檢測抗體的濃度進行了優化。結果顯示,以2 μg/mL原核表達的黃色熒光蛋白為檢測對象,商品化的兔源黃色熒光蛋白多克隆抗體作為包被抗體,吸光度值隨著其稀釋倍數的降低而升高,在1∶20 時達到飽和(圖1)。同樣,商品化的鼠源黃色熒光蛋白單克隆抗體作為檢測抗體,吸光度值隨著其稀釋倍數的降低而升高,在1∶4 000時達到飽和(圖2)。在此條件下(包被抗體1∶20稀釋,檢測抗體1∶4 000稀釋),不同濃度的黃色熒光蛋白與吸光度值之間呈現良好線性關系。因此,本文將包被抗體的濃度確定為1∶20稀釋,將檢測抗體的濃度確定為1∶4 000稀釋。
2.2 基因重組球蟲可溶性蛋白中黃色熒光蛋白含量的測定 基因重組球蟲表達異源蛋白的水平受啟動子的調控。對比組蛋白4(His4)和膜抗原13(SAG13)啟動子調控黃色熒光蛋白表達的基因重組球蟲EtM2e和EtER,前者的熒光蛋白強度弱于后者(見中插彩版圖3)。利用建立的夾心ELISA方法對2株基因重組球蟲熒光蛋白的表達水平進行測定。首先建立黃色熒光蛋白濃度和吸光度值的標準曲線,呈正相關線性關系(y=0.920 7x+0.096 3,R2=0.991 2)。以100.0 μg/mL的EtM2e和EtER可溶性抗原加入檢測體系,吸光值分別為0.382和0.865,即黃色熒光蛋白的濃度分別為0.31 μg/mL和0.94 μg/mL。而加入野生型球蟲可溶性蛋白的吸光度值為0.01,說明球蟲組分與包被抗體和檢測抗體無交叉反應。因此,黃色熒光蛋白在EtM2e和EtER可溶性蛋白的占比分別為3.1‰和9.4‰,證實SAG13啟動子調控異源蛋白表達的水平優于His4啟動子,與熒光顯微鏡觀察一致。
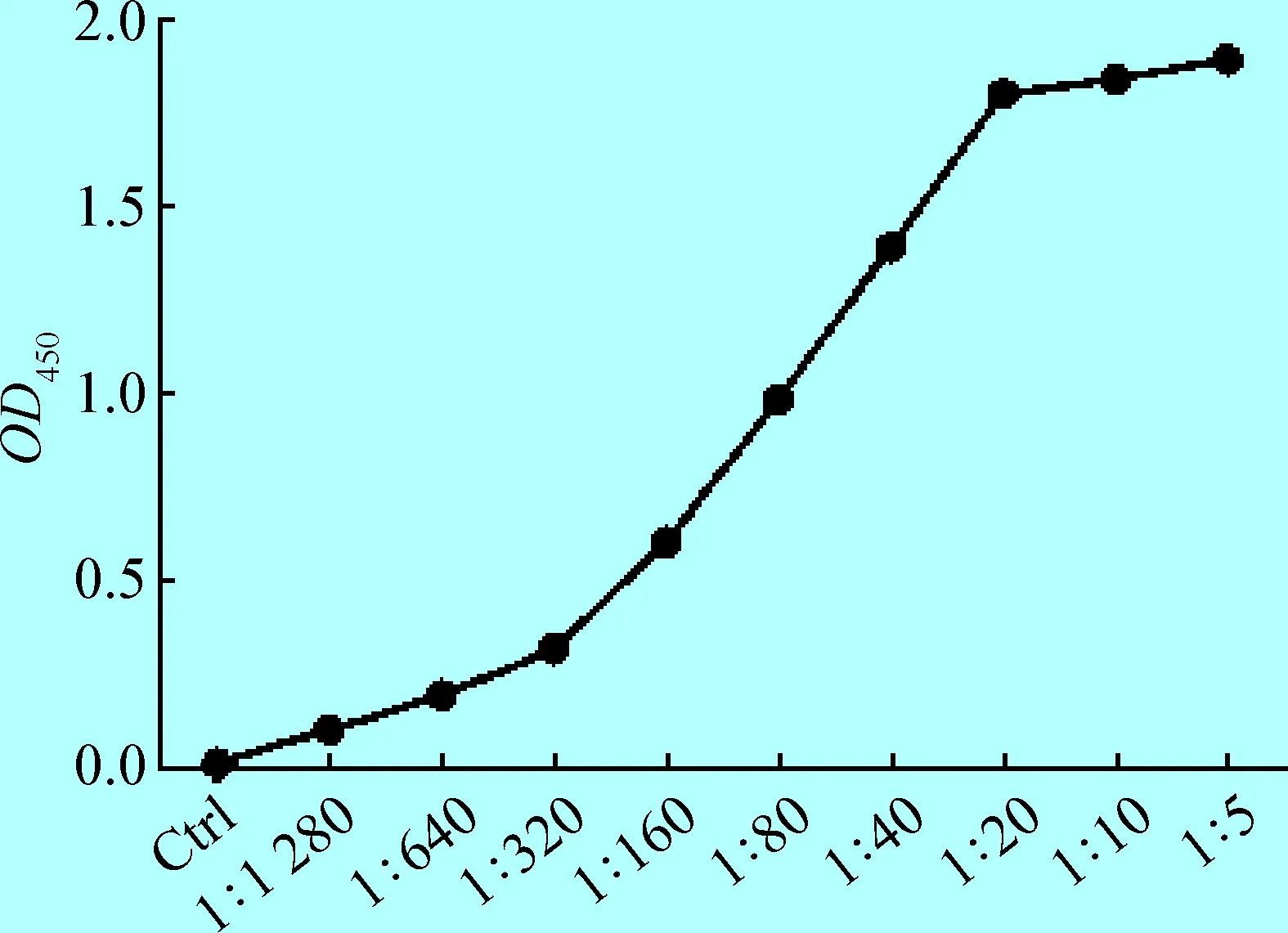
圖1 包被抗體最佳包被濃度的確定Fig.1 Determination of the optimal coating concentration of coated antibodies
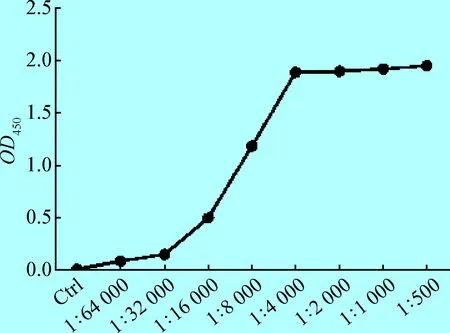
圖2 檢測抗體最佳稀釋濃度的確定Fig.2 Determination of the optimal dilution concentration of the detection antibody
3 討論
本試驗建立了測定球蟲混合可溶性組分中黃色熒光蛋白含量的夾心ELISA方法,具有較高的靈敏性,實現了對不同啟動子調控熒光蛋白表達水平的定量比較,為后續基因重組球蟲作為疫苗載體啟動子的選擇等提供參考。
與常規蛋白定量方法,如雙縮脲法、Lowry法、紫外分光光度法、考馬斯亮藍結合法和BCA法等相比,本試驗建立的夾心ELISA方法優勢在于能夠檢測混合蛋白組分中特定/單一蛋白的含量或濃度[4]。影響夾心ELISA方法檢測效果的因素很多,包括包被液、封閉液的選擇,包被和抗原抗體反應時間等[5],本試驗僅對包被抗體和檢測抗體的濃度進行了優化,其他反應條件則采取實驗室前期建立的ELISA檢測體系,檢測靈敏度可達3.0 ng。在后續研究中,可對其他條件進行優化來提升檢測的靈敏度。對本試驗而言,影響檢測效果的因素還包括包被抗體和檢測抗體的特異性與反應性:(1) 球蟲可溶性組分復雜,包含數千種蛋白,除與特定蛋白黃色熒光蛋白發生特異性反應外,與其他組分應無交叉反應(2.2結果已證實);(2) 包被抗體、檢測抗體與酶標二抗之間應無交叉免疫反應(2.1結果已證實)。
艾美耳球蟲生活史復雜,宿主體內的裂殖生殖階段異源抗原隨著蟲體的大量擴增而擴增,被宿主免疫系統識別,激發免疫應答,這也是球蟲作為疫苗載體的優勢之一[6-7]。基因重組球蟲表達異源蛋白的水平在內生性發育的不同階段表達水平可能存在差異,本試驗基于孢子化卵囊階段的基因重組球蟲表達異源蛋白的水平,為分析內生性發育各階段異源抗原的表達水平提供了科學依據。挖掘高效的持家基因啟動子是提升基因重組球蟲表達異源蛋白水平的有效策略,也是優化其作為疫苗載體的突破口之一。
4 結論
本試驗建立了一種測定混合組分中特定/單一蛋白含量的夾心ELISA方法,具有較高的靈敏性。

