鑒別口蹄疫病毒O型、A型、AsiaⅠ型三重RT-PCR檢測方法的建立
馬震原, 閆若潛, 趙雪麗, 謝彩華, 曹偉偉, 王淑娟, 王東方, 王華俊, 王 翠
(河南省動物疫病預防控制中心, 河南鄭州450008)
口蹄疫(Foot-and-mouth disease,FMD) 是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)引起的以偶蹄動物感染為主的急性、熱性、高度接觸性傳染病[1]。該病傳播快,傳染性強,暴發時可給世界范圍畜牧業造成嚴重危害。因此,世界動物衛生組織(OIE) 將其列為法定報告動物疫病的首位[2]。我國也將其列為一類重大動物疫病。FMDV病原變異大,現已發現有7個血清型[3],而我國主要受O、A型及AsiaⅠ型3種血清型的威脅[4]。FMDV各血清型之間無交叉免疫性,同一血清型內的不同亞型之間也只有部分有交叉免疫性[5]。因此,對FMDV的快速檢測及血清型鑒定是有效控制該病流行的關鍵。
不同血清型FMDV感染的臨床癥狀難以被區分,傳統的檢測方法很難準確判斷[6-7]。目前,常用于FMDV檢測的主要方法為酶聯免疫吸附試驗(Enzyme linked immunosorbent assay,ELISA) 和分子生物學檢測方法等。而ELISA目前只能用于評價口蹄疫單一血清型的抗體水平[8-9],無法實現對不同血清型抗原進行鑒別檢測。普通RT-PCR方法具有快速、特異、敏感等優點,不依賴于價格昂貴的儀器,可在基層疫病病原學檢測中廣泛實踐應用。本試驗針對O型、A型與AsiaⅠ型3種血清型設計特異性引物,建立FMDV O型、A型與AsiaⅠ型三重RT-PCR檢測方法,直接對3種血清型進行鑒定,方法快速、特異、準確,為臨床中有效準確地對FMDV快速分型提供有力的技術支持。
1 材料與方法
1.1 毒株 經滅活的FMDV O型、A型和AsiaⅠ型標準株細胞培養物,購自國內某單位生產的口蹄疫檢測試劑盒;經滅活的豬水皰病病毒(SVDV)、豬繁殖與呼吸綜合征病毒(PRRSV)、豬瘟病毒(CSFV)、豬偽狂犬病病毒(PRV)、豬細小病毒(PPV)、豬附紅細胞體(Eperythrozoonsuis)及豬弓形蟲(Toxoplasmosis)等毒株及正常BHK-21細胞株,均由河南省動物疫病預防控制中心提供。
1.2 儀器和試劑 PCR擴增儀,德國Biomotra公司產品;Kingfishier全自動核酸提取儀,美國Thermo Fisher公司產品;凝膠成像分析系統,美國AIpha Innotech 公司產品;恒溫水浴振蕩器(HZQ-Q),哈爾濱東聯電子技術開發有限公司產品;臺式高速冷凍離心機,美國Heraeus公司產品;ExTaqDNA聚合酶、dNTPs、DNA回收試劑盒等,均購自寶生物工程(大連)有限公司;pGEM-T Easy載體、JM109感受態細胞,均購自Promega公司。
1.3 引物設計與合成 以FMDV O型、A型和AsiaⅠ型均高度保守的2B基因為模板設計反轉錄引物P0,根據VP1基因設計3對特異性引物,分別命名為P1/P2、P3/P4、P5/P6,由寶生物工程(大連)有限公司合成,擴增出的片段大小分別為234 bp、326 bp和467 bp。
1.4 樣品核酸的提取和反轉錄 磁珠法提取經滅活的FMDV O型、A型和AsiaⅠ型標準株細胞培養物、正常BHK-21細胞、SVDV、PRRSV、CSFV 樣品的總RNA和PRV、PPV、Eperythrozoonsuis、Toxoplasmosis樣品的總DNA。提取樣本總RNA經反轉錄后,其cDNA置于-20 ℃凍存備用。
1.5 PCR擴增及測序 通過對PCR反應體系及反應條件的優化,以經滅活的FMDV O型、A型和AsiaⅠ型標準株細胞培養物等量混合物cDNA為模板進行三重RT-PCR擴增,同時設正常BHK-21細胞cDNA 為陰性對照。PCR產物經電泳鑒定后克隆入pGEM-T Easy載體,送寶生物工程(大連)有限公司進行測序鑒定。
1.6 敏感性試驗 將FMDV O型、A型和AsiaⅠ型標準株細胞培養物cDNA根據濃度成比列混合,每種cDNA的終濃度為1.0×107拷貝/μL,以10倍系列稀釋濃度為1.0×107~1.0×100拷貝/μL的混合cDNA為模板,同時設正常BHK-21細胞cDNA為陰性對照,進行敏感性檢測。
1.7 特異性試驗 以SVDV、PRRSV、CSFV樣品cDNA和PRV、PPV、豬附紅細胞體及豬弓形蟲樣品DNA,同時設經滅活的FMDV O型、A型和AsiaⅠ型標準株細胞培養物等量混合物cDNA為陽性對照,正常BHK-21細胞cDNA為陰性對照,進行PCR擴增以驗證該方法的特異性。
1.8 穩定性和重復性試驗 以1.6敏感性試驗的系列稀釋濃度cDNA為模板進行PCR擴增,每個系列重復3次試驗,以驗證該方法的穩定性和重復性。
1.9 臨床應用試驗 由具備國內口蹄疫病毒分離培養研究資質的實驗室以本試驗建立的三重RT-PCR方法對其保存的10 份臨床疑似樣品進行檢測,并與其之前的分離鑒定結果進行比較。同時設陰、陽性對照,同1.7特異性試驗。
2 結果
2.1 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法的建立 以經滅活的FMDV O型、A型和AsiaⅠ型標準株等量細胞培養液混合物cDNA為模板,擴增出了3條預期大小的目的條帶,分別為234 bp、326 bp和467 bp;以單一標準株細胞培養液RNA反轉錄產物為模板,均能擴增出相應的條帶;陰性對照未擴增出任何條帶(見圖1)。將3條不同的PCR擴增產物克隆入pGEM-T Easy載體進行測序,與GenBank中已登錄序列進行比對,3種血清型O型、A型和AsiaⅠ型擴增片段核苷酸序列同源性均達98%以上。
2.2 敏感性試驗 FMDV三種血清型O型、A型和AsiaⅠ型標準株細胞培養物cDNA最低檢測限均為100 拷貝/μL,均出現大小為234 bp、326 bp和467 bp 左右的目的條帶(見圖2),表明本試驗建立的FMDV O型、A型和AsiaⅠ型三重RT-PCR方法的最低檢測限度為100 拷貝/μL。
2.3 特異性試驗 陽性對照擴增出234 bp、326 bp和 467 bp 三條目的條帶,而陰性對照、 SVDV、PRRSV、CSFV、PRV、PPV、Eperythrozoonsuis、Toxoplasmosis樣品均未擴增出任何條帶(見圖3)。

圖1 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法擴增電泳圖Fig.1 Identification result of RT-PCR for serotype O,A and AsiaⅠ FMDVM:DL-2 000 DNA marker; 1: FMDV O型、A型和AsiaⅠ型標準株等量細胞培養液混合物; 2: FMDV O型培養物; 3: FMDV A型培養物; 4: FMDV AsiaⅠ型培養物; 5:陰性對照M: DL-2 000 DNA marker; 1: Mixture of serotype O, A and AsiaⅠ FMDV standard strain infected cell culture; 2: Serotype O FMDV standard strain infected cell culture; 3: Serotype A FMDV standard strain infected cell culture; 4: Serotype AsiaⅠ FMDV standard strain infected cell culture; 5: Negative control
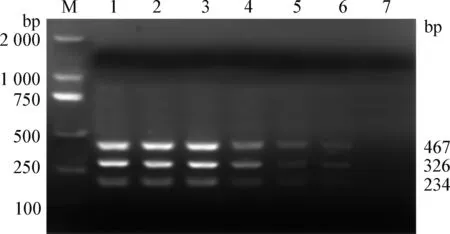
圖2 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法敏感性試驗擴增電泳圖Fig.2 Analysis of sensitivity test of RT-PCR for serotype O,A and AsiaⅠ FMDVM:DL-2 000 DNA marker; 1~7:10倍系列稀釋的濃度均為1.0×107~1.0×100 拷貝/μL的FMDV三種血清型O型、A型和AsiaⅠ型培養物混合物M:DL-2 000 DNA marker; 1~7:Mixture serotype of O, A and AsiaⅠ FMDV plasmids in concentration of 1.0×107 ~1.0×100 copies/μL
2.4 穩定性和重復性試驗 濃度為1.0×107~1.0×102拷貝/μL模板的3次重復擴增結果均為陽性;濃度為1.0×101~1.0×100拷貝/μL模板的3次重復結果均為陰性。表明本試驗建立的FMDV O型、A型和AsiaⅠ型三重RT-PCR方法穩定性和重復性較好。
2.5 臨床應用試驗 對10份臨床疑似樣品株進行檢測,結果為口蹄疫O型陽性樣本4份、口蹄疫型A型陽性樣本1份、口蹄疫AsiaⅠ型陽性樣本3份、陰性樣本2份(見圖4)。此檢測結果與以前的分離鑒定結果符合率為100%。

圖3 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法特異性試驗擴增電泳圖Fig.3 Analysis of specificity of RT-PCR for serotype O,A and AsiaⅠFMDVM:DL-2 000 DNA marker; 1:陽性對照; 2:陰性對照; 3~9:SVDV, PRRSV, CSFV, PRV, PPV, Eperythrozoon suis and ToxoplasmosisM:DL-2 000 DNA marker; 1:Positive control; 2:Negative control; 3~9:SVDV, PRRSV, CSFV, PRV, PPV, Eperythrozoon suis and Toxoplasmosis
3 討論
我國是口蹄疫多發區,流行毒株種類較多。O型口蹄疫幾乎每年都會發生,而且波及范圍較廣泛;AsiaⅠ型在多個省份出現過疫情,已經報告有豬感染后死亡的病例;A型從2009年初至今,已有多個省份發生,涉及到牛和羊。當前我國不僅面臨FMDV毒株繁多、血清型復雜的嚴峻形勢,而且各亞型毒株在豬群中共感染,導致發病率與死亡率增高、免疫失敗散發,使防控難度大大增加。因此,對FMDV的快速分型檢測是控制疫情的有效手段,也是科學免疫的必要前提。目前,只有分子生物學檢測技術可以滿足快速準確地進行抗原分型的要求,同時可檢測到滅活病毒的核酸,較大程度地提高了檢測工作的安全性[10]。

圖4 FMDV O型、A型和AsiaⅠ型三重RT-PCR方法臨床樣本檢測電泳圖Fig.4 Clinical test of RT-PCR for serotype O,A and AsiaⅠ FMDVM:DL-2 000 DNA marker; 1:陽性對照; 2:陰性對照; 3~12:10份臨床疑似樣品M:DL-2 000 DNA marker; 1:Positive control; 2:Negative control; 3~12:10 suspected clinical samples
FMDV主要的非結構蛋白和保守序列主要包括2B、3D和IRES 等[11]。同源性分析顯示,2B區最為保守,同源性為 87.7%~95.2%;其次是 3C,第三是 3D[12]。同時有研究者發現,以2B為模板建立的RT-PCR方法敏感性更高[13]。因此,本試驗建立的FMDV O型、A型和AsiaⅠ型三重RT-PCR方法選取高度保守的2B基因區域設計反轉錄引物,對3種血清型病毒核酸反轉錄均能得到各自特異的cDNA。 本方法設計的3對型特異性引物是以FMDV的結構蛋白VP1為目的區域。因為該蛋白位于病毒衣殼表面,是決定FMDV抗原性的主要蛋白;同時VP1是能夠誘導動物產生中和抗體的唯一蛋白,臨床上合成肽疫苗的選擇區域來源于VP1上在129~169 負責保護性免疫的氨基酸區域;而不同血清型的VP1蛋白同源性僅有約60%[14-15],這恰好為鑒別不同血清型提供了特異性基因區域的要求。本試驗建立的鑒別FMDV O型、A型和AsiaⅠ型三重RT-PCR方法選擇VP1基因上不同區域為模板設計特異性引物,不存在交叉反應,擴增條帶分別為234、326 bp和467 bp,條帶特異清晰,通過一次PCR反應就能達到較好的血清型分型效果。
通過對不同稀釋度的3種血清型樣品cDNA混合物進行檢測,驗證得到本方法的最低檢測限度達到100 拷貝/μL,敏感性較高,可從較大程度上減少漏檢的可能,并能夠更好地檢出隱性感染病原體。本試驗建立的方法與臨床上常與FMDV混合感染或臨床癥狀難以區分的病原核酸無任何交叉反應,說明本方法具有較好的特異性,能夠準確地應用于FMDV的臨床檢測,對FMD綜合防控具有重要的意義。

