介孔有機硅為載體的納米遞送系統制備及其體外化療-光熱聯合治療性能研究
曾雨淋, 陳佳杰, 田正芳, 朱敏, 朱鈺方,3
介孔有機硅為載體的納米遞送系統制備及其體外化療-光熱聯合治療性能研究
曾雨淋1,2, 陳佳杰1,3, 田正芳2, 朱敏1, 朱鈺方2,3
(1. 上海理工大學 材料科學與工程學院, 上海 200093; 2. 黃岡師范學院 化學化工學院, 催化材料制備及應用湖北省重點實驗室, 黃岡 438000; 3. 中國科學院 上海硅酸鹽研究所, 上海 200050)
有機/無機雜化的介孔有機硅納米顆粒因其高的比表面積、豐富的介孔孔道、功能性的骨架以及高的藥物裝載量等特點而在生物醫學領域受到廣泛關注。本研究提出以二硫鍵橋接的有機/無機雜化介孔有機硅納米顆粒為載體共裝載化療藥物和光熱劑, 設計制備以DNA分子作為控釋“開關”修飾介孔有機硅納米顆粒的納米遞送系統(ICG/DOX-MONs @DNA20)。該納米遞送系統結合了光熱劑的光熱效應以及DNA分子隨溫度升高而從顆粒表面脫附的特性, 可實現近紅外光照射激發藥物在腫瘤細胞中的控制釋放, 同時獲得藥物化療–光熱聯合治療腫瘤的效果。實驗結果表明, 納米遞送系統在近紅外光照下能迅速升溫至43 ℃以上的熱療溫度, 而且在37 ℃條件下6 h內僅緩慢釋放藥物12.3%, 而當溫度升至43 ℃時則快速釋放藥物52.4%; 細胞實驗顯示該納米遞送系統能夠被HeLa腫瘤細胞吞噬, 在近紅外光照下有明顯的藥物化療-光熱聯合治療效果。因此, ICG/DOX-MONs@DNA20納米遞送系統在藥物化療-光熱聯合治療腫瘤方面具有應用前景。
介孔有機硅; 納米載體; 控制釋放; 聯合治療
惡性腫瘤已成為當今世界威脅人類健康的主要疾病之一。藥物化療是臨床上腫瘤治療的主要方法, 但是高毒性的化療藥物往往對機體造成嚴重的毒副作用, 且腫瘤細胞容易產生耐藥性而降低治療效 果[1-4]。因此, 除藥物化療外, 人們不斷探尋新型的腫瘤治療方式, 以提高腫瘤臨床治療效果。其中, 光熱治療通過近紅外光輻照在腫瘤部位聚集的光熱劑而產生熱量, 使得局部溫度快速上升而導致腫瘤細胞消融, 具有外源性控制、無創、低副作用等優勢[5], 是實現腫瘤精準治療的有效策略之一。源于腫瘤的復雜性和多樣性以及以提高腫瘤治療效果為目的, 目前腫瘤治療研究已經從單一療法逐步向聯合療法發展[6-13]。已經有研究表明, 藥物化療與光熱治療的聯合治療模式, 不僅可以發揮各自治療方式的治療效果, 而且光熱治療引起的局部溫度升高可以提高腫瘤細胞對化療藥物的敏感性而增強藥物化療的治療效果。因此, 藥物化療與光熱治療的聯合治療模式顯示出顯著的超加性(即“1+1>2”)效應[14], 其協同治療效果明顯高于單一療法。
研究表明, 納米材料能夠通過腫瘤的高通透性和滯留效應(Enhanced permeability and retention effect, EPR)在腫瘤部位富集。基于納米顆粒載體的腫瘤治療方式, 將化療藥物和光熱劑通過有效手段裝載于納米顆粒載體, 能夠防止藥物和光熱劑在血液循環或健康組織中的提前釋放, 成為改善治療效果和降低毒副作用的途徑之一[3,15]。近幾十年來, 有機膠束、脂質體、生物降解高分子、水凝膠、無機納米粒子等各種納米材料作為載體遞送藥物等診療劑, 其中有機納米載體化學性質不穩定, 容易造成藥物等診療劑的崩解釋放, 無機納米顆粒則面臨生物降解性差等問題[16-18]。已有研究表明, 有機/無機雜化納米顆粒兼具有機納米材料和無機納米顆粒的優點, 能有效改善溶血[19]、增強生物降解性[20-21]以及降低細胞毒性等, 因此在納米遞送系統領域具有良好的應用前景[22]。已有研究將有機/無機雜化的介孔有機硅納米顆粒用于藥物遞送、成像引導的藥物化療等[6,23], 但以介孔有機硅納米顆粒構建納米遞送系統用于藥物化療-光熱聯合治療腫瘤的研究還未見報道。
本研究提出以二硫鍵橋接的有機/無機雜化介孔有機硅納米顆粒(Mesoporous organosilica nanoparticles, MONs)為載體共裝載化療藥物(阿霉素DOX)和光熱劑(吲哚菁綠ICG), 設計以DNA分子作為控釋“開關”修飾介孔有機硅納米顆粒的納米遞送系統。該納米遞送系統結合了ICG的光熱效應以及DNA分子隨溫度升高而從MONs表面脫附的特性來激發DOX和ICG在腫瘤細胞中的控制釋放, 同時獲得藥物化療-光熱聯合治療腫瘤的效果。
1 實驗方法
1.1 藥品及試劑
正硅酸四乙酯(TEOS, AR)、十六烷基三甲基氯化銨(CTAC, AR)、三乙醇胺(TEA, AR)、雙-[γ-(三乙氧基硅)丙基]-二硫化物(BTDS)、無水甲醇(AR)、無水乙醇(≥99.7%)、無水甲苯(AR)、3-氨基三乙氧基硅烷(APTES, 98%)、濃鹽酸(HCl, 36%~38%)、鹽酸阿霉素(DOX, 98%)、吲哚菁綠(ICG)、-羥基琥珀酰亞胺(NHS)、嗎啉乙磺酸(MES)和1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC)均購于國藥集團化學試劑有限公司。DMEM培養基、胎牛血清(FBS)、青鏈霉素混合液、谷胱甘肽(GSH, ≥95%)和胰酶購買于上海潤成生物有限公司。Cell Counting Kit-8 (CCK-8試劑盒)購自上海碧云天生物技術有限公司。磷酸鹽藥片、DNA購自生工生物工程(上海)有限公司, DNA序列為5’-COOH-(CH2)6-ACT CCT GGT ATG TAG CGC TA.
1.2 介孔有機硅納米顆粒的合成及氨基修飾
二硫鍵橋接的MONs制備參照文獻報道的方法[21,25]: 2 g CTAC和1 mL TEA的水溶液(10wt%)加入20 mL去離子水, 置于80 ℃油浴中加熱攪拌至其完全溶解; 接著滴加1 mL TEOS和0.2 mL BTDS的均勻混合液, 繼續反應4 h后將白色沉淀進行高速離心和乙醇洗滌數次, 得到含有結構導向劑的MONs。結構導向劑去除采用鹽酸乙醇溶液萃取法, 即將含有結構導向劑的MONs超聲分散于300 mL鹽酸乙醇溶液(HCl:EtOH= 1: 10)中, 于80 ℃條件下油浴回流12 h, 離心分離并收集沉淀, 此萃取過程重復3次后用乙醇洗滌顆粒, 于80 ℃真空干燥后得到MONs。MONs的氨基修飾過程如下: 將100 mg MONs超聲分散于40 mL無水甲苯中, 并在100 ℃油浴中處理2 h以除盡體系中的水分; 然后向上述懸浮液中加入1.5 mL APTES, 在100 ℃條件下回流20 h后高速離心分離, 最后將離心產物用甲苯和乙醇洗滌3次后于60 ℃下真空干燥, 即得到氨基修飾的MONs (MONs-NH2)。
1.3 藥物/光熱劑裝載及包封
本研究以MONs-NH2為載體, 選用DOX為模型藥物、ICG為光熱劑、羧基修飾的鏈長為20堿基的DNA(DNA20)為控釋“開關”構建納米遞送系統。將ICG和DOX分別配制成0.5和1 mg/mL的甲醇溶液, 各取10 mL溶液混合后加入20 mg MONs-NH2,然后于室溫條件下避光攪拌24 h。最后離心分離–甲醇洗滌–離心分離后得到ICG和DOX共裝載的MONs(ICG/DOX-MONs)。
DNA20包封過程如下[25-26]: 將DNA20配制成濃度為100 μmol/L的水溶液, 并于–20 ℃保存備用。取50 μL DNA20溶液, 加入50 μL EDC溶液(20 mg/mL)振蕩2 min后, 再加入30 μL NHS溶液(20 mg/mL), 繼續振蕩20 min以活化DNA20的5’端羧基; 然后, 將活化的DNA20溶液加入到2 mL ICG/DOX-MONs的MES(10 mmol/L, pH 6.0)懸浮液中, 室溫避光搖晃24 h后得到DNA20包封的ICG/DOX-MONs (ICG/DOX-MONs@DNA20)。最后, 離心分離并用PBS緩沖液洗滌三次后分散于PBS緩沖液中備用。
1.4 結構與理化性能表征
采用Tecnai G2 F30型場發射電子透射顯微鏡和FEI Quanta 450型場發射電子顯微鏡觀察顆粒的形貌和微觀結構。采用Tristar 3020型比表面積和孔徑分析儀測定樣品的比表面積和孔徑分布。采用Nanodrop 2000C型超微量紫外–可見光分光光度計測定藥物/光熱劑的裝載與釋放。采用808 nm近紅外激光發生器和FLIR AX5 series型紅外成像儀測定樣品的光熱性能。紅外圖譜采用KBr壓片法, 在LAM750型紅外光譜儀上測定。采用Epoch型酶標儀測定細胞存活率。采用Olympus IX73P1F型倒置熒光顯微鏡觀察細胞吞噬情況。采用馬爾文Nano-ZS90納米粒徑和電位分析儀測定動態光散射(DLS)顆粒粒徑分布和顆粒表面Zeta電位。
1.5 光熱性能測試
分別配制濃度為0、20、50、100、200、300 μg/mL的顆粒懸浮液, 取1 mL置于48孔板中。用808 nm光源進行照射, 功率密度為0.75 W/cm2, 光照時間為6 min, 使用熱成像記錄儀記錄樣品溫度, 繪制樣品溫度隨時間的變化曲線。另一方面, 對100 μg/mL顆粒懸浮液改變功率密度0.5、0.75、1、2 W/cm2, 光照6 min, 記錄樣品的升溫曲線。
1.6 藥物/光熱劑釋放性能研究
不同溫度下的藥物釋放: 將ICG/DOX- MONs@DNA20顆粒分散于PBS溶液中得到1 mg/mL的顆粒懸浮液, 取5 mL分別在37和43 ℃的水浴中振蕩, 每隔1 h取出15 μL液體同時補充15 μL新鮮緩沖液。使用Nanodrop 2000C測定其在480 nm (DOX)和780 nm (ICG)處的吸光度, 各測試3次, 繪制藥物釋放率隨時間變化的曲線。另外, 采用相同的方法還測定了在37和43 ℃的交替溫度情況下的DOX和ICG釋放率。
1.7 體外細胞毒性評估
本研究以小鼠的子宮頸癌細胞(HeLa)為細胞模型, 培養基為DMEM, 培養基中加入10%(/)胎牛血清(FBS)、100 U/mL青霉素和100 mg/mL鏈霉素; 細胞培養在37 ℃、5% CO2氣氛的CO2培養箱中。采用標準的CCK-8方法分析MONs的體外細胞毒性。將細胞均勻地播種在96孔板中, 細胞密度為4000個/孔, 培養24 h待細胞貼壁后去除培養基, 然后每孔加入100 μL MONs的DMEM溶液(濃度分別為0、12.5、25、50、100、200 μg/mL); 孵育24 h后, 吸取上層液體, 每孔加入100 μL PBS洗滌, 除去死細胞、細胞代謝物以及加入的顆粒; 接著每孔加入100 μL CCK-8溶液, 共孵育3 h后, 吸取上層液體用于酶標儀測定其450 nm處的吸光度。另一方面, 細胞與MONs共培養24 h后用PBS洗滌, 除去死細胞、細胞代謝物以及加入的顆粒后, 每孔再加入100 μL新鮮DMEM培養液繼續培養24 h, 然后每孔加入100 μL CCK-8溶液, 共孵育3 h后, 吸取上層液體用于酶標儀測定其450 nm處的吸光度。將MONs溶液共培養組的活細胞數與空白對照組的活細胞數之間的比值作為細胞毒性分析的依據。
1.8 細胞吞噬
將HeLa細胞均勻播種在24孔板中, 細胞密度為5000個/孔, 待細胞貼壁后, 吸取培養基, 然后每孔加入500 μL的顆粒DMEM溶液(50 μg/mL), 空白組(不加顆粒)加入等體積的培養液; 與細胞共培養3 h后, 吸取上層液體, 接著用PBS洗滌2次以去除未被吞噬的顆粒; 每孔加入500 μL的多聚甲醛溶液(wt%)固定細胞15 min, 用DAPI將細胞核染色5 min; 最后, 細胞用PBS洗滌3次后用倒置熒光顯微鏡觀察顆粒在細胞內的分布情況。
1.9 聯合治療
采用ICG/DOX-MONs顆粒為比較組研究ICG/DOX-MONs@DNA20的化療–光熱聯合治療效果: 配制濃度為100 μg/mL的 ICG/DOX-MONs和ICG/DOX-MONs@DNA20的DMEM溶液待用。將HeLa細胞均勻播種于96孔板中, 細胞密度為8000個/孔, 待細胞貼壁后吸取培養液, 加入100 μL顆粒懸浮液, 每種材料各加15個孔, 設為不光照、一次光照、兩次光照三個組, 每組5個平行樣, 空白組作為對照; 培養5 h后使用近紅外光照射, 功率密度為2 W/cm2, 照射時間為3 min/孔; 照射后的細胞繼續培養3 h后, 兩次光照組重復上述光照操作, 光照后繼續培養3 h。然后采用與上述顆粒細胞毒性測試相同的CCK-8方法測定細胞活性。
2 結果與討論
2.1 MONs的微觀形貌及結構
MONs顆粒的形貌如圖1(a, b)所示。MONs 顆粒為球形, 顆粒尺寸均勻, 粒徑約45 nm; DLS測試顆粒粒徑尺寸比SEM和TEM觀察粒徑略大(圖1(c)), 這是因為DLS測試得到的是顆粒的水合粒徑, 同時也與部分顆粒輕微團聚有關。放大的TEM照片中能清晰看到均勻的介孔孔道分布。圖1(d)的N2吸附脫附等溫線及相應的孔徑分布圖也表明MONs具有介孔結構, 其比表面積為444.5 m2/g, 平均孔徑約為4.5 nm。因此, MONs可作為納米載體裝載藥物、光熱劑等客體分子。
2.2 納米遞送系統制備及其理化性能
本研究的ICG/DOX-MONs@DNA20納米遞送系統制備包括MONs表面氨基修飾、ICG/DOX裝載和DNA20包封。圖2(a, b)為ICG/DOX-MONs @DNA20納米遞送系統制備過程各階段顆粒表面Zeta電位變化和紅外光譜圖。由圖可以看出, MONs的氨基修飾使顆粒表面Zeta電位由–16.9 mV變為+24.2 mV, 且紅外圖譜在1472 cm–1處出現氨基的彎曲振動峰, 表明氨基成功修飾在MONs表面[27-28]。
由于ICG和DNA分子為負電荷, ICG/DOX的裝載和DNA20包封使得顆粒表面Zeta電位逐步降低。在ICG/DOX-MONs@DNA20顆粒的紅外圖譜上出現酰胺鍵中—C==O—的特征振動峰(1640 cm–1)[29],這是由于DNA20包封ICG/DOX-MONs顆粒是通過DNA20的5’端羧基和ICG/DOX-MONs顆粒表面氨基之間的酰胺化反應實現的, 也證明DNA20的成功包封。另一方面, ICG/DOX-MONs@DNA20納米遞送系統制備過程各階段顆粒的紫外–可見光光譜中的特征吸收峰的變化也進一步表明ICG/DOX的裝載和DNA包封的成功實現。同時, 利用紫外–可見光光譜分析計算, 得到DOX和ICG的裝載量分別為27.2和69.9 μg/mg, 負載率分別為8.2%和21.0%。
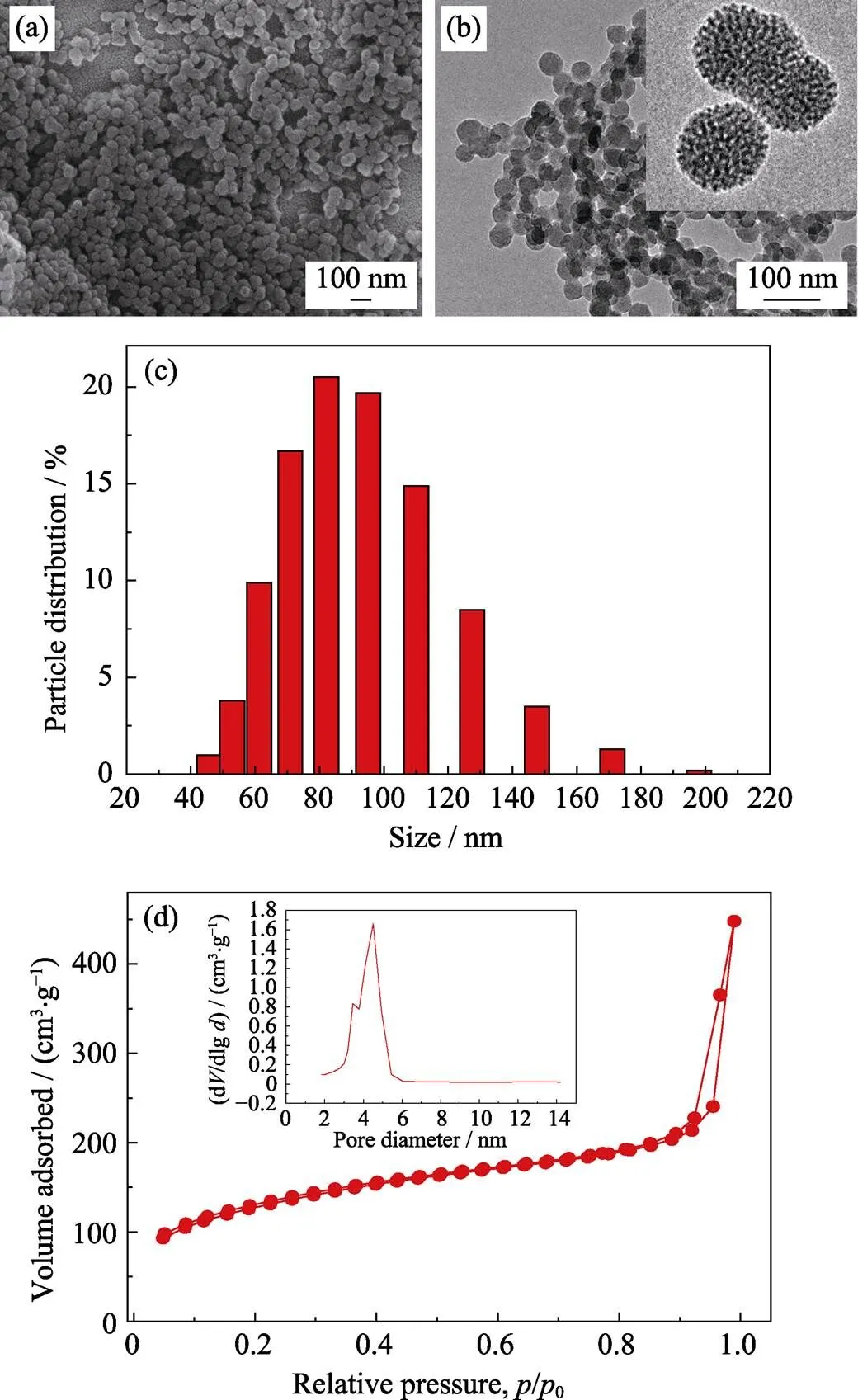
圖1 MONs的形貌、結構表征
(a) SEM image of MONs; (b) TEM images of MONs; (c) DLS particle size distribution of MONs; (d) N2adsorption-desorption isotherm and the corresponding pore size distribution of MONs
2.3 納米遞送系統的光熱性能
因ICG為FDA批準臨床使用的醫療診斷菁染料, 具有光熱效應。本研究將ICG裝載于納米遞送系統, 賦予了納米遞送系統光熱性能。圖3為ICG/DOX-MONs@DNA20顆粒的光熱升溫曲線。
由圖可見, 在光功率密度為0.75 W/cm2的近紅外光照射下, 不同濃度的顆粒懸浮液溫度隨濃度增加而升高; 當顆粒懸浮液濃度為200 μg/mL時, 近紅外光照射6 min可使懸浮液溫度從26 ℃升至50℃(圖3(a))。另一方面, 在顆粒懸浮液濃度一定的情況下, 懸浮液溫度隨光功率密度增加而升高(圖3(b)), 即調節近紅外光的光功率密度可以控制納米遞送系統的升溫情況。因此, ICG的光熱效應沒有因MONs的裝載而失效, ICG/DOX-MONs@DNA20納米遞送系統的光熱效應能滿足光熱治療要求。另一方面, 熱效應能夠破壞DNA20與顆粒表面的作用力, 使得DNA20從顆粒表面脫附而打開顆粒的介孔孔道, 實現DOX和ICG的可控釋放[24]。
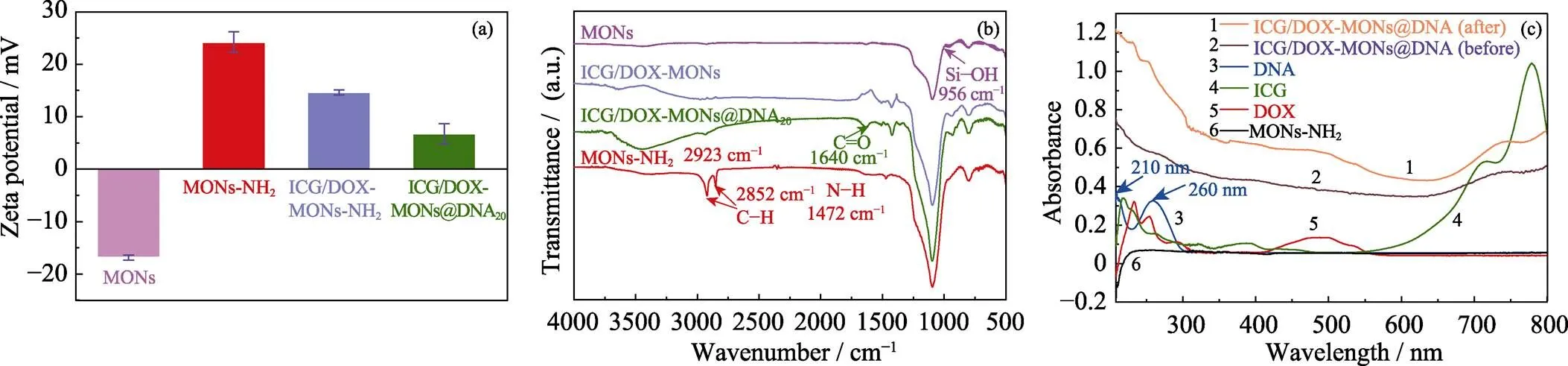
圖2 MONs、MONs-NH2、ICG/DOX-MONs和ICG/DOX-MONs@DNA20納米顆粒的(a)Zeta表面電位變化, (b)FT-IR譜圖, 及(c)UV-Vis光譜圖
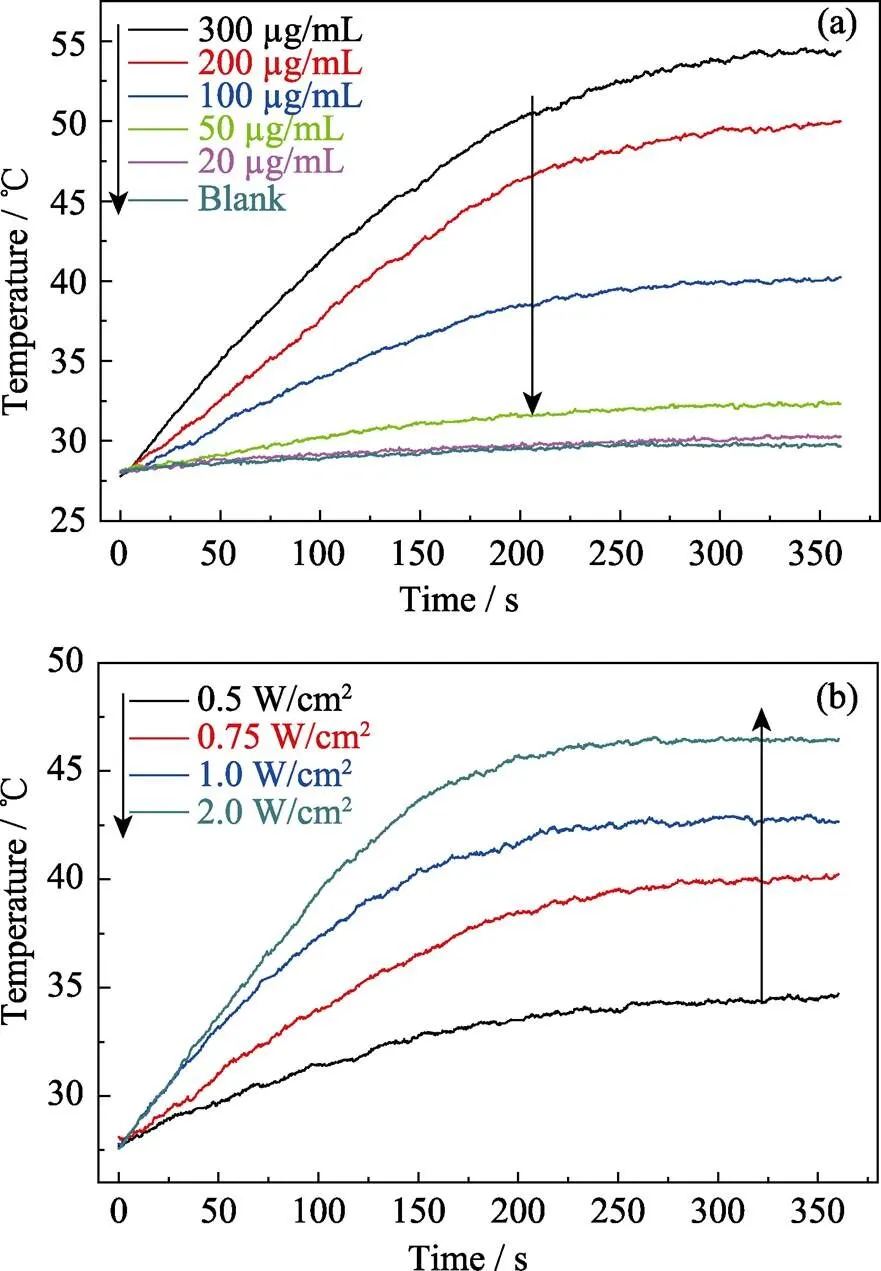
圖3 (a)不同濃度ICG/DOX-MONs@DNA20懸浮液在0.75 W/cm2的近紅外光照射下的光熱升溫曲線與(b) 100 μg/mL的ICG/DOX-MONs@DNA20懸浮液在不同功率密度的近紅外光照射下的光熱升溫曲線
2.4 納米遞送系統的藥物釋放性能
圖4(a,b)為ICG/DOX-MONs@DNA20納米遞送系統在37和43 ℃緩沖液中DOX和ICG的釋放曲線。由圖可見, 在37和43 ℃的緩沖液中釋放6 h, DOX的釋放量分別為12.3%和52.4%, ICG的釋放量分別為26.4%和71.1%, 表明該納米遞送系統具有明顯的溫度控制釋放性能, 即在43 ℃下可快速釋放DOX和ICG, 而在37 ℃下只能非常緩慢地釋放DOX和ICG。一方面, 這樣的溫度控制釋放可一定程度上防止藥物提前釋放; 另一方面43 ℃也達到了熱療溫度范圍, 納米遞送系統的光熱效應滿足周圍溫度達到43 ℃, 因而可實現光熱誘導藥物控制釋放。
因DNA20的5’端羧基與顆粒表面氨基以酰胺鍵結合, 而其余部分則通過靜電作用吸附于顆粒表面, 因此小范圍的溫度變化可破壞較弱的靜電作用, 而不影響酰胺鍵結合[24]。所以通過小范圍的溫度變化有可能控制DNA20與顆粒表面的靜電作用強弱, 從而實現DNA20包封介孔孔道的“開啟”和“關閉”狀態。圖4(c)為ICG/DOX-MONs@ DNA納米遞送系統在37~43 ℃交替溫度條件下的DOX和ICG釋放曲線。由圖可見, 當溫度從37 ℃升高到43 ℃并保持1 h, DOX和ICG都出現快速釋放; 當溫度從43 ℃降至37 ℃并保持10 h, DOX和ICG的釋放則非常緩慢。重復升溫和降溫的條件, DOX和ICG的釋放情況呈現相似的趨勢。因此, ICG/DOX-MONs@ DNA20納米遞送系統可通過溫度變化實現可逆的孔道“開啟”和“關閉”狀態, 更好地控制DOX和ICG的釋放。
2.5 材料的細胞毒性及細胞吞噬
圖5為MONs與HeLa細胞共培養24和48 h后的細胞毒性。由圖可以看出, MONs與細胞共培養24 h后, HeLa細胞活性未受MONs影響, 即使顆粒濃度高達200 μg/mL, 細胞存活率仍高達98.4%。為了觀察MONs在被細胞吞噬后對細胞的毒性影響, 對與MONs共培養24 h后的細胞去除未被吞噬的顆粒, 繼續培養24 h后測定細胞存活率。結果顯示, MONs被細胞吞噬后繼續培養24 h, HeLa細胞的存活率與共培養24 h后的細胞存活率都沒有顯著性差異, 表明細胞在一定的顆粒濃度下吞噬MONs后不會對其細胞活性產生影響。因此, MONs具有較低的細胞毒性。
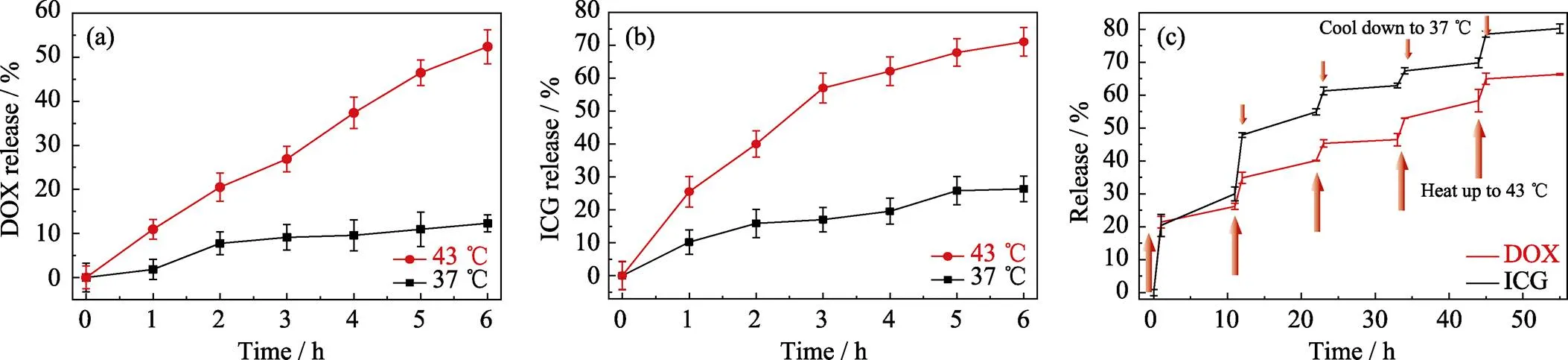
圖4 ICG/DOX-MONs@DNA20在37和43 ℃條件下的(a) DOX和(b) ICG的釋放曲線, 以及(c) ICG/DOX-MONs@DNA20在37和43 ℃交替變溫條件下的DOX和ICG的釋放曲線
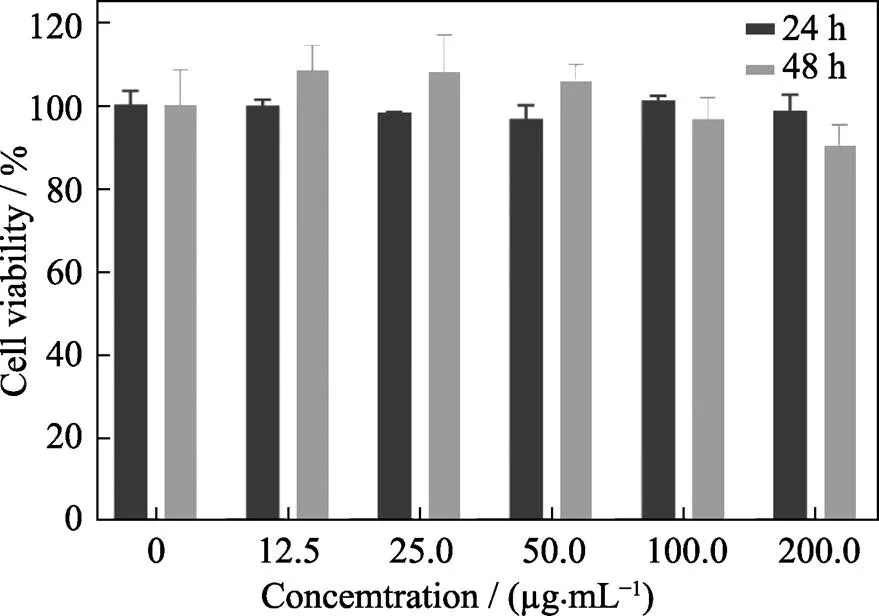
圖5 MONs對HeLa細胞與不同濃度MONs共培養24和48 h后的細胞活性情況
腫瘤細胞吞噬納米遞送系統會對后續治療效果產生重要影響。本研究采用倒置熒光顯微鏡觀察了HeLa細胞吞噬顆粒的結果。如圖6所示, 在激發光照射下的細胞核因被DAPI染色而發出藍色熒光; 因DOX在激發光照射下發紅色熒光, 對于ICG/DOX-MONs和ICG/DOX-MONs@DNA20顆粒, 可觀察到紅色熒光緊密圍繞著細胞核, 表明HeLa細胞能夠吞噬ICG/DOX-MONs和ICG/DOX-MONs @DNA20顆粒, 因而使DOX和ICG的腫瘤細胞內遞送成為可能, 從而提高遞送效率和腫瘤治療效果。
2.6 藥物化療–光熱聯合治療
為了進一步評估ICG/DOX-MONs@DNA20納米遞送系統的近紅外光照激發藥物釋放的藥物化療聯合光熱治療的效果, 以空白組和ICG/DOX-MONs組為對照組, 分別測定納米遞送系統與HeLa細胞共培養后在不光照、一次光照和兩次光照條件下HeLa細胞的存活率。
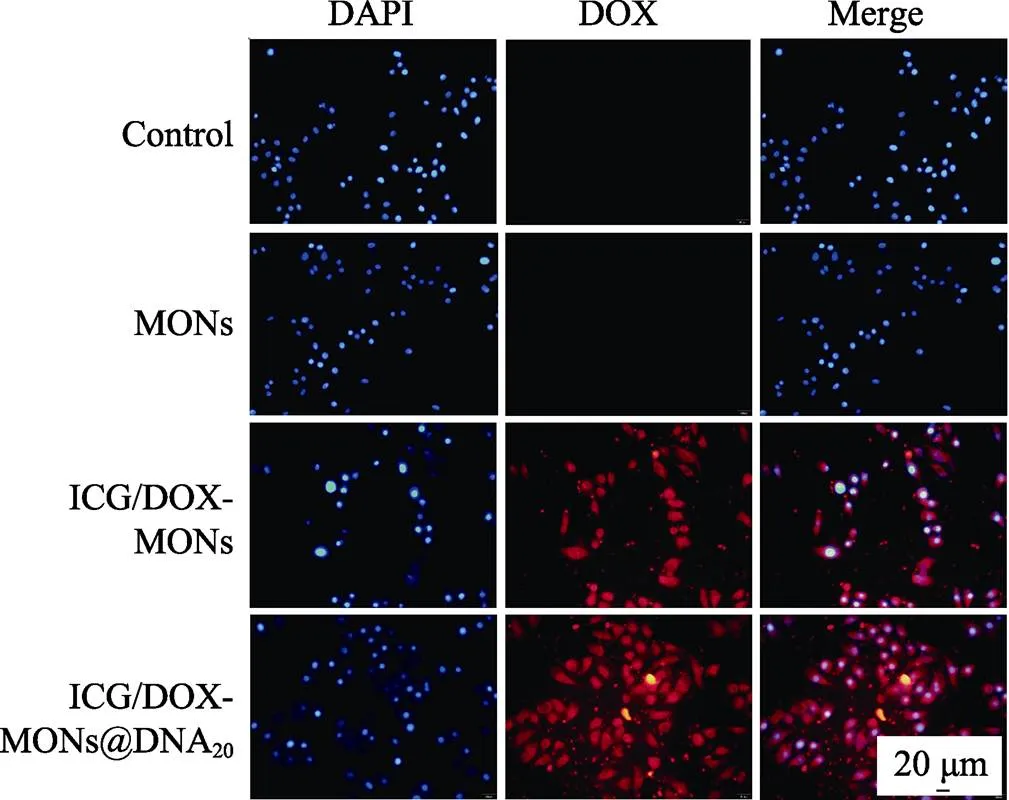
圖6 HeLa細胞與不同顆粒共培養3 h后的細胞吞噬不同顆粒結果(藍色: 細胞核; 紅色: DOX)
如圖7所示, 在無近紅外光照條件下, ICG/DOX-MONs@DNA20組無細胞毒性, 表明納米遞送系統的DNA包封可有效防止DOX大量泄漏; ICG/DOX-MONs組則產生明顯的細胞毒性, 這是由于DOX從顆粒中緩釋而引起細胞死亡。經過一次近紅外光照后, ICG/DOX-MONs組的細胞活性下降了25.1%, 而ICG/DOX-MONs@DNA20組的細胞活性則由94.0%下降至37.4%, 這是由于DNA20包封組在近紅外光照后升高溫度而釋放孔道中的DOX, 從而獲得藥物化療–光熱聯合治療效果; 而ICG/DOX-MONs顆粒由于提前釋放DOX, 近紅外光照只產生光熱治療效果。經過兩次近紅外光照后, ICG/DOX-MONs組的細胞活性基本不再下降, 這是由于ICG的光熱不穩定性而造成光熱治療失效; ICG/DOX-MONs@DNA20組的細胞活性仍下降了約17%, 這是由于第二次近紅外光照將繼續釋放DOX, 而且ICG因MONs保護而仍然具有光熱效應, 因而繼續發揮藥物化療–光熱聯合治療效果。以上結果表明ICG/DOX-MONs@DNA20納米遞送系統能夠將藥物和光熱劑高效遞送到腫瘤細胞, 在近紅外光照射下獲得藥物化療–光熱聯合治療效果。
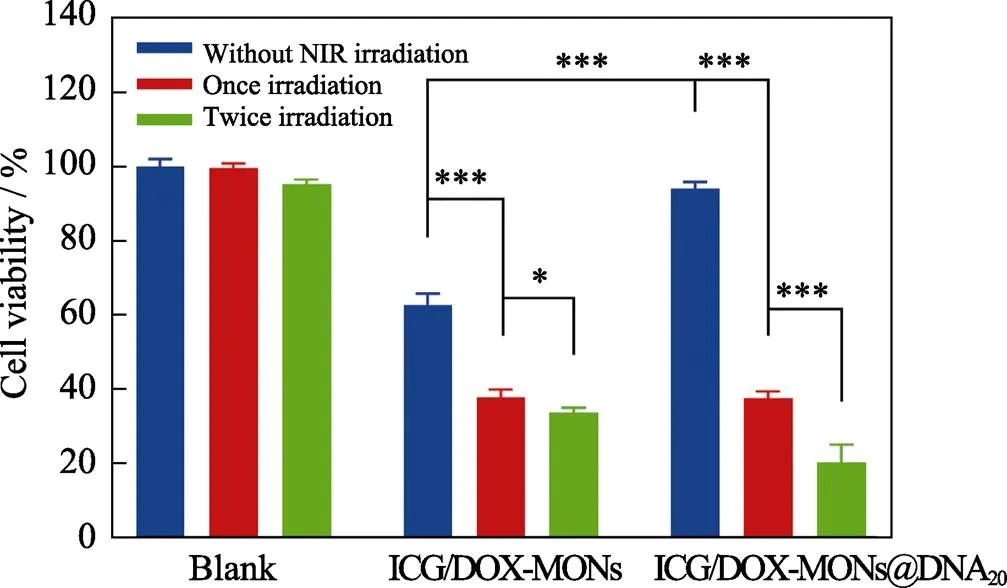
圖7 HeLa細胞與ICG/DOX-MONs和ICG/DOX-MONs@ DNA20共培養后在有或無近紅外光照下的細胞存活率
3 結論
本研究設計制備了以二硫鍵橋接的有機/無機雜化MONs為載體共裝載化療藥物DOX和光熱劑ICG, 并以DNA分子包封MONs表面的ICG/DOX- MONs@DNA20納米遞送系統。在近紅外光照射下, ICG/DOX-MONs@DNA20納米顆粒具有光熱效應, 能夠產生熱量使顆粒周圍溫度達到光熱治療的溫度要求。另一方面, ICG/DOX-MONs @DNA20納米顆粒在37 ℃條件下僅緩慢釋放DOX和ICG, 而當溫度升至43 ℃時表現出DOX和ICG的快速釋放, 因而具有光熱誘導藥物控制釋放性能。細胞實驗結果表明ICG/DOX-MONs@DNA20納米遞送系統能夠被腫瘤細胞吞噬, 并且在近紅外光照下顯示出明顯的藥物化療–光熱聯合治療效果。因此, ICG/DOX- MONs@DNA20納米遞送系統在藥物化療–光熱聯合治療腫瘤方面具有應用前景。
[1] WEN JIA,YANG KUI, LIU FENG-YU,. Diverse gatekeepers for mesoporous silica nanoparticle based drug delivery systems., 2017, 46(19): 6024–6045.
[2] ZHANG YA-RU, LIN RUN, LI HONG-JUN,. Strategies to improve tumor penetration of nano-medicines through nanoparticle design., 2019, 11(1): e1519–1–12.
[3] QIAO YI-TIAN, WAN JIAN-QIN, ZHOU LI-QIAN,. Stimuli- responsive nanotherapeutics for precision drug delivery and cancer therapy., 2019, 11(1): e1527–1–20.
[4] OVERCHUK MARTA, ZHENG GANG. Overcoming obstacles in the tumor microenvironment: recent advancements in nanoparticle delivery for cancer theranostics., 2018, 156: 217–237.
[5] VANKAYALARAVIRAJ,HWANG KUO-CHU. Near-infrared-light- activatablenanomaterial mediated phototheranostic nanomedicines: an emerging paradigm for cancer treatment., 2018, 30(23): 1706320–1–7.
[6] HAYASHIKOICHIRO,MARUHASHITAKUMA. One-pot synthesis of dual stimulus-responsive degradable hollow hybrid nanoparticles for imageguided trimodal therapy., 2016, 26(47): 8613–8622.
[7] WANG ZHENG, ZHANG FAN, SHAO DAN,. Janus nanobullets combine photodynamic therapy and magnetic hyperthermia to potentiate synergetic anti-metastatic immunotherapy., 2019, 6(22): 1901690–1–10.
[8] FAN WEN-PEI, LU NAN, HUANG PING. Glucose-responsive sequential generation of hydrogen peroxide and nitric oxide for synergistic cancer starving-like/gas therapy., 2017, 56(5): 1229–1233.
[9] FAN WEN-PEI, LU NAN, SHEN ZHE-YU. Generic synthesis of small-sized hollow mesoporous organo-silica nanoparticles for oxygen-independent X-ray-activated synergistic therapy., 2019, 10(1): 1–14.
[10] WU JIAN-RONG, BREMNER DAVID H, NIU SHI-WEI,. Chemodrug-gated biodegradable hollow mesoporous organosilica nanotheranostics for multi-modal imaging-guided low-temperature photo-thermal therapy/chemotherapy of cancer., 2018, 10(49): 42115–42126.
[11] LI ZHEN-LI, HAN JUN, YU LUO-DAN,. Synergistic sonodynamic/chemotherapeutic suppression of hepatocellular carcinoma by targeted biodegradable mesoporous nanosonosensitizers., 2018, 28(26): 1800 145–1–16.
[12] LI LING, YANG ZHEN, FAN WEN-PEI,.polymerized hollow mesoporous organosilica bio-catalysis nanoreactor for enhancing ROS-mediated anticancer therapy., 2020, 30(4):1907716–1–11.
[13] CHEN JIA-JIE, LIU JIA-XING, HU YA-PING,. Metal-organic framework-coated magnetite nano-particles for synergistic magnetic hyperthermia and chemotherapy with pH-triggered drug release., 2019, 20(1): 1043–1054.
[14] FAN WEN-PEI, YUNG BRYANT, HUANG PING. Nanotechnology for multimodal synergistic cancer therapy., 2017, 117(22): 13566–13638.
[15] PRASAD MINAKSHI, LAMBE UPENDRA P,. Nanotherapeutics: an insight into healthcare and multi-dimensional applications in medical sector of the modern world., 2018, 97: 1521–1537.
[16] KOTARO MATSUMOTO, TAN LE HOANG DOAN, NGOC XUAN DAT MAI,Anticancer drug delivery capability of biodegradable PMO in the chicken egg tumor model., 2018, 44: 103–116.
[17] AGRAWAL GARIMA, AGRAWAL RAHUL. Janus nanoparticles: recent advances in their interfacial and biomedical applications., 2019, 2(4): 1738–1757.
[18] MA BAO-YUAN, TIAN ZHENG-FANG, ZHU YU- FANG. Biodegradable silicon-based mesoporous nanoparticles for nanomedicine., 2018, 10(6): e159.
[19] TANG WEI, FAN WEN-PEI, WANG ZHAN-TONG. Acidity/ reducibility dual-responsive hollow mesoporous organosilica nanoplatforms for tumor-specific self-assembly and synergistic therapy., 2018, 12(12): 12269–12283.
[20] HUANG PING, CHEN YU, HAN LIN,Molecularly organic/ inorganic hybrid hollow mesop-orous organosilica nanocapsules with tumor-specific biodegradability and enhanced chemotherapeutic functionality., 2017, 125: 23–37.
[21] YU LUO-DAN, CHEN YU, LIN HAN,Ultra-small mesoporous organosilica nanoparticles: morphology modulations and redox-responsive bio-degradability for tumor-specific drug delivery., 2018, 161: 292–305.
[22] JONAS G CROISSANT, YEVHEN FATIEIEV, ABDULAZIZ ALMALIK,Mesoporous silica and organosilica nanoparticles: physical chemistry, biosafety, delivery strategies, and biomedical applications., 2018, 7(4): 1700831–1–75.
[23] FENTON OWEN S, OLAFSON KATY N, PILLAI PADMINI S,Advances in biomaterials for drug delivery., 2018, 30(29): 1705328–1–29.
[24] XU YI, ZHU YU-FANG, KASKEL STEFAN. A smart magnetic nanosystem with controllable drug release and hyperthermia for potential cancer therapy., 2015, 5(121): 99875–99883.
[25] HUANG PING, QIAN XIAO-QIN, CHEN YU,Metalloporphyrin-encapsulated biodegradable nano-systems for highly efficient magnetic resonance imaging-guided sonodynamic cancer therapy., 2017, 139(3): 1275–1284.
[26] TAO CUI-LIAN, ZHU YU-FANG, XU YI, ZHU MIN,. Mesoporous silica nanoparticles for enhancing the delivery efficiency of immuno-stimulatory DNA drugs., 2014, 43(13): 5142–1–50.
[27] LAI XIN, SUN DAN, HOU YI,Amino- functionalized multilayer core-shell mesoporous organo-silica nanospheres for Cr(VI) removal., 2018, 5(18),180 0630–1–11.
[28] HU LIN-LIN, MENG JIE, ZHANG DAN-DAN,Functionalization of mesoporous organosilica nano-carrier for pH/glutathione dual-responsive drug delivery and imaging of cancer therapy process., 2018, 177: 203–211.
[29] DOUSTKHAH ESMAIL, MOHTASHAM HAMED, FARAJZADEH MUSTAFA,. Organosiloxane tunability in mesoporous organosilica and punctuated Pd nanoparticles growth; theory and experiment., 2020, 293: 109832–1–8.
Preparation of Mesoporous Organosilica-based Nanosystem forSynergistic Chemo- and Photothermal Therapy
ZENG Yulin1,2, CHEN Jiajie1,3, TIAN Zhengfang2, ZHU Min1, ZHU Yufang2,3
(1. School of Materials Science and Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China; 2. Hubei Key Laboratory of Processing and Application of Catalytic Materials, College of Chemical Engineering, Huanggang Normal University, Huanggang 438000, China; 3. Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, China)
Organic-inorganic hybrid mesoporous organosilica has gained more attention in biomedicine due to its high surface area, mesoporous channels, functional framework, and high drug loading capacity. In this study, disulfide- bridged hybrid mesoporous organosilica nanoparticles (MONs) as nanocarriers were employed to construct a nanosystem (ICG/DOX-MONs@DNA20) for delivering drugs and photothermal agents, in which DNA molecules as “switches” were modified on the surface of MONs to control drug release.The results showed that the ICG/DOX-MONs@DNA20nanosystem could increase the temperature to above 43 ℃ for photothermal therapy with near-infrared (NIR) laser irradiation. On the other hand, the ICG/DOX-MONs@DNA20nanosystem exhibited a very slow release of DOX (12.3% in 6 h) at 37 ℃, but a rapid release of DOX (52.4% in 6 h) occurred at 43 ℃. Cell culture experiments indicated that the nanosystem can be internalized by HeLa cells, and exhibited an enhanced therapeutic efficacy of synergistic chemo- and photothermal therapy. Hence, the ICG/DOX-MONs@DNA20nanosystem might be promising for synergistic chemo- and photo-thermal tumor therapy.
mesoporous organosilica; nanocarriers; controlled release; synergistic therapy
TQ174
A
1000-324X(2020)12-1365-08
10.15541/jim20200091
2020-02-24;
2020-03-10
國家自然科學基金面上項目(51572172); 上海理工大學科技發展項目(2018KJFZ016, 2019KJFZ023)
National Natural Science Foundation of China (51572172); University of Shanghai for Science and Technology (2018KJFZ016, 2019KJFZ023)
曾雨淋(1995–), 女, 碩士研究生. E-mail: 1591422585@qq.com
ZENG Yulin (1995–), female, Master candidate. E-mail: 1591422585@qq.com
朱敏, 副教授. E-mail: mzhu@usst.edu.cn; 朱鈺方, 教授. E-mail: zjf2412@163.com
ZHU Min, associate professor. E-mail: mzhu@usst.edu.cn; ZHU Yufang, professor. E-mail: zjf2412@163.com
- 無機材料學報的其它文章
- An Injectable Composite Bone Cement Based on Mesoporous Borosilicate Bioactive Glass Spheres
- A Layered Uranyl Coordination Polymer with UV Detection Sensitivity, Stability, and Reusability
- 原位聚合三維陶瓷骨架增強全固態鋰電池電解質
- WO3納米花的熱處理晶格調控及WO3/CdS/α-S異質結的構筑
- 共擠出法制備雙層中空纖維陶瓷復合膜
- Stable Zirconium Carbide Fibers Fabricated by Centrifugal Spinning Technique

