不同殺菌劑對小麥赤霉病及籽粒DON毒素的控制效果
陳宏州 吳佳文 莊義慶 楊紅福 吳琴燕 徐超 繆康 姚克兵
摘要 :為探明不同殺菌劑對小麥赤霉病和小麥籽粒DON毒素(包括DON、3-ADON和15-ADON)的控制效果,采用菌絲生長速率法測定了12種藥劑對禾谷鐮刀菌野生型菌株PH-1的室內活性,同時采用液相色譜串聯質譜法(LC-MS)測定了這些藥劑對DON毒素的抑制效果,并開展了小麥赤霉病及籽粒DON毒素的田間防治試驗。結果表明,12種原藥對菌絲生長抑制活性強弱依次為氟唑菌酰羥胺>咪鮮胺>戊唑醇>丙硫菌唑>葉菌唑>氰烯菌酯>氟環唑>多菌靈>甲基硫菌靈>吡唑醚菌酯>嘧菌酯>井岡霉素A。氟環唑EC 50和EC 90離體脅迫均刺激DON毒素產生,其他殺菌劑EC 50和EC 90脅迫均抑制DON毒素產生。田間試驗結果表明,200 g/L氟唑菌酰羥胺SC、30%丙硫菌唑OD和20%葉菌唑WP病指防效和DON防效為87.68%~94.77%;430 g/L戊唑醇SC、25%氰烯菌酯SC、45%咪鮮胺EW、25%氟環唑SC、50%多菌靈WP和70%甲基硫菌靈WP病指防效和DON防效為57.63%%~85.49%;250 g/L吡唑醚菌酯EC和250 g/L嘧菌酯SC病指防效分別為72.18%和51.98%,DON防效分別為43.06%和-7.96%;24%井岡霉素A AS病指防效和DON防效分別為42.37%和62.87%。藥劑離體和田間控毒效果不完全一致,赤霉病有效防控是DON防控的前提,病害防效與DON防效不完全一致,本研究為小麥赤霉病及籽粒DON毒素防控提供了科學依據。
關鍵詞 :小麥赤霉病; 禾谷鐮刀菌; 毒力測定; 脫氧雪腐鐮刀菌烯醇; 防治效果
中圖分類號:
S 435.12.45
文獻標識碼: B
DOI: 10.16688/j.zwbh.2021084
Control efficacy of different fungicides on Fusarium head blight and deoxynivalenol in wheat grain
CHEN Hongzhou1, WU Jiawen2, ZHUANG Yiqing3, YANG Hongfu1, WU Qinyan1,
XU Chao1, MIAO Kang1, YAO Kebing1*
(1.Zhenjiang Institute of Agricultural Sciences in Hilly Area of Jiangsu Province, Jurong 212400, China;
2.Plant Protection and Quarantine Station of Jiangsu Province, Nanjing 210036, China;
3.Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract
In order to investigate the control efficacy of different fungicides on Fusarium head blight (FHB) and deoxynivalenol (DON) (containing DON, 3-acetyl-deoxynivalenol (3-ANON) and 15-acetyl-deoxynivalenol (15-ADON), the same below) in wheat grain, the indoor activity of 12 fungicides to Fusarium graminearum wild-type strain PH-1 was detected by using mycelium growth rate method, the inhibitory effect of these fungicides on DON was detected by using liquid chromatography tandem mass spectrometry (LC-MS) method, and the field control tests on FHB and DON in wheat grain was also conducted.Indoor toxicity tests showed that the inhibiting activity of 12 fungicides TC to mycelium growth were in the following order: pydiflumetofen > prochloraz > tebuconazole > prothioconazole > metconazole > phenamacril > epoxiconazole > carbendazim > thiophanate-methyl > pyraclostrobin > azoxystrobin > validamycin A.Epoxiconazole at the concentration of EC 50 and EC 90stimulated the production of DON in vitro, while other fungicides at the concentration of EC 50 and EC90 inhibited the production of DON.Field trials showed that the FHB disease index (DI) and DON control efficacy of pydiflumetofen 200 g/L SC, prothionazole 30% OD and metconazole 20% WP were 87.68%-94.77%, while those of tebuconazole 430 g/L SC, phenamacril 25% SC, prochloraz 45% EW, epoxiconazole 25% SC, carbendazim 50% WP and thiophanate-methyl 70% WP were 57.63%-85.49%.The DI control efficacy of pyraclostrobin 250 g/L EC and azoxystrobin 250 g/L SC were 72.18% and 51.98%, respectively, and the DON control efficacy were 43.06% and -7.96%, respectively.The DI and DON control efficacy of validamycin A 24% AS were 42.37% and 62.87%, respectively.The DON control efficacy of fungicides in vitro and in field was not completely consistent.Effective FHB control was the premise of DON control.The control efficacy of FHB was not completely consistent with that of DON.The results provides a scientific basis for the control of FHB and DON in wheat grain.
Key words
Fusarium head blight; Fusarium graminearum; toxicity test; deoxynivalenol; control efficacy
主要由禾谷鐮刀菌Fusarium graminearum(有性態:玉蜀黍赤霉Gibberella zeae)和亞洲鐮刀菌F.asiaticum引起的小麥赤霉病(Fusarium head blight, FHB)[12],在世界各地均有發生,不僅會造成小麥減產,而且病菌還會產生多種真菌毒素,如:脫氧雪腐鐮刀菌烯醇(deoxynivalenol, DON)及其乙酰化衍生物(3A-DON和15A-DON)、雪腐鐮刀菌烯醇(nivalenol)、玉米赤霉烯酮(zearalenone)等,帶來食品安全問題[34]。此外,帶菌種子還是赤霉病初侵染源之一[5]。
近年來,由于缺乏有效的抗病品種、氣候條件變化、秸稈還田以及抗多菌靈病原種群的迅速擴展等原因,赤霉病導致我國每年超過500萬hm2(約20%)的小麥嚴重減產[6],并且病害呈北擴西移態勢,常發區已擴展到黃淮南部麥區,西北麥區病害發生也明顯加重[7]。在我國,DON是污染小麥的主要真菌毒素,據報道,2010年安徽和江蘇省小麥籽粒樣品DON檢出率達89.3%,DON含量在259~4 975 μg/kg之間,平均為1 962 μg/kg,約70%的籽粒樣品DON含量超標(高于1 000 μg/kg)[8]。歐洲食品安全局(European Food Safety Authority)調查顯示,2007年-2012年歐盟供人食用的谷物樣品中DON(包括DON、3A-DON和15A-DON)檢出率達43.5%,35.7%的樣品DON含量高于100 μg/kg,DON含量均值為112 μg/kg,其中3A-DON和15A-DON平均占比達20%[9]。美國谷物化學家協會(American Association of Cereal Chemists)報告稱,2003年-2014年美國運至面粉加工廠的小麥樣品中有18.9%的樣品DON含量至少達300~500 μg/kg,30%以上的軟質小麥樣品DON含量超過2 000 μg/kg,2014年樣品DON含量均值為850 μg/kg[10]。DON性質穩定,耐熱、耐壓、耐弱酸、耐儲藏,一般的食品加工不能破壞其結構,加堿或高壓處理才可破壞部分毒素,具有細胞毒性,可引起人畜急慢性中毒,被國際癌癥研究機構(International Agency for Research on Cancer)列為第三類致癌物[11]。依據聯合國糧食及農業組織(Food and Agriculture Organization of the United Nations)規定,人體DON臨時最大每日耐受攝入量為1 μg/(kg·d)。許多國家都制定了毒素限量標準,我國《食品安全國家標準食品中真菌毒素限量》(GB2761-2017)中規定谷物及其制品中DON限量為1 000 μg/kg[12],美國、歐盟和加拿大食品中DON限量指標分別為1 000、500 μg/kg和2 000 μg/kg[13]。鑒于當前赤霉病危害與籽粒毒素污染現狀,急需優化赤霉病防治藥劑,有效防治病害的同時降低毒素污染,確保小麥高產穩產、保障食品質量安全。
為探明不同殺菌劑對小麥赤霉病和籽粒DON毒素(包括DON、3-ADON和15-ADON,下同)的控制效果,筆者采用菌絲生長速率法分別檢測了氟唑菌酰羥胺、咪鮮胺、戊唑醇、丙硫菌唑、葉菌唑、氰烯菌酯、氟環唑、多菌靈、甲基硫菌靈、吡唑醚菌酯、嘧菌酯和井岡霉素A等12種原藥對禾谷鐮刀菌野生型菌株PH-1的室內毒力,采用液相色譜串聯質譜法(LC-MS)分別檢測了12種原藥對PH-1菌株菌絲生長抑制EC 50和EC 90濃度離體脅迫下DON毒素產量,并進行了200 g/L氟唑菌酰羥胺SC、45%咪鮮胺EW、430 g/L戊唑醇SC、30%丙硫菌唑OD、20%葉菌唑WP、25%氰烯菌酯SC、25%氟環唑SC、50%多菌靈WP、70%甲基硫菌靈WP、250 g/L吡唑醚菌酯EC、250 g/L嘧菌酯SC和24%井岡霉素A AS等12種單劑推薦劑量下對小麥赤霉病及籽粒DON毒素的田間防治試驗,以期為小麥赤霉病防治及降低籽粒DON毒素污染提供科學依據。
1 材料與方法
1.1 材料
供試菌株:禾谷鐮刀菌野生型菌株PH-1(F.graminearum PH-1)[14],由江蘇省農業科學院植物保護研究所提供。
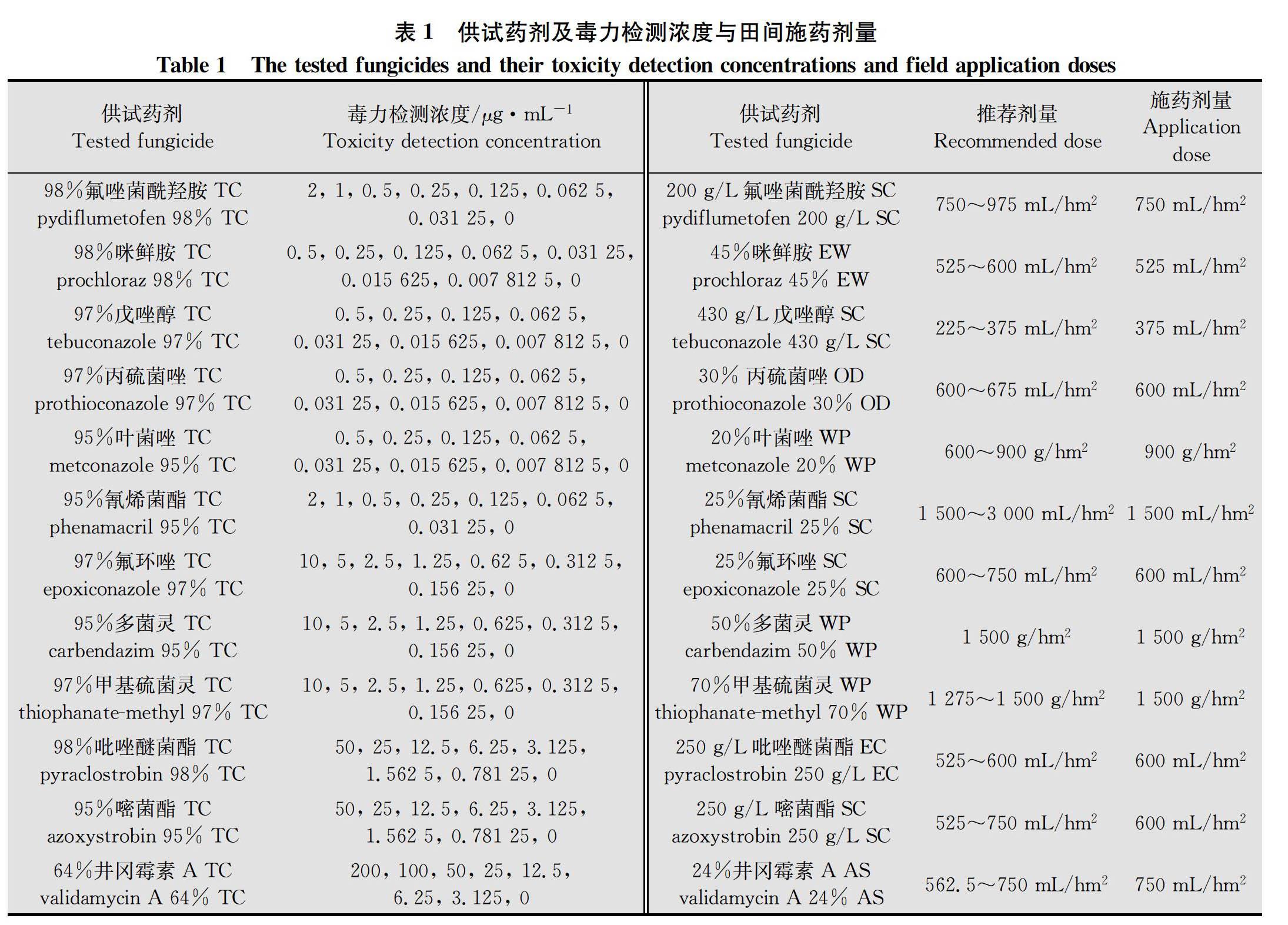
供試藥劑:98%氟唑菌酰羥胺原藥(TC)、 200 g/L氟唑菌酰羥胺懸浮劑(SC),瑞士先正達作物保護有限公司;98%咪鮮胺原藥、95%葉菌唑原藥、95%多菌靈原藥,江蘇輝豐生物農業股份有限公司;97%戊唑醇原藥,江蘇中旗作物保護股份有限公司;97%丙硫菌唑原藥、30%丙硫菌唑可分散油懸浮劑(OD),安徽久易農業股份有限公司;95%氰烯菌酯原藥、25%氰烯菌酯懸浮劑(SC),江蘇省農藥研究所股份有限公司;97%氟環唑原藥、50%多菌靈可濕性粉劑(WP),江蘇藍豐生物化工股份有限公司;97%甲基硫菌靈原藥,江蘇嘉隆化工有限公司;98%吡唑醚菌酯原藥,江蘇寶靈化工股份有限公司;95%嘧菌酯原藥,利爾化學股份有限公司;64%井岡霉素A原藥,浙江省桐廬匯豐生物科技有限公司;45%咪鮮胺水乳劑(EW),江蘇華農生物化學有限公司;430 g/L戊唑醇懸浮劑,拜耳作物科學(中國)有限公司;20%葉菌唑可濕性粉劑(試驗樣品),江蘇省綠盾植保農藥實驗有限公司;25%氟環唑懸浮劑,青島中達農業科技有限公司;70%甲基硫菌靈可濕性粉劑,揚州市蘇靈農藥化工有限公司;250 g/L吡唑醚菌酯乳油(EC),江蘇耘農化工有限公司;250 g/L嘧菌酯懸浮劑,江陰蘇利化學股份有限公司;24%井岡霉素A水劑(AS),武漢科諾生物科技股份有限公司(表1)。供試12種原藥用于室內毒力測定及離體控毒試驗,12種制劑用于田間試驗。將95%多菌靈原藥用適量0.1 mol/L鹽酸溶液溶解,64%井岡霉素A 原藥用適量無菌水溶解,其他原藥分別用適量丙酮溶解后用無菌水定容至一定體積,并加入5%的吐溫80作為乳化劑,各藥劑均配制成50 000 μg/mL的母液冷藏備用。
供試培養基及植物:馬鈴薯葡萄糖瓊脂(potato dextrose agar, PDA)培養基:去皮馬鈴薯200 g、葡萄糖20 g、瓊脂18 g、蒸餾水1 L,用于PH-1菌株的培養、保存及室內藥劑試驗;綠豆湯(mung bean broth, MBB)培養基:綠豆60 g、蒸餾水1 L,用于PH-1分生孢子培養;蔗糖硫酸銨培養基:蔗糖30 g、(NH 4) 2SO 4 2 g、KH 2PO 4 1 g、MgSO 4·7H 2O 0.5 g、KCl 0.5 g、FeSO 4·7H 2O 0.01 g、200 μL微量元素溶液(每100 mL含量:檸檬酸5 g、ZnSO 4·7H 2O 5 g、CuSO 4·5H 2O 0.25 g、MnSO 4·H 2O 0.05 g、H 3BO 3 0.05 g、NaMoO 4·2H 2O 0.05 g)、蒸餾水1 L、pH 6.5,用于PH-1菌株離體產毒培養。‘鎮麥12號’麥種,由江蘇丘陵地區鎮江農業科學研究所提供,屬春性中熟小麥品種。
試劑及儀器:丙酮(分析純),國藥集團化學試劑有限公司;甲醇和乙腈(色譜純),美國默克公司;HPLC級乙酸銨,德國CNW公司;DON、3-ADON、15-ADON標準品(濃度均為100 mg/mL),美國Romer國際貿易有限公司。99%水楊肟酸(salicylhydroxamic acid, SHAM),美國Acros Organics公司,用適量甲醇溶解,配制成50 000 μg/mL的母液冷藏備用。GZP-300A型智能光照培養箱,南京恒裕儀器設備制造有限公司;THZ-702B型振蕩培養箱,太倉華大實驗儀器科技有限公司;Agilent 1290 型UPLC系統,安捷倫科技(中國)有限公司;AB Sciex 4500 質譜檢測器,美國AB Sciex公司;AWL-020I-P超純水系統,美國艾科浦國際有限公司; TTL-DCII型氮吹儀,北京同泰聯科技發展有限公司;H2050R型離心機,湖南湘儀實驗室儀器開發有限公司;KQ-250E 型超聲波清洗器,昆山禾創超聲儀器有限公司;YK-200B高速粉碎機,山東省青州市益康中藥機械配件廠。
1.2 方法
1.2.1 不同殺菌劑對PH-1菌株的室內毒力測定
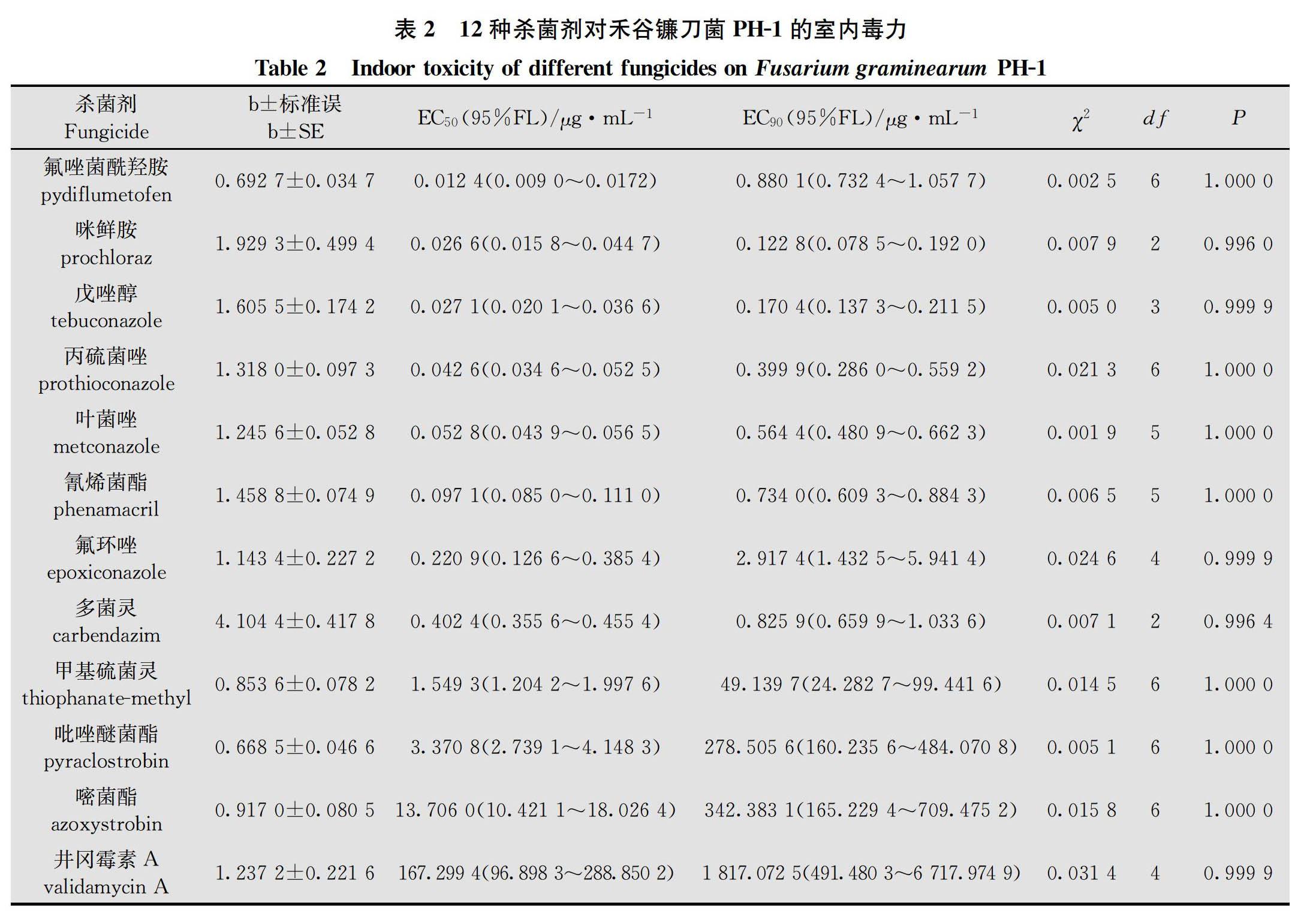
采用菌絲生長速率法[15],在預試驗的基礎上分別將12種原藥按有效劑量進行2倍梯度稀釋,獲得7個不同濃度梯度的含藥PDA培養基,以添加無菌水作空白對照。吡唑醚菌酯和嘧菌酯的處理與對照中均加入100 μg/mL的旁路氧化酶抑制劑SHAM,各處理重復4次(表2)。將PH-1菌株轉接至PDA中,28℃活化72 h,然后在菌落邊緣打取直徑為4 mm的菌餅,并分別轉接到含藥和對照PDA中,28℃培養72 h,待對照平皿菌落長至平皿直徑約4/5時,采用十字交叉法測量各處理的菌落直徑,并計算菌絲生長平均抑制率。菌絲生長平均抑制率=(對照菌落平均直徑-處理菌落平均直徑)/(對照菌落平均直徑-接種菌餅直徑)×100%。采用DPS 7.05數據處理系統,基于各藥劑對菌絲生長平均抑制率為5%至95%的毒力測定數據,分別計算出12種原藥對PH-1菌株菌絲生長抑制的毒力回歸方程、EC 50和EC 90及95%置信限等參數,并對毒力回歸方程進行卡方檢驗。
1.2.2 不同殺菌劑離體脅迫下PH-1菌株產DON毒素檢測
將PH-1菌株轉接PDA平皿中,28℃活化72 h,接種于含MBB培養基的250 mL三角瓶(100 mL/瓶) 后置于搖床,28℃、180 r/min暗培養7 d后收集分生孢子懸浮液備用。配制蔗糖硫酸銨培養基并分裝至250 mL三角瓶(100 mL/瓶),121℃下濕熱滅菌20 min,冷卻至室溫后接種分生孢子懸浮液(接種濃度為1.0×105個/mL),28℃、140 r/min 暗培養7 d。培養12 h 時,每瓶分別加入1 mL氟唑菌酰羥胺、咪鮮胺、戊唑醇等12種原藥母液,并使培養基中的藥劑終濃度為相應藥劑對PH-1菌株菌絲生長抑制的EC 50和EC 90,以添加1 mL無菌水為空白對照。各處理重復3次,試驗重復3次。培養7 d測定培養液pH后,用1號Whatman濾紙過濾,濾液于-20℃冷凍保存以備DON毒素檢測,菌絲體用無菌水沖洗兩次[16]。菌絲體置于干燥箱中60℃烘干至恒重,用電子天平稱量其重量。
采用液相色譜串聯質譜法(LC-MS)略作改進檢測PH-1菌株培養濾液DON毒素[17]。分別將各處理的培養濾液置于室溫復溶后放在搖床上140 r/min振蕩30 min,然后2 500 r/min 離心5 min取上清液(待檢液)備用;將氨基柱置于固相萃取裝置上用 2 mL甲醇活化(棄濾液),活化后加入2 mL待檢液過柱,過柱后再用2 mL 甲醇洗脫2次,收集流出液,將收集到的濾液氮吹干后用1 mL流動相重溶后待上機檢測。LC-MS檢測條件:Agilent 1290型UPLC系統,色譜柱:Agilent C 18柱(柱長100 mm,柱內徑2.1 mm,填料粒徑1.7 μm),柱溫:40℃;進樣量:2 μL;流速:0.2 mL/min;流動相:A(5 mmol/L醋酸銨水溶液),B(10%甲醇);梯度洗脫:90% A-10% B(0~1 min),10% A-90% B(4~5min),10% A-90% B(6min),90% A-10% B(6~10min)。AB Sciex 4500質譜,離子化模式:電噴霧電離模式(ESI);質譜掃描方式:多反應監測模式(MRM);離子源溫度:500 ℃;駐留時間:100 ms;霧化氣:50 psi;輔助氣:50 psi;氣簾氣:35 psi;噴霧電壓:5 500 V (ESI+);碰撞室射出電壓:6 V (ESI+);DON、3-ADON 和 15-ADON母離子分別為297.2、339 Da和339 Da,DON、3-ADON和15-ADON定量子離子分別為249、231 Da和137 Da。
DON毒素以DON毒素的產量/菌絲干重(μg/g菌絲干重)的量表述,并計算不同殺菌劑離體脅迫下PH-1菌株產DON毒素抑制率。DON毒素抑制率=(對照DON毒素-處理DON毒素)/對照DON毒素×100%。
1.2.3 不同殺菌劑對小麥赤霉病及籽粒DON毒素的田間防控試驗
于2019年10月至2020年5月,在江蘇丘陵地區鎮江農業科學研究所農業科技創新中心試驗田(119.30°E,31.96°N,海拔21 m)進行12種藥劑對赤霉病及籽粒DON毒素的田間防控試驗。試驗田土壤為下蜀馬肝土,有機質含量中等,供試小麥品種為‘鎮麥12號’。近年來試驗田塊赤霉病均發生較重,小麥生育期內肥水及蟲草害按常規管理。試驗設200 g/L氟唑菌酰羥胺SC、45%咪鮮胺EW、430 g/L戊唑醇SC、30%丙硫菌唑OD、 20%葉菌唑WP、25%氰烯菌酯SC、25%氟環唑SC、50%多菌靈WP、70%甲基硫菌靈WP、250 g/L吡唑醚菌酯EC、250 g/L嘧菌酯SC和24%井岡霉素A AS 等12個單劑處理,各藥劑施藥劑量均為廠家推薦劑量(表1)。以噴施等量清水為對照,每個處理重復3次,共39個小區,小區面積為30 m2,小區設保護行并隨機區組排列。施藥2次,間隔7 d,小麥揚花約10%(2020年4月13日)時使用鄭州綠帝農用機械有限公司生產的WBD-16型電動噴霧器第1次均勻噴霧施藥。噴液量為600 L/hm2,對照區噴施等量清水,施藥后至試驗結束,不噴施其他任何藥劑。
赤霉病發生穩定后(2020年5月11日)調查發病情況,采用對角線五點取樣,每處理調查500穗,病穗嚴重度分級標準及數據處理方法參照江蘇省農作物病蟲害預測預報方法[18]。病情指數和防治效果計算公式分別為:病情指數=Σ(各級病穗數×相應病級數值)/(調查總穗數×最高級代表值)×100;防治效果=(對照病情指數-處理病情指數)/對照病情指數×100%。
小麥成熟后(2020年5月29日),所有處理的每個小區對角線五點取樣,每點剪取0.25 m2的所有麥穗,人工脫粒并曬干混勻后將各處理的籽粒樣品用高速粉碎機進行粉碎,過20目篩,嚴格清理以免相互污染,收集各處理樣品粉末進行DON毒素檢測。采用液相色譜串聯質譜法(LC-MS)略作改進檢測樣品粉末DON毒素[17],稱取5 g樣本粉末置于50 mL離心管中,加入25 mL 84%乙腈溶液(提取液)后置于搖床上140 r/min振蕩30 min,3 000 r/min離心5 min取上清液后石墨化碳柱過濾,收集的溶液氮氣吹干,用1 mL 10%甲醇復溶,再用0.22 μm微孔濾膜過濾后上機檢測,LC-MS檢測條件同1.2.2。DON毒素含量以DON毒素的總量/樣品粉末干重(ng/g或μg/g粉末干重)的量表述,并計算不同殺菌劑對籽粒DON毒素的防治效果。DON毒素防效=(對照DON毒素含量-處理DON毒素含量)/對照DON毒素含量×100%。
1.3 數據分析
采用DPS 7.05數據處理系統對試驗數據進行統計分析,應用Duncan氏新復極差法進行差異顯著性檢驗;采用Excel軟件進行不同殺菌劑對赤霉病病指防效和籽粒DON毒素防效相關性分析并制圖。
2 結果與分析
2.1 不同殺菌劑對PH-1菌株的室內毒力
室內毒力測定結果得出,12種原藥對PH-1菌株的室內毒力由高至低依次為氟唑菌酰羥胺>咪鮮胺>戊唑醇>丙硫菌唑>葉菌唑>氰烯菌酯>氟環唑>多菌靈>甲基硫菌靈>吡唑醚菌酯>嘧菌酯>井岡霉素A;氟唑菌酰羥胺、咪鮮胺、戊唑醇、丙硫菌唑、葉菌唑、氰烯菌酯對PH-1菌株菌絲生長抑制EC 50為0.012 4~0.097 1 μg/mL,對菌絲生長抑制活性整體較高;氟環唑、多菌靈和甲基硫菌靈EC 50為0.220 9~1.549 3 μg/mL,對菌絲生長抑制活性中等;吡唑醚菌酯和嘧菌酯EC 50分別為3.370 8 μg/mL和13.706 0 μg/mL,對菌絲生長抑制活性相對較低;農用抗生素類殺菌劑井岡霉素A EC 50為167.299 4 μg/mL,對菌絲生長抑制活性最低(表2)。
2.2 不同殺菌劑離體脅迫下PH-1菌株產DON毒素效應
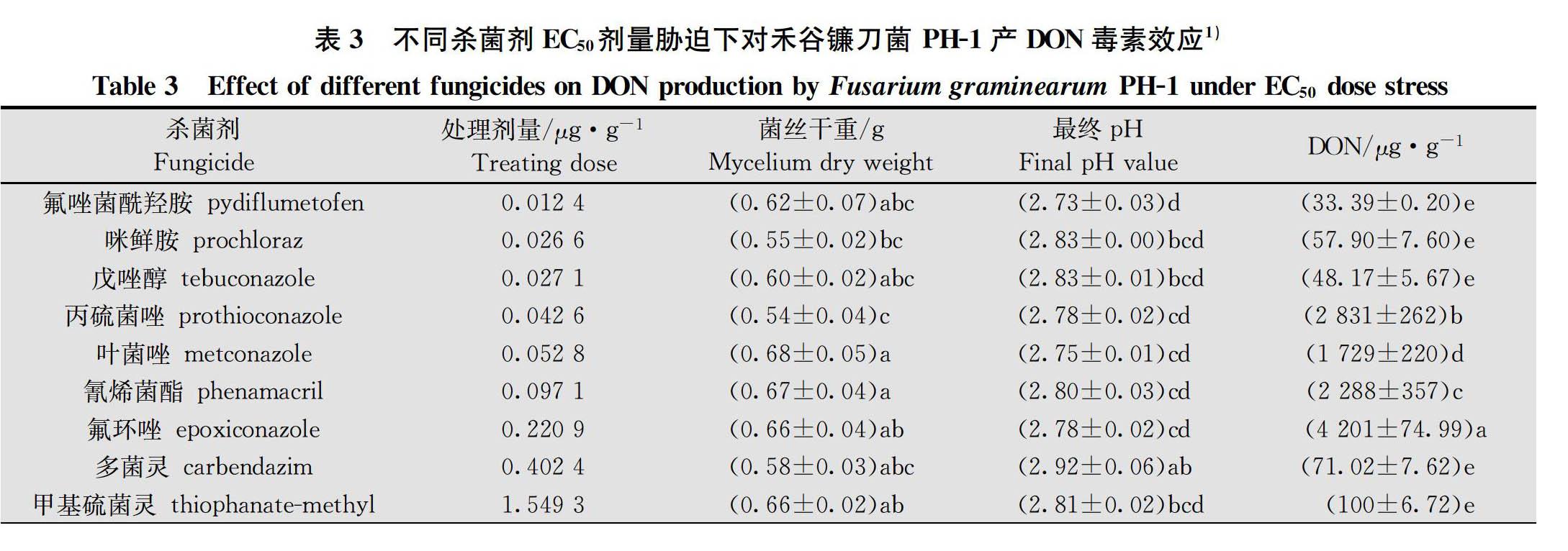
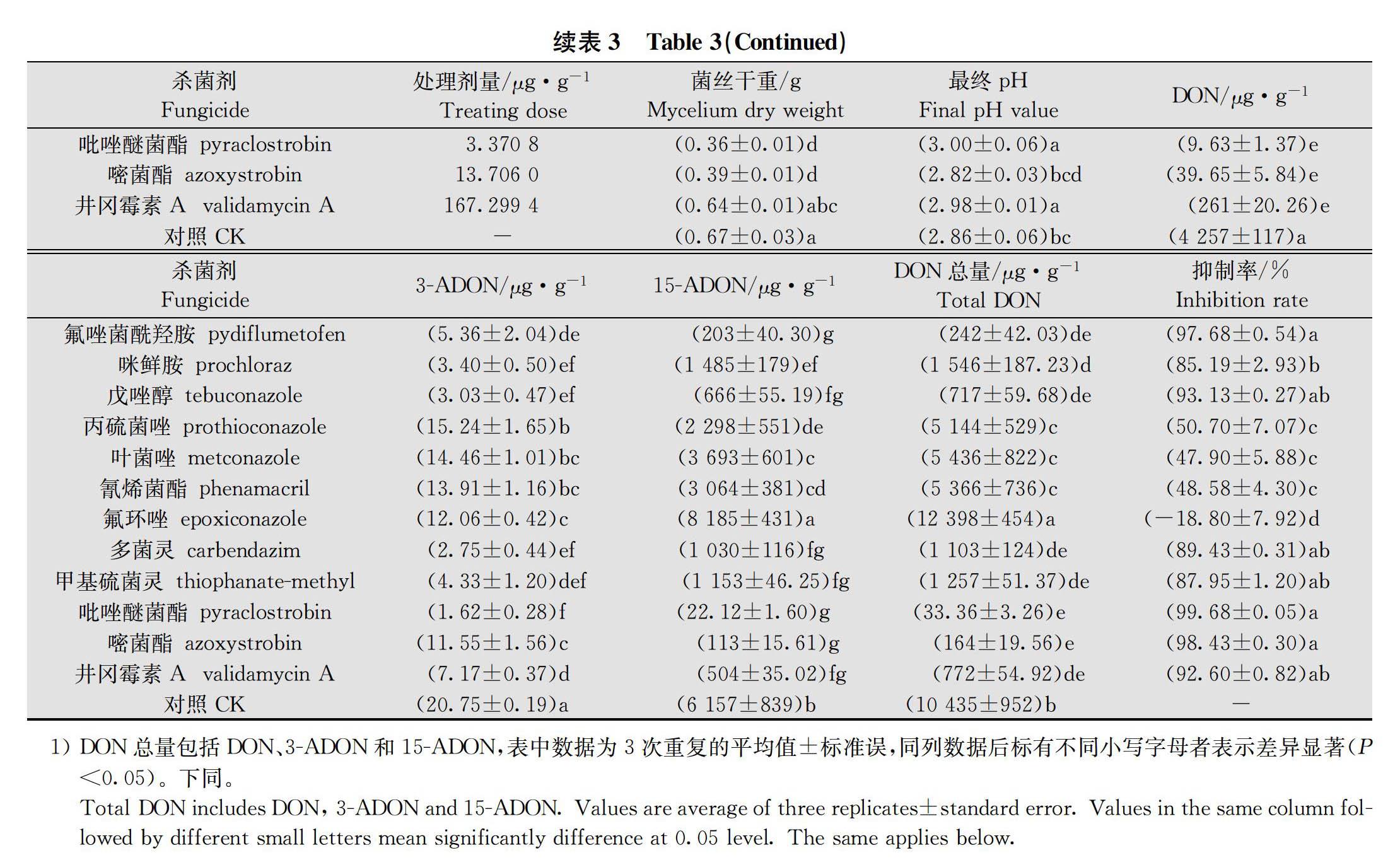
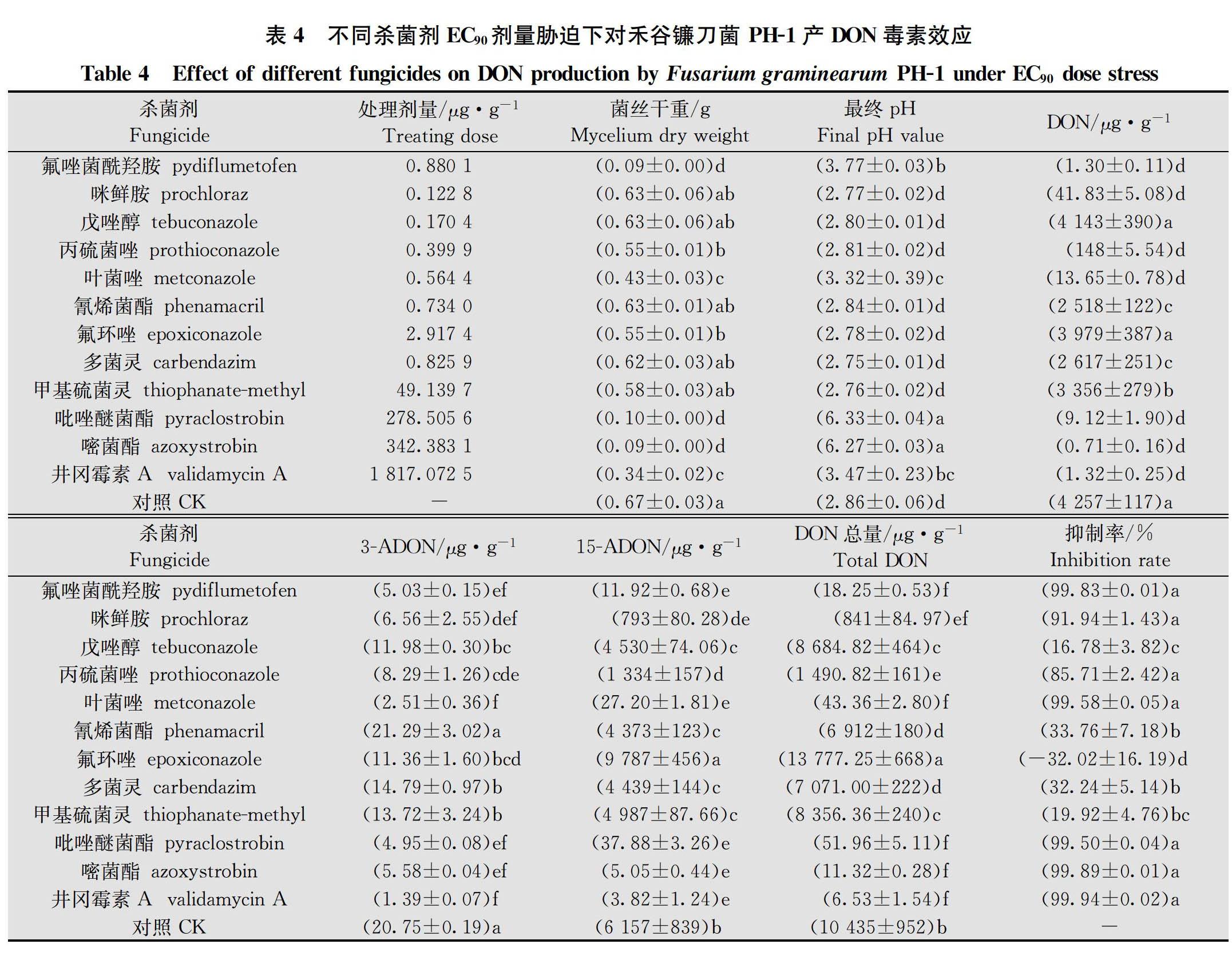
在分別以蔗糖和硫酸銨為碳氮源的蔗糖硫酸銨液體培養基中,12種殺菌劑原藥對PH-1菌株菌絲生長抑制EC 50和EC 90濃度離體脅迫下產DON毒素(包括DON、3-ADON和15-ADON)檢測結果得出,
12種供試殺菌劑在EC 50濃度脅迫下對PH-1菌株產DON毒素抑制率為-18.80%~99.68%,EC 90濃度脅迫下對PH-1菌株產DON毒素抑制率為-32.02%~99.94%;氟唑菌酰羥胺、甲氧基丙烯酸酯類殺菌劑吡唑醚菌酯和嘧菌酯以及農用抗生素類殺菌劑井岡霉素A對禾谷鐮刀菌產DON毒素均具有優良抑制效果;咪唑類殺菌劑咪鮮胺,三唑類殺菌劑戊唑醇、丙硫菌唑和葉菌唑以及苯并咪唑類殺菌劑多菌靈和甲基硫菌靈對產DON毒素均具不同程度的抑制效果,但劑量效應波動較大;氰烯菌酯對產DON毒素抑制效果較差;三唑類殺菌劑氟環唑刺激DON毒素產生(表3~表4)。
2.3 不同殺菌劑對小麥赤霉病及籽粒DON毒素的田間防效
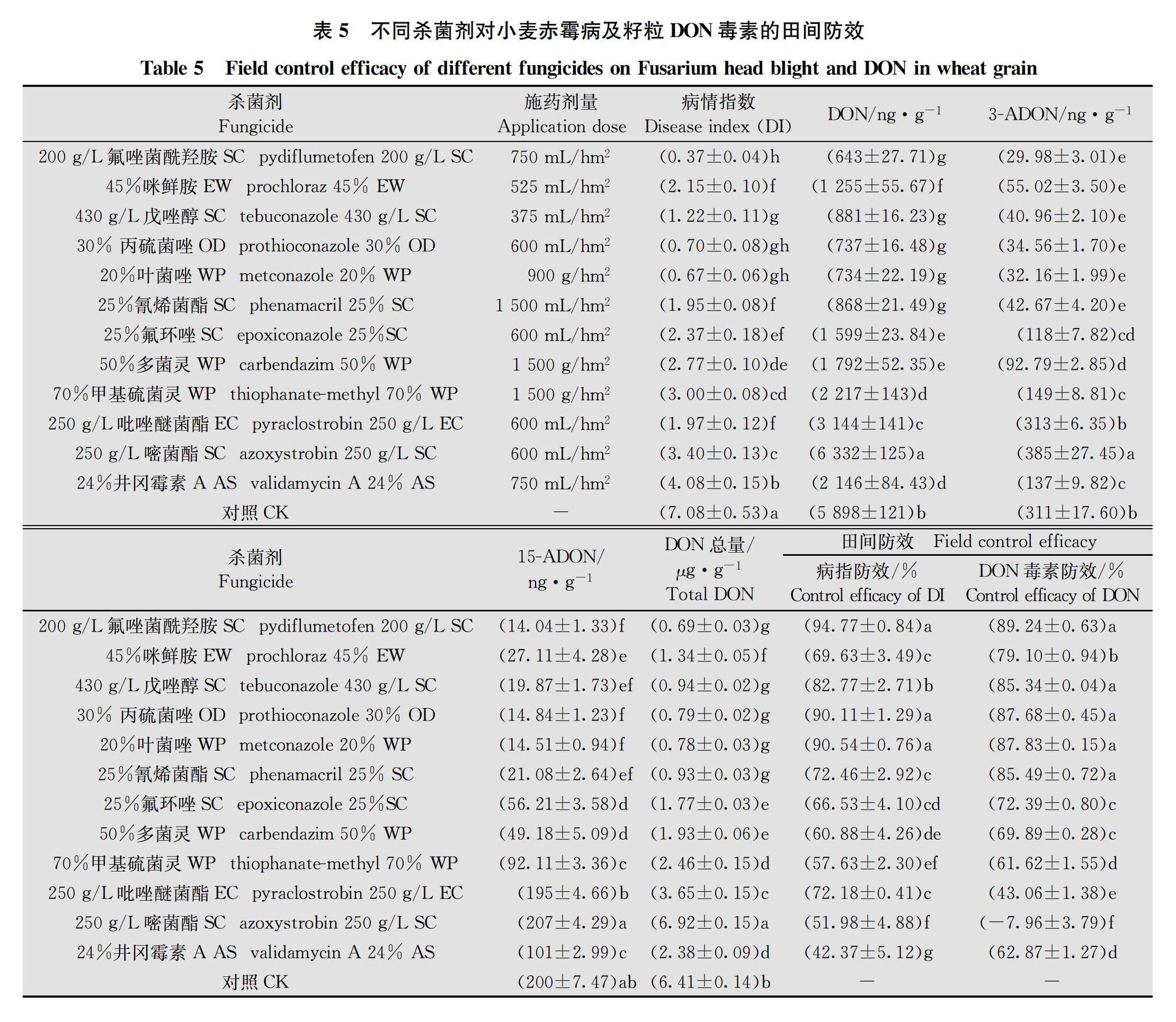
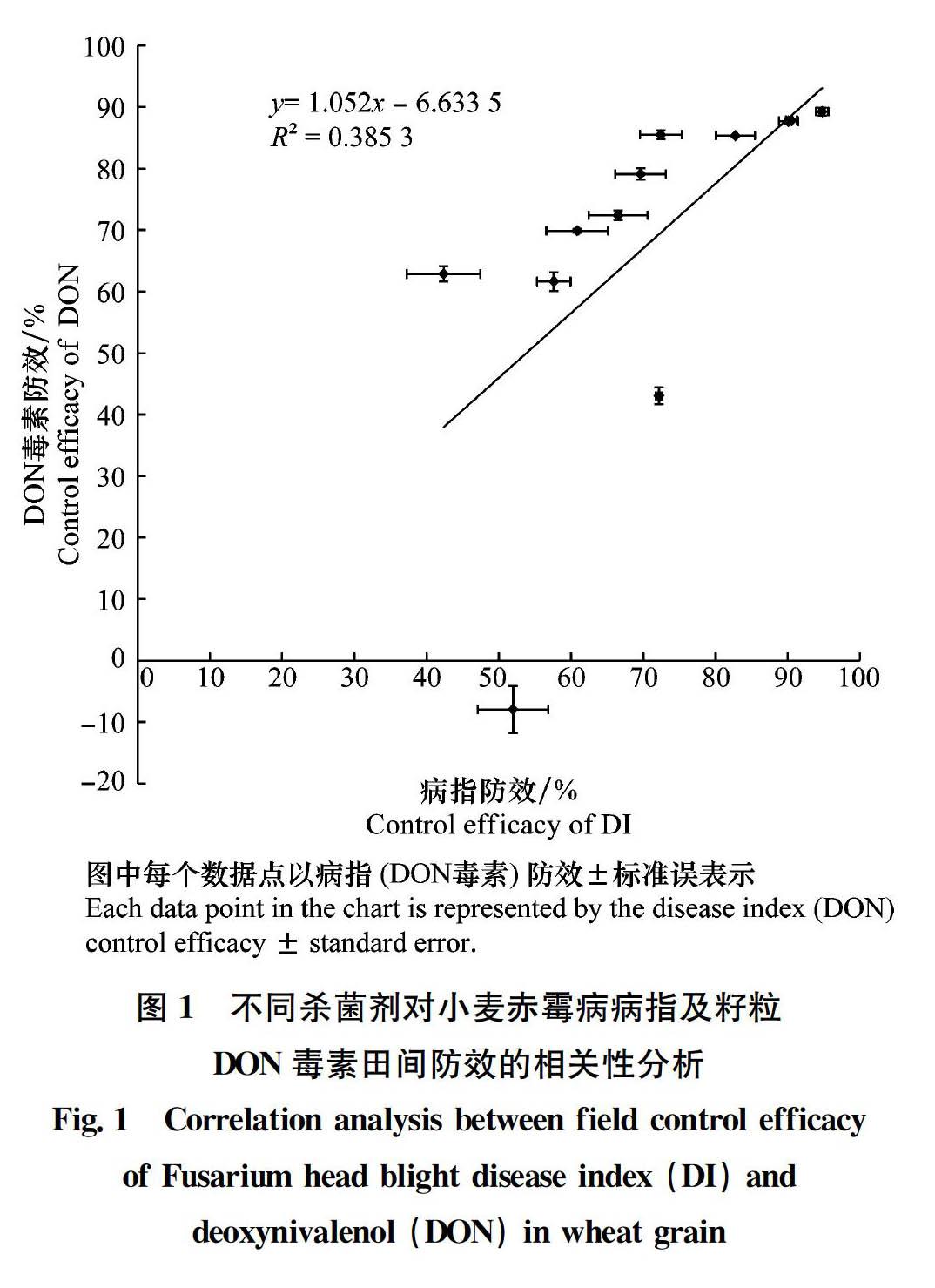
田間試驗結果得出,200 g/L氟唑菌酰羥胺SC 750 mL/hm2對赤霉病病指防效和小麥籽粒DON毒素(包括DON、3-ADON和15-ADON)防效均最高,分別為94.77%和89.24%; 24%井岡霉素A AS 750 mL/hm2病指防效最低,防效為42.37%;250 g/L嘧菌酯SC 600 mL/hm2 DON防效最低,防效為-7.96%。基于推薦劑量下對赤霉病和籽粒DON毒素的田間防效,12種藥劑大致可分為以下6個類別: 1)200 g/L氟唑菌酰羥胺SC、30%丙硫菌唑OD 和20%葉菌唑WP等3種制劑,對赤霉病及籽粒毒素防效優良; 2)430 g/L戊唑醇SC和25%氰烯菌酯SC等2種制劑,對赤霉病及籽粒毒素防效約為72%~85%,防效良好; 3)45%咪鮮胺EW和25%氟環唑SC等2種制劑,對赤霉病及籽粒毒素防效約為66%~79%,防效一般; 4)50%多菌靈WP和70%甲基硫菌靈WP等2種制劑,對赤霉病及籽粒毒素防效約為57%~69%,防效較差; 5)250 g/L吡唑醚菌酯EC和250 g/L嘧菌酯SC等2種制劑,對赤霉病病指防效不突出,并且對籽粒DON毒素防效明顯低于病指防效,甚至增加籽粒毒素污染;6)24%井岡霉素A AS,對赤霉病病指防效較差,但對籽粒毒素防效明顯高于病指防效,具一定的降低籽粒毒素污染作用(表5)。12種單劑對赤霉病病指防效和籽粒DON毒素防效的線性相關性分析得出,線性回歸方程為y=1.052x-6.633 4, R2值為0.385 3,在0.05水平上顯著(圖1)。這表明,病指防效與毒素防效不完全一致,不同殺菌劑對赤霉病及籽粒毒素的田間防效呈正相關。
3 討論
長期以來,小麥赤霉病危害造成的產量損失與毒素污染一直是全球普遍關注的問題[19],由于缺乏有效的抗病品種,藥劑防治仍是減輕赤霉病危害和毒素污染的主要措施[20]。我國防治赤霉病的藥劑較多,但真正高效防治赤霉病,同時又顯著降低毒素污染的品種并不多。因此,尋求和開發新型藥劑防治赤霉病以達到高防效、降毒素、增產量、提品質的目的尤為重要。在本研究中,琥珀酸脫氫酶抑制劑(succinate dehydrogenase inhibitor, SDHI)類殺菌劑氟唑菌酰羥胺,對禾谷鐮刀菌PH-1菌株的抑菌活性、離體控毒效果以及田間病害防效和DON毒素防效均非常優異。SDHI類殺菌劑氟唑菌酰羥胺,也是全球范圍內不可多得的赤霉病高防效藥劑,已于2019年在我國獲得正式登記并成為赤霉病防治藥劑的強有力補充,應用前景廣闊。SDHI類殺菌劑大多作用位點單一,抗性發展水平較高,因此,在生產中需將氟唑菌酰羥胺與其他不同作用機理的殺菌劑復配或輪換使用。
在赤霉病防治藥劑中,甾醇脫甲基抑制劑 (demethylation inhibitor, DMI) 類殺菌劑是最常用藥劑,如戊唑醇、葉菌唑和丙硫菌唑等多種DMI類殺菌劑可有效防控赤霉病并降低毒素污染[21]。在本研究中,戊唑醇、丙硫菌唑和葉菌唑等DMI類殺菌劑均對禾谷鐮刀菌PH-1菌絲生長具優良抑制活性,離體脅迫下具有不同程度的控毒效果但劑量效應波動較大,田間病害和DON毒素防效較好,尤其是丙硫菌唑和葉菌唑對赤霉病及籽粒毒素防效優良。DMI類殺菌劑氟環唑離體條件下刺激DON毒素產生,但在田間對赤霉病及籽粒毒素防效與DMI類殺菌劑咪鮮胺相當。Duan等[22]報道氟環唑在離體條件下刺激DON產生及Tri5基因表達,但在田間氟環唑(225 g/hm2)對赤霉病及籽粒毒素防效優于多菌靈(750 g/hm2)而僅略低于氰烯菌酯(375 g/hm2),并且還具有延緩小麥植株衰老與增產的作用。Tang等[23]報道禾谷鐮刀菌肌球蛋白I在其真菌毒素生物合成中起著關鍵作用,肌球蛋白抑制劑類殺菌劑氰烯菌酯能夠抑制禾谷鐮刀菌DON毒素合成;黃婷婷[24]報道在液體搖培條件下氰烯菌酯EC 50或EC 90劑量處理禾谷鐮刀菌抗性菌株,菌株產毒能力均受強烈抑制,氰烯菌酯可有效控制菌株產毒能力。在本研究中,氰烯菌酯在EC 50和EC 90劑量脅迫的液體搖培條件下對產DON毒素抑制效果均較差,在田間對赤霉病及籽粒毒素污染防效良好。相關研究表明,甲氧基丙烯酸酯類殺菌劑嘧菌酯刺激禾谷鐮刀菌產DON毒素,不建議用于赤霉病及DON毒素防控[2526]。Simpson等[27]報道嘧菌酯對不產毒病原菌如:雪腐鐮刀菌Microdochium nivale等抑菌效果較好,而對產毒鐮刀菌抑制效果較差,田間噴施嘧菌酯后菌群結構發生變化,產毒鐮刀菌菌群占比上升,最終導致毒素污染增加。殷憲超等[28]報道嘧菌酯對小麥DON防效為負值,苯并咪唑類殺菌劑多菌靈對赤霉病和DON防效均較差,嘧菌酯和多菌靈不宜單獨用于赤霉病和DON的防控。在本研究中,甲氧基丙烯酸酯類殺菌劑吡唑醚菌酯和嘧菌酯對禾谷鐮刀菌菌絲生長抑制活性相對較低,離體脅迫下對禾谷鐮刀菌產DON毒素均具優良抑制效果,在田間對赤霉病防效不佳,吡唑醚菌酯對籽粒毒素防效明顯低于病指防效,嘧菌酯則增加籽粒毒素污染。苯并咪唑類殺菌劑多菌靈和甲基硫菌靈對禾谷鐮刀菌菌絲生長抑制活性適中,離體脅迫下具有不同程度的控毒效果但劑量效應波動較大,田間病害和DON毒素防效較差。Li等[29]報道井岡霉素通過干擾海藻糖酶的活性抑制了禾谷鐮刀菌DON生物合成,既降低了禾谷鐮刀菌的致病力從而減輕了病害,又降低了小麥籽粒毒素污染;此外,井岡霉素還能誘導寄主抗性,增強了小麥對禾谷鐮刀菌的抗性。在本研究中,井岡霉素A對禾谷鐮刀菌菌絲生長抑制活性最低,離體脅迫下對禾谷鐮刀菌產DON毒素具優良抑制效果,田間對赤霉病防效較差但對毒素防效明顯高于病指防效,具一定的降低籽粒毒素污染作用。DON等單端孢霉烯族毒素的生物合成是以乙酰輔酶A為基本前提,起始于反式法尼基焦磷酸環化形成單端孢霉二烯,再經過一系列的加氧、異構化、環化和酯化反應,最終形成不同結構的毒素,毒素的生物合成受水分、溫度、碳氮源、胺、pH、光和活性氧等多種因素影響[23,30]。可見,藥劑離體控毒效果和田間控毒效果不完全一致。
相關研究表明,赤霉病病指與籽粒DON毒素污染呈顯著正相關,這也預示著有效防控赤霉病也將減少籽粒DON毒素污染[31]。在本研究中,不同殺菌劑對赤霉病及籽粒DON毒素防效呈正相關,病害與毒素防效不完全一致,病害有效防控是毒素防控的前提。在赤霉病防控中,藥劑防治已被廣泛使用,但即使噴施最好的殺菌劑也不能完全有效地防控赤霉病。因此,赤霉病和籽粒毒素污染防控需采取包括種植抗病(耐病)品種、優化田間水肥管理、病害預測預報、藥劑防治以及得當收獲與貯藏措施等多方面的綜合防控措施,方可達到理想效果,從而保障小麥優質安全高效生產。
參考文獻
[1] O’DONNELL K, WARD T J, ABERRA D, et al. Multilocus genotyping and molecular phylogenetics resolve a novel head blight pathogen within the Fusarium graminearum species complex from Ethiopia [J]. Fungal Genetics and Biology, 45(11): 15141522.
[2] YLIMATTILA T, GAGKAEVA T, WARD T J, et al. A novel Asian clade within the Fusarium graminearum species complex includes a newly discovered cereal head blight pathogen from the Russian Far East [J]. Mycologia, 2009, 101(6): 841852.
[3] MCMULLEN M, JONES R, GALLENBERG D. Scab of wheat and barley: A re-emerging disease of devastating impact [J]. Plant Disease 1997, 81(12): 13401348.
[4] SCHMEITZL C, WARTH B, FRUHMANN P, et al. The metabolic fate of deoxynivalenol and its acetylated derivatives in a wheat suspension culture: identification and detection of DON-15-O-glucoside, 15-acetyl-DON-3-O-glucoside and 15-acetyl-DON-3-sulfate [J]. Toxins, 2015, 7(8): 31123126.
[5] PARRY D W, JENKINSON P, MCLEOD L, et al. Fusarium ear blight (scab) in small grain cereals-a review [J]. Plant Pathology, 1995, 44(2): 207238.
[6] LIU Ye, CHEN Xiang, JIANG Jinhua, et al. Detection and dynamics of different carbendazim-resistance conferring β-tubulin variants of Gibberella zeae collected from infected wheat heads and rice stubble in China [J]. Pest Management Science, 2014, 70(4): 12281236.
[7] 陳云, 王建強, 楊榮明, 等. 小麥赤霉病發生危害形勢及防控對策[J]. 植物保護, 2017, 43(5):1117.
[8] CUI Li, SELVARAJ J N, XING Fuguo, et al. A minor survey of deoxynivalenol in Fusarium infected wheat from Yangtze-Huaihe river basin region in China [J]. Food Control, 2013, 30(2): 469473.
[9] European Food Safety Authority. Deoxynivalenol in food and feed: Occurrence and exposure [J]. EFSA Journal, 2013,11(10):156.
[10]BIANCHINI A, HORSLEY R, JACK M M, et al. DON occurrence in grains: a north American perspective [J]. Cereal Foods World, 2015, 60(1):3256.
[11]ROTTER B A, PRELUSKY D B, PESTKA J J. Toxicology of deoxynivalenol (vomitoxin) [J]. Journal of Toxicology & Environmental Health, 1996, 48(1):134.
[12]國家食品藥品監督管理總局. 食品安全國家標準食品中真菌毒素限量: GB 2761-2017 [S]. 北京: 中國標準出版社, 2017.
[13]BAI Guihua, SHANER G. Management and resistance in wheat and barley to Fusarium head blight [J]. Annual Review of Phytopathology, 2004, 42(1):135161.
[14]CUOMO C A, GULDENER U, XU Jinrong, et al. The Fusarium graminearum genome reveals a link between localized polymorphism and pathogen specialization [J]. Science, 2007, 317(5843): 14001402.
[15]黃國洋. 農藥試驗技術與評價方法[M]. 北京: 中國農業出版社, 2000:3031.
[16]PINSON G L, RICHARD F F, FRASSE P, et al. Magnesium represses trichothecene biosynthesis and modulates Tri5, Tri6, and Tri12 genes expression in Fusarium graminearum [J]. Mycopathologia, 2008, 165(1): 5159.
[17]國家食品藥品監督管理總局.食品安全國家標準食品中脫氧雪腐鐮刀菌烯醇及其乙酰化衍生物的測定: GB 5009.111-2016 [S]. 北京: 中國標準出版社, 2016.
[18]江蘇省植物保護站. 農作物主要病蟲害預測預報與防治[M]. 南京: 江蘇科學技術出版社, 2006: 15.
[19]DA ROCHA M E B, FREIRE F D C O, MAIA F E F, et al. Mycotoxins and their effects on human and animal health [J]. Food Control, 2014, 36(1): 159165.
[20]RUDD J C, HORSLEY R D, MCKENDRY A L, et al. Host plant resistance genes for Fusarium head blight: Sources, mechanisms, and utility in conventional breeding systems [J]. Crop Science, 2001, 41(3): 620627.
[21]PAUL P A, MCMULLEN M P, HERSHMAN D E, et al. Meta-analysis of the effects of triazole-based fungicides on wheat yield and test weight as influenced by Fusarium head blight intensity [J]. Phytopathology,2010, 100(2): 160171.
[22]DUAN Yabing, XIAO Xuemei, LI Tao, et al. Impact of epoxiconazole on Fusarium head blight control, grain yield and deoxynivalenol accumulation in wheat [J]. Pesticide Biochemistry and Physiology, 2018, 152: 138147.
[23]TANG Guangfei, CHEN Yun, XU Jinrong, et al. The fungal myosin I is essential for Fusarium toxisome formation [J/OL]. PLoS Pathogens, 2018, 14(1): e1006827. DOI: 10.1371/journal.ppat.1006827.
[24]黃婷婷. 多菌靈·氰烯菌酯對禾谷鐮孢菌DON毒素合成的影響[D]. 南京: 南京農業大學, 2016.
[25]BLANDINO M, MINELLI L, REYNERI A. Strategies for the chemical control of Fusarium head blight: effect of yield, alveographic parameters and deoxynivalenol contamination in winter wheat grain [J]. European Journal of Agronomy, 2006, 25(3): 193201.
[26]徐飛, 王俊美, 楊共強, 等. 不同殺菌劑防治小麥赤霉病及減少籽粒中DON毒素積累的效果[J]. 植物保護, 2018, 44(3): 214219.
[27]SIMPSON D R, WESTON G E, TURNER J A, et al. Differential control of head blight pathogens of wheat by fungicides and consequences for mycotoxin contamination of grain [J]. European Journal of Plant Pathology, 2001, 107: 421431.
[28]殷憲超, 武德亮, 孟旭, 等. 不同殺菌劑及其復配制劑在小麥赤霉病及嘔吐毒素防治中的作用[J]. 麥類作物學報, 2020, 40(10): 12751280.
[29]LI Jing, DUAN Yabing, BIAN Chuanhong, et al. Effects of validamycin in controlling Fusarium head blight caused by Fusarium graminearum: Inhibition of DON biosynthesis and induction of host resistance [J]. Pesticide Biochemistry and Physiology, 2019, 153: 152160.
[30]DESJARDINS A E. Fusarium mycotoxins: chemistry, genetics and biology [M]. St. Paul, MN, USA, APS Press, 2006: 3353.
[31]WEGULO S N. Factors influencing deoxynivalenol accumulation in small grain cereals [J].Toxins, 2012, 4(12): 11571180.
(責任編輯:田 喆)

