藤茶查爾酮合成酶基因AgCHS1的克隆及功能鑒定
許明,林世強,倪冬昕,伊恒杰,劉江洪,楊志堅,鄭金貴
藤茶查爾酮合成酶基因的克隆及功能鑒定
許明,林世強,倪冬昕,伊恒杰,劉江洪,楊志堅,鄭金貴
(福建農林大學農學院/作物生物技術福建省高校重點實驗室/作物遺傳育種與綜合利用教育部重點實驗室,福州 350002)
【】查爾酮合成酶(chalcone synthase,CHS)是植物類黃酮生物合成的第一個關鍵酶,從藤茶中克隆,分析其序列特征及其在藤茶中的組織表達特異性,通過體外酶活性檢測和煙草遺傳轉化對其功能進行鑒定,為進一步研究藤茶類黃酮累積的調控機理提供理論基礎。根據藤茶轉錄組測序結果設計引物,以藤茶葉片cDNA和基因組DNA為模板,PCR擴增得到。利用生物信息學方法分析該基因的序列特征,使用MEGA6和DNAMAN軟件進行多重序列比對,并構建系統進化樹。通過原核表達系統獲得的重組蛋白,分析該重組蛋白對底物的催化活性,并通過高效液相色譜-質譜(HPLC-MS)對酶促反應產物進行鑒定。利用qRT-PCR技術對在藤茶不同器官的表達水平進行分析,并采用硝酸鋁比色法測定相應的總黃酮含量變化。構建植物過量表達載體,通過葉盤法轉化煙草,篩選陽性轉基因后代,對T2代株系花瓣中的花青素和黃酮醇含量進行檢測。的ORF長1 182 bp,編碼393個氨基酸,基因組序列長1 315 bp,含2個外顯子和1個內含子。生物信息學分析表明,AgCHS1為穩定的親水蛋白。通過與其他物種的CHS蛋白多序列比對發現,AgCHS1含有查爾酮合成酶家族的特征序列和活性位點殘基,包括丙二酰CoA結合位點和三聯活性中心位點,與其他物種的CHS序列一致性較高。系統進化分析顯示,AgCHS1與葡萄、山葡萄的CHS處于同一進化分支,親緣關系最近。熒光定量PCR結果表明,在成熟葉和花中的表達量最高,在老葉中的表達量最低。藤茶不同器官的總黃酮含量與表達水平呈顯著正相關。體外酶活性分析顯示,重組的AgCHS1蛋白可以催化底物對-香豆酰輔酶A和丙二酰輔酶A生成柚皮素,說明該蛋白具有查爾酮合成酶活性。獲得5株煙草轉基因陽性株系,其中2株的花瓣顏色明顯加深;與對照相比,轉基因株系OE3、OE4花瓣中的花青素含量分別提高56.6%和25.3%,OE3的黃酮醇含量沒有顯著差異,OE4的黃酮醇含量提高39.1%。AgCHS1是藤茶中催化合成查爾酮的關鍵酶,過量表達可以提高轉基因植物中花青素和黃酮醇的含量。
藤茶;查爾酮合成酶;酶活性;花青素;黃酮醇
0 引言
【研究意義】藤茶學名為顯齒蛇葡萄(W.T.Wan),屬于葡萄科蛇葡萄屬藤本植物,主要分布在中國福建、云南、廣東、廣西、貴州和湖南等長江以南的山區,民間將其作為茶藥兩用植物應用已有數百年的歷史[1]。藤茶的主要有效成分是以二氫楊梅素為主的黃酮類化合物,具有抗氧化、保肝護肝、降血壓和抗腫瘤等多種功效[1-3]。研究表明,品種、季節和栽培條件等多種因素都會造成藤茶黃酮含量出現較大差異,從而影響藤茶產品的質量甚至療效[3-5]。因此,開展藤茶黃酮類化合物合成關鍵基因的克隆、功能鑒定及其調控機制研究,對藤茶藥用品質提升及其資源持續高效利用具有重要意義。【前人研究進展】黃酮類化合物(又稱類黃酮)的生物合成途徑在國內外已有了較為廣泛地研究,其合成途徑的主要步驟已基本探明[6]。查爾酮合成酶(chalcone synthase,CHS)屬于III型聚酮合成酶(polyketide synthase,PKS)家族,是類黃酮合成途徑中的第1個關鍵結構酶,負責催化3分子丙二酰CoA與1分子的對-香豆酰輔酶A縮合形成柚皮素查爾酮,并進一步生成黃酮醇、異黃酮和花青素等各類黃酮類化合物[7]。廣泛存在于高等植物中,目前已經在煙草[8]、虎杖[9]、蘋果[10]、桑樹[11]、雪蓮[12]、地錢[13]、香雪蘭[14]等多種植物中被克隆,并明確了其功能。主要以多基因家族形式存在[15],不同植物中數目不等,例如在水稻中可能有27個[16],煙草中至少有5個成員[8],而金魚草中只有1個[17]。近期Li等[18]利用高通量轉錄組測序技術,注釋了多條與藤茶相關的unigene,暗示在藤茶中也是以多基因家族形式存在。對不同植物的分子系統進化研究發現,超基因家族的起源較早,但在長期進化過程中,家族成員內部發生了多樣的遺傳改變,使其功能上可能各有分工[7]。典型的CHS催化生成查爾酮,進入花青素合成途徑,而其他成員則催化生成一些與植物抗逆相關的產物[15]。增強或抑制不同植物的表達,能改變植物花色或抗逆能力[14,19-20]。此外,的表達受發育階段和環境因子的影響,在不同組織和器官中的表達模式也存在差異[21-22]。【本研究切入點】前期研究已從藤茶中克隆和注釋了一部分,并對其序列進行了生物信息學分析[18,23],但對其功能的研究尚未見報道。【擬解決的關鍵問題】本研究基于轉錄組測序基礎,從藤茶中克隆得到1條的編碼區序列,命名為,通過生物信息學分析、組織表達特異性分析、體外酶活性檢測和煙草遺傳轉化試驗,探討該基因在藤茶類黃酮生物合成過程中的作用,為進一步研究藤茶類黃酮高效累積的分子機理奠定基礎。
1 材料與方法
試驗于2017年9月至2020年5月在福建農林大學農學院作物生物技術福建省高校重點實驗室進行。
1.1 植物材料與試劑
藤茶引自福建尤溪縣下村林場,經福建農林大學植物學教研室鑒定為葡萄科蛇葡萄屬顯齒蛇葡萄。在同一植株上分別采集幼葉、成熟葉、老葉、莖、花和根,液氮速凍后研磨成粉末,然后分成2份,一部分用于總RNA提取,另一部分凍干后貯存于-80℃冰箱,用于總黃酮的提取與含量測定。
植物總RNA提取試劑盒、質粒提取DNA和膠回收試劑盒購自北京艾德萊生物科技有限公司。限制性內切酶、T4 DNA連接酶、克隆載體pMD-18T、原核表達載體pET28a-pGTf2、大腸桿菌感受態細胞(DH5α)、ExTaq DNA聚合酶購自寶生物工程(大連)有限公司。反轉錄試劑盒和Sybr Green qPCR Master Mix購自BBI生命科學有限公司。二氫楊梅素、槲皮素對照品購自上海同田生物技術股份有限公司,丙二酰輔酶A、柚皮素購自美國Sigma公司,對-香豆酰輔酶A購自德國MicroCombiChem公司。引物合成和測序均由上海生工有限公司合成。
1.2 基因組DNA、總RNA的提取和第一鏈cDNA合成
采用CTAB法提取藤茶葉片基因組DNA。藤茶不同組織RNA的提取參照筆者實驗室前期建立的方法[24]進行,煙草總RNA的提取參考植物RNA提取試劑盒說明書進行。通過1%瓊脂糖凝膠電泳檢測DNA和總RNA的完整性,用Nanodrop 2000分光光度計測定樣品濃度和純度。利用PrimeScript? RT reagent試劑盒(Takara)將總RNA反轉錄為第一鏈cDNA。
1.3 AgCHS1的克隆與序列分析
根據前期藤茶葉片轉錄組的測序結果(NCBI登錄號:SRP241021),設計5′端分別帶H I和I酶切位點的特異性引物AgCHS1-F/R(表1),分別以藤茶葉片DNA和cDNA為模板,利用ExTaq DNA聚合酶進行PCR擴增,反應條件為:94℃預變性5 min;94℃ 30 s,54℃ 30 s,72℃ 60 S,30個循環;72℃延伸10 min。PCR產物經瓊脂糖凝膠電泳后回收目的片段,將回收產物與pMD18-T載體連接并轉化大腸桿菌感受態,挑選陽性克隆進行測序。
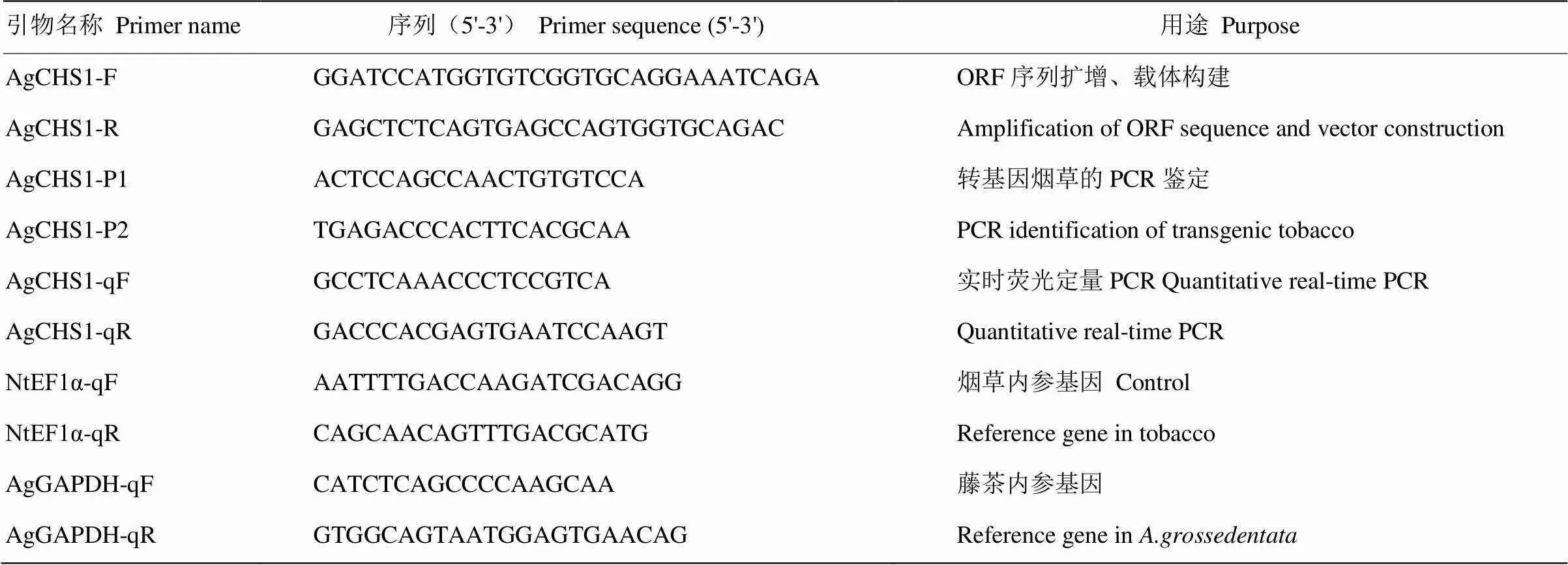
表1 本試驗中所用的引物序列
將測序所得序列在NCBI上進行同源性比對(http://blast.ncbi.nlm.nih.gov/Blast.cgi),借助ProtParam(http://www.expasy.ch/tools/protparam.html)分析編碼蛋白質的氨基酸組成、等電點和相對分子質量。使用CDD(http://www.ncbi.nlm.nih.gov/cdd)分析其保守結構域。采用DNAMAN軟件進行氨基酸的多重比對分析。使用MEGA 6軟件構建不同物種CHS蛋白的系統進化樹。
1.4 AgCHS1重組蛋白原核表達及純化
用HⅠ和Ⅰ雙酶切含有的pMD-18T載體,回收片段,連接到用相同內切酶消化的pET28a-pGTf2載體上,將連接產物導入大腸桿菌BL21(DE3)感受態中,鑒定出陽性單菌落并測序。確定序列及載體組裝無誤后,使用0.4 mmol?L-1IPTG誘導表達目的蛋白,誘導表達條件及步驟參照LIN等[25]的方法。采用Bradford法測定蛋白濃度。
1.5 AgCHS1體外酶活性試驗
AgCHS1酶活性測定參照YAHYAA等[10]的方法并略作修改,250 μL反應體系包括15 μmol·L-1的對-香豆酰輔酶A、56 μmol·L-1的丙二酰輔酶A、0.1 mol·L-1磷酸鉀緩沖液(pH 7.0)以及2.0 μg純化的AgCHS1。將上述反應體系置于35℃下反應30 min后,加入等體積乙酸乙酯抽提2次,于12 000 r/min離心10 min;取上清液真空干燥后,加入250 μL 50%(v/v)的甲醇水溶液溶解殘留。通過UPLC(Waters,2695)對酶促反應產物進行初步分析,再利用HPLC-MS(Thermo Fisher,LCQ Fleet)對產物進行鑒定。液相條件:液相柱BEH C18,粒徑1.7 μm, 2.1 mm×100 mm;柱溫35℃;進樣量2 μL。A相:1.0%乙酸;B相:100%乙腈;流速:0.3 mL?min-1。質譜條件:離子源為電噴霧(ESI-),毛細管溫度300℃,鞘氣(N2)15 arb,噴霧電壓-4.47 kV,檢測電壓1.5 kV,時間100 ms,碰撞氣體He,母離子選擇寬度:3 u,采集范圍100—600 m/z。
1.6 基因表達分析
根據所獲得的序列,采用Primer5.0軟件設計熒光定量PCR引物(表1)。藤茶的內參基因為[26],煙草的內參基因為。熒光定量反應體系為:SybrGreen qPCR Master Mix(2×)10 μL,10 μmol·L–1上、下游引物各0.4 μL,cDNA 2 μL,加ddH2O至終體積20 μL。反應在ABI StepOne型熒光定量PCR儀上進行,程序為95℃變性3 min,95℃變性5 s,60℃退火延伸30 s,45個循環,于60℃收集熒光,反應結束后分析熒光值變化曲線和熔解曲線,每個反應重復3次,采用2?ΔΔCt算法計算基因相對表達量。
1.7 植物表達載體構建及轉基因煙草的獲得
利用H Ⅰ和I雙酶切pBI121載體,回收載體大片段,與1.3中回收的片段連接,將連接產物轉化DH5α感受態細胞,通過酶切鑒定陽性克隆,得到植物表達載體pBI-35S:AgCHS1,采用凍融法將其導入根癌農桿菌EHA105中,按照Ning等[27]的方法進行煙草遺傳轉化。提取T0代抗性植株葉片DNA,用引物AgCHS1-P1/P2進行PCR驗證,陽性植株連續自交種植2代后獲得T2代植株,用于后續的檢測。
1.8 黃酮類物質的提取與測定
藤茶不同器官總黃酮的提取參照Li等[18]介紹的提取方法,然后采用硝酸鋁比色法[28],檢測樣品溶液在324 nm波長的吸收值,通過二氫楊梅素的標準曲線換算樣品中的總黃酮含量。煙草花瓣花青素的提取與測定按照Wang等[29]的方法,并略作修改。取50 mg野生型和轉基因煙草的花瓣(鮮重,M),加入1 mL酸化甲醇(含1% HCl(v/v)),黑暗條件下提取24 h,10 000 r/min離心10 min,取上清液,用紫外可見光分光光度計(Thermo Scientific,Evolution 201)測定530 nm與657 nm處的吸光值(A530和A657)。相對花青素含量(Q)用公式(Q=(A530-0.25×A 657)M)計算。煙草花瓣黃酮醇的提取與測定參照TIRUMALAI等[30]的方法進行,并略作修改。取100 mg新鮮的煙草花瓣在液氮中研磨成粉末,加入2.0 mL 75%乙醇提取3 h,濾液干燥后,溶解于1.0 mL 75%乙醇中。取0.1 mL提取液,加入0.5 mL 5% NaNO2,搖勻放置6 min,再加10% Al(NO3)3,搖勻放置6 min,最后加入2.5 mL 1.0 mol·L-1NaOH溶液中止反應,放置15 min后,在波長510 nm處測定吸光值。按照槲皮素的標準曲線換算樣品中總黃酮醇含量。
2 結果
2.1 AgCHS1的克隆和生物信息學分析
根據轉錄組測序信息,設計特異性引物,以藤茶葉片cDNA為模板,擴增得到的ORF序列(GenBank登錄號為MT316507)長度為1 182 bp,編碼393個氨基酸。以基因組DNA為模板,擴增得到的gDNA序列(GenBank登錄號為MT316508)長度為1 315 bp(圖1-A),與ORF序列比對后發現,具有一個內含子(133 bp),外顯子1為178 bp,外顯子2為1 004 bp,內含子遵循GT/AG規則(圖1-B)。
通過ProtParam在線分析AgCHS1蛋白理化性質,其理論分子量為42.8 kD,理論等電點(pI)為6.15,分子式為C1908H3059N513O565S19,帶負電荷的氨基酸(Asp+Glu)為48個,帶正電荷的氨基酸(Arg+Lys)為43個,不穩定系數為34.71,屬于穩定性蛋白。平均親水性(GRAVY)為-0.045<0,表明AgCHS1屬于親水性蛋白。

A:AgCHS1的PCR擴增產物,M:DL5000;1:ORF擴增產物;2:基因組DNA擴增產物。B:AgCHS1的結構
利用DNAMAN軟件將AgCHS1與葡萄、水稻、擬南芥、煙草等常見植物的CHS進行序列多重比對,發現該蛋白與葡萄CHS的氨基酸序列相似度最高,達到96.7%,與陸地棉、水稻、擬南芥、煙草的相似度分別為89.1%、82.2%、84.5%和86.5%,與付明等[23]報道的藤茶CHS氨基酸序列存在較大差異,二者相似度為88.1%。AgCHS1含有查爾酮合成酶家族典型的Cys-His-Asn三聯活性中心位點和2個高度保守的苯丙氨酸殘基Phe215和Phe265(圖2),這些位點與查爾酮合成酶底物特異性相關[29]。此外,AgCHS1還具有丙二酰輔酶A結合位點和2個高度保守的CHS特征序列RLMMYQQGCFAGGTVLR和GVLFGFGPGL(圖2)。進一步說明本研究所克隆的序列為藤茶的序列。
采用MEGA 6軟件鄰接法(Neighbor-Joining,NJ),對包括藤茶在內的14種植物的CHS蛋白序列進行聚類分析,構建系統進化樹。結果顯示,藤茶AgCHS1與同科的葡萄、山葡萄進化關系最近,與圓葉葡萄、茶樹、陸地棉的進化關系也較近,而與白鮮、甜橙等進化關系較遠(圖3)。
2.2 藤茶不同器官AgCHS1的表達及總黃酮含量
對在藤茶幼葉、成熟葉、老葉、莖、花和根中的表達進行分析。結果顯示,在藤茶所有器官中均有表達。其中,成熟葉和花中的表達量最高,在老葉中的表達量最低。在葉片3個不同發育時期,的表達水平呈先升后降的趨勢。總黃酮含量變化趨勢與的表達變化基本一致(圖4),二者在0.05水平上呈顯著正相關(相關系數為0.9224),說明的表達在藤茶總黃酮積累過程中可能發揮著重要作用。
2.3 AgCHS1的原核表達、純化與酶活性測定
將重組質粒pET28a-AgCHS1/pGTf2轉化至大腸桿菌BL21,經IPTG誘導,超聲裂解和Ni親和層析柱純化,得到純化的AgCHS1重組蛋白。經SDS-PAGE確定其分子量約為43 kD(包括His標簽),與預期分子量大小一致(圖5)。通過Bradford法測定AgCHS1蛋白含量為0.75 mg?mL-1。
在體外酶促反應中,當以對-香豆酰輔酶A與丙二酰輔酶A為底物時,AgCHS1能有效催化柚皮素查爾酮合成,然后柚皮素查爾酮自發異構化為柚皮素。HPLC-MS結果顯示,AgCHS1酶促反應產物色譜峰的保留時間出現在6.8 min,與柚皮素標準品的保留時間一致(圖6-A、B),而空載蛋白對照組未觀察到目標峰(圖6-C)。柚皮素標準品二級質譜中母離子峰的質荷比(m/z)為271,其子離子峰m/z為151和177(圖6-D、E),通過文獻檢索和標準品比對,確定酶促反應產物二級質譜中具有相應的特征離子峰(圖6-F、G)。說明AgCHS1編碼的蛋白具有查爾酮合成酶活性,在體外能夠催化對-香豆酰輔酶A生成柚皮素。
2.4 AgCHS1在煙草中的過量表達
構建由組成型啟動子CaMV35S調控表達的植物表達載體,采用農桿菌介導法將其轉到早花煙草中,獲得5株獨立的卡那霉素抗性植株。經PCR檢測5株全部呈陽性(圖7-A),其中2株(OE3和OE4)的花瓣顏色比野生型對照明顯加深(圖7-B),且該表型在后代能穩定傳遞。花青素含量測定結果顯示,過表達株系OE3、OE4花瓣中的花青素含量分別比野生型對照提高56.6%和25.3%(圖7-C,<0.05)。進一步通過熒光定量PCR檢測發現,在株系OE3和OE4花瓣中的轉錄水平要遠高于野生型株系(圖7-D),且其表達量與花青素含量相一致,說明的過量表達促進了煙草花瓣的花青素生物合成。另外,CHS同時也是植物黃酮醇合成途徑上游編碼酶基因,其上調表達可能影響黃酮醇的累積,因此對轉基因煙草花瓣的黃酮含量進行測定(圖7-E)。結果顯示,在上述兩個過表達株系中,雖然OE3的花瓣顏色比對照加深更明顯,但其黃酮醇含量與野生型對照沒有顯著差異,而株系OE4卻比對照提高了39.1%(<0.05)。

AgCHS1:藤茶Ampelopsis grossedentata;VvCHS:葡萄Vitis vinifera NP_001267879.1;GhCHS1:陸地棉Gossypium hirsutum CV72638;OsCHS:水稻Oryza sativa CAA61955.1;AtCHS:擬南芥Arabidopsis thaliana AAA32771.1;NtCHS:煙草Nicotiana tabacum ANA78328.1。▲:Cys-His-Asn三聯活性中心;★:表示苯丙氨酸殘基Phe215和Phe265;方框為CHS高度保守特征序列,下劃線為丙二酰CoA結合位點▲: Cys-His-Asn triple active center; ★: phenylalanine residues Phe215 and Phe265; the highly conserved CHS signature sequence are boxed with black line; the malonyl-CoA binding site are underlined

圖3 AgCHS1與其他植物CHS蛋白的系統進化樹分析

不同字母表示在P<0.05水平差異顯著。下同Different letters indicate statistical difference (P<0.05). The same as below
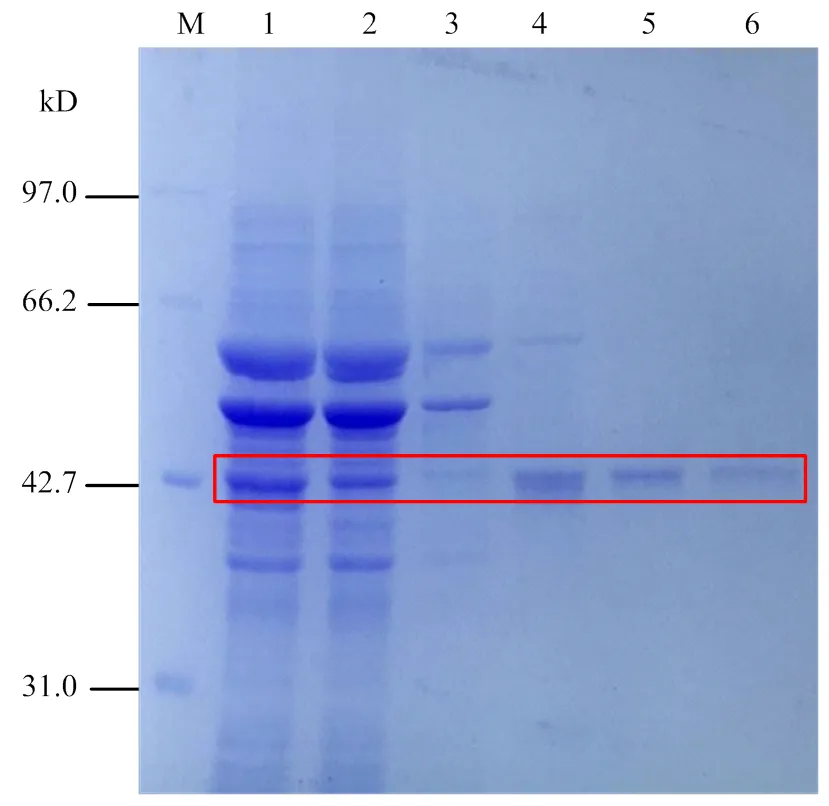
M:蛋白Marker;1:離心后的裂解液上清;2:裂解液上清經過Ni柱的流穿;3:Binding buffer洗脫;4:Binding buffer + 60 mmol?L-1咪唑洗脫;5:Binding buffer + 90 mmol?L-1咪唑洗脫;5:Binding buffer + 250 mmol?L-1咪唑洗脫
3 討論
CHS是高等植物中分布最廣泛的類型III PKS,具有相對保守的基因結構和較高的序列相似性[31-32]。本研究根據藤茶葉片轉錄組測序結果設計引物,克隆獲得,與多數物種的大小基本一致[8-14]。目前報道的多數植物序列只含有1個內含子,但也有少數例外,比如金魚草含有2個內含子[17],紫丁香沒有內含子[29],而在小立碗蘚(Physcomitrella patens)基因家族的14個成員中,存在外顯子-內含子的多種組合類型[33]。本研究克隆的藤茶基只含有1個內含子,這與多數報道[8,13-14,32]的植物結構相類似。序列多重比對發現,AgCHS1包含查爾酮合成酶家族的特征序列以及高度保守的活性氨基酸殘基,與葡萄、水稻、擬南芥、煙草等常見植物的CHS氨基酸序列有較高的相似性(82.2%—96.7%),證實屬于結構保守型CHS基因。另外,AgCHS1與付明等[23]報道的藤茶CHS上存在一定的序列差異,但它們的特征性保守位點基本相同(結果未列),據此判斷它們屬于藤茶CHS家族的不同成員,可能在藤茶類黃酮生物合成過程中發揮相似的作用。以上這些結果說明在序列上與其他植物的有諸多相似之處,屬于典型的查爾酮合成酶家族基因。

CHS的體外酶活性于1972年首次在歐芹懸浮細胞培養物中被檢測到[34]。本研究通過原核表達重組蛋白的方法,對AgCHS1重組蛋白的體外酶活特性進行了分析,發現該重組蛋白可以催化對-香豆酰輔酶A與丙二酰輔酶A的縮合反應,形成柚皮素,說明AgCHS1具有查爾酮合成酶的活性。值得注意的是,酶促產物除了主產物柚皮素之外,還存在少量的副產物(圖6-A),類似的情況也出現在小立碗蘚[35]、地錢[36]等植物CHS的體外酶促反應中,推測該副產物可能是CHS酶促反應早期的脫軌產物Bisnoryangonin(BNY)或4-Coumaroyltriaceticacid lactone(CTAL)[37],有待于進一步鑒定。另據報道,CHS起始底物較為寬泛,但對脂肪族酰基輔酶A和芳香族酰基輔酶A具有明顯偏好性[14,38]。例如,對小立碗蘚PpCHS的體外活性分析表明,該酶的底物除了對-香豆酰輔酶A外,還可以是肉桂酰輔酶A或二氫香豆酰輔酶A,但在這些底物中,PpCHS更偏好對-香豆酰輔酶A[35]。同樣,黃芩CHS的底物特異性分析也表明,CHS可以同時接受苯甲酰輔酶A、苯乙酰輔酶A、異戊基輔酶A和異丁酰輔酶A等芳香族和脂肪族酰基輔酶A,生成多種反應產物[38]。鑒于上述這些發現,需要進一步研究對不同底物的催化效率,以明確其體內的生理作用底物。

A:轉基因煙草的PCR鑒定;B:花瓣表型;C:花瓣表達量;D:花瓣相對花青素含量;E:花瓣的相對黃酮醇含量
M:DL1000 DNA標準分子量;P:質粒對照,WT:野生型;OE1—OE5:轉基因株系。不同字母表示在<0.05水平差異顯著
A: PCR identification of transgenic tobacco; B: Petal phenotypes; C:expression in petal; D: Relative anthocyanin content; E: Relative flavonol content; M: DNA marker DL1000; P: Plasmid control; WT: Wild type; OE1-5: different transgenic lines. Different letters indicate statistical difference (<0.05)
圖7 過量表達對煙草花色、花青素和黃酮醇含量的影響
Fig. 7 Efects of overexpressionon the color, anthocyanin and flavonol content of tobacco
黃酮類物質與植物花色關系密切[39],作為類黃酮合成途徑的上游編碼酶基因,其基因表達量的增加或減少都可能導致植物花色的變化。在矮牽牛中過量表達小蒼蘭,可顯著增加黃酮醇和花青苷的含量,并使花瓣由原來的白色變為粉紅色[14]。在煙草中過量表達紫丁香,可使花瓣顏色明顯加深,花青素含量提高50%以上[29]。相反地,抑制煙草[19]、大麗花[40-41]和三環草[42]等植物中的表達,可導致花青素含量降低,花色隨之變淡或出現完全白色的花。本研究將轉入野生型煙草中過表達,結果顯示轉基因植株花瓣顏色由淡紫色變成紫紅色,花青素含量也相應的增加,此結果與前人報道的結果基本一致。值得注意的是,在本研究獲得的2個煙草過表達轉基因株系中,株系OE3花青素含量的增加幅度大于株系OE4,但其黃酮醇含量卻沒有增加,而株系OE4卻提高了39.1%,這可能與黃酮醇和花青素合成調控方式較為復雜有關。黃酮醇和花青素處于類黃酮合成途徑不同的代謝分支,它們的合成除了受上游CHS、F3H等酶的影響,還與下游DFR和FLS兩種酶對分支點中間產物二氫黃酮醇的競爭有關[43]。
4 結論
從藤茶克隆到查爾酮合成酶基因,該基因編碼蛋白具有典型的CHS家族蛋白保守結構域,在體外能夠催化對-香豆酰輔酶A生成柚皮素,過量表達該基因可以提高煙草的花青素和黃酮醇的含量,說明可能在藤茶類黃酮的生物合成中發揮重要作用。
[1] FAN L, TONG Q, DONG W W, YANG G J, HOU X L, XIONG W, SHI C Y, FANG J G, WANG W Q. Tissue distribution, excretion, and metabolic profile of dihydromyricetin, a flavonoid from Vine Tea () after oral administration in rats., 2017, 65(23): 4597-4604.
[2] 何桂霞, 裴剛杜, 方麓, 歐陽文, 李斌. 藤茶化學成分的研究. 中國現代中藥, 2007, 9(12): 11-13.
HE G X, PEI G D, FANG L, OUYANG W, LI B. Studies on chemical constituents of., 2007, 9(12): 11-13.(in Chinese)
[3] 冉京燕, 方建國, 謝雪佳, 熊微, 王文清. 藤茶的本草資源學研究概況. 中草藥, 2016, 47(20): 3728-3735.
RAN J Y, FANG J G, XIE X J, XIONG W, WANG W Q. Scientific research on herbal resource of vine tea., 2016, 47(20): 3728-3735. (in Chinese)
[4] 王元霞, 洪正善, 楊柯, 曾春暉. 藤茶中二氫楊梅素的研究進展. 沈陽藥科大學學報, 2020, 37(6): 569-576.
WANG Y X, HONG Z S, YANG K, ZENG C H. Research progress of dihydromyricetin in., 2020, 37(6): 569-576.(in Chinese).
[5] 王丹丹, 王文清, 施春陽, 熊微, 侯小龍, 方建國. 藤茶中二氫楊梅素含量變異研究進展. 中藥材, 2015, 38(9): 1996-1999.
WANG D D,WANG W Q,SHI C Y,XIONG W, HUO X L, FANG J G. Research progress on variation of dihydromyricetin content in., 2015, 38(9): 1996-1999. (in Chinese)
[6] TOHGE T, DE SOUZA L P, FERNIE A R. Current understanding of the pathways of flavonoid biosynthesis in model and crop plants., 2017, 68(15): 4013-4028.
[7] 包穎, 郭昌鋒, 陳少華, 劉梅. 植物查爾酮合成酶超基因家族的分子進化. 植物學報, 2015, 50(1): 55-71.
BAO Y, GUO C F, CHEN S H, LIU M. Molecular evolution of chalcone synthase gene superfamily in plants., 2015, 50(1): 55-71.(in Chinese)
[8] CHEN S, PAN X H, LI Y T, CUI L J, ZHANG Y C, ZHANG Z M, PAN G T, YANG J, CAO P J, YANG A G. Identification and characterization of chalcone synthase gene family members in., 2017, 36: 374-384.
[9] MA L Q, PANG X B, SENG Y H, PU G B, WANG H H, LEI C Y, WANG H, LI G F, LIU B Y, YE H C. A novel type III polyketide synthase encoded by a three-intron gene from., 2009, 229: 457-469.
[10] YAHYAA M, ALI S, DAVIDOVICH-RIKANATI R, IBDAH M, SHACHTIER A, EYAL Y, LEWINOHN E, IBDAH M. Characterization of three chalcone synthase-like genes from apple (xBorkh.)., 2017, 140: 125-133.
[11] WANG C H, ZHI S, LIU C Y, XU F X, ZHAO A C, WANG X L, TANG X, LI Z G, HUANG P H, YU M D. Isolation and characterization of a novel chalcone synthase gene family from mulberry., 2017, 115: 107-118.
[12] 夏芳, 李厚華, 付春祥, 虞珍珍, 徐彥軍, 趙德修. 水母雪蓮查爾酮合酶基因的克隆、表達及酶活分析. 生物工程學報, 2011, 27(9): 363-370.
XIA F, LI H H, FU C X, YU Z Z, XU Y J, ZHAO D X.Cloning, expression and characterization of chalcone synthase from., 2011, 27(9): 363-370.(in Chinese)
[13] YU H N, WANG L, SUN B, GAO S, CHENG A X, LOU H X. Functional characterization of a chalcone synthase from the liverwort., 2015, 34(2): 233-245.
[14] SUN W, MENG X, LIANG L, JIANG W, HUANG Y, HE J, HU H, ALMQVIST J, GAO X, WANG L. Molecular and biochemical analysis of chalcone synthase from freesia hybrid in flavonoid biosynthetic pathway.. 2015, 10(3):e0119054.
[15] 韓穎穎, 明鳳. 選擇與適應: 蘭科植物查爾酮合酶基因家族成員的分子進化和功能趨異. 中國農業科技導報, 2012, 14(4): 73-80.
HAN Y Y, MING F. Selection and adaptation: Molecular evolution and functional divergence of orchid chalcone synthase gene family members., 2012, 14(4): 73-80. (in Chinese)
[16] HU L F, HE H H, ZHU C L, PENG X S, FU J R, HE X P, CHEN X R, QUYANG L J, BIAN J M, LIU S Q. Genome?wide identification and phylogenetic analysis of the chalcone synthase gene family in rice., 2017, 130: 95-105.
[17] SOMMER H, SAEDLER H. Structure of the chalcone synthase gene of., 1986, 202(3): 429-434.
[18] LI X H, CAO M H, MA W B, JIA C H, LI J H, ZHANG M X, LIU C C. CAO Z Z, FARUQUE M O, HU X B. Annotation of genes involved in high level of dihydromyricetin production in vine tea () by transcriptome analysis., 2020, 20(1): 131.
[19] WANG C K, CHEN P Y, WANG H M, TO K Y. Cosuppression of tobacco chalcone synthase using Petunia chalcone synthase construct results in white flowers., 2006, 47(1): 71-82.
[20] CHEN L J, GUO H M, LIN Y, CHENG H M. Chalcone synthase EaCHS1 fromfunctions in salt stress tolerance in tobacco., 2015, 34(5): 885-894.
[21] WANG C C, FU D Q. Virus-induced gene silencing of the eggplant chalcone synthase gene during fruit ripening modifies epidermal cells and gravitropism., 2018, 66(11): 2623-2629.
[22] 趙學榮, 楊燕, 雒曉鵬, 姚攀鋒, 王安虎, 趙海霞, 吳琦. 苦蕎查爾酮合酶基因FtCHS1啟動子的克隆及分析. 植物科學學報, 2017, 35(4): 543-550.
ZHAO X R, YANG Y, LUO X P, YAO P F, WANG A H, ZHAO H X, WU Q. Cloning and analysis of chalcone synthase gene FtCHS1 promoter inGaertn., 2017, 35(4): 543-550. (in Chinese)
[23] 付明, 魏麟, 余娟, 余小林. 顯齒蛇葡萄查耳酮合成酶基因cDNA克隆及蛋白質序列分析. 中草藥, 2013, 44(1): 85-89.
FU M, WEI L, YU J, YU X L. cDNA cloning and protein sequence analysis of chalcone synthase gene in leaves of.,2013, 44(1): 85-89.(in Chinese)
[24] 許明, 伊恒杰, 郭佳鑫, 唐進蘭, 林世強, 楊志堅, 鄭金貴. 藤茶黃烷酮3-羥化酶基因AgF3H的克隆及表達分析. 西北植物學報, 2020, 40(2): 185-192.
XU M, YI H J, GUO J X, TANG J L, LIN S Q, YANG Z J, ZHENG J G. Cloning and expression analysis of a flavanone 3-hydroxylase gene from., 2020, 40(2): 185-192. (in Chinese)
[25] LIN S Q, BI L J, ZHANG X E. A simplified method for reconstituting activeDNA polymerase Ⅲ., 2011, 2(4): 303-307.
[26] 許明, 伊恒杰, 趙帥, 張玉文, 楊志堅, 鄭金貴. 顯齒蛇葡萄實時熒光定量PCR內參基因的篩選與驗證. 中草藥, 2017, 6(3): 1192-1198.
XU M, YI H J, ZHAO S, ZHANG Y W, YANG Z J, ZHENG J G. Screening and validation of reference genes for quantitative RT-PCR analysis in., 2017, 6(3): 1192-1198. (in Chinese)
[27] NING G G, XIAO X, LV H Y, LI X, ZUO Y, BAO M Z. Shortening tobacco life cycle accelerates functional gene identification in genomic research., 2012, 14(6): 934-943.
[28] 秦亞茹, 張友勝, 張凱, 丁振東, 曾萍, 孔繁晟. 藤茶總黃酮檢測方法的對比研究. 現代食品科技, 2019, 35(12): 302-309.
QIN Y R, ZHANG Y S, ZHANG K, DING Z D, ZENG P, KONG F S. Comparative study of determination methods of total flavonoids in vine tea ()., 2019, 35(12): 302-309. (in Chinese)
[29] WANG Y, DOU Y, WANG R, GUAN X L, HU Z H, ZHENG J. Molecular characterization and functional analysis of chalcone synthase fromLindl. in the flavonoid biosynthetic pathway., 2017, 635: 16-23.
[30] TIRUMALAI V, SWETHA C, NAIR A, PANDIT A, SHIVAPRASAD P V. miR828 and miR858 regulate VvMYB114 to promote anthocyanin and flavonol accumulation in grapes., 2019, 70(18): 4775-4791.
[31] 馬蘭青, 師光祿, 葉和春, 劉本葉, 王有年. 植物類型Ⅲ聚酮合酶超家族基因結構、功能及代謝產物. 生物工程學報, 2010, 26(11): 1482-1492.
MA L Q, SHI G L, YE H C, LIU B Y, WANG Y N. Plant-specific type III polyketide synthase superfamily:gene structure, function and metabolistes., 2010, 26(11): 1482-1492. (in Chinese)
[32] 張麗群, 韋康, 王麗鴛, 成浩, 劉本英, 龔武云. 茶樹CHS基因結構及編碼區單核苷酸多態性分析. 中國農業科學, 2014, 47(1): 133-144.
ZHANG L Q, WEI K, WANG L Y, CHENG H, LIU B Y, GONG W Y. The structure and single nucleotide polymorphism analysis of chalcone synthase genes in tea plant ()., 2014, 47(1): 133-144. (in Chinese)
[33] KODURI P H, GORDON G S, BARKER E I, COLPITTS C C, ASHTON N W, SUH D Y. Genome-wide analysis of the chalcone synthase superfamily genes of., 2010, 72(3): 247-263.
[34] KREUZALER F, HAHLBROCK K. Enzymatic synthesis of aromatic compounds in higher plants:formation of naringenin (5,7,4’- trihydroxyflavanone) from-coumaroyl coenzyme A and malonyl coenzyme A., 1972, 28(1): 69-72.
[35] JIANG C G, SCHOMMER C K, KIM S Y, SUH D Y. Cloning and characterization of chalcone synthase from the moss,., 2006, 67(23): 2531-2540.
[36] YU H N, LIU X Y, GAO S, SUN B, ZHENG H B, JI M, CHENG A X, LOU H X. Structural and biochemical characterization of the plant type III polyketide synthases of the liverwort., 2018, 125: 95-105.
[37] WAKI T, MAMEDA R, NAKANO T, YAMADA S, TERASHITA M, ITO K, TENMA N, LI Y B, FUJINO N, UNO K, YAMASHITA S, AOKI Y, DENESSIOUK K, KAWAI Y, SUGAWARA S, SAITO K, YONEKURA-SAKAKIBARA K, MORITA Y, HOSHINO A, TAKAHASHI S, NAKAYAMA T. A conserved strategy of chalcone isomerase-like protein to rectify promiscuous chalcone synthase specificity., 2020, 11(1): 870.
[38] MORITA H, TAKAHASHI Y, NOGUCHI H, ABE I. Enzymatic formation of unnatural aromatic polyketides by chalcone synthase., 2000, 279(1): 190-195.
[39] 李辛雷, 殷恒福, 范正琪, 李紀元. 山茶芽變花色與花青苷的關系. 中國農業科學, 2019, 52(11): 1961-1969.
LI X L, YIN H F, FAN Z Q, LI J Y. The relationship between anthocyanins and flower colors of bud mutation in., 2019, 52(11): 1961-1969. (in Chinese)
[40] OHNO S, HOSOKAWA M, KOJIMA M, KITAMURA Y, HOSHINO A, TATSUZAWA F, DOI M, YAZAWA S. Simultaneous post- transcriptional gene silencing of two different chalcone synthase genes resulting in pure white flowers in the octoploid dahlia., 2011, 234: 945-958.
[41] OHNO S, HORI W, HOSOKAWA M, TATSUZAWA F, DOI M. Post-transcriptional silencing of chalcone synthase is involved in phenotypic lability in petals and leaves of bicolor dahlia () ‘Yuino’., 2018, 247: 413-428.
[42] KAMIISHI Y, OTANI M, TAKAGI H, HAN D, MORI S, TATSUZAWA F, OKUHARA H, KOBAYASHI H, NAKANO M. Flower color alteration in the liliaceous ornamental, sp. by RNA interference-mediated suppression of the chalcone synthase gene., 2012, 30(2): 671-680.
[43] YUAN Y W, REBOCHO A B, SAGAWA J M, STANLEY L E, BRADSHAW, H D. Competition between anthocyanin and flavonol biosynthesis produces spatial pattern variation of floral pigments betweenspecies.of, 2016, 113: 2448-2453.
Cloning and Function Characterization of Chalcone Synthase Gene
XU Ming, LIN ShiQiang, NI DongXin, YI HenJie, LIU JiangHong, YANG ZhiJian, ZHENG JinGui
(College of Agriculture, Fujian Agriculture and Forestry University/Key Laboratory of Crop Biotechnology in Fujian Province University/Key Laboratory of Ministry of Education for Genetics, Breeding and Multiple Utilization of Crops, Fuzhou 350002)
【】Chalcone synthase(CHS) is the first key enzyme in the biosynthesis of plant flavonoids. In this study, thewascloned from, the gene sequence and tissue specific expression were analyzed, and the gene function was characterized viaenzymatic activity assay and transformation of, aiming to provide a theoretical basis for further elucidating the flavonoid accumulation of the. 【】The primers were designed according to the transcriptome ofand the leaf cDNA and genomic DNA were used as templates to amplify thewith PCR. The sequence features were analyzed with bioinformatic methods. The MEGA6 and DNAMAN were used for multiple sequences alignment and phylogenetic tree construction. The AgCHS1 recombinant protein was obtained via prokaryotic expression, and the enzymatic activities of the protein on substrates were assayed by identifying the catalytic products with HPLC-MS. The expression ofAgCHS1 in different organs was quantified by qRT-PCR, and the content of total flavonoids was determined by Al(NO)colorimetric method. The overexpression vector was constructed and transformed to N. tabacumby using the leaf disk method. The transgenic plants were screened and the contents of anthocyanin and flavonol in the petal of T2strain were measured.【】The ORF ofhad a length of 1 182 bp and encoded 393 amino acids. The genomic DNA spanned 1 315 bp, containing 2 exons and 1 intron. The bioinformatic analysis showed that AgCHS1 was a stable hydrophilic protein. The results of sequence alignments indicated that the AgCHS1 possessed the signature sequence and enzymatic site residues of the chalcone synthase gene superfamily, including the binding site of malonyl-CoA and triple active center, which share a high similarity with the CHS proteins of other species. The phylogenetic analysis showed that AgCHS1 had a close relationship with and was in the same clade with the CHSs ofand. The results of fluorescent qPCR showed thatexpressed highest in the mature leaf and the flower, and lowest in the old leaf. There was a positive correlation between the expression level ofgene and the content of total flavonoids in different organs of. Theenzymatic analysis showed that the recombinant AgCHS1 was able to catalyze the substrates-coumaroyl-CoA and CoA malonyl-CoA to produce naringenin, demonstrating the activity of chalcone synthase. 5 transgeniclines were obtained, 2 of which showed a significant deeper leaf color. The anthocyanin contented of the transgenic lines OE3 and OE4 increased by 56.6% and 25.3%, respectively, compared to the control. The flavonol content of line OE3 showed no significant difference, which of the line OE4 were increased by 39.1%.【】The AgCHS1 was the key enzyme in the flavonoid biosynthesis of, and the overexpression ofincreased the contents of anthocyanin and flavonol in transgenic plants.
; chalcone synthetase; enzyme activity; anthocyanin; flavonol

10.3864/j.issn.0578-1752.2020.24.012
2020-05-14;
2020-07-15
國家科技支撐計劃(2013BAD01B05)、福建農林大學科技創新專項基金(KFA17424A)
許明,Tel:0591-83789231;E-mail:xmfau@163.com。通信作者鄭金貴,Tel:0591-83789231;E-mail:jgzheng@fafu.edu.cn
(責任編輯 趙伶俐)

