柚籽非脂溶性抗氧化成分提取及鑒定
丘苑新,楊靜嫻,馬路凱,何娣
(仲愷農業工程學院 輕工食品學院,廣東 廣州, 510225)
柚子中柚籽約占整果重的10.3%[1],一直以來,中醫上都會利用柚籽來輔助治療疝氣、肺寒咳嗽、發黃、乳腺增生等癥狀[2]。柚籽作為采后處理加工環節的主要副產物,由于其苦味,目前僅有少量用作中醫藥材原料,絕大部分被丟棄。其本身所具有的保健、藥用和經濟價值尚未引起足夠的重視。
柚籽提取物的黃酮、類檸檬苦素、多糖等抗氧化成分及活性的相關研究甚少,絕大部分的研究集中在柚子果肉和果皮中。陽梅芳等[3]、莊遠紅等[4]研究了柚子中黃酮和總酚的含量,發現不同部位黃酮和總酚的分布差異大,而柚籽中總體上偏低,正是由于柚籽中活性成分的含量較低,因此對柚籽的研究較多的集中在柚籽油中,柚籽油中含有多種不飽和脂肪酸,但提取完柚籽油后的籽粕利用率很低,周強[5]研究了柚皮和柚籽中的活性成分,并僅對柚籽中類檸檬苦素進行了結構鑒定;金海莉等[6]研究了葡萄柚籽提取物對黃牛肉保鮮效果,SAVKIN發現添加了葡萄柚籽提取物的黃牛肉保鮮期延長了2~4 d,說明柚類籽提取物的開發具有一定的應用價值。因此,本研究以梅縣金柚的柚籽為原料,通過提取和萃取,獲得其不同極性溶劑的分步萃取物,測定不同極性溶劑萃取物的氧化能力和還原能力,利用超高壓液相-高分辨質譜聯用(ultra high performance loquid chromatography-mass spectrometry,UHPLC-MS)技術快速分析萃取物中有效萃取物的化學成分,以期為開發利用柚籽資源提供一定的技術依據,為開發先導藥物提供原料,有效促進柚子產業的健康、可持續發展。
1 材料與方法
1.1 材料與試劑
柚籽,梅州市客家土特產提供;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2′-聯氮-雙-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) ,ABTS]、水楊酸、VC,上海源葉生物科技公司;Na2HPO4、NaH2PO4、鐵氰化鉀、三氯乙酸、FeCl3、FeSO4、H2O2、過硫酸鉀、HCl、無水乙醇、石油醚、二氯甲烷、乙酸乙酯、正丁醇,廣州特一生物科技有限公司,以上試劑均為分析純;乙腈、甲酸,麥克林公司,均為色譜級;對照品柚皮苷、檸檬苦素、黃柏酮、香豆素、阿魏酸(純度≥98%),成都曼思特生物科技有限公司。
1.2 儀器與設備
TU-1900雙光束紫外可見分光光度計,天津凱爾曼豐科技有限公司;Infinite?200 PRO酶標儀,深圳市恩科生物科技有限公司;超高效液相色譜儀,Q-Exactive 型質譜儀,美國賽默飛公司。
1.3 試驗方法
1.3.1 柚籽不同極性溶劑分步萃取物的制備
取干燥的柚籽粉碎,經亞臨界設備除油,用70%乙醇、料液比1∶20(g∶mL)、水浴溫度50 ℃條件下提取6 h,得到乙醇浸膏。取柚籽乙醇提取浸膏,用石油醚、氯仿、乙酸乙酯和正丁醇分步萃取,濃縮凍干得到固體粉末,備用。
1.3.2 柚籽乙醇粗提物及其溶劑萃取物抗氧化活性研究
1.3.2.1 DPPH自由基清除能力測定
參照ZHAO等[7]的方法并作適當的修改。以VC為陽性對照,取20 μL不同濃度的樣品和VC于96孔板中,再加入180 μL濃度為150 μmol/mL的 DPPH溶液測定的吸光度值為A1;以蒸餾水為空白此時吸光度值為A0,以20 μL蒸餾水+150 μmol/mL DPPH溶液(180 μL)為對照,吸光度值為A2,用酶標儀在517 nm處測定吸光值。清除率計算如公式(1)所示:
(1)
1.3.2.2 ABTS自由基清除能力測定
參照SAVIKIN等[8]的方法并作適當的修改。取0.4 mL不同濃度的樣品溶液于玻璃試管中,加入3 mL ABTS工作液,室溫下避光反應30 min,于732 nm處測定吸光值A1,無水乙醇代替ABTS工作液扣除樣品溶液的本底吸收,吸收值為A2,用相同體積的樣品溶劑代替樣品溶液作為對照,吸光值為A0,用VC作為陽性對照,清除率計算如公式(2)所示:
(2)
1.3.2.3 羥自由基清除能力測定
參照ZHAO等[7]的方法并作適當的修改。各測定管中依次加入1 mL的9 mmol/L FeSO4溶液,1 mL的9 mmol/L水楊酸-乙醇溶液,1 mL不同濃度的待測樣品溶液,1 mL 0.03%(體積分數)H2O2。混勻后,37 ℃水浴加熱15 min后取出,在510 nm測不同樣品的吸光值,以VC為陽性對照Ax,設空白對照A0。以蒸餾水代替水楊酸-乙醇為樣品本底Ay,清除率計算如公式(3)所示:
(3)
1.3.2.4 總還原能力測定
參照ZHAO等[7]的方法并作適當的修改。在10 mL離心管中依次加入1 mL不同濃度的樣品溶液、2.5 mL 0.2 mol/L的PBS緩沖溶液(pH=6.6)和2.5 mL 10 g/L鐵氰化鉀溶液,50 ℃水浴20 min,向混合液中加入2.5 mL 100 g/L TCA,充分混勻,離心10 min。取上清液2.5 mL,再依次加入2.5 mL蒸餾水和0.5 mL 0.1%的FeCl3溶液,室溫下反應10 min測定吸光度值A1,以蒸餾水為空白測定吸光度值A0,在700 nm處測定其吸光值,其總還原力計算如公式(4)所示:
A總還原力=A1-A0
(4)
1.3.3 柚籽乙酸乙酯部位化學成分分析
UHPLC條件:色譜柱Zorbax Eclipse C18(1.8 μm×2.1 mm×100 mm);以0.1%(體積分數)甲酸水溶液為流動相A,以乙腈為流動相B;梯度洗脫:0.0~2.0 min,5% B,2.0~6.0 min,5%~30% B,6.0~7.0 min,30% B,7.0~12.0 min,30%~78% B,12.0~14.0 min,78% B,14.0~17.0 min,78%~95% B,20~21 min,95%~5% B,21~25 min,5% B,流速0.3 mL/min,自動進樣器溫度4 ℃,色譜柱溫度30 ℃。
質譜條件:電噴霧離子源(ESI),選擇正、負離子模式同時檢測,離子源噴霧電壓3.5 kV;鞘氣流速45 arb;輔助氣流速15 arb;離子傳輸管溫度330 ℃。掃描方式為一級掃描與數據依賴性二級質譜掃描(Full Scan/dd-MS2),一級分辨率120 000,二級分辨率60 000,掃描范圍(m/z)100~1 500。
1.3.4 對照品溶液的制備
分別精確稱取柚皮苷、黃柏酮、檸檬苦素、阿魏酸、香豆素對照品適量,用乙腈溶解定容至10 mL,經0.22 μm濾膜過濾。
1.4 數據分析
所有數據均平行測定3次。用SPSS 25軟件對所有數據進行方差分析(ANOVA)。利用鄧肯多重比較法對數據進行顯著性分析。利用Compound Discoverer 3.1數據分析系統進行分析。根據二級質譜信息利用Thermo mzCloud在線數據庫, Thermo mzValut本地數據庫等對物質鑒定。

表1 柚籽不同極性溶劑分步提取物對DPPH自由基的清除能力Table 1 DPPH free radical scavenging activity of different polar solvent separate-step extracts from pomelo seed at different concentrations
2 結果與分析
2.1 柚籽不同極性溶劑萃取物抗氧化活性評價
2.1.1 柚籽不同極性溶劑萃取物對DPPH自由基清除能力
由表1可知,柚籽不同極性溶劑不同質量濃度的萃取物對DPPH自由基的清除效果存在顯著性差異(P<0.05),且相同質量濃度的不同提取物之間也存在顯著性差異(P<0.05)。其中乙酸乙酯萃取物對DPPH自由基的清除率隨質量濃度的增加可見明顯的趨勢,在質量濃度為0.8 mg/mL時清除率為(72.73±0.31)%,其IC50值為0.21 mg/mL,與其他極性萃取物存在顯著性差異(P<0.05),但其清除率效果與陽性對照(VC)比較相對較弱。清除效果最差的為石油醚萃取物,且隨著質量濃度的增加其清除率增加較慢。其DPPH自由基清除能力順序為:VC(IC500.04 mg/mL)>乙酸乙酯(IC500.21 mg/mL)>正丁醇(IC500.34 mg/mL)>70%(體積分數)乙醇(IC500.48 mg/mL)>水(IC501.47 mg/mL)>二氯甲烷(IC501.50 mg/mL)>石油醚(IC504.24 mg/mL)。
2.1.2 柚籽不同極性溶劑萃取物對ABTS自由基清除能力
由表2可知,柚籽不同極性溶劑萃取物及VC陽性對照品對ABTS自由基均具有較強的清除作用。當質量濃度為0.05 mg/mL時,VC陽性對照品的清除率為(86.08±0.71)%,與其他萃取物存在顯著性差異(P<0.05),但隨著質量濃度的增加,其清除率增加相對較快,在質量濃度為0.6 mg/mL時,乙酸乙酯萃取物的清除率為(97.11±0.20)%和VC陽性對照(98.13±0.12)%無顯著差異(P>0.05),且其質量濃度在0.4、0.6和0.8 mg/mL時的清除率無明顯差異(P>0.05)。石油醚萃取物對ABTS自由基的清除效果最弱,在質量濃度為0.05 mg/mL時清除率僅為(10.30±0.36)%。其ABTS自由基清除能力的大小順序為:VC(IC500.00 mg/mL)>乙酸乙酯(IC500.03 mg/mL)>正丁醇(IC500.04 mg/mL)>70%(體積分數)乙醇(IC500.06 mg/mL)>二氯甲烷(IC500.13 mg/mL)>水(IC500.21 mg/mL)>石油醚(IC501.08 mg/mL)。

表2 柚籽不同極性溶劑萃取物對ABTS自由基的清除能力Table 2 ABTS free radical scavenging activity of different polar solvent separate-step extracts from pomelo seed at different concentrations
2.1.3 柚籽不同極性溶劑分步提取物對羥自由清除能力
由表3可知,柚籽不同極性溶劑萃取物及VC陽性對照品對羥自由基的清除均有一定的效果。其中VC陽性對照對羥自由基的清除率最高,在質量濃度達到0.8 mg/mL時,其清除率達到(97.44±0.31)%,IC50值為0.12 mg/mL。6組極性溶劑萃取物清除羥自由基的能力均低于VC,且存在顯著差異(P<0.05),且質量濃度在0.05~0.4 mg/mL時,其清除率均<50%,隨著質量濃度的增加,其清除率增加相對較慢,其中70%(體積分數)乙醇提取物和乙酸乙酯萃取物的清除效果顯著高于其他4組(P<0.05),當質量濃度為0.8 mg/mL時,其清除率分別為(54.33±0.89)%和(55.75±0.14)%。其對羥自由基清除能力的大小順序為:VC(IC500.12 mg/mL)>乙酸乙酯(IC500.60 mg/mL)>70%(體積分數)乙醇(IC500.66 mg/mL)>正丁醇(IC500.95 mg/mL)>二氯甲烷(IC501.74 mg/mL)>石油醚(IC502.12 mg/mL)>水(IC502.79 mg/mL)。
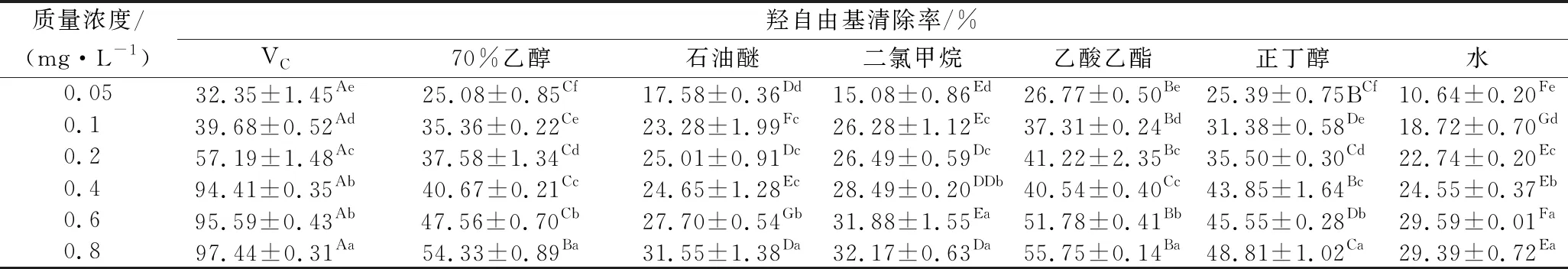
表3 柚籽不同極性溶劑萃取物對羥自由基的清除能力Table 3 Hydroxyl free radical scavenging activity of different polar solvent separate-step extracts from pomelo seed at different concentrations
2.1.4 柚籽不同極性溶劑萃取物總還原能力
由表4可知,柚籽不同極性溶劑萃取物的總還原能力與VC陽性對照相比較差,其中VC陽性對照品的質量濃度在0.4~0.8 mg/mL時,其還原能力已無顯著差異(P>0.05),但柚籽不同極性溶劑萃取物的還原能力與濃度明顯存在一定的量效關系,且不同極性溶劑萃取物的還原能力差異顯著(P<0.05)。其中乙酸乙酯萃取物的還原能力相對較好,當質量濃度在0.8 mg/mL時,其還原能力為0.936±0.011,但其還原能力還是遠低于VC陽性對照品。水萃取物的還原能力最差,在質量濃度為0.8 mg/mL時,其還原力僅為(0.193±0.005)。其還原能力的大小順序為:VC(IC500.02 mg/mL)>乙酸乙酯(IC500.38 mg/mL)>70%(體積分數)乙醇(IC500.50 mg/mL)>正丁醇(IC500.60 mg/mL)>石油醚(IC500.89 mg/mL)>二氯甲烷(IC500.96 mg/mL)>水(IC502.37 mg/mL)。

表4 柚籽不同極性溶劑萃取物的總還原力Table 4 Reducing power of different polar solvent separate-step extracts from pomelo seed at different concentrations
2.2 柚籽乙酸乙酯萃取物化學組成
對抗氧化結果分析,乙酸乙酯萃取部位的抗氧化性優于其他5組,故針對乙酸乙酯萃取物進行UHPLC-MS分析。在正、負離子檢測模式下,獲得樣品的總離子流圖,共鑒定出33種化合物,其中5種化合物經與對照品比對確認,見圖1,化學鑒定結果如表5所示。
2.3 化合物結構鑒定
根據結構鑒定表可知,乙酸乙酯萃取物含有較豐富的黃酮及其苷類、酚類等化合物,此類物質具有較強的抗氧化效果[9-10],對部分化合物進行二級質譜裂解途徑分析。其中,黃酮類化合物在植物體內大部分與糖結合,形成苷類或以碳糖基的形式存在,部分以游離的形式存在。其質譜裂解規律主要是失去CO、CO2、C2H2O、H2O 等中性離子,易發生逆狄爾斯-阿爾德(Diels-Alder reaction,RDA)裂解[11]。以山奈酚為例,山奈酚保留時間為7.103 min,在正離子模式下準分子離子峰為m/z287.054 66[M+H]+,推測其元素組成為C15H10O6。其可能的裂解途徑見圖2,準分子離子峰首先裂解失去中性離子CO,再分別失去C6H6O碎片基團和H2O分子,形成m/z241.049 06[M+H-CO-H2O]+和m/z165.018 26[M+H-CO-C6H6O]+碎片離子,同時,準分子離子峰先后失去C4H4O4碎片基團和H2O分子,產生m/z153.018 25[M+H-C4H4O4-H2O]+碎片離子,隨后m/z153.018 25發生RDA裂解,經過數據庫檢索及結合文獻[12-13]報道,主要的碎片離子峰與山奈酚的裂解規律一致,可以推測該化合物為山奈酚。

A-乙酸乙酯萃取物;B-對照品圖1 正離子模式總離子流圖Fig.1 Total ion chromatogram in positive mode注:圖中編號物質與表5一致

表5 柚籽乙酸乙酯部位化學成分鑒定表Table 5 Identification of chemical constituents in ethyl acetate fraction of pomelo seed

續表5

圖2 山奈酚可能的裂解途徑Fig.2 Possible fragmentation pathways of kaempferol


圖3 檸檬苦素可能的裂解途徑Fig.3 Possible fragmentation pathways of limonin
酚類化合物的裂解規律主要是丟失H2O、HCOOH、CO2等中性分子[16-17]。以阿魏酸為例推測其可能的裂解途徑(圖4),在正離子模式下得到準分子離子m/z195.065 22[M+H]+,保留時間為6.947 min,預測其元素組成為C10H10O4。準分子離子峰發生裂解,失去H2O分子,形成m/z177.054 55[M+H-H2O]+碎片基團;或失去1分子CH3OH形成碎片m/z163.038 93[M+H-CH3OH]+,繼而再失去1分子H2O,形成碎片m/z145.028 37[M+H-CH3OH-H2O]+碎片基團;準分子離子峰裂解或還以失去一分子HCOOH形成碎片m/z149.059 69[M+H-HCOOH]+,再失去1分子CH3OH碎片基團,形成m/z117.033 69[M+H-HCOOOH-CH3OH]+碎片基團。經過數據庫檢索及結合文獻報道[15],主要碎片離子峰與檸檬苦素的裂解規律一致,可以推測該化合物為阿魏酸。

圖4 阿魏酸可能的裂解途徑Fig.4 Possible fragmentation pathways of ferulic acid
3 討論
天然抗氧化劑主要來源于黃酮類化合物以及植物酚類[18],從植物中尋找天然的抗氧化劑成為近代科學研究的熱點之一。在本研究中,柚籽的6種極性部位萃取物的抗氧化效果均表現出一定的差異,其中,乙酸乙酯萃取物的抗氧化活性優于其他5組,通過液相色譜-質譜聯用儀進行成分鑒定發現,柚籽中黃酮的種類較豐富,正負離子模式下共鑒定出17種化合物,根據峰面積的大小,計算其在整個柚籽成分中的相對含量為18.152%。進一步證實柚籽中黃酮類化合物的含量較低,分析其原因可能為自然界中黃酮類物質多數以糖苷元的形式存在[9], 柚皮和囊衣層中黃酮含量較高可能是由于柚皮、囊中含有大量的纖維素,黃酮類物質容易與糖類物質結合形成黃酮苷類,因此在柚皮和囊中起到一定的富集作用,而柚籽中的成分主要為粗脂肪和蛋白質,不利于總酚和黃酮類物質的富集。
從乙酸乙酯萃取物共鑒定出4類具有生物活性的化合物,如黃酮及其苷類化合物、酚類化合物、香豆素類及肉桂酸類,據研究,張華等[19]對15種柑橘果皮種的主要物質進行抗氧化比較,其中咖啡酸、阿魏酸表現出較強的抗氧化活性,圣草酚、圣草次苷具有中等的抗氧化活性;王之路[20]對柚皮苷、普魯寧和柚皮素3種物質進行抗氧化比較發現,普魯寧對DPPH自由基具有較好的清除作用,IC50值為(4.09±0.02)mg/mL,柚皮素對ABTS自由基的清除能力較強,IC50值為1.03 mg/mL;已有研究報道[21-24],山奈酚,槲皮素、異鼠李素、諾卡酮、對香豆酸、秦皮乙素等均具有抗氧化活性;本文在柚籽乙酸乙酯萃取物鑒定出的物質中,除包括上述所提到的各種物質外,還有柚皮苷、山奈酚-7-O-葡萄糖苷、檸檬苦素、橙皮素、木犀草素、香豆素等具有生物活性的物質,因此推測柚籽抗氧化活性高的可能原因為各種抗氧化物質協同作用的效果,多種抗氧化功效因子可能通過相互修復再生形成抗氧化還原系統,促進柚籽抗氧化效果的提高。目前國內外對于天然產物中抗氧化成分之間的構效關系、協同作用和拮抗作用等方面仍缺乏系統性的研究,因此柚籽中的各類物質之間的抗氧化活性和相互作用機制還需進一步探討。
本實驗采用UHPLC-MS技術對柚籽成分進行分析,通過質譜數據及已報道的文獻[25],對部分化合物進行裂解分析推測,根據其各自的二級特征碎片離子推測了山奈酚、普魯寧、檸檬苦素及阿魏酸的裂解途徑,黃酮類化合物母核質譜裂解通常發生在碳環上,易丟失CO、CO2、C2H2O、H2O 等中性離子,發生RDA裂解;萜類化合物易丟失H2O、CO、CO2;酚類化合物易丟失H2O、HCOOH、CO2等中性分子。
4 結論
柚籽不同極性溶劑萃取物與VC對照品對ABTS自由基具有較強的清除效果,對DPPH自由基和羥基自由基有一定的清除效果,總還原能力相對較弱。其中,乙酸乙酯萃取物對3種自由基的清除能力和還原能力均優于其他5種提取物,但均低于VC對照品。經UHPLC-MS共鑒定出33種化合物,推測柚籽抗氧化效果顯著的原因可能為多種抗氧化物質的協同作用,各種抗氧化功效因子在體系中產生游離基相互作用生成新的抗氧化物質,使得抗氧化活性增強。本實驗對柚籽提取物中的化合物進行較全面的分析,綜上,柚籽提取物具有較好的抗氧化活性,但仍需進一步闡明組成與其抗氧化性之間的關系,明確柚籽中各組分之間可能存在的協同作用。

