轉BpLTP4煙草耐鹽性分析
石晶靜 郭依萍 于穎 周美琪 王超
(東北林業大學 東北林業大學林木遺傳育種國家重點實驗室,哈爾濱 150040)
植物生長過程中可能會受到多種不良環境的影響,比如高鹽、高溫、干旱、低溫等。高鹽土壤會導致植物生長代謝紊亂,進而影響植物的正常生長發育。白樺(B. platyphyllaSuks.)是一個北溫帶的廣布種,生長迅速,基本密度、木材硬度、白度、纖維形態、化學組分及打漿性能均符合造紙用材的要求,是優良的短周期闊葉紙漿用材樹種,具有全球范圍內的廣闊的發展前景。鑒定白樺耐鹽相關基因,研究其耐鹽機制,利用分子育種手段培育耐鹽白樺新品種,對于困難立地條件下白樺用材林和紙漿材林建設具有重要意義。
高鹽土壤會誘導植物體內特異蛋白過量表達,有研究顯示脂質轉運蛋白(Lipid transfer proteins,LTP)作為植物體內的防御性蛋白在抵抗非生物脅迫中有重要的作用[1]。Kader[2]在研究脂質轉運過程時發現在細胞膜上有蛋白可以轉運磷脂并且與脂肪酸物質特異性結合。因此,將這一蛋白命名為脂質轉運蛋白。LTP是一種小分子堿性可溶蛋白,在可溶性蛋白中占4%[3]。LTP蛋白的二級結構主要由H1、H2和H3和H4四個a-螺旋構成,并形成一個穩定的空間結構[4]。LTP蛋白的三維結構含有一個內嵌的疏水腔,推測疏水腔與磷脂等疏水分子形成復合體從而實現磷脂轉運。鹽害不僅會影響植物體內特定酶活性還會影響植物的代謝途徑。有研究發現鹽脅迫可以直接影響植物細胞的膜脂和膜蛋白,加劇膜脂的氧化程度,增大脂膜的透性,破壞植物細胞膜的完整性,直接導致細胞內的電解質和小分子的有機物滲透,破壞物質交換的平衡[5]。植物會通過改變自身的生理和新陳代謝的途徑來抵抗鹽脅迫對植物細胞膜造成的損傷。因此,研究重點開始集中于膜透性的變化[6]。LTP可以在生物膜之間轉運脂質,因此推測其在植物抗逆過程中起重要的作用[7]。Torres-Schumann等[8]在鹽脅迫處理番茄后發現,脅迫6 h后LTP開始實現誘導表達,脅迫12 h后LTP表達量達到最大值。Rabbani等[9]研究發現高鹽脅迫水稻后可以誘導LTP表達。Jang等[10]研究小麥TaLTP1啟動子發現,在鹽脅迫下LTP顯著上調表達。李誠斌等[11]將巴西旱稻中的OsLTP1通過農桿菌介導法轉化水稻日本晴中并進行耐鹽分析發現,轉基因植物在1.5%的NaCl培養基中的生長能力明顯高于對照株系,說明轉基因水稻較對照株系更具有耐鹽性。劉關君等[12]發現鹽脅迫能夠誘導西伯利亞寥nsLTP在不同組織中表達。擬南芥中存在耐鹽LTP[13],LTP在植物抗鹽的過程中扮演著重要的角色[14]。但目前對于LTP響應鹽脅迫的分子基礎尚不清楚。
本研究利用擬南芥LTP序列與白樺基因組數據庫進行比對,篩選并克隆白樺LTP,研究其序列特征及鹽脅迫響應,并將其轉入煙草,對其耐鹽性進行分析,旨為研究LTP的耐鹽分子調控機制及分子遺傳改良奠定基礎。
1 材料與方法
1.1 材料
提取RNA的材料為野生型白樺組培苗,培養于東北林業大學林木遺傳育種國家重點實驗室組織培養室,溫度為25℃,16 h光照/8 h黑暗,光照強度400 μmol/m2s。將東北林業大學林木遺傳育種國家重點實驗室保存的SR-1煙草(Nicotiana tabacumL.cv.Petit Havana SR-1)種子用1 mL 20%的NaClO清洗;之后用無菌水清洗,將清洗后的種子平鋪于1/2MS固體培養基上,置于組培室中培養2周,將小苗移出到生根培養基中生長20 d用于侵染。大腸桿菌(Escherichia coli)Top10、根瘤農桿菌(Agrobacterium tumefaciens)EHA105菌株、植物表達載體pROKⅡ為東北林業大學林木遺傳育種國家重點實驗室保存。DAB顯色試劑盒(Solarbio,北京);配制NBT染液時需要用pH7.8的1mol/L磷酸緩沖液溶解NBT粉末;Evans Blue染液配制用雙蒸水將Evans Blue的粉末溶解后備用。所有染液每100 mL均需中加入10 μL TritonX-100。
1.2 方法
1.2.1BpLTP4的克隆及表達載體的構建 利用擬南芥數據庫(http://www.arabidopsis.org/)查找耐鹽LTP基因AT5G59310.1,采用同源序列比對的方法,在白樺基因組數據庫(http://birch.genomics.cn/)進行比對分析。將獲得的序列利用NCBI blastX程序對其進行進一步功能注釋。
根據CDS序列設計克隆引物,引物為LTPpROKⅡ-F:5'-CTCTAGAGGATCCCATGGCAAGGTTC GCAGCTTT-3';LTP-pROKⅡ-R:5'-TCGAGCTCGGT ACCCTTACATCATCATCATCATCATCTTGGAACAAT CGGTAG-3'(金唯智,江蘇)。
以白樺組培苗為材料,液氮充分研磨后,用植物總RNA提取試劑盒(Bioteke Corporation)提取白樺的總RNA;利用反轉錄試劑盒(PrimeScriptTM RT reagent Kit)合成第一鏈cDNA。以cDNA為模板通過PCR擴增目標基因。經1%瓊脂糖/EB凝膠電泳檢測后利用膠回收試劑盒進行膠回收(OMEGA)。利用In-Fusion高效連接酶(In-Fusion Advantage PCR Cloning Kit)將BpLTP4片段與pROKⅡ線性載體50℃連接。將重組載體轉入Top10大腸桿菌感受態中,挑取單克隆菌落進行菌液PCR檢驗,將陽性克隆的菌液進行DNA測序驗證(擎科,廣州),測序序列經比對正確后為pROKⅡ-LTP重組載體。
1.2.2BpLTP4的生物信息學分析 利用ExPASy提供的ProtScale對LTP4進行親水性分析;利用TMHMM Server v.2.0預測LTP4的跨膜區域;利用在線軟件SOPMA和SWISS-MODEL分別預測LTP4蛋白的二級結構和三級結構;利用BioEdit軟件對LTP4蛋白進行多序列比對分析;利用MEAG軟件采用 Neighbor-Joining法對LTP4蛋白及查閱相關文獻獲得的其他物種耐鹽LTP基因進行進化樹分析。
1.2.3 鹽脅迫下BpLTP4表達模式分析 利用熒光定量PCR法對鹽脅迫下LTP4進行表達量分析,以4周齡的東北林業大學野生型土培白樺幼苗為試驗材料。用200 mmol/L NaCl澆灌處理幼苗(0、6、12、24和48 h),用植物總RNA提取試劑盒(Bioteke Corporation)提取白樺的總RNA;利用反轉錄試劑盒(PrimeScriptTMRT reagent Kit)合成第一鏈cDNA。根據BpLTP4序列設計定量引物LTP4 F:5'-ATGGCAAGGTTCGCAGCTTT-3',LTP4 R:5'-TATTCGAAGCAGCATCGAGT-3',選擇beta-tubulin和ubiquitin(GenBank Ac. Num.:HO112154和FG065618)作為內參基因[15]。在Bio-Rad Hercules.CA.USA.上完成qRT-PCR反應。用2-ΔΔCT方法進行相對表達量分析[16]。
1.2.4 植物工程菌制備 將測序鑒定成功的BpLTP4-pROKⅡ的大腸桿菌用小劑量質粒提取試劑盒(OMEGA)提取質粒后用液氮法將重組質粒轉入EHA105農桿菌感受態細胞中,均勻涂布于含有25 mg/L Rif和50 mg/L Kana的固體LB培養基上,倒置于28℃的恒溫培養箱中培養2-3 d。挑取單菌落于LB液體培養基(25 mg/L Rif 和 50 mg/L Kana)培養,并做PCR鑒定。
1.2.5 葉盤法轉化煙草 吸取800 μL過夜活化OD600的陽性克隆農桿菌于100 mL LB液體培養基(50 mg/L Kana,50 mg/L GM,50 mg/L Rif)中,28℃震蕩培養菌液的OD600于0.4-0.6。將組培的煙草葉片無菌操作切成2-3 cm的小塊平鋪于1/2MS固體培養基上備用,將菌液4℃離心10 min后用MS液體培養基重懸加入100 μmol/L AS,將切好的葉片置于重懸液中輕搖8 min;取出煙草葉片,濾紙吸去葉片上多余的菌液,置于分化培養基上暗培養2 d;將葉片取出換至選擇培養基中16 h光照/8 h暗培至葉片分化出抗性芽后,將其轉移至生根培養基(50 mg/L Kana)中培養。
1.2.6 轉基因煙草耐鹽功能分析
1.2.6.1 鹽脅迫下發芽率測定 將野生型煙草種子和BpLTP4轉基因煙草種子等量(30±3個)的點在不含NaCl和含有150 mmol/L NaCl的1/2MS固體培養基平板上,培養10-12 d,觀察生長情況,計算煙草種子發芽率。采用SPSS18.0對發芽率進行顯著性差異分析。
1.2.6.2 鹽脅迫下根長性狀分析 將野生型煙草種子和BpLTP4轉基因煙草種子在不含NaCl的培養基上培養10 d后將其分別轉移至含有0和150 mmol/L NaCl的1/2MS固體培養基平板上,培養15 d后,將其平鋪在培養基上測量其根長并進行數據統計分析。采用SPSS18.0對發芽率進行顯著性差異分析。
1.2.6.3 鹽脅迫下組織化學染色分析 將野生型煙草種子和BpLTP4轉基因煙草種子在不含NaCl的培養基上培養10 d后將其轉移至土中繼續培養15 d,而后分別對WT和轉基因植株進行150 mmol/L NaCl澆灌脅迫處理與水澆灌對照處理5 d,分別剪取脅迫處理和對照處理的煙草葉片進行DAB、NBT及Evans blue化學染色。
1.2.7 鹽脅迫下生理生化指標測定 將WT煙草種子和BpLTP4轉基因煙草種子在不含NaCl的培養基上培養10 d后轉移至土中繼續培養15 d,而后分別對WT和轉基因植株進行150 mmol/L NaCl澆灌脅迫處理與水澆灌對照處理35 d,取脅迫處理與對照處理的植株用液氮研磨后測定其POD、SOD活性(建成生物工程研究所試劑盒,南京)。采用SPSS18.0對POD、SOD酶活活性進行顯著性差異分析。
2 結果
2.1 BpLTP4的克隆
在白樺基因組中通過同源序列比對及保守結構域分析篩選LTP。鑒定出一條白樺LTP,該基因CDS全長357 bp,氨基酸序列全長118 aa。將其命名為BpLTP4。利用RT-PCR克隆目的基因獲得長度為357 bp的基因目的片段(圖1)。
2.2 BpLTP4的生物信息學分析
BpLTP4的氨基酸親水性預測值在0.5-2.5之間,為疏水性蛋白。BpLTP4蛋白的潛在跨膜區包含1-30位氨基酸,其中1-6位的氨基酸在膜內,7-29位的氨基酸是跨膜的螺旋結構,第30位后的氨基酸在細胞膜外發揮功能,因此推測BpLTP4存在一個潛在的跨膜區。二級結構預測結果顯示,BpLTP4蛋白主要由α螺旋及不規則卷曲構成,并含有少量的延伸鏈和β轉角;三級結構預測結果顯示,該蛋白由α螺旋、β折疊、β轉角和無規則卷曲相互盤繞、折疊三維構象(圖2)。多序列比對結果顯示BpLTP4蛋白在保守位置帶有8個Cys殘基,是LTP家族基因重要結構[17](圖3)。進化樹分析結果顯示BpLTP4蛋白與耐鹽蛋白ThLTP(ACM78614.1)[18]、TaLTP(EF342573.1)[19]、AtLTP3(AT5G59320.1)和AtLTP4(AT5G59310.1)[13]同源性高,因此,推測BpLTP4具有耐鹽功能(圖4)。
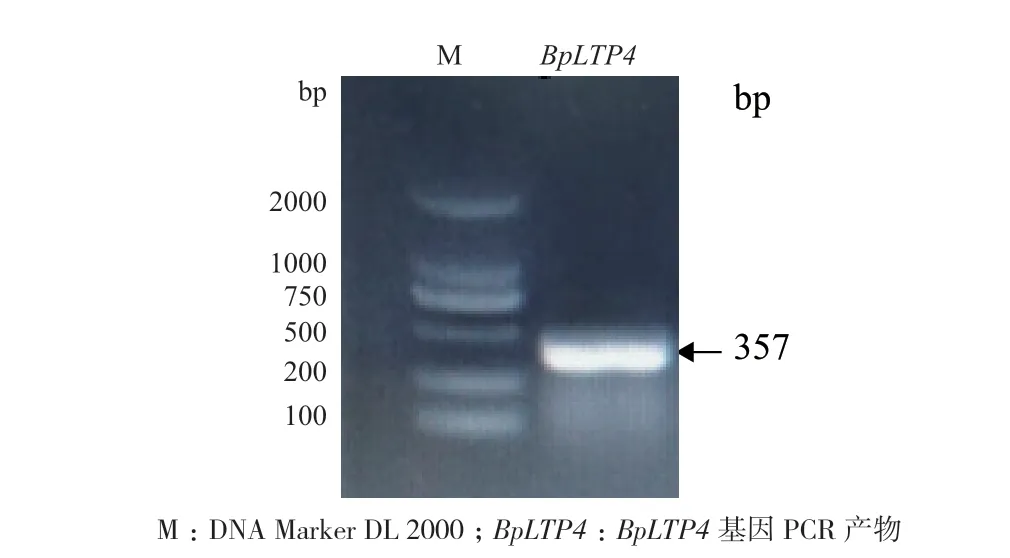
圖1 BpLTP4的PCR擴增

圖2 BpLTP4的生物信息學分析
2.3 鹽脅迫下BpLTP4表達模式分析
利用qRT-PCR定量分析結果(圖5)顯示BpLTP4在脅迫處理6 h,表現出一個低度的下調表達,在12和24 h時隨著脅迫時間變長BpLTP4的表達量開始逐步上升,在脅迫處理48 h時高度誘導表達,說明BpLTP4參與鹽脅迫應答。
2.4 BpLTP4轉基因煙草的鑒定
通過農桿菌階段的葉盤轉化法,獲得CaMV 35S Pronoter驅動BpLTP4表達的轉基因煙草抗性株系。提取轉基因和野生型煙草DNA,用pROKⅡ載體引物對其進行PCR檢測,結果(圖6)顯示BpLTP4成功轉入煙草,獲得3個煙草轉基因株系。
2.5 鹽脅迫下發芽率分析
為分析鹽脅迫條件下轉基因煙草的耐鹽性,首先對其進行NaCl處理下的發芽率分析(圖7),WT和3個轉基因株系在不含NaCl的培養基上種子發芽率為100%,在含有150 mmol/L NaCl的培養基上培養時,發芽率均明顯下降,WT的發芽率僅為11.42%,轉基因株系的發芽率分別為64.7%、54.54%和51.51%,是WT的5.6倍、4.7倍和4.5倍。說明轉基因株系種子較WT耐鹽性高。

圖3 LTP4蛋白與其他LTP抗性基因蛋白序列比對分析

圖4 BpLTP4蛋白與LTP其他耐鹽蛋白系統進化分析

圖5 NaCl脅迫處理后白樺BpLTP4表達量分析

圖6 BpLTP4轉基因煙草DNA分子檢測

圖7 NaCl脅迫處理轉BpLTP4煙草種子發芽情況分析
2.6 鹽脅迫下生長性狀分析
為進一步分析其生長性狀的差異,將脅迫條件下生長至15 d的煙草平鋪在培養基上觀察其生長狀態,測量其根長并進行數據統計分析(圖8),在未脅迫處理條件下,對照和轉基因株系根長及生長性狀差別不明顯。在150 mmol/L NaCl脅迫條件下,WT葉片出現明顯鹽害性狀,葉片變黃,而轉基因株系葉片變色不明顯。轉基因株系根長是WT的1.099倍、1.233倍和1.242倍。說明BpLTP4提高了轉基因株系的耐鹽性。
2.7 鹽脅迫下組織化學染色分析
為進一步分析其提高轉基因煙草耐鹽性的作用機制,剪取脅迫處理和未脅迫處理的煙草葉片進行組織化學染色(圖9),未脅迫處理時的染色情況一致,顏色均淺,脅迫處理后的WT與3個轉基因株系的DAB染色均變深,說明脅迫處理后轉基因煙草的H2O2的積累少于WT。NBT染色情況與DAB染色情況相似,說明轉基因煙草清除O2-的能力較野生型煙草強,轉基因株系更耐鹽。在未脅迫處理時,WT和轉基因株系的細胞完整性未受到影響,幾乎不染色。而脅迫處理后,轉基因株系的染色情況較WT染色淺,說明轉基因株系細胞完整性高于WT。以上結果說明,BpLTP4異源轉化煙草通過清除ROS來提高煙草的耐鹽性。

圖8 NaCl脅迫處理下轉BpLTP4煙草表型分析

圖9 NaCl脅迫下轉BpLTP4煙草組織化學染色分析
2.8 鹽脅迫下生理生化指標測定
取脅迫處理與未脅迫處理的植株經液氮充分研磨后測定過氧化物酶(POD)、超氧化物歧化酶(SOD)活性(圖10)。未脅迫處理時,轉基因株系與WT的POD、SOD活性差異不明顯,在經過150 mmol/L NaCl脅迫處理后,3個轉基因株系的POD活性分別是WT的1.27倍、1.28倍、1.22倍,SOD活性分別是WT的1.26倍、1.28倍、1.22倍。脅迫處理后WT和轉基因株系的POD活性分別是是未脅迫處理的1.18倍、1.38倍、1.33倍、1.39倍。脅迫處理后WT和轉基因株系的SOD活性分別是是未脅迫處理的1.02倍、1.18倍、1.16倍、1.18倍。說明轉基因煙草在受到NaCl脅迫處理后通過提高植物體內POD和SOD保護酶的酶活性來提高轉基因煙草的耐鹽性。

圖10 NaCl脅迫下轉BpLTP4煙草生理指標分析
3 討論
高等植物脂質轉運蛋白是一種分子量為3-9 kD的小分子堿性蛋白[15],占可溶性蛋白的4% 左右。BpLTP4的蛋白分子量為12.31 kD,分子量較棉花[20]、小麥[21]、擬南芥[20]等的LTP家族基因偏大。有研究顯示LTP參與疏水性相互作用,其在細胞壁擴張中起著至關重要的作用[22]。本研究對BpLTP4的親水性預測分析結果也顯示該蛋白為疏水性蛋白。多序列比對結果顯示BpLTP4在保守位置帶有8個Cys殘基是LTP家族基因特有結構。進一步對BpLTP蛋白的三級結構預測結果顯示,該蛋白由α螺旋、β折疊、β轉角和無規則卷曲相互盤繞、折疊三維構象,該蛋白具有通過4對二硫鍵交聯的4個α螺旋構成一個疏水腔結構[23]。進化樹分析發現BpLTP4與其他物種的耐鹽基因具有較高的同源性,因此,推測BpLTP4也具有耐鹽性。Moraes等[24]用150 mmol/L NaCl脅迫處理水稻后,用qRT-PCR進行LTP表達量測定發現LTP7和LTP10參與鹽脅迫應答。為了分析BpLTP4是否參與鹽脅迫應答,本研究利用qRT-PCR分析BpLTP4在鹽脅迫下的表達模式,發現BpLTP4的表達受鹽脅迫誘導,進一步說明其可能參與植物的耐鹽調控。
將基因穩定轉化至模式植物中是研究該基因功能最直接有效的方法,通過研究轉基因植物的性狀或功能的變化來研究該基因的功能[25]。李健[18]將ThLTP轉入山新楊中,用不同濃度NaCI脅迫處理組培苗,統計度量分化率、生長量、生根率、鹽害指數等指標,發現轉ThLTP山新楊株系提高了植株的耐鹽能力。Xu等[26]用高鹽脅迫處理轉NtLTP4煙草進行耐鹽功能分析,通過組織化學染色及生理生化指標測定發現NtLTP4在高鹽條件下不僅抑制了植物體內ROS的產生,而且參與了ROS的清除過程,因此提高了轉基因植株的抗氧化能力。為分析BpLTP4是否能夠提高植物耐鹽性,具有耐鹽功能,本研究將BpLTP4利用農桿菌介導葉盤轉化法轉入煙草,以發芽率、根長、及生理生化指標測定作為耐鹽性的度量指標,對BpLTP4煙草轉基因株系的耐鹽性進行初步分析。發芽率和根長指標均說明BpLTP4能夠提高煙草的耐鹽性。進一步利用DAB、NBT和Evans blue染色來判斷轉BpLTP4基因煙草株系與野生型株系在NaCl脅迫處理后細胞內的H2O2、O2-的積累量和細胞完整性。發現轉基因株系染色情況較WT染色淺,說明在NaCl脅迫處理后轉基因株系H2O2、O2-的積累量較野生型少,NaCl脅迫處理后轉基因株系細胞完整性更好。本研究進而測定了NaCl脅迫處理后的轉BpLTP4煙草株系與野生型株系的POD、SOD酶活活性,結果發現BpLTP4在轉基因煙草中能夠通過提高保護酶活性來清除ROS,從而提高轉基因煙草耐鹽性。
4 結論
克隆獲得BpLTP4,其CDS全長為357 bp。BpLTP4為疏水性蛋白,且存在一個潛在的跨膜區。該蛋白是有α螺旋、β折疊、β轉角和無規則卷曲相互盤繞、折疊成三維構象。具有LTP家族特有的8個Cys殘基結構特點,且與耐鹽基因同源性高。獲得3個BpLTP4過表達煙草轉基因株系。BpLTP4轉基因株系在150 mmol/L NaCl的培養基中發芽率較野生型高;轉基因株系幼苗生長狀態較野生型健康,且根長較野生型長;脅迫處理后的轉基因株系的組織化學染色較野生型淺,POD、SOD活性明顯增高。因此BpLTP4通過提高保護酶活性清除ROS來提高轉基因煙草的耐鹽性,具有一定的耐鹽性。

