惡臭假單胞菌的正丁醇耐受性馴化及比較基因組學分析
肖 琳, 吳安寧, 許國超, 韓瑞枝, 倪 曄*
(1.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫214122;2.江南大學 生物工程學院,江蘇 無錫214122)
惡臭假單胞菌廣泛分布于自然界中,常被用來降解環境中的一些有機溶劑,如對硝基苯酚、水楊酸、烷烴等。劉忠等分離到一株合成L-半胱氨酸的惡臭假單胞菌[1],廣東省農科院土壤肥料研究所解開治等人發現一株能高效降解擬除蟲菊酯的惡臭假單胞菌XP12[2],這在生物農藥領域具有重要應用價值。然而,當有機溶劑含量較高時,菌體本身的存活率就會下降,進而導致生物降解及生物合成的功能受到影響。目前,有關惡臭假單胞菌有機溶劑耐受性元件及改造方面的研究較少[3-4]。作者通過ARTP誘變技術對惡臭假單胞菌進行隨機誘變,在高正丁醇壓力下進行馴化培養,定向篩選高正丁醇耐受性菌株。
ARTP誘變育種[4]是近年來發展起來的一種新型的育種技術,它受到射頻功率的驅動,可以產生等離子射流,進而影響細胞壁和質膜的結構和滲透性,導致DNA損傷,包括錯義突變,缺失或移碼突變[5-8]。由于ARTP技術具有活性粒子濃度高、操作容易、運行成本低廉、安全性好,正突變率高以及對環境無污染等特點[9],在微生物突變育種及生物醫學領域得到廣泛應用。南京工業大學姜岷團隊利用ARTP誘變策略將大腸桿菌AFP111中木糖轉化為琥珀酸代謝途徑的關鍵物質ATP的濃度提高了1.33倍[10];南京農業大學趙耕毛團隊通過ARTP技術培育Arthrobactersp.KQ11突變體,使其葡聚糖酶活性明顯增加[11];成都大學田敏團隊通過ARTP誘變獲得一株達托霉素高產菌株[12]。
基因組重測序是高通量測序的一種重要應用,通過對基因組序列已知的個體進行基因組測序[13],并在個體或者群體水平上進行差異性研究。日本學者Kamada等同時利用第三代測序儀PacBio RS sequencer和第二代測序儀Illumina MiSeq對納豆枯草芽孢桿菌進行高通量測序和比較基因組研究,得到一個更為完整和高質量的全基因組序列,填補了之前對該菌株測序的空白,并發現了330個新的蛋白質編碼序列[14-15];中國農業科學院朱振東團隊通過基因組重測序鑒定候選基因,并為大豆中的新型疫霉菌抗性基因RpsHC18開發診斷標記[16]。以上結果表明,新一代測序是一種精確、快速且經濟有效的研究動植物和微生物多樣性的重要手段。因此,作者通過對ARTP隨機誘變并馴化獲得的高正丁醇耐受性惡臭假單胞菌進行全基因組重測序,根據測序所得的SNV和Indels分布進行KEGG/GO注釋并分析,為進一步研究其溶劑耐受性提供了理論依據。
正丁醇是一種較常見的短鏈醇類有機物,其用途非常廣泛,主要用于生產酯類衍生物,如:鄰苯二甲酸正丁酯、丙烯酸丁酯及醋酸丁酯等;此外,正丁醇還是一種極具潛力的新型生物燃料。目前,已有許多關于丙酮丁醇梭菌、大腸桿菌等微生物菌株正丁醇耐受性的研究報道,而對于惡臭假單胞菌的正丁醇耐受性的研究較少。宋亮[17-18]等通過蛋白質組學研究發現了惡臭假單胞菌中3-羥基異丁酸脫氫酶、異分支酸水解酶超家族、蛋白延伸因子EF-Ts對大腸桿菌有機溶劑耐受性影響較大;錢曉紅[19]等通過構建全局轉錄因子突變庫,最終篩選到兩株高有機溶劑耐受菌;張法[20]等篩選到一株耐受更高正丁醇和環己烷的突變株,并通過基因敲除發現對大腸桿菌有機溶劑耐受性影響較大的兩個基因;司海明[21]等通過基因芯片技術,發現了一系列與大腸桿菌有機溶劑耐受性相關的關鍵基因;吳安寧[22]等從分子伴侶出發,發現secB及其突變體T10A可顯著提高大腸桿菌正丁醇耐受性。作者旨在對馴化獲得的惡臭假單胞菌菌株進行基因組重測序,挖掘與正丁醇耐受性相關的元件,為構建正丁醇耐受性宿主菌提供理論依據。
1 材料與方法
1.1 菌株、培養條件及馴化實驗方法
菌株:P.putida901,作者所在實驗室保藏。培養于固體或液體營養肉湯培養基(胰蛋白胨10 g/L,NaCl 5 g/L,牛肉浸膏3 g/L)中。誘變后的菌株在涂板后用液體營養肉湯培養基從固體平板上洗脫至液體搖瓶(50 mL)中,振蕩培養6 h后加入正丁醇,繼續培養18 h后進行轉接傳代,最后通過計算它們的比生長速率對最終的馴化菌株進行耐受性比較。
1.2 ARTP隨機誘變方法
采用思清源生物科技公司的常壓室溫等離子體誘變系統,實驗中以時間為可變參數,設定功率為100 W[1-4]。P.putida901菌株培養至對數期,用無菌生理鹽水洗滌兩次后稀釋至A600nm為0.5~0.7之間,取10μL該稀釋菌液滴在載片上,涂布均勻,將它們分別暴露在ARTP粒子流下10、15、20、35 s,處理過后的載片轉移至含有1 mL營養肉湯培養基的EP管中于30℃和120 r/min振蕩培養2 h,之后將培養液稀釋102,103,104倍,取50μL涂布于固體平板上(每個稀釋樣品做3次平行涂布),在30℃培養24 h。
1.3 全基因組重測序方案
利用Illumina HiSeq測序平臺進行全基因組重測序,根據制造商所給方案進行二代測序樣品庫的構建,首先將基因組DNA隨機切割成500 bp的小片段,用End Prep Enzyme Mix處理片段進行末端修復,使其在一個反應中同時進行5′磷酸化和dA-加尾,最后通過T-A連接來在兩端添加銜接子。使用AxyPrep Mag PCR Clean-up(Axygen)對銜接子修飾后的DNA片段進行分離純化,從中回收長度約410 bp的片段(具有約350 bp的插入片段)(見表1)。然后使用P5和P7引物對每個樣品擴增8個循環,因為兩個引物都攜帶可以進行橋式PCR的序列,并且P7引物還攜帶堿基標簽,故可以多路復用。使用AxyPrep Mag PCR Clean-up純化PCR產物,通過Agilent 2100生物分析儀對其進行驗證,并通過Qubit2.0熒光計進行定量。然后根據制造商的說明書將具有不同索引的文庫多路復用并加載到Illumina HiSeq儀器上。使用2×150雙端配置進行測序,圖像分析和堿基調用則由HiSeq儀器上的HiSeq控制軟件進行。

表1 測序方案Table 1 The Sequencing protocol
1.4 全基因組重測序數據分析軟件及方法
數據過濾可以去除原始數據中帶有的接頭和低 質 量 的reads, 對 于 所 有 原 始reads, 使 用Cutadapt1.9.1去除銜接子的序列、聚合酶鏈式反應中的引物序列等,使用BWA0.7.12將干凈數據繪制到參考基因組,使用PicardV1.119刪除重復的映射結果,SNV/InDel的注釋則是由Annovar完成,Pindel和CNVnator用于進行基因組結構變異分析。
2 結果與討論
2.1 高正丁醇耐受性突變體的馴化篩選
為篩選高正丁醇耐受性突變體,利用ARTP誘變育種技術對菌株P.putida901進行隨機誘變和正丁醇馴化培養。
首先考察了不同ARTP照射時間與P.putida901致死率的關系曲線(見圖1)。圖中在15 s誘變時間下,致死率為81.7%,10 s誘變時間下致死率為54.3%,均處于合理水平,因此選用10 s和15 s的照射時間進行誘變處理。在進行傳代培養時,正丁醇添加的初始質量濃度為4 g/L,并以質量濃度為0.8 g/L的梯度逐漸增加,每個質量濃度下進行5輪轉接,最終在10 s誘變條件下獲得耐受12 g/L質量濃度的正丁醇的突變株。經驗證發現在9.6 g/L質量濃度的正丁醇下,突變株對正丁醇耐受性提高了約兩倍(見圖2)。對于15 s誘變時間,在正丁醇質量濃度增加到9.6 g/L時突變體正丁醇耐受性效果反而變差,推測可能是由于該條件下突變率和負突變增多,導致致死率增加。隨后,對未經任何馴化的惡臭假單胞菌(WT)、經正丁醇馴化后的惡臭假單胞菌(WTn-butanol)以及經ARTP技術誘變并馴化后的惡臭假單胞菌(ARTP10S)進行基因組重測序。
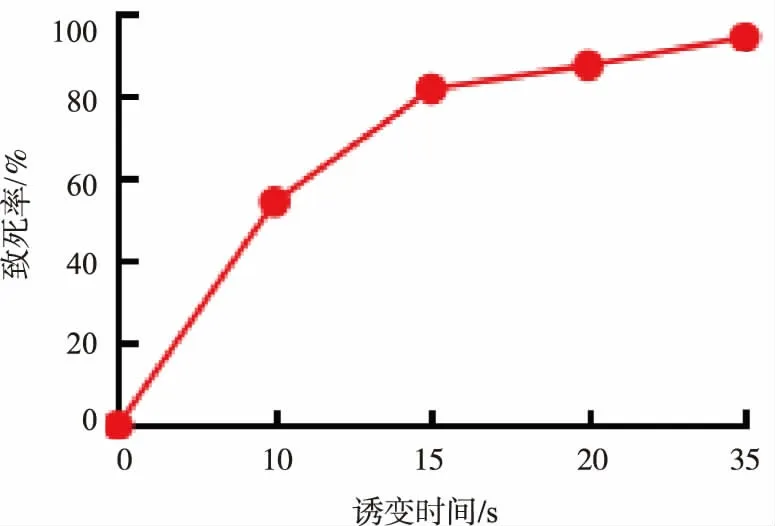
圖1 不同ARTP誘變處理時間下P.putida 901的致死率Fig.1 Mortality rate of P.putida 901 under different ARTP mutagenesis time

圖2 對照(WT)與經誘變馴化后菌株的比生長速率Fig.2 Specific growth rate of control strain(WT)and adapted strain
2.2 突變體的基因組重測序結果和分析
為探究突變株與野生型菌株之間的差異,利用第二代測序技術,構建插入片段長度為350 bp的文庫,采用測序平臺Illumina HiSeq對文庫進行測序,根據參考基因組比對結果進行注釋,得到表2中的數據。結果顯示3個測序樣本之間WTn-butanol的PF數據(pass filtering data)和干凈數據(Clean data)與其他兩個樣本的數據量差異較大,因為干凈數據是在PF數據基礎上進一步刪除質量不好的reads后得到的數據,這說明測序過程中WTn-butanol樣本測序所得到的質量不好的reads數較少,因此其干凈數據與其他兩者相差較大。而所有樣品的SNV和Indels數相差在15~50個之間,這表明相對于參考基因組來說,3個樣品各自都有特異的突變,同時還可能有共同的突變。

表2 測序結果中的SNV和Indel數據統計Table 2 SNV and Indel statistics in sequencing results
此外,根據物種的已知基因,將物種的基因組劃分為不同的功能單位,然后依據突變所發生的位置,將每個突變位點進行功能區域分類,并對各樣本所檢測到的突變位點依據功能區進行分類統計。從表3發現,大部分突變位點分布在基因的外顯子區,即CDS區或者mRNA區,而 在ncRNA區、3'UTR區及一些剪切位點區域的突變個數是0,這說明突變發生在基因編碼區中比較多,在非編碼區突變很少,一方面可能是因為這些區域在基因組上所占比例較小,發生突變的概率較小;另一方面可能是因為突變發生在這些區域會影響到不同RNA之間的結合,因為突變位點若位于mRNA 3′UTR區,會影響microRNA對其結合,導致mRNA降解受阻,mRNA表達會上升,進而影響到一些關鍵蛋白的表達,如與耐受性相關的外排泵蛋白及其他的膜蛋白。
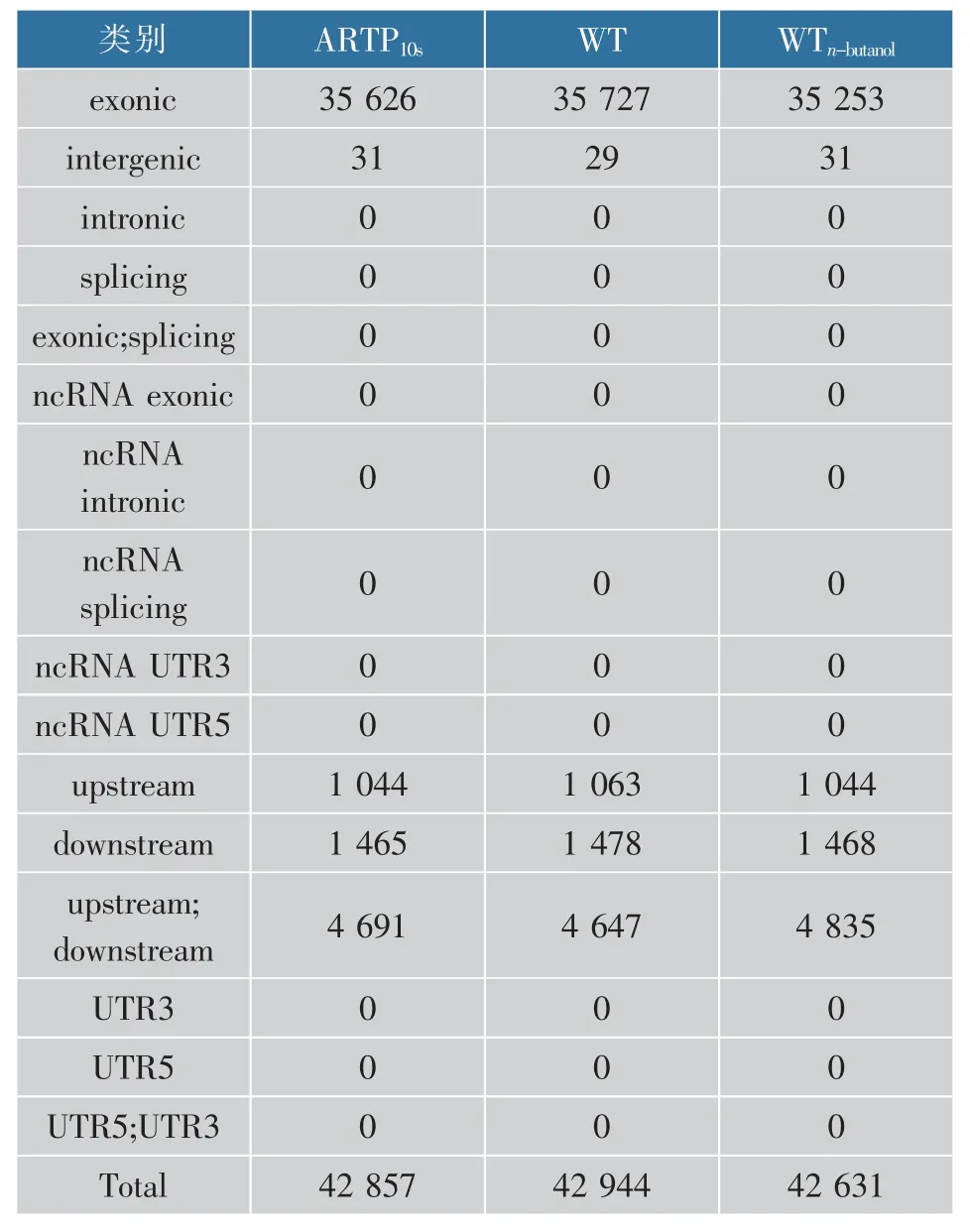
表3 SNV/Indels在基因組不同功能區域的分布狀況Table 3 Distribution of SNV/Indels in different functional regions of the genome
接著,對各個樣本之間進行分組(WT/ARTP10S、WT/WTn-butanol、ARTP10S/WTn-butanol)和比較基因組學研究,以期獲得它們之間共有和特有的突變數目(見圖3)。分析發現它們彼此之間相對于參考基因組來說,共有突變基因數目相近(均為41 000左右),其中最多的是WT,并通過兩兩之間的比較發現它們的特有突變基因數目相差至少有1 100個。在WT/WTn-butanol分組中,WT的特有突變占總突變數的3.7%,WTn-butanol的特有突變比例為3.0%;而在WT/ARTP10S分 組 中,WT的 特 有 突 變WTn-butanol的特有突變比例為2.9%,ARTP10S特有突變比例為2.7%;在WTn-butanol/ARTP10S分組中,ARTP10S的特有突變比例為3.3%,WTn-butanol的特有突變比例為2.7%,這說明在同樣的正丁醇脅迫條件下,經過ARTP誘變系統處理過的菌株的突變個數多于未經誘 變 的菌株。 而相對 于WT來說,WTn-butanol和ARTP10S兩者之間的特有突變差異為0.3%,這些結果說明ARTP誘變技術及正丁醇馴化都不同程度地對基因組序列突變產生了特有的影響,并且正是由于這些差異的突變而導致細胞的耐受性產生變化,后期將對這些差異突變進行更深層次的研究,以期獲得更多參與正丁醇耐受性相關的細胞元件。

圖3 不同樣本中突變基因的Venn圖分布狀況Fig.3 Venn plot of mutations in different samples
2.3 基因組重測序結果的功能注釋
根據總的Indels分布情況(見圖4)發現Indels長度集中分布在1~50 bp區域,并且數量最多的還是1 bp大小的片段插入,且隨著插入片段越長,Indels數目也越來越少。相對于參考基因組來說,樣本WTn-butanolIndels數目最多(2 205個),其次是WT(2 171個),最少的是ARTP10S(2 153個),這與圖3反映的結果一致。上述結果說明ARTP處理10 s并沒有引起基因序列的大面積缺失或者插入,僅僅是一些小片段的插入或者缺失,通過進一步分析發現Indels插入位置在treZ、fimV、LOR等基因上,其中treZ基因所編碼的麥芽糖寡糖基海藻糖水解酶能夠水解海藻糖,而海藻糖是能夠穩定生物膜和蛋白質結構的物質,破壞其水解酶基因能夠提高海藻糖的含量,進而穩定細胞生物膜,提高細胞的耐受性;fimV基因編碼細胞運動蛋白,LOR基因編碼細胞膜組件蛋白,這與細胞的生理性應激反應相關。
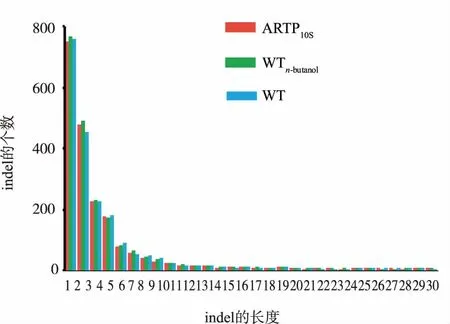
圖4 不同樣本Indel的長度分布狀況Fig.4 Distribution of Indel length
將測序結果中的SNV及Indels使用GO數據庫進行本體功能分析,同時通過在線軟件鏈接KEGG數據庫對測序樣本分組的SNV/Indels進行信號通路分析。根據KEGG數據庫功能注釋發現其含有人類疾病、有機體系、代謝、細胞過程、環境應激、遺傳信息處理等6個功能大類,每一大類中又可以分為不同的代謝功能類別,共有59條代謝通路。分別 統 計 了WT/ARTP10S、WT/WTn-butanol、ARTP10S/WTn-butanol之間所有突變基因的功能,重點比較了WT/ARTP10S的注釋結果,發現最多的共有突變主要涉及代謝相關的基因,占總突變的98.6%(見圖5),而這一大類中數目最多的是氨基酸代謝相關的基因突變,占14.2%的比例,其次是糖代謝相關,占比12.2%,說明正丁醇脅迫下惡臭假單胞菌細胞中糖代謝、氨基酸代謝相關物質含量發生了改變,正丁醇脅迫下菌株的糖酵解途徑和三羧酸循環可能被抑制,氨基酸代謝和糖代謝相關基因的突變使細胞內有足夠的能量供應,維持細胞生長,以抵抗外界不利因素,使其更進一步適應正丁醇環境,進而提高耐受性。同時比較了WT/ARTP10S突變之間的差異基因注釋結果,從圖6可以看到,突變總數目最多的依然是代謝類相關基因,占比為78.6%。突變差異數目最多的基因是環境應激大類中的膜轉運相關基因,占總差異突變數的14.3%。由于膜轉運蛋白與細胞耐受性緊密聯系,當環境中正丁醇進入細胞內對其生長產生抑制時,細胞則通過膜轉運蛋白將正丁醇排出細胞外,進而提高其自身的正丁醇耐受性。根據GO數據庫注釋結果發現所有突變涉及分子功能、細胞組件、生物學過程等多種生理代謝工程。通過統計WT/ARTP10S這一組的結果(圖7),發現其中涉及分子功能的比例是44.2%,其突變基因數目從高到低依次為催化活力、結合相關基因、核酸結合轉錄因子活力、轉運活力、分子轉導活力、電子載體活力、抗氧化活力與蛋白結合轉錄因子活力、結構分子活力相關基因。涉及生物過程的基因比例是48.2%,其突變數目從高到低依次是代謝過程、細胞的過程、生物調節、單一的生物過程、定位、運動、再生相關基因。而細胞組分這一類比例較少,為7.6%,它的基因突變數目從高到低依次是細胞組分、膜組分、膜、大分子復合物、細胞器組分及擬核相關基因。綜上,三大類功能中基因突變數較多的有蛋白或者膜結合相關的基因、代謝過程相關基因及膜轉運和膜組分相關基因,而這些基因與細胞的正丁醇耐受性緊密聯系,各司其職。首先,膜組分相關基因合成的細胞膜能夠阻擋正丁醇進入細胞,產生防護的第一道屏障;其次,進入細胞的正丁醇,可通過膜轉運蛋白將其輸送至細胞外;最后,若膜轉運蛋白被破壞,細胞可通過自身的糖代謝、氨基酸代謝相關基因的調節來抵抗環境中壓力。

圖5 WT/ARTP10S共有基因突變的KEGG數據庫注釋結果統計Fig.5 KEGG database annotation results of WT/ARTP10S shared gene mutation
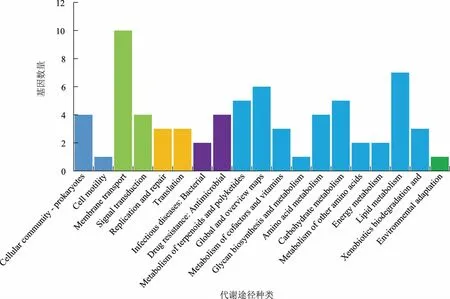
圖6 WT/ARTP10S差異突變基因的KEGG數據庫注釋結果統計Fig.6 KEGG database annotation results of WT/ARTP10S differential gene mutation
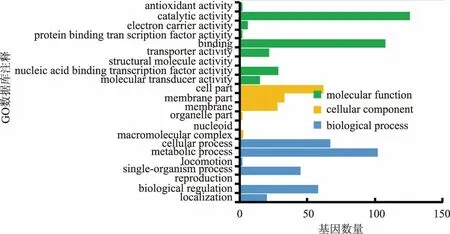
圖7 WT/ARTP10S相對參考基因組的所有突變在GO數據庫注釋結果統計Fig.7 GO database annotation results of WT/ARTP10S mutant genes
3 結語
采用ARTP技術對P.putida901進行隨機誘變和馴化篩選,使其對正丁醇的耐受質量濃度從4 g/L提高至12 g/L。在9.6 g/L正丁醇質量濃度下,突變株的比生長速率提高了2倍以上。運用高通量測序技術對經過ARTP誘變后傳代馴化的惡臭假單胞菌進行測序,發現經ARTP誘變后的樣本基因效果比野生型有所減少。通過KEGG數據庫對差異基因進行代謝通路分析[23-25],發現突變最多的是氨基酸等代謝相關基因。通過GO數據庫對突變基因進行注釋發現基因突變主要集中于分子功能相關、結合相關及擬核相關基因群[25-27]。本研究為惡臭假單胞菌的溶劑耐受性元件挖掘和菌株表型改造等研究提供了一定的依據。

