UPLC法同時測定市售菟絲子中5種化學成分的含量
唐冰雯,林秀蓮,李華
(1.廣州衛生職業技術學院,廣東 廣州 510450;2.廣東藥科大學,廣東 廣州 510006;3.廣東省藥品檢驗所,廣東 廣州 510663)
菟絲子收載于《中國藥典》2015年版,為旋花科植物南方菟絲子(CwscwiaaustralisR.Br.)或菟絲子(CuscutachinensisLam.)干燥成熟種子,辛、甘,平,歸肝、腎、脾經。可補益肝腎、固精縮尿、安胎、明目、止瀉,外用消風祛斑[1]。研究發現菟絲子主要藥效成分除常見的黃酮類化合物外,還有酚酸類和木質素類等化合物[2-4],具有多種功效如保肝、免疫調節、抗衰老、抗氧化、促性腺激素樣等[5]。有文獻報道利用高效液相色譜(HPLC)法對菟絲子中的黃酮類化合物進行質量控制[6-8],而由于市售的菟絲子藥材品種繁多,產地廣泛,且存在生產和來源的差異,進而出現藥材的質量差異從而影響其藥效及臨床的合理應用。在建立了菟絲子飲片指紋圖譜及含菟絲子成分的補腎強身片的質量控制及物質基礎研究等前期研究基礎上[9-10],為了進一步全面、快速、準確地控制菟絲子的質量,本試驗選擇黃酮類中的金絲桃苷、異槲皮苷、紫云英苷、山柰酚及具備抗炎作用的酚酸類物質綠原酸,作為菟絲子的質量控制指標,并以此建立超高效液相色譜(UPLC)法同時測定這5類化學成分的含量,為進一步提高和完善菟絲子質量標準提供參考。
1 儀器與試藥
島津Nexera LC-30A超高效液相色譜儀,配有LC30-AD二元泵,SIL-30AC自動進樣器,SPD-M30A PDA檢測器,CTO-20AC柱溫箱;KQ-300DE型超聲提取儀(昆山市超聲儀器有限公司);電子天平(Sartorius CP224S及CP225D)。乙腈,色譜純(美國Honeywell公司);甲醇和甲酸,分析純(廣州化學試劑廠)。
紫云英苷對照品(含量:98.0%,批號:480104),購于上海安譜實驗科技股份有限公司;異槲皮苷對照品(含量:92.9%,批號:111809-201403),山柰素對照品(含量:95.5%,批號:110861-201310)、金絲桃苷對照品(含量:94.3%,批號:111521-201507)、綠原酸對照品(含量:96.2%,批號:110753-201415)均購買于中國食品藥品檢定研究院。樣品為來源于19個生產廠家的菟絲子藥材共20批次,經廣東省藥品檢驗所中藥室林錦峰主任鑒定均為旋花科植物南方菟絲子(CwscwiaaustralisR.Br.)或菟絲子(CuscutachinensisLam.)干燥成熟種子。藥材樣品覆蓋全國9省(市)包括北京、安徽、河北、甘肅、浙江、青海、江蘇、廣西、四川等,詳見表1。
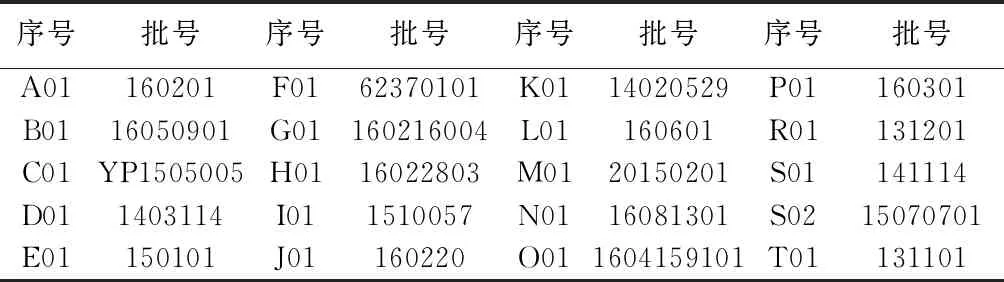
表1 樣品信息
2 方法與結果
2.1 色譜條件 Agilent SB-C18色譜柱(100 mm×2.1 mm,1.8 μm);乙腈(A)-0.2%甲酸水溶液(B)作為流動相,梯度洗脫(程序為0~4 min,7%→9%A;8~11 min,13%A;11~18 min,13%→14%A;18~24 min,14%→30%A;24~30 min,30%→31%A);柱溫:35 ℃;分段檢測波長(1~5 min,325 nm; 5~12 min,260 nm;12~30 min,360 nm);體積流量:0.4 mL·min-1;進樣量:2 μL。
2.2 溶液的制備
2.2.1 供試品溶液的制備 取菟絲子粉末適量過二號篩,精密稱定約1 g,置50 mL量瓶中,加入40 mL的80%甲醇,采用超聲處理60 min(功率500 W,頻率40 kHz),放冷后用80%甲醇定容,搖勻,過濾,取續濾液,即可。
2.2.2 混合對照品溶液的制備 取各對照品適量,精密稱定,加甲醇溶解制成混合對照貯備液(每1 mL含異槲皮苷180.60 μg、紫云英苷173.07 μg、金絲桃苷226.32 μg、山柰酚173.28 μg、綠原酸200.09 μg)。
2.3 色譜系統適用性試驗 分別精密吸取“2.2.2”項下制成的混合對照溶液(含異槲皮苷22.57 mg·L-1、紫云英苷21.63 mg·L-1、金絲桃苷28.29 mg·L-1、山柰酚21.65 mg·L-1、綠原酸25.01 mg·L-1)和供試品溶液各2 μL,按照“2.1”項下色譜條件進行分析,結果見圖1。異槲皮苷、紫云英苷、金絲桃苷、山柰酚、綠原酸與相鄰的色譜峰分離度均大于1.5,拖尾因子在0.95~1.05之間,理論板數以各成分色譜峰計算均在6 000以上。
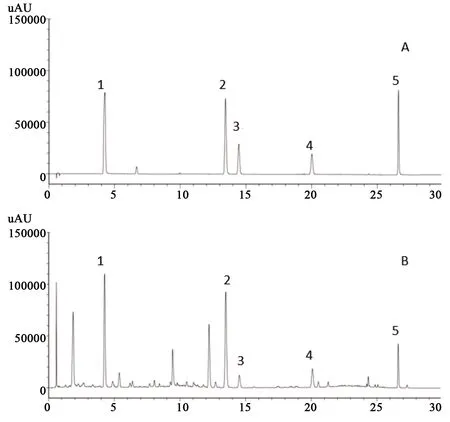
A.混合對照溶液;B.樣品 1-綠原酸(chlorogenic acid);2-金絲桃苷(hyperoside);3-異槲皮苷(isoquercitrin);4-紫云英苷(astragalin); 5-山柰素(kaempferol)圖1 混合對照品系統適應性色譜圖
2.4 線性與范圍 精密量取“2.2”項下混合對照溶液適量,逐級稀釋到不同質量濃度的混合對照溶液異槲皮苷(180.60、90.30、45.15、22.57、11.29、2.26、0.45 mg·L-1);紫云英苷(173.07、86.53、43.27、21.62、10.87、2.16、0.43 mg·L-1);金絲桃苷(226.32、113.16、56.58、28.29、14.14、2.83、0.56 mg·L-1);山柰酚(173.28、86.62、43.31、21.65、10.83、2.16、0.43 mg·L-1);綠原酸(200.09、100.05、50.02、25.01、12.51、2.50、0.50 mg·L-1),按照“2.1”項下色譜條件進樣測定。以峰面積A為縱坐標,質量濃度C(mg·L-1)為橫坐標進行線性回歸,結果見表2,5種成分峰面積與濃度的線性關系良好(r>0.999 9)
2.5 檢測限與定量限 按照“2.1”項下色譜條件,通過稀釋不同濃度的標準品得到5種成分的定量限(S/N為10)和檢測限(S/N為3),結果見表2。
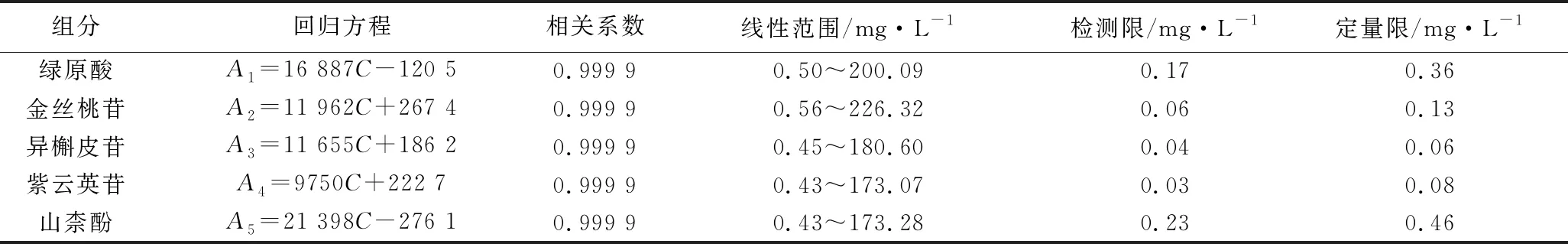
表2 5種成分的回歸方程和線性范圍
2.6 精密度試驗 取混合對照溶液(含異槲皮苷22.57 mg·L-1、紫云英苷21.63 mg·L-1、金絲桃苷28.29 mg·L-1、山柰酚21.65 mg·L-1、綠原酸25.01 mg·L-1),按“2.1”項下的色譜條件連續進樣5次,以峰面積為指標計算RSD(n=5),考察方法的精密度。測定綠原酸、金絲桃苷、異槲皮苷、紫云英苷、山柰酚的平均峰面積分別為426 025、345 229、266 540、215 548、465 495,峰面積RSD分別為0.38%、0.79%、0.99%、1.46%、0.65%,說明該儀器精密度良好。
2.7 穩定性試驗 取批號160201的同一份供試品溶液,按“2.1”項下的色譜條件分別于0、2、4、8、12、24 h測定,選用峰面積為指標計算RSD(n=6),考察方法的穩定性。測定綠原酸、金絲桃苷、異槲皮苷、紫云英苷、山柰酚的平均峰面積分別為655 981、724 005、100 986、169 143、201 480、峰面積RSD分別為0.30%、0.36%、0.63%、0.22%、0.40%,表明供試品溶液在24 h內穩定.
2.8 重復性試驗 取同一批號樣品(批號:160201),平行制備6份供試品溶液,按“2.1”項下的色譜條件測定,以峰面積為指標計算RSD(n=6),考察方法的重復性。分別測定綠原酸、金絲桃苷、異槲皮苷、紫云英苷、山柰酚的平均含量為1.9370、3.0113、0.4268、0.9163、0.4712 mg·g-1,峰面積RSD為1.85%、1.59%、1.18%、2.36%、2.64%,表明方法重復性良好。
2.9 加樣回收試驗 精密稱取已知綠原酸、金絲桃苷、異槲皮苷、紫云英苷及山柰酚含量的菟絲子樣品(批號:160201)約0.5 g,共9份,于每3份中分別加入近似1∶0.5、1∶1、1∶1.5的各個對照品溶液,按照“2.2.1”項下制備供試品溶液,測定峰面積,計算回收率,結果見表3。5種化合物的平均回收率(n=9)分別為102.0%(RSD=1.56%)、99.0%(RSD=2.90%)、100.1%(RSD=3.19%)、100.2%(RSD=3.00%)、99.3%(RSD=4.25%),說明該方法的準確度良好。
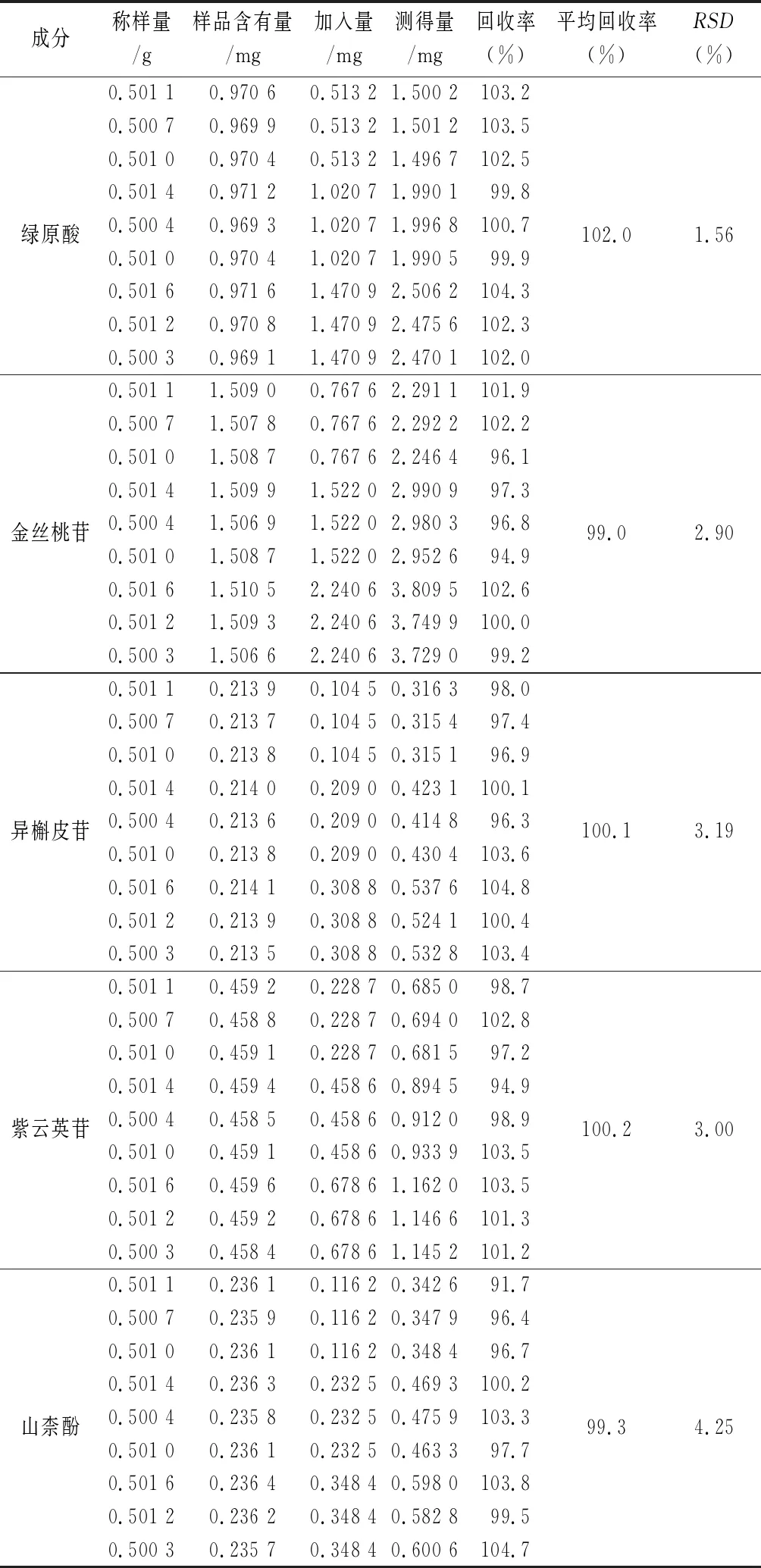
表3 回收率試驗結果(n=9)
2.10 樣品含量測定 分別精密吸取20批次供試品溶液2 μL,進樣測定。選用外標法分別計算綠原酸、金絲桃苷、異槲皮苷、紫云英苷和山柰酚的含量,結果見表4。比較20批次樣品5種成分含量及總含量發現,大部分廠家生產的菟絲子質量一致性較好,也有部分批次樣品5種成分含量及總含量較低,存在一定差異。
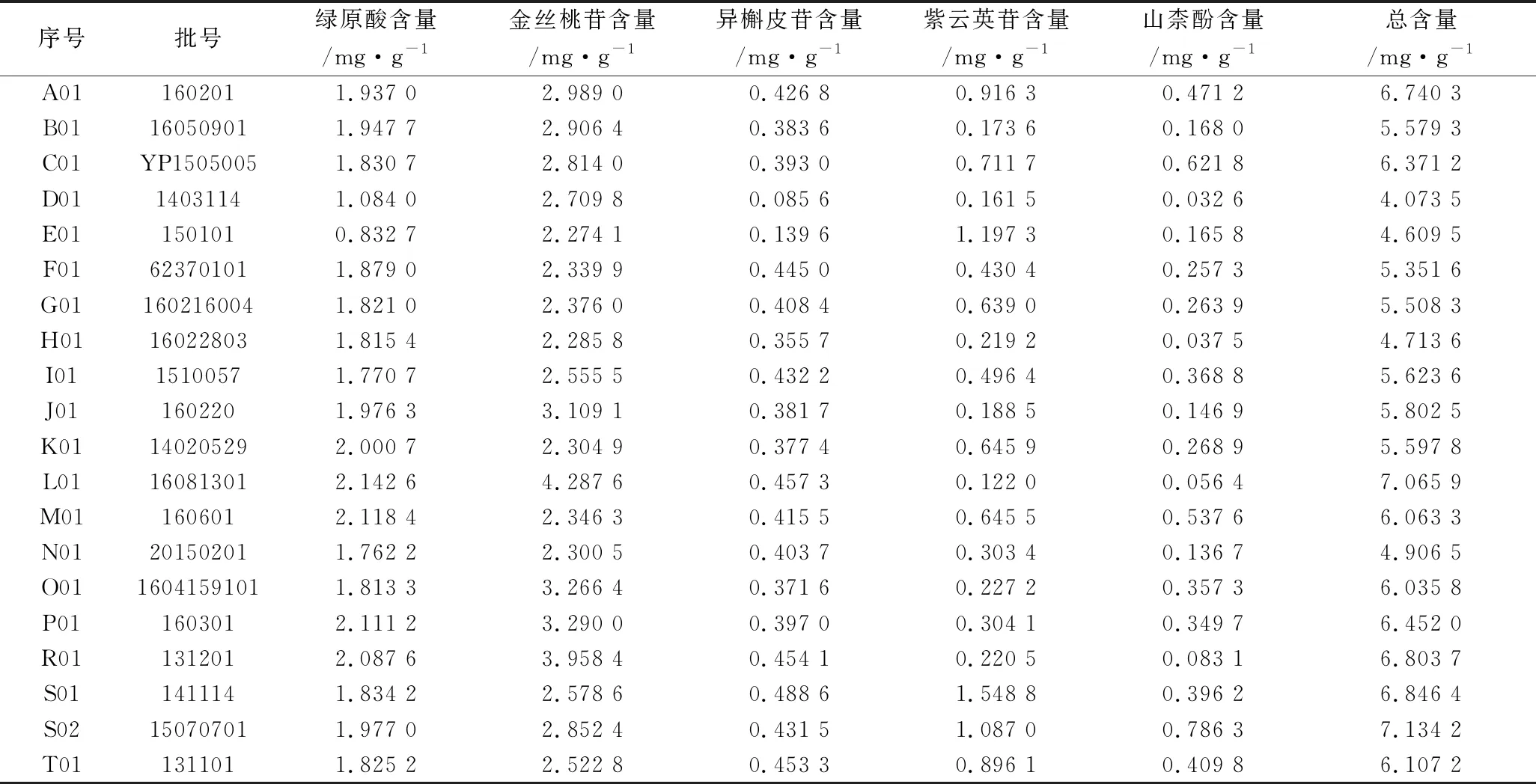
表4 5種成分含量測定結果(n≥3)
3 討論
本文測定的菟絲子化學成分可分為黃酮類和酚酸兩大類,其中金絲桃苷、異槲皮苷、紫云英苷和山柰酚為黃酮類,綠原酸為酚酸類。通過考察不同比例的甲醇-水(40∶60、80∶60、100∶0)來尋找最佳提取溶劑,結果顯示甲醇-水(80∶20)提取率最高,故采用甲醇-水(80∶20)作為提取溶劑。試驗還考察了加熱回流法和超聲提取法兩種不同提取方式,結果顯示兩種提取方法的提取結果相近,考慮到試驗的簡便性,選用超聲提取的方法。同時還分別考察20、40、60、80 min的超聲提取效果,結果表明60 min與80 min的超聲提取率接近,為了縮短試驗時間,采用超聲提取60 min為宜。對于InertSustainSwiftTMC18(100 mm×2.1 mm,1.9 μm)、Agilent SB-C18(100 mm×2.1 mm,1.8 μm)、WatersACQUITYTMBEH C18(100 mm×2.1 mm,1.7 μm)等3種不同廠家和不同粒徑的色譜柱也進行了考察,結果表明以上3種色譜柱均可實現較好的分離樣品,獲得良好的峰形和分離度。此外,選用二極管陣列檢測器來記錄200~400 nm的紫外吸收光譜圖,結果表明,綠原酸在325 nm處有較好的吸收,金絲桃苷、異槲皮苷、紫云英苷和山柰酚均在360 nm處有較好的吸收,且為了基線更加平穩,選擇分段波長檢測:0~5 min,325 nm;5~12 min,260 nm;12~30 min,360 nm。
從各廠家批次樣品含量分析結果來看,發現綠原酸含量在0.832 7~2.142 6 mg·g-1之間,金絲桃苷含量在2.282 5~4.287 6 mg·g-1之間,異槲皮苷含量在0.856~0.488 6 mg·g-1之間,紫云英苷含量在0.896 1~1.548 8 mg·g-1之間,山柰酚含量在0.032 6~0.786 3 mg·g-1。不同的廠家和生產批號的菟絲子飲片中5種化學成分的含量接近,但是仍出現了個別樣品的酚酸及黃酮類物質含量偏低的情況。可能原因考慮為不同廠家的地域氣候等因素及不同批號間飲片不同的生產時間和貯存條件的所帶來的差異。
本試驗系統考察了樣品前處理方法和色譜條件對菟絲子中酚酸類和黃酮類成分含量測定方法的影響,并在此基礎建立快速、簡便、準確的UPLC法同時測定菟絲子中綠原酸、金絲桃苷、異槲皮苷、紫云英苷、和山柰酚5種成分的含量,并對該方法進行了系統的方法學驗證。UPLC法靈敏度高、穩定性好,本試驗所建立的含量測定方法適用于菟絲子藥材的質量控制研究,為進一步提高和完善菟絲子質量標準提供參考。

