姜黃素調節SREBP和FAS改善非酒精性脂肪性肝病的研究
陳仲生?閻文柱
【摘要】目的 探究姜黃素對非酒精性脂肪性肝病(NAFLD)的作用和可能機制。方法 18只SD大鼠隨機分為對照組、模型組和姜黃素組,每組各6只。模型組和姜黃素組予以高脂高膽固醇食物10 ml/kg灌胃,對照組給予等量生理鹽水灌胃。建模成功后,姜黃素組每日給予姜黃素100 mg/kg灌胃,對照組和模型組給予等量的羧甲基纖維素鈉。治療4周后,檢測大鼠血清ALT、AST、甘油三酯(TG)和總膽固醇(TC)水平,HE染色觀察大鼠肝臟組織病理學變化,免疫組織化學法檢測大鼠肝組織固醇調節元件結合蛋白(SREBP)和脂肪酸合成酶(FAS)蛋白的表達情況,蛋白免疫印跡法檢測沉默調節蛋白6(Sirt6)和磷酸化腺苷酸活化蛋白激酶(p-AMPK)蛋白表達變化。結果 模型組ALT、AST、TG、TC、SREBP和FAS蛋白表達均高于對照組(P均< 0.05);姜黃素組ALT、AST、TG、TC、SREBP和FAS蛋白表達均低于模型組(P均< 0.05)。模型組Sirt6、p-AMPK蛋白表達均低于對照組(P均< 0.05);姜黃素組Sirt6、p-AMPK蛋白表達均高于模型組(P均< 0.05)。結論 姜黃素可以減輕大鼠NALFD的脂肪沉積和肝損傷,可能與Sirt6、p-AMPK的表達上調相關。
【關鍵字】非酒精性脂肪性肝病;固醇調節元件結合蛋白;脂肪酸合成酶;姜黃素;
沉默調節蛋白6;磷酸化腺苷酸活化蛋白激酶
Curcumin alleviates non-alcoholic fatty liver disease by regulating SREBP and FAS Chen Zhongsheng, Yan Wenzhu. Department of Gastroenterology, the Third Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
Corresponding author, Yan Wenzhu
【Abstract】Objective To explore the regulatory mechanism of curcumin in the treatment of non-alcoholic fatty liver disease (NAFLD). Methods Eighteen male SD rats were randomly divided into the control, model and curcumin treatment groups, 6 rats in each group. In the model and curcumin treatment groups, NAFLD rat models were established by gavage with high-fat and high-cholesterol diet, and an equivalent amount of normal saline was given in the control group. After the model establishment,? the rats were given with gavage with 100 mg/kg curcumin in the curcumin treatment group, and an equivalent amount of sodium carboxymethyl cellulose was given in the control and model groups. At 4 weeks after treatment, the serum levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST), triglyceride (TG) and total cholesterol (TC) were detected. Pathological changes of liver tissues were observed by HE staining. The expression levels of sterol regulatory element-binding protein (SREBP) and fatty acid synthase (FAS) proteins in liver tissues were characterized by immunohistochemical staining. The expression levels of silent information regulator 6 (Sirt6) and phosphorylated adenylate-activated protein kinase (p-AMPK) proteins were measured by Western blot. Results In the model group, the expression levels of ALT, AST, TG, TC, SREBP and FAS proteins were significantly higher compared with those in the control group (all P < 0.05). In the curcumin treatment group, the expression levels of ALT, AST, TG, TC, SREBP and FAS proteins were significantly lower compared with those in the model group (all P < 0.05). In the model group, the expression levels of Sirt6 and p-AMPK proteins were significantly lower than those in the control group (both P < 0.05). In the curcumin treatment group, the expression levels of Sirt6 and p-AMPK proteins were significantly higher than those in the model group (both P < 0.05). Conclusion Curcumin can alleviate lipid deposition and hepatic injury in NALFD rats probably by up-regulating the expression levels of Sirt6 and p-AMPK.
【Key words】Non-alcoholic fatty liver disease;Sterol regulatory element-binding protein;
Fatty acid synthetase;Curcumin;Silent information regulator 6;
Phosphorylated adenylate-activated protein kinase
非酒精性脂肪性肝病(NAFLD)是指排除長期大量飲酒和其他明確的肝臟損傷因素所引起的脂質在肝細胞中儲積為病理改變的肝臟代謝性疾病。近年來,NAFLD逐漸成為全球最常見的慢性肝病[1]。目前關于NAFLD發病機制尚不十分明確,現被公認的是“二次打擊學說”。其可能的機制有氧化應激、內質網應激、胰島素抵抗、炎癥反應以及自噬與DNA 損傷等[2-4]。固醇調節元件結合蛋白(SREBP)和碳水化合物反應原件結合蛋白是調節肝臟脂質合成的關鍵性基因,進而參與調控肝臟脂質代謝過程[5-6]。因此,通過尋找有效藥物抑制SREBP表達,對于改善NAFLD脂質代謝紊亂至關重要。
姜黃素是一種多酚類物質,從植物姜黃中提取。研究發現,姜黃素具備抗炎、抗氧化、抗腫瘤、抗自噬、抗胰島素抵抗等作用,且對于糖尿病、COPD、動脈粥樣硬化、自身免疫性疾病的治療都有確切的效果。既往研究發現,姜黃素能夠通過調節SREBP,進而參與肝臟脂質代謝[7]。在NAFLD大鼠中,降脂顆粒可以通過下調肝X受體α和SREBP-1c的表達,調節脂肪酸代謝[8]。但是有關姜黃素對SREBP調節的分子機制尚不完全清楚。因此,本實驗研究通過構建NAFLD型大鼠模型,探究姜黃素對SREBP的分子調控機制。
材料與方法
一、材 料
1.實驗動物
實驗選取雄性SPF級別,體質量為180 ~ 200 g的SD大鼠共18只(購于錦州醫科大學動物中心)并通過動物倫理委員會批準(批號:20190816),實驗動物飼養于濕度在30% ~ 70%、溫度維持在25 ℃的動物房內并采取晝夜交替光照處理。
2.主要實驗藥品及試劑
膽固醇(萬邦實業有限公司,批號:2017 031625),姜黃素(上海瑞永生物科技有限公司), SREBP一抗和脂肪酸合成酶(FAS)一抗抗體(武漢Proteintech),沉默調節蛋白6(Sirt6)一抗(武漢博士德公司),腺苷酸活化蛋白激酶(AMPK)一抗(美國Cell Signaling Technology),β-actin一抗(江蘇碧云天公司) PVDF膜(Millipore公司),SDS-PAGE凝膠(武漢博士德公司),一抗、二抗稀釋液(江蘇碧云天公司)。
3.主要實驗儀器
純水儀器(湖南湘儀公司),酶標儀(江蘇碧云天公司),組織切片機(武漢賽默飛公司),熒光倒置顯微鏡(日本Olmpus公司),凝膠電泳裝置(北京六一生物科技有限公司),顯影儀(上海西唐生物科技有限公司),脫色搖床(上海魯碩實業有限公司),高速離心機(上海盧湘儀離心機儀器有限公司)。
二、方 法
1.造模及分組
將18只實驗大鼠隨機分為3組,每組各6只,即為對照組、模型組、姜黃素組。模型組和姜黃素組予以高脂高膽固醇食物10 ml/kg灌胃,對照組給予生理鹽水10 ml/kg灌胃。其中高脂高膽固醇食物的配制為60%豬油、10%膽固醇及30%玉米面加200 ml食用水,熬制成糊狀,放入37℃恒溫箱內,對照組給予常規飼料飼養。3個月后隨機處死模型組和姜黃素組各1只大鼠,肝臟病理見肝脂肪細胞變性表明建模成功。姜黃素組給予姜黃素100 mg/kg按每日1次給藥;對照組和模型組給予等量的生理鹽水灌胃;持續給藥4周。隔夜禁食水,次日清晨予大鼠腹腔注射1%戊巴比妥鈉麻醉,稱重、解剖并左心室采血,取部分肝臟組織浸泡于4%的多聚甲醛,經脫水、石蠟包埋后行HE染色和免疫組織化學檢測。
2.相關指標檢測
按照試劑盒說明書進行大鼠血清中ALT、AST、甘油三酯(TG)、總膽固醇(TC)含量測定。HE染色:4%的多聚甲醛固定大鼠肝臟組織,石蠟包埋后切片,之后行HE染色操作。免疫組織化學染色:①石蠟切片60℃下烘烤1 h;②脫蠟至水,二甲苯處理3次,每次5 min,無水乙醇處理3次,每次10 min,95%乙醇處理2次,每次10 min,dd H2O洗2次,每次5 min,0.01 mmol/L磷酸鹽緩沖液(PBS)洗3次,每次10 min;③消除過氧化物酶體,3% H2O2溶液孵育10 min,0.01 mmol/L PBS洗3次,每次5 min;④微波抗原修復,枸櫞酸鈉緩沖液(pH 6.0)250 ml置于微波爐中450 W預熱5 min,將組織放入緩沖液中,微波250 W加熱10 min,冷卻至室溫,約耗時40 min,雙蒸水洗3次,每次5 min,PBS洗3次,每次5 min;⑤封閉,利用5%的BSA封閉1 h;⑥打孔透膜,利用0.3%的Triton X-100孵育10 min;⑦一抗孵育,4℃濕盒孵育SREBP和FAS抗體過夜;⑧二抗孵育;⑨二氨基聯苯胺(DAB)顯色、蘇木素復染,梯度乙醇脫水,二甲苯透明;⑩中性樹膠封片和顯微鏡下觀察結果。
蛋白免疫印跡法:①組織碾磨,將處理完成的各組大鼠肝臟組織取出,采用PBS清洗后并用手術剪刀剪取少許肝臟組織放置于組織碾磨管內,按照1∶5的比例加入組織裂解液后放置于組織碾磨儀中充分碾磨3 ~ 5 min;②離心,4℃以
12 000 rpm離心15 min,取組織上清液;③蛋白質濃度測定,利用二辛可寧酸(BCA)法進行蛋白質濃度定量測定;④凝膠電泳,按照上樣量為40 μg
進行蛋白凝膠電泳120 min;⑤轉膜,依據蛋白質marker指示進行切膠,并放置聚偏二氟乙烯(PVDF)膜進行轉膜約90 min;⑥封閉,5%的脫脂牛奶封閉1 ~ 2 h;⑦孵育一抗,洗脫完成,孵育對應的一抗過夜;⑧孵育二抗,室溫條件下,二抗孵育約2 h;⑨顯影,將孵育完成的PVDF膜使用吐溫-20的PBS洗滌2 ~ 3次,每次5 min,滴加顯影液顯影并拍照。
三、統計學處理
采用SPSS 18.0進行數據分析。正態分布計量資料采用表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P < 0.05為差異有統計學意義。
結果
一、姜黃素對大鼠血清生化指標的影響
與對照組相比,模型組ALT、AST、TG和TC增高,差異均有統計學意義(P均< 0.05);與模型組相比,姜黃素組ALT、AST、TG和TC均降低(P均< 0.05)。
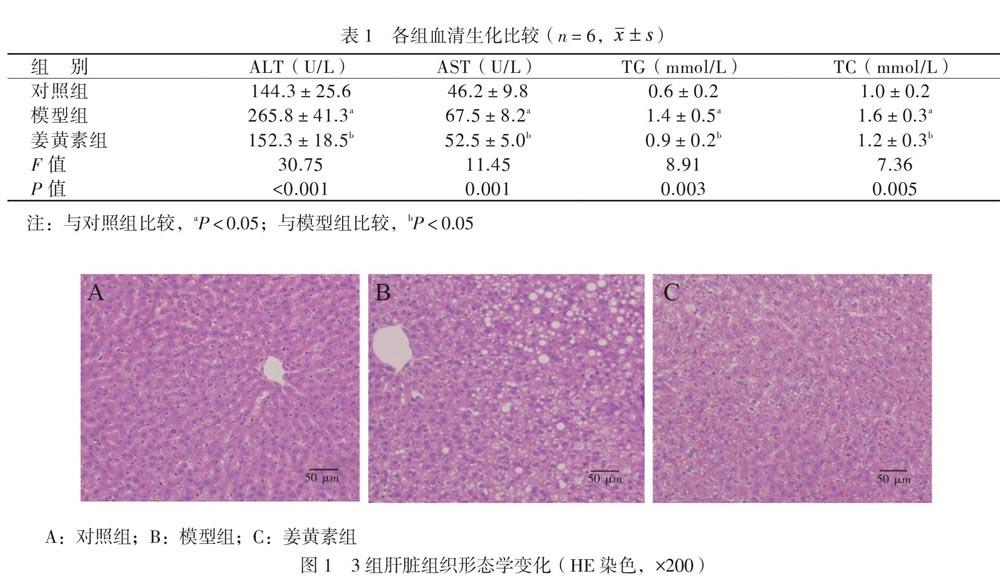
二、HE染色觀察大鼠肝臟組織形態學變化
與對照組相比,模型組肝小葉內彌漫性分布著空泡細胞,空泡大小不一,肝小葉結構尚存,邊界模糊,有淋巴細胞分布于肝臟。相比于模型組,姜黃素組的肝小葉內空泡細胞明顯減少,肝小葉結構清晰,肝臟內的空泡細胞數量最少,見圖1。
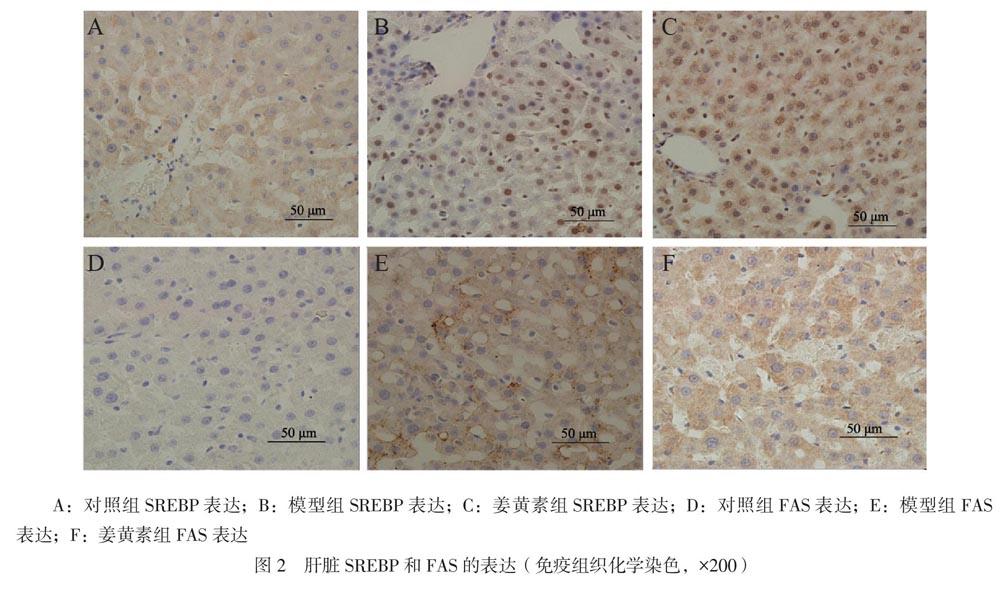
三、免疫組織化學法檢測大鼠肝臟組織中的SREBP和FAS表達
SREBP和FAS的定位都位于細胞質內:與對照組相比,模型組SREBP和FAS的表達增加;與模型組相比,姜黃素組SREBP和FAS的表達減少,見圖2。
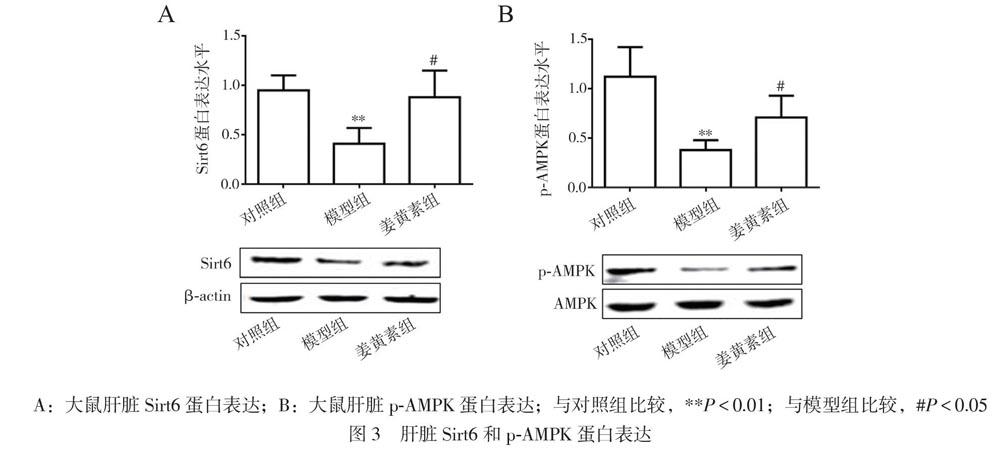
四、姜黃素對大鼠肝臟Sirt6和p-AMPK表達的影響
3組肝臟組織Sirt6和p-AMPK蛋白表達比較差異均有統計學意義(FSirt6 = 12.83,PSirt6 = 0.001;Fp-AMPK = 16.67,Pp-AMPK< 0.001),相比于對照組,模型組Sirt6和p-AMPK蛋白表達降低(P均< 0.05);與模型組相比,姜黃素組Sirt6和p-AMPK蛋白表達升高(P均< 0.05),見圖3。
討論
NAFLD是以彌漫性肝細胞脂肪病變而導致的一種病理性臨床病理綜合征。NAFLD是一種進展性疾病,其發病機制尚不明確。既往研究發現胰島素抵抗、脂質代謝異常、炎性細胞因子和氧化應激所致肝細胞凋亡等因素是NAFLD發生和發展的主要原因[9]。現有研究者提出在NAFLD的“二次打擊學說”中,初次主要是胰島素抵抗所致,胰島素抵抗主要通過促使外周脂解增加和高胰島素血癥引起肝細胞脂肪蓄積,并增加了對內、外源性損害因子敏感性。二次打擊主要為反應性氧化代謝產物、脂肪細胞因子、腸應激和腸道菌群內毒素等各種損害因子誘導活動UCP-2、FAS配體等,進而使得脂肪變性的肝細胞出現炎癥、壞死等一系列病理生理學改變[10-12]。
NAFLD是指中性脂肪在肝細胞內以脂滴或者脂質囊泡的形式在胞質中過度積累。在諸多研究中發現總膽固醇在NAFLD是非酒精性脂肪性肝炎形成和發展中所起的脂毒性作用尚不完全清楚。因此,通過研究NAFLD中膽固醇合成和代謝的相關基因顯得尤為重要。SREBP屬于螺旋-環-螺旋-亮氨酸拉鏈(bHLH-ZIP)結構家族,是一種節脂質合成的轉錄因子家族,是由SREBP 1a、SREBP 1c 、SREBP 2三種亞型構成[13-14]。多項研究均指出SREBPS在NAFLD的發生發展中起重要作用。近年來諸多研究也發現姜黃素可以通過降低TG、TC改善NAFLD。研究發現,姜黃素可通過下調節SREBP和FAS表達,減少脂質在肝臟內沉積,降低脂毒性對肝臟損害,進而保護肝臟細胞,使得病情得以逆轉,從而治療NAFLD[15]。對此本研究初步研究發現,相比于模型組,通過姜黃素大鼠灌胃處理的NAFLD組SREBP和FAS的表達明顯下降,AST、ALT、TG和TC水平均明顯降低。上述結果表明,姜黃素可能通過調節SREBP和FAS,從而降低TG、TC等合成,改善NAFLD。那么姜黃素是通過何種分子機制調控SREBP表達?
Sirt6是Sirtuins家族成員之一,具有高度保守的NAD+依賴性的去乙酰化酶,可能通過調節內皮一氧化氮合酶而發揮抗心肌肥大的作用[16]。以往研究發現,Sirt6基因缺失是導致TG累積的主要因素,與脂肪性肝臟疾病密切相關[17]。在高脂喂養的小鼠中Sirt6的表達顯著降低,通過過表達Sirt6可以降低小鼠血液脂質含量,減少肝臟內脂肪的積累[18]。亦有研究證實,Sirt6可以通過增加AMP/ATP比例,活化AMPK信號通路,進而調控SREBP蛋白表達[19]。因此,在本實驗研究中,我們通過蛋白免疫印跡法檢測大鼠肝臟組織中Sirt6和p-AMPK蛋白表達。結果發現,相比于對照組,模型組Sirt6和p-AMPK蛋白表達均明顯降低,給予姜黃素處理可以促進Sirt6和p-AMPK蛋白表達,進而改善NAFLD。綜上所述,姜黃素可以減輕大鼠NALFD的脂肪沉積和肝損傷,可能與Sirt6、p-AMPK的表達上調相關。以上研究結果為姜黃素治療NAFLD提供了新的理論依據。
參 考 文 獻
[1] Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology,2016,64(1):73-84.
[2] Kim SB, Kang OH, Lee YS, Han SH, Ahn YS, Cha SW, Seo YS, Kong R, Kwon DY. Hepatoprotective effect and synergism of bisdemethoycurcumin against MCD diet-induced nonalcoholic fatty liver disease in mice. PLoS One,2016,11(2):e014 7745.
[3] Macías J, Mancebo M, Merino D, Téllez F, Montes-Ramírez ML, Pulido F, Rivero-Juárez A, Raffo M, Pérez-Pérez M, Merchante N, Cotarelo M, Pineda JA; Spanish AIDS Research Network-HEP09 Study Group. Changes in liver steatosis after switching from efavirenz to raltegravir among human immunodeficiency virus-Infected patients with nonalcoholic fatty liver disease. Clin Infect Dis,2017,65(6):1012-1019.
[4] Sun LY, Yang YS, Qu W, Zhu ZJ, Wei L, Ye ZS, Zhang JR, Sun XY, Zeng ZG. Gut microbiota of liver transplantation recipients. Sci Rep,2017,7(1):3762.
[5] 耿得珍, 卜亞茹, 焦波. 潛在的代謝性疾病治療靶點——固醇調節元件結合蛋白.中國藥學雜志, 2019, 54(15):1205-1210.
[6] Horton JD, Goldstein JL, Brown MS. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. J Clin Invest,2002,109(9):1125-1131.
[7] 韓曉群, 林劍國, 楊婧. 姜黃素對活化肝星狀細胞內脂質水平的影響及其機制. 解放軍醫學雜志, 2018, 43(12):1019-1023.
[8] 楊麗麗, 王淼, 柳濤, 宋海燕,勵冬斐,鄭培永,劉平,季光. 降脂顆粒對非酒精性脂肪性肝病大鼠肝X受體α和固醇調節元件結合蛋白1c表達的影響. 中西醫結合學報, 2011, 9(9):998-1004.
[9] 肖陽, 侯云鶴,尹鑫,康鳳,李樹德,楊世昆,陶建平.人參皂苷Rg1干預非酒精性脂肪肝模型大鼠肝細胞的凋亡.中國組織工程研究,2019,23(3):384-390.
[10] 張姍姍, 王來友. 非酒精性脂肪性肝病藥物治療學前沿與展望. 世界華人消化雜志,2019,27(2):73-79.
[11] Satapathy SK, Sanyal AJ. Epidemiology and natural history of nonalcoholic fatty liver disease. Semin Liver Dis,2015,35(3):221-235.
[12] Musso G, Cassader M, Rosina F, Gambino R. Impact of current treatments on liver disease, glucose metabolism and cardiovascular risk in non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of randomised trials. Diabetologia,2012,55(4):885-904.
[13] Brown MS, Goldstein JL. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell,1997,89(3):331-340.
[14] Goldstein JL, Rawson RB, Brown MS. Mutant mammalian cells as tools to delineate the sterol regulatory element-binding protein pathway for feedback regulation of lipid synthesis. Arch Biochem Biophys,2002,397(2):139-148.
[15] Engelking LJ, Cantoria MJ, Xu Y, Liang G. Developmental and extrahepatic physiological functions of SREBP pathway genes in mice. Semin Cell Dev Biol,2018,81:98-109.
[16] 黃小陽,李卓明,劉志平,劉培慶. SIRT6通過調節eNOS抑制心肌肥大的機制研究.中山大學學報(醫學科學版), 2015,36(3):338-345.
[17] Xiong X, Yu J, Fan R, Zhang C, Xu L, Sun X, Huang Y, Wang Q, Ruan HB, Qian X. NAMPT overexpression alleviates alcohol-induced hepatic steatosis in mice. PLoS One,2019,14(2):e0212523.
[18] Kim HS, Xiao C, Wang RH, Lahusen T, Xu X, Vassilopoulos A, Vazquez-Ortiz G, Jeong WI, Park O, Ki SH, Gao B, Deng CX. Hepatic-specific disruption of SIRT6 in mice results in fatty liver formation due to enhanced glycolysis and triglyceride synthesis. Cell Metab,2010,12(3):224-236.
[19] Kanfi Y, Peshti V, Gil R, Naiman S, Nahum L, Levin E, Kronfeld-Schor N, Cohen HY. SIRT6 protects against path-ological damage caused by diet-induced obesity. Aging Cell,2010,9(2):162-173.
(收稿日期:2020-06-11)
(本文編輯:楊江瑜)

