二糖磷酸化酶及其在體外合成生物學中的應用
李國瑋,游淳
1(天津科技大學 生物工程學院,天津,300457)2(中國科學院天津工業生物技術研究所,天津,300308)
糖苷磷酸化酶催化多糖或寡糖非還原末端的糖基部分與無機磷酸鹽縮合,形成糖基磷酸(圖1)。磷酸化酶這一術語最早出現于1938年,CORID等[1]將其描述為產生葡萄糖1-磷酸的一種因子。這些酶遵循“底物名稱+磷酸化酶”的命名規則,其EC號的通用格式為2.4.x.x,例如蔗糖磷酸化酶,其底物為蔗糖,EC號為2.4.1.7。磷酸化酶在酶的歷史上占有重要地位,CARL和GERTY由于發現了糖原磷酸化酶獲得了1947年的諾貝爾生理學獎,EDMOND和EDWIN[2]因鑒定了肌肉糖原磷酸化酶的磷酸化作用而獲得1992年的諾貝爾醫學獎。

圖1 糖原磷酸化酶催化反應示意圖Fig.1 The reactions illustrated are of glycogen phosphorylase
糖苷磷酸化酶(glycoside phosphorylase,GP)與糖苷轉移酶(glycosyltransferase,GT)、糖苷水解酶(glycoside hydrolase,GH)是可以使糖苷鍵形成與斷裂的3種主要酶。與糖苷水解酶相比,糖苷磷酸化酶產物的代謝結合不需要ATP,同時由于其催化的反應可逆,可以逆向反應合成一些寡糖。與合成酶——糖苷轉移酶相比,糖苷磷酸化酶不需要斷開高能的糖基-核苷酸鍵(磷酸二酯鍵),且底物成本低,使得磷酸化酶在工業方面的研究更加廣泛。
1 酶活力測定方法
傳統的磷酸化酶酶活力測定方法為高效液相色譜法(HPLC),其缺點是需要昂貴的設備以及特殊的色譜柱。現在人們通常使用基于磷酸鹽比色法的酶活力測定方法,磷酸鹽比色法是基于磷酸鹽和鉬酸鹽與還原劑或染料形成的有色絡合物,該方法使得磷酸化酶的酶活力測定更加簡便經濟。近年來磷酸鹽比色法的研究與應用還在不斷深入,測量方法也日漸成熟。1999年ELIZABETH等[3]比較了5種基于磷鉬酸鹽絡合物的磷酸鹽比色法,發現抗壞血酸還原法具有顏色穩定和低背景值的優勢。2004年GAWRONSKI等[4]將磷酸鹽一抗壞血酸比色法用于測定谷氨酰胺合成酶的活性測定,檢測的線性范圍從不足5 nmol/L擴大到100 nmol/L。2010年,GROE E等[5]對GAWRONSKI等的方法進行改良后用于糖苷磷酸化酶篩選,改良后檢測的線性范圍達到3 mmol/L。此外,除磷酸鹽比色法之外還可以通過特定的試劑盒檢測底物消耗或產物生成來定義磷酸化酶活性。
2 二糖磷酸化酶的分類與作用
按照底物的不同可以將磷酸化酶分為3大類,二糖磷酸化酶、寡糖磷酸化酶以及多糖磷酸化酶。由于在磷酸化酶家族中主要為二糖磷酸化酶,本綜述僅對二糖磷酸化酶進行討論。關于其他磷酸化酶可以參考其他綜述[6-9]。
根據糖基供體和所得的糖基磷酸的異頭碳構型是否一致,可以將二糖磷酸化酶分為保留型和翻轉型[10]。保留型的二糖磷酸化酶不會改變底物和磷酸化產物之間的異頭碳構型,即α-糖苷底物被轉化為α-糖基磷酸,β-糖苷底物被轉化為β-糖基磷酸。保留型二糖磷酸化酶分布在GH和GT家族中。其中蔗糖磷酸化酶為GH13家族,最早在1942年被SCHWARZ等[11]發現。來自Bifidobacteriumadolescentis的蔗糖磷酸化酶的晶體結構以及定點突變等的研究表明,其利用雙置換機制催化蔗糖轉化為α-D-葡萄糖1-磷酸和D-果糖[12]。1988年KITAMOTO等[13]在真菌Flammulinaelutipes中發現海藻糖磷酸化酶,海藻糖磷酸化酶(保留型)為GT4家族,利用直接親和置換機制催化海藻糖形成α-D-葡萄糖1-磷酸和D-葡萄糖(表1)。

表1 保留型二糖磷酸化酶分類Table 1 Classification of retaining disaccharide phosphorylases
翻轉型的二糖磷酸化酶能夠改變磷酸化產物的異頭碳構型,即α-糖苷底物被轉化為β-糖基磷酸,或β-糖苷底物被轉化為α-糖基磷酸。翻轉型二糖磷酸化酶全部存在于GH家族中,即GH65、GH94、GH112和GH130。與保留型二糖磷酸化酶相比,翻轉型二糖磷酸化酶家族龐大,4個家族多達13個酶。
GH65家族中的二糖磷酸化酶作用于α-葡萄糖苷,除異麥芽糖之外的所有通過α-糖苷鍵連接的二糖均可以被相應的翻轉型二糖磷酸化酶磷酸化產生β-D-葡萄糖1-磷酸。其中產生β-D-葡萄糖1-磷酸和D-葡萄糖的酶包括麥芽糖磷酸化酶、曲二糖磷酸化酶、黑曲霉糖磷酸化酶和海藻糖磷酸化酶(翻轉型)(表2)。麥芽糖磷酸化酶首先在Neisseriameningitidis被發現[14],但編碼其蛋白的基因則首先從Lactobacillussanfranciscensis中被克隆[15]。海藻糖磷酸化酶(翻轉型)最早發現于原生動物Euglenagracilis中[16],其基因則首先從Thermoanaerobacterbrockii中被克隆[17]。曲二糖磷酸化酶從T.brockii被鑒定[18]與克隆[19]。黑曲霉糖磷酸化酶于2012年在Clostridiumphytofermentans被NIHIRA等[20]發現,黑曲霉糖磷酸化酶與其他相關酶耦聯后通過多酶級聯反應可以從麥芽糖、蔗糖、淀粉中生產黑曲霉糖[21]。作用于二糖并歸類于該家族的另一個磷酸化酶是α-D-葡萄糖基-1,3-L-鼠李糖磷酸化酶,NIHIRA等[22]在C.phytofermentans中發現該酶,并發現其具有嚴格的區域選擇性,在逆向反應中僅利用L-鼠李糖作為受體。
GH94家族中的二糖磷酸化酶除N,N’-二乙酰基殼二糖磷酸化酶之外均在β-葡萄糖苷構型的底物上有活性,N,N’-二乙酰基殼二糖磷酸化酶催化產物為乙酰基-D-葡萄糖胺和乙酰基-D-葡糖胺1-磷酸,其他2種酶催化產物則均為D-葡萄糖1-磷酸和D-葡萄糖。其中纖維二糖磷酸化酶最為著名,1955年首先在Clostridiumthermocellum中發現[23],并最先從Clostridiumstercorarium中克隆[24]。昆布二糖磷酸化酶最早發現于E.gracilis中[25],從Paenibacillussp.中鑒定出活性[26]并隨后在Acholeplasmalaidlawii中克隆了其基因[27]。N,N’-二乙酰基殼二糖磷酸化酶是作用于N-乙酰基-β-氨基葡萄糖苷的一種酶,在ibriofurnissii中發現[28],該酶被認為與幾丁質的代謝有關[7]。
GH112家族是作用于β-半乳糖苷生成α-D-半乳糖1-磷酸的磷酸化酶家族。目前只包括β-D-半乳糖基-1,3-N-乙酰基己糖胺磷酸化酶和β-D-半乳糖基-1,4-L-鼠李糖磷酸化酶兩種二糖磷酸化酶。β-D-半乳糖基-1,3-N-乙酰基己糖胺磷酸化酶首先在Bifidobacteriumbifidum的無細胞提取物中被鑒定[29],其基因則最先從Bifidobacteriumlongum中被克隆[30]。2009年在C.phytofermentans的基因組中發現了β-D-半乳糖基-1,4-L-鼠李糖磷酸化酶[31],隨后NAKAJIMA等人對該酶進行了性質鑒定,發現其不僅能磷酸化β-D-半乳糖基-1,4-L-鼠李糖,并且還顯示出對次要底物β-D-半乳糖基-1,3-D-葡萄糖的活性[32]。
GH130家族的二糖磷酸化酶作用于β-甘露糖苷,可產生α-D-甘露糖1-磷酸。該家族包括3個二糖磷酸化酶,分別是β-1,2-甘露二糖磷酸化酶、β-D-甘露糖基-D-葡萄糖磷酸化酶和β-D-甘露糖基-1,4-N-乙酰氨基葡萄糖磷酸化酶。2014年CHIKU等[33]從Thermoanaerobactersp.中鑒定出β-1,2-甘露二糖磷酸化酶,隨后TSUDA等[34]對來源于Listeriainnocua的β-1,2-甘露二糖磷酸化酶進行了表征。從Bacteroidesfragilis中發現編碼β-D-甘露糖基-D-葡萄糖磷酸化酶的基因,并確定該酶催化的反應為:β-D-甘露糖基-1,4-D-葡萄糖+Pi→α-D-甘露糖1-磷酸+D-葡萄糖[35]。2013年NIHIRA等[36]在Bacteroidesthetaiotaomicron中鑒定出β-D-甘露糖基-1,4-N-乙酰氨基葡萄糖磷酸化酶,并指出其催化β-D-甘露糖基-1,4-N-乙酰基-D-葡萄糖胺轉化為α-D-甘露糖1-磷酸和N-乙酰基-D-葡萄糖胺。

表2 翻轉型二糖磷酸化酶分類Table 2 Classification of in erting disaccharide phosphorylases
3 二糖磷酸化酶在體外合成生物學中的應用與存在的問題
3.1 合成寡糖及其他高價值化學品
1985年MURAO等[37]通過偶聯海藻糖磷酸化酶和麥芽糖磷酸化酶從麥芽糖合成海藻糖,首先麥芽糖磷酸化酶催化麥芽糖生成β-葡萄糖1-磷酸和葡萄糖,然后海藻糖磷酸化酶以β-葡萄糖1-磷酸和葡萄糖為底物合成海藻糖,這是首次報道通過結合兩種磷酸化酶方式來制備海藻糖。AERTS等[38]詳細研究了蔗糖磷酸化酶的受體特性,表明該酶具有廣泛的受體特異性。此后,基于這種結合2種或多種酶的方式以及二糖磷酸化酶寬松的受體偏好性,許多研究小組對生產稀有糖或寡糖展開研究。MORIMOTO等[39]通過使用葡萄糖1-磷酸作為糖基供體和8種酮己糖作為受體,利用來自Leuconostocmesenteroides的蔗糖磷酸化酶合成了8種相應的D-葡萄糖基-酮己糖,其中D-葡萄糖基-阿洛酮糖產率最高。ICHIKAWA等[40]采用一鍋法從蔗糖合成N-乙酰氨基乳糖。WILDBERGER等[41]利用蔗糖磷酸化酶將蔗糖轉化為葡萄糖1-磷酸后,將葡萄糖1-磷酸分別與D-甘露糖、D-半乳糖、D-乙酰氨基葡萄糖、D-葡萄糖胺、L-巖藻糖、D-木糖、D-阿拉伯糖、L-阿拉伯糖作為共同底物通過α-葡萄糖1-磷酸酶(EC 3.1.3.10)生產8種相應的糖1-磷酸。
綜上所述,我們可以總結出一種合成寡糖或高附加值產物的普遍策略,即使用二糖磷酸化酶作為葡萄糖1-磷酸的原位生成器,然后將其作為其他磷酸化酶或其他酶元件所催化反應的底物。
目前已經有很多基于上述策略利用二糖磷酸化酶進行生物催化合成高價值化學品的應用研究。例如纖維二糖磷酸化酶與纖維二糖水解酶(EC 3.2.1.91)、內切葡聚糖酶(EC 3.2.1.4)以及α-葡聚糖磷酸化酶(EC 2.4.1.1)共同作用從纖維素合成直鏈淀粉(圖2)[42]。纖維二糖磷酸化酶與纖維糊精磷酸化酶(EC 2.4.1.49)、聚磷酸葡萄糖激酶(EC 2.7.1.63)、葡萄糖磷酸變位酶(EC 5.4.2.2)、肌醇1-磷酸合成酶(EC
5.5.1.4)、肌醇單磷酸酶(EC 3.1.3.25)進行級聯反應催化纖維糊精合成肌醇(圖3)[43]。蔗糖磷酸化酶與磷酸葡萄糖變位酶、肌醇1-磷酸合成酶、肌醇單磷酸酶將蔗糖轉化為肌醇與果糖(圖4)[44]。昆布二糖磷酸化酶和異淀粉酶(EC 3.2.1.68)、α-葡聚糖磷酸化酶、4-葡聚糖轉移酶(EC 2.4.1.25)構成多酶催化途徑從麥芽糊精和葡萄糖合成昆布二糖(圖5)[45]。
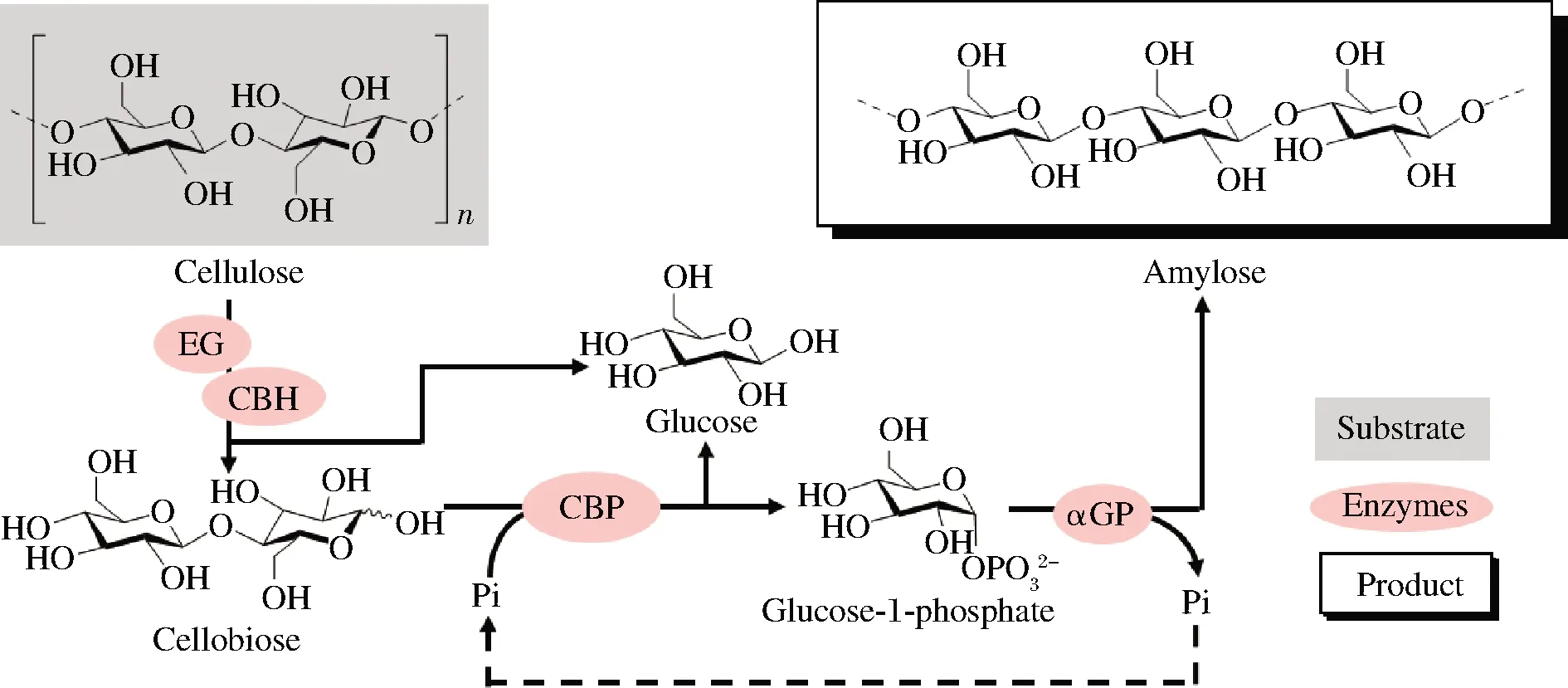
EG-內切葡聚糖酶(endoglucanases);CBH-纖維二糖水解酶(cellobiohydrolase);CBP-纖維二糖磷酸化酶(cellobiose phosphorylase);αGP-α-葡聚糖磷酸化酶(α-glucan phosphorylase)圖2 纖維二糖磷酸化酶參與纖維素合成直鏈淀粉Fig.2 Cellobiose phosphorylase participates in synthesis of amylose from cellulose
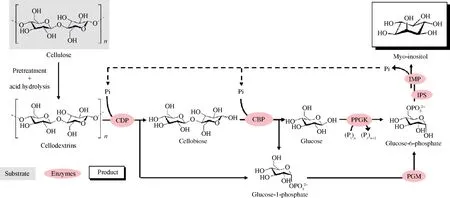
CDP-纖維糊精磷酸化酶(cellodextrin phosphorylase);CBP-纖維二糖磷酸化酶(cellobiose phosphorylase);PPGK-聚磷酸葡萄糖激酶(polyphosphate glucokinase);PGM-葡萄糖磷酸變位酶(phosphoglucomutase);IPS-肌醇1-磷酸合成酶(inositol 1-phosphate synthase);IMP-肌醇單磷酸酶(inositol monophosphatase)圖3 纖維二糖磷酸化酶參與纖維糊精合成肌醇Fig.3 Cellobiose phosphorylase participates in synthesis of myo-inositol from cellodextrins
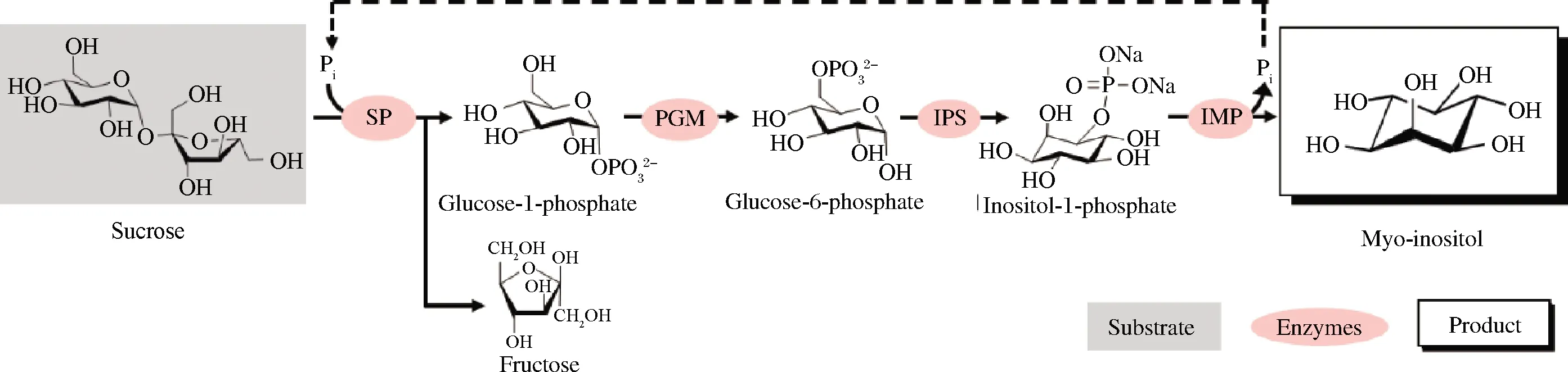
SP-蔗糖磷酸化酶(sucrose phosphorylase);PGM-葡萄糖磷酸變位酶(phosphoglucomutase);IPS-肌醇1-磷酸合成酶(inositol 1-phosphate synthase);IMP-肌醇單磷酸酶(inositol monophosphatase)圖4 蔗糖磷酸化酶參與蔗糖合成肌醇Fig.4 Sucrose phosphorylase participates in synthesis of myo-inositol from sucrose
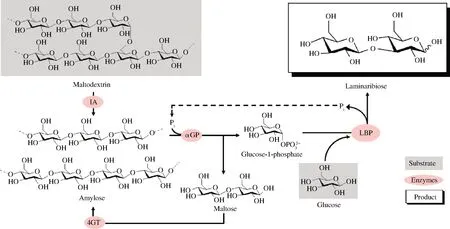
IA-異淀粉酶(isoamylase);4GT-4-葡聚糖轉移酶(4-α-glucanotransferase);αGP-α-葡聚糖磷酸化酶(α-glucan phosphorylase);LBP-昆布二糖磷酸化酶(laminaribiose phosphorylase)圖5 昆布二糖磷酸化酶參與麥芽糊精和葡萄糖合成昆布二糖Fig.5 Laminaribiose phosphorylase participates in synthesis of laminaribiose from maltodextrin and glucose
3.2 能源開發
自第二次工業革命以來,人類對不可再生資源的消耗導致化石燃料逐漸枯竭,有限的不可再生資源迫使人類開始開發各種可持續綠色能源,如太陽能、風能、水能等等。其中氫能被認為是最具潛力的綠色能源,未來氫能源有望替代化石能源成為工業化生產中最好的燃料。目前氫氣的生產主要來源于天然氣,還有一少部分來源于電解水和太陽能分解水,然而這兩種技術由于其成本昂貴、生產效率低等問題并不適合實際社會應用。為了減少對化石燃料的依賴,使氫能源可持續生產,近年來科學家們開發了一種新的產氫技術,而二糖磷酸化酶在這其中扮演了重要角色。2009年,YE等[46]通過將纖維二糖磷酸化酶與12個酶耦聯構建了一個體外合成氫氣途徑,成功利用纖維二糖產氫(圖6)。在該途徑中,首先纖維二糖磷酸化酶將纖維二糖轉化為葡萄糖1-磷酸,其次葡萄糖磷酸變位酶催化葡萄糖-1-磷酸產生葡萄糖6-磷酸,然后兩種脫氫酶——葡萄糖6-磷酸脫氫酶和6-磷酸葡糖酸脫氫酶催化NADPH和核酮糖5-磷酸的生成,同時磷酸戊糖途徑的8個酶催化核酮糖5-磷酸再生葡萄糖6-磷酸,最后氫化酶催化NADPH產生氫氣。2014年,MYUNG等[47]設計了由15種酶組成的體外合成酶促途徑,以蔗糖為底物利用蔗糖磷酸化酶將其轉化為下游反應的底物——葡萄糖1-磷酸和果糖(圖7),并通過分批補料的方法使氫氣最終的產率達到9.74 mmol/(L·h)。
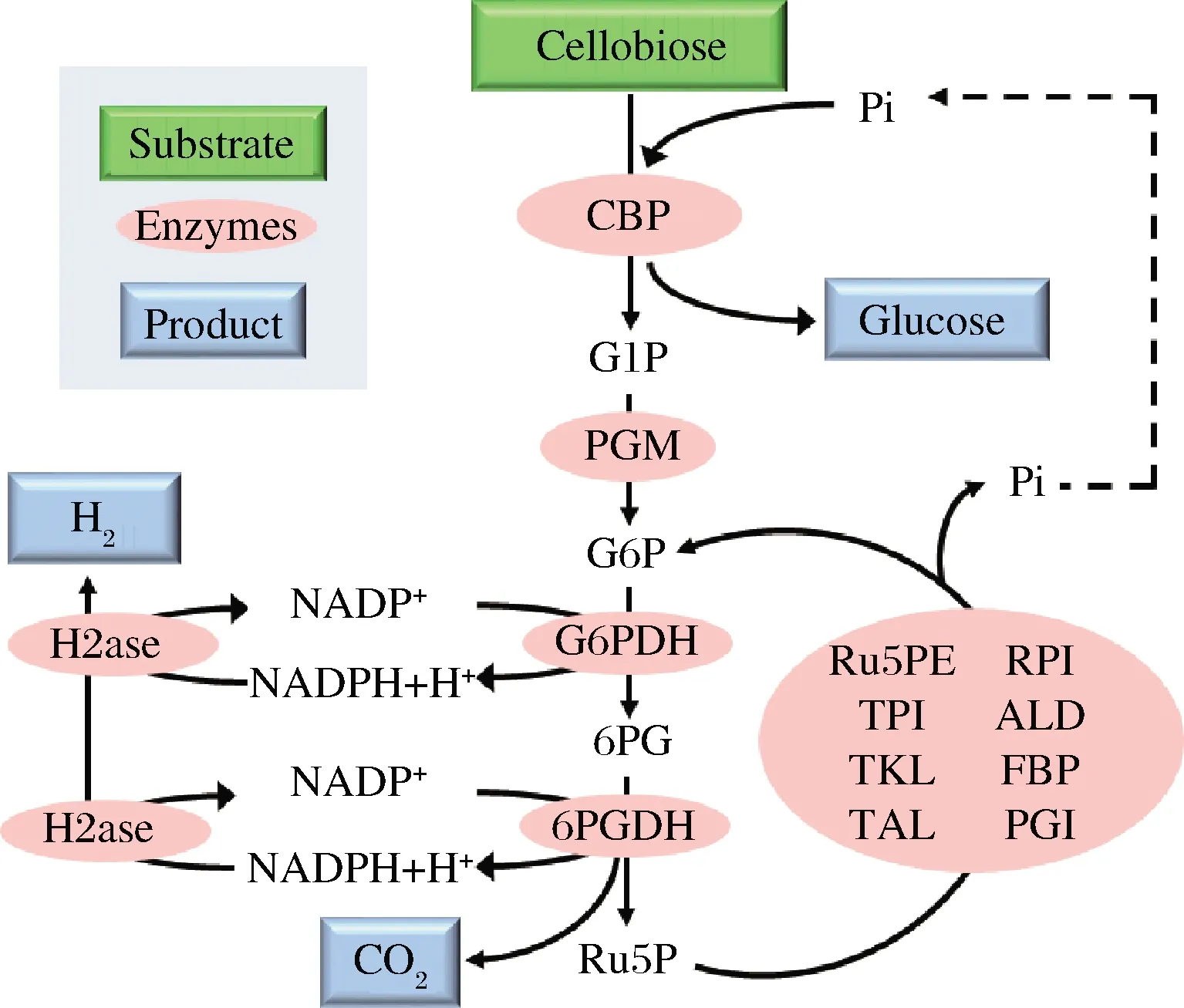
CBP-纖維二糖磷酸化酶(cellobiose phosphorylase);PGM-葡萄糖磷酸變位酶(phosphoglucomutase);G6PDH-葡萄糖6-磷酸脫氫酶(glucose 6-phosphate dehydrogenase);6PGDH-6-磷酸葡糖酸脫氫酶(6-phosphogluconate dehydrogenase);Ru5PE-核酮糖5-磷酸3-差向異構酶(ribulose 5-phosphate epimerase);RPI-核糖5-磷酸異構酶(phosphoribose isomerase);TKL-轉酮醇酶(transketolase);TAL-轉醛醇酶(transaldolase);TPI-丙糖磷酸異構酶(triose phosphate isomerase);ALD-果糖二磷酸醛縮酶(aldolase);FBP-果糖二磷酸酶(fructose-1,6-bisphosphatase);PGI-磷酸葡萄糖異構酶(phosphoglucose isomerase);H2ase-氫化酶(hydrogenase);G1P-葡萄糖1-磷酸(glucose 1-phosphate);G6P-葡萄糖6-磷酸(glucose 6-phosphate);6PG-葡萄糖6-磷酸內酯(6-phosphogluconate);Ru5P-核酮糖5-磷酸(ribulose 5-phosphate)圖6 纖維二糖磷酸化酶參與纖維二糖產氫氣Fig.6 Cellobiose phosphorylase participates in production of hydrogen from cellobiose
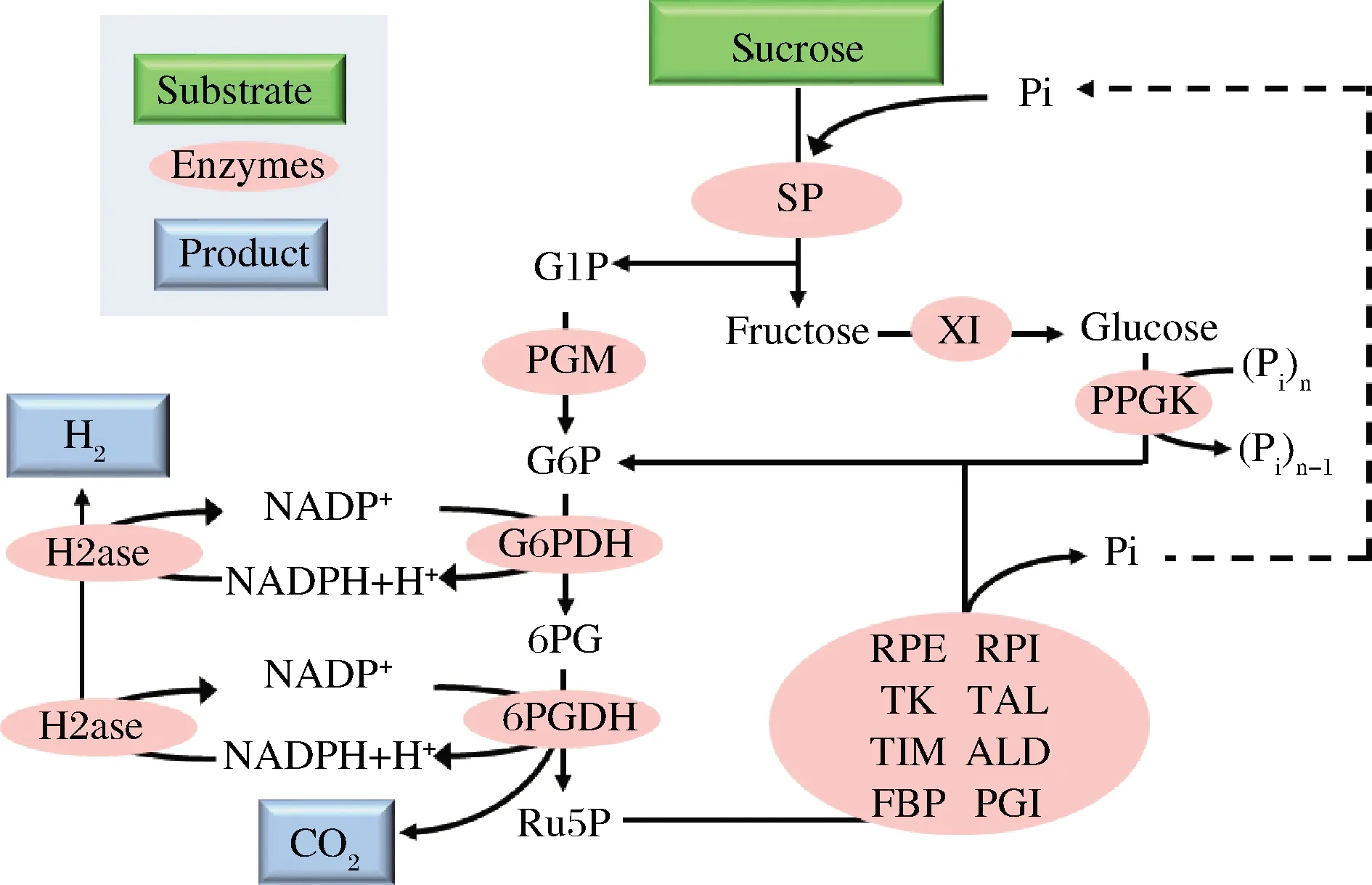
SP-蔗糖磷酸化酶(sucrose phosphorylase);PGM-葡萄糖磷酸變位酶(phosphoglucomutase);XI-木糖異構酶(xylose isomerase);PPGK-聚磷酸葡萄糖激酶(polyphosphate glucokinase);G6PDH-葡萄糖6-磷酸脫氫酶(glucose 6-phosphate dehydrogenase);6PGDH-6-磷酸葡糖酸脫氫酶(6-phosphogluconate dehydrogenase);RPE-核酮糖5-磷酸3-差向異構酶(ribulose 5-phosphate epimerase);RPI-核糖5-磷酸異構酶(phosphoribose isomerase);TK-轉酮醇酶(transketolase);TAL-轉醛醇酶(transaldolase);TIM-丙糖磷酸異構酶(triose phosphate isomerase);ALD-果糖二磷酸醛縮酶(aldolase);FBP-果糖二磷酸酶(fructose-1,6-bisphosphatase);PGI-磷酸葡萄糖異構酶(phosphoglucose isomerase);H2ase-氫化酶(hydrogenase);G1P-葡萄糖1-磷酸(glucose 1-phosphate); G6P-葡萄糖6-磷酸(glucose 6-phosphate);6PG-葡萄糖6-磷酸內酯(6-phosphogluconate);Ru5P-核酮糖5-磷酸(ribulose 5-phosphate)圖7 蔗糖磷酸化酶參與蔗糖產氫氣Fig.7 Sucrose phosphorylase participates in production of hydrogen by oxidation of sucrose
除氫能之外,最近利用糖作為燃料的酶燃料電池作為下一代環保型電池受到了人們極大的關注。酶燃料電池是一種以酶為催化劑,將生物能和化學能轉化為電能的裝置[48],具有安全、清潔、可再生的特點。2017年,ZHU等[49]設計了一種體外15酶合成途徑,該途徑可以共同利用酶燃料電池陽極室中的蔗糖、葡萄糖和果糖,其中蔗糖磷酸化酶參與了該途徑的第一步反應(圖8)。這項實驗成果表明二糖磷酸化酶有助于開發多種以糖類物質為動力的酶燃料電池,未來更多的二糖磷酸化酶將為今后提取混合糖燃料中存儲的巨大能量提供可行性解決方案。
3.3 存在的問題
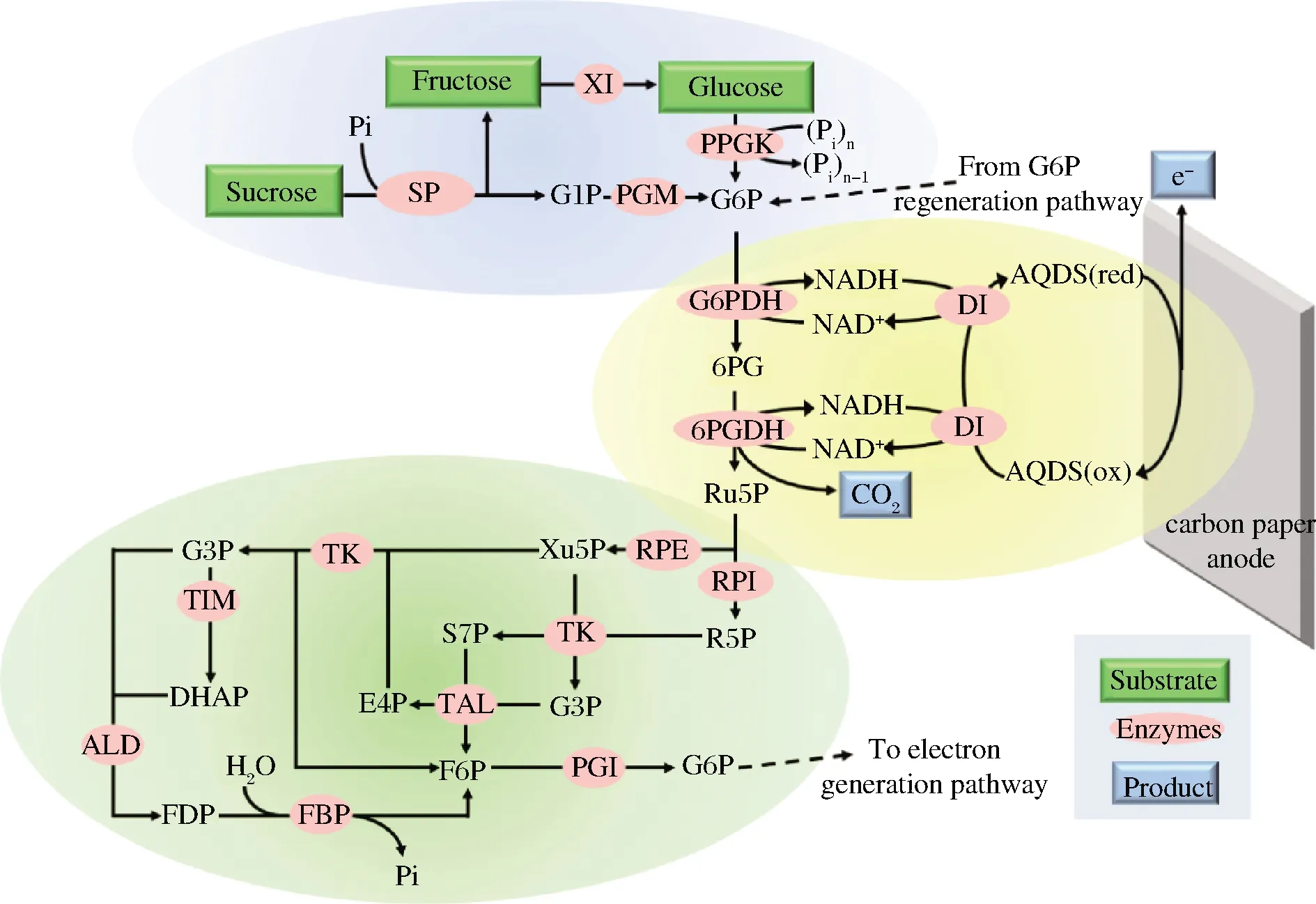
SP-蔗糖磷酸化酶(sucrose phosphorylase);PGM-葡萄糖磷酸變位酶(phosphoglucomutase);XI-木糖異構酶(xylose isomerase);PPGK-聚磷酸葡萄糖激酶(polyphosphate glucokinase);G6PDH-葡萄糖6-磷酸脫氫酶(glucose 6-phosphate dehydrogenase);6PGDH-6-磷酸葡糖酸脫氫酶(6-phosphogluconate dehydrogenase);DI-黃遞酶(diaphorase);RPE-核酮糖5-磷酸3-差向異構酶(ribulose 5-phosphate epimerase);RPI-核糖5-磷酸異構酶(phosphoribose isomerase);TK-轉酮醇酶(transketolase);TAL-轉醛醇酶(transaldolase);TIM-丙糖磷酸異構酶(triose phosphate isomerase);ALD-果糖二磷酸醛縮酶(aldolase);FBP-果糖二磷酸酶(fructose-1,6-bisphosphatase);PGI-磷酸葡萄糖異構酶(phosphoglucose isomerase);G1P-葡萄糖1-磷酸(glucose 1-phosphate); G6P-葡萄糖6-磷酸(glucose 6-phosphate);6PG-葡萄糖6-磷酸內酯(6-phosphogluconate);Ru5P-核酮糖5-磷酸(ribulose 5-phosphate);R5P-核糖5-磷酸(ribose 5-phosphate);Xu5P-木酮糖5-磷酸(xylulose 5-phosphate);G3P-甘油醛3-磷酸(glyceraldehyde 3-phosphate);S7P-景天庚酮糖7-磷酸(sedoheptulose 7-phosphate);E4P-丁糖4-磷酸(erythrose 4-phosphate);DHAP-二羥基丙酮3-磷酸(dihydroxyacetone 3-phosphate);F6P-果糖6-磷酸(fructose 6-phosphate);FDP-果糖1,6-二磷酸(fructose 1,6-bisphosphate)圖8 蔗糖磷酸化酶參與蔗糖產電Fig.8 Sucrose phosphorylase participates in generation bioelectricity by oxidation sucrose
盡管二糖磷酸化酶已經在體外合成生物學應用中取得了重大進展,然而要實現大規模生物制造仍存在一些距離。目前我們仍然不清楚為何該磷酸化過程主要作用于己糖而似乎并不存在于戊糖中,因此二糖磷酸化酶僅鑒定了14種受體底物,這嚴重限制了二糖磷酸化酶的廣泛應用。另外很多二糖磷酸化酶的穩定性達不到工業化操作的條件。因此通過基因挖掘篩選新型二糖磷酸化酶或對現有二糖磷酸化酶進行蛋白質工程改造,擴大二糖磷酸化酶的底物譜和熱穩定性,可以提高二糖磷酸化酶在體外合成生物學中的應用范圍。酶的成本是也是體外生物合成平臺商業化的關鍵因素,可以通過重組蛋白表達、密碼子優化、高密度發酵等方式提高酶的表達水平和降低酶的生產成本,在此基礎上,通過酶固定化方式可以實現對二糖磷酸化酶的回收利用,從而進一步降低酶的成本。
4 結論與展望
盡管二糖磷酸化酶僅僅是浩瀚酶庫中的一小部分,但近年來被公認為在體外生物合成系統中是有價值的酶促工具。目前所有的二糖磷酸化酶均分布在GH和GT家族中,共6個家族15種酶,其受體底物共14種,供體特異性比較狹窄,僅局限于D-葡萄糖1-磷酸、D-半乳糖1-磷酸和D-甘露糖1-磷酸,所以二糖磷酸化酶在體外合成生物學中面臨底物譜狹窄的問題,加上熱穩定性和生產成本等問題,大大限制了二糖磷酸化酶在體外合成生物學中的工業化應用。然而隨著現代基因組測序技術和宏基因組技術的高速發展以及酶改造手段的開發,會有越來越多具有新功能的二糖磷酸化酶被發掘。通過具有新功能的二糖磷酸化酶的蛋白質結構和新功能之間關系的研究,對此類酶的認知將會更加深入,這將有助于二糖磷酸化酶在體外生物合成中的應用更加廣泛且有效。

