PKC介導(dǎo)P38MAPK通路調(diào)控結(jié)直腸癌細(xì)胞MMP-9表達(dá)及侵襲的研究
姜媛 謝海娟 王毓興
[摘要] 目的 研究MAPK信號通路對結(jié)直腸癌SW480細(xì)胞MMP-9表達(dá)及細(xì)胞侵襲作用的影響。 方法 觀察蛋白激酶C激活劑TPA誘導(dǎo)下SW480細(xì)胞形態(tài)學(xué)的改變;蛋白免疫印跡法檢測MMP-9、P38MAPK蛋白的表達(dá),zymography法檢測MMP-9蛋白的分泌,利用Transwell實(shí)驗(yàn)觀察細(xì)胞侵襲能力。 結(jié)果 顯微鏡下觀察,隨著TPA濃度的升高,細(xì)胞形態(tài)逐漸改變成針尖樣;蛋白免疫印跡法顯示,TPA處理下P38磷酸化增加,MMP-9蛋白表達(dá)和分泌增加,呈時(shí)間依賴性;并且腫瘤細(xì)胞侵襲能力隨之增強(qiáng);而通過預(yù)處理PKC抑制劑和P38抑制劑,可明顯抑制TPA誘導(dǎo)的MMP-9表達(dá)和細(xì)胞侵襲能力。 結(jié)論 在結(jié)直腸癌SW480細(xì)胞中PKC激動(dòng)劑TPA通過激活P38 MAPK信號通路調(diào)控MMP-9表達(dá)及細(xì)胞侵襲,為阻止結(jié)直腸癌侵襲轉(zhuǎn)移研究提出多方位的作用靶點(diǎn)和新思路。
[關(guān)鍵詞] 基質(zhì)金屬蛋白-9;促分裂原活化蛋白激酶P38;細(xì)胞侵襲;蛋白激酶C;結(jié)直腸癌
[中圖分類號] R735.35 ? ? ? ? ?[文獻(xiàn)標(biāo)識碼] A ? ? ? ? ?[文章編號] 1673-9701(2020)26-0004-04
[Abstract] Objective To study the effect of MAPK signaling pathway on the MMP-9 expression and cell invasion in colorectal cancer SW480 cells. Methods The morphological changes of SW480 cells induced by TPA, the activator of protein kinase C(PKC), were observed. Western blot method was adopted to detect the expression of MMP-9 and P38MAPK protein. Zymography was used to detect the secretion of MMP-9 protein. Transwell experiment was performed for the observation of cell invasion ability. Results Under microscope, with the increase of TPA concentration, the cell morphology gradually changed into pinpoint shape. Western blot method showed that after TPA treatment, the phosphorylation of P38 and the expression and secretion of MMP-9 protein increased in a time-dependent manner, and the tumor cell invasion ability was enhanced. However, the pretreatment of PKC inhibitor and P38 inhibitor can obviously inhibit the MMP-9 expression and cell invasion ability induced by TPA. Conclusion TPA, a PKC agonist, regulates and controls the MMP-9 expression and cell invasion through activating P38MAPK signaling pathway in colorectal cancer SW480 cells, which provides multi-directional targets and new ideas for the research on preventing the invasion and metastasis of colorectal cancer.
[Key words] Matrix metalloproteinase-9; P38 mitogen-activated protein kinase; Cell invasion; Protein kinase C; Colorectal cancer
結(jié)直腸癌(Colorectal cancer,CRC)約占全球所有新發(fā)癌癥病例的10%,也是我國最常見的消化道惡性腫瘤之一,15%~25%的CRC患者在初診時(shí)已發(fā)生遠(yuǎn)處轉(zhuǎn)移[1,2]。細(xì)胞侵襲是腫瘤轉(zhuǎn)移過程的前提條件,是腫瘤患者治療失敗和致死的關(guān)鍵因素,腫瘤侵襲相關(guān)研究一直是結(jié)直腸癌研究的焦點(diǎn)。基質(zhì)金屬蛋白酶(MMPs)是腫瘤浸潤轉(zhuǎn)移過程中的啟動(dòng)因子,降解基底膜、細(xì)胞外基質(zhì)等,促進(jìn)腫瘤細(xì)胞向周圍組織浸潤、最終導(dǎo)致遠(yuǎn)處轉(zhuǎn)移[3]。MMP-9是MMPs家族中的重要成員,它參與多種人類腫瘤的發(fā)展,通過基底膜和細(xì)胞外基質(zhì)的降解促進(jìn)腫瘤進(jìn)展,包括侵襲、轉(zhuǎn)移、生長和血管生成[4]。國外報(bào)道證實(shí)結(jié)直腸癌患者M(jìn)MP-9表達(dá)水平與預(yù)后密切相關(guān)[5]。蛋白激酶C(PKC)是調(diào)控細(xì)胞增殖、凋亡和遷移等多種過程的主要信號因子。有報(bào)道顯示,PKC與結(jié)直腸癌侵襲密切相關(guān)[6,7]。PKC激活劑TPA已被公認(rèn)為腫瘤促進(jìn)劑,也是MMPs的強(qiáng)激活劑,可促進(jìn)乳腺癌細(xì)胞侵襲中MMP-9合成和分泌[8]。因此,抑制MMPs被認(rèn)為是降低腫瘤細(xì)胞侵襲潛力的新策略。本研究旨在探討MAPK信號通路對結(jié)直腸癌細(xì)胞PKC/MMP-9表達(dá)和細(xì)胞侵襲的作用,為進(jìn)一步了解結(jié)直腸癌侵襲遷移提供多方位的分子位點(diǎn),現(xiàn)報(bào)道如下。
1 材料與方法
1.1 材料來源
人結(jié)直腸癌SW480細(xì)胞株(中科院上海細(xì)胞庫),RPMI-1640培養(yǎng)基(Gibco公司);胎牛血清(Hyclone公司);TPA、GF109203X、SB203580(Sigma公司);Bradford蛋白濃度測定試劑盒、ECL試劑盒(北京索萊寶公司);anti-p38、anti-p-p38、anti-β-actin(Abcam公司);anti-MMP-9、HRP標(biāo)記IgG(Santa Cruz公司);Transwell侵襲系統(tǒng)(costor公司)。
1.2 方法
1.2.1 細(xì)胞培養(yǎng) ?人結(jié)直腸癌細(xì)胞株SW480細(xì)胞使用10%胎牛血清(FBS)和1%抗生素的RPMI-1640培養(yǎng)基,在5%CO2、37℃培養(yǎng)箱中培養(yǎng),當(dāng)細(xì)胞生長至80%~90%時(shí)進(jìn)行傳代培養(yǎng)。
1.2.2 細(xì)胞形態(tài)學(xué)觀察 ?取對數(shù)生長期SW480細(xì)胞,按所需濃度接種于6孔板中,待細(xì)胞長至50%~60%愈合后,更換新鮮培養(yǎng)基,給予不同濃度(0、20、50、100 nM)TPA處理24 h后,在倒置顯微鏡下觀察細(xì)胞形態(tài)學(xué)變化。
1.2.3 蛋白印跡法檢測蛋白表達(dá) ?根據(jù)研究目的,100 nM TPA處理0、0.5、1、3、6、12、24 h,或用1 μM GF109203X、20 μM SB203580預(yù)處理SW480細(xì)胞1 h,然后與100 nM TPA共孵育24 h。用冰冷的蛋白提取液裂解細(xì)胞,用Bradford法測定裂解液中的蛋白質(zhì)濃度。每組30 μg蛋白與2×SDS加樣緩沖液混勻制備成上樣液,進(jìn)行SDS-PAGE電泳分離蛋白,并轉(zhuǎn)移到PVDF膜上,用5%脫脂牛奶封閉2 h,然后在4℃下與1∶2000稀釋的一抗孵育過夜,洗膜5次,以1∶2000稀釋的HRP-IgG二抗常溫孵育2 h,洗膜,用ECL試劑盒顯色,用圖像分析儀通過信號分析確定蛋白表達(dá)水平。
1.2.4 明膠酶譜法檢測MMP-9的活性 ?使用無FBS的培養(yǎng)基進(jìn)行處理,用1 μM GF109203X、20 μM SB203580預(yù)處理SW480細(xì)胞1 h,然后與100 nM TPA孵育24 h。經(jīng)24 h處理后收集培養(yǎng)基,與非還原樣品緩沖液混合,在含有0.1%明膠的聚丙烯酰胺凝膠中電泳,用2.5%Triton X-100溶液在室溫下洗滌30 min,然后用5 mM CaCl2,0.02% Brij,50 mM Tris-HCl(pH=7.5)溶液在37℃中孵育過夜。用0.25%考馬斯亮藍(lán)染色及脫色,并在圖像分析儀上拍照。
1.2.5 Transwell檢測細(xì)胞侵襲能力 ?利用Transwell侵襲實(shí)驗(yàn)檢測各實(shí)驗(yàn)組對SW480細(xì)胞的侵襲作用。侵襲實(shí)驗(yàn)在24孔板中進(jìn)行,用20 μL基質(zhì)膠涂層。基質(zhì)膠在培養(yǎng)基中重新水化30 min,各組細(xì)胞懸液分別加入上室,條件培養(yǎng)基加入下室孵育24 h。孵育后,用棉簽去除腔室上側(cè)的細(xì)胞,0.1%甲醇固定細(xì)胞并用臺(tái)盼藍(lán)溶液染色,利用光學(xué)顯微鏡隨機(jī)5個(gè)視野計(jì)數(shù)侵入細(xì)胞。
1.3 觀察指標(biāo)
觀察各組細(xì)胞形態(tài)學(xué)變化、P38MAPK信號通路、MMP-9蛋白表達(dá)以及細(xì)胞侵襲能力的變化。觀察各種抑制劑對TPA誘導(dǎo)MMP-9蛋白表達(dá)及分泌的影響。
1.4 統(tǒng)計(jì)學(xué)方法
采用SPSS16.0統(tǒng)計(jì)學(xué)軟件對實(shí)驗(yàn)結(jié)果進(jìn)行分析。計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(x±s)表示,多組數(shù)據(jù)比較采用單因素方差分析,組間比較采用獨(dú)立樣本t檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 TPA對SW480細(xì)胞形態(tài)學(xué)的影響
觀察不同濃度(0、20、50、100 nM)PKC激動(dòng)劑TPA誘導(dǎo)SW480細(xì)胞24 h后細(xì)胞形態(tài)學(xué)的變化,如封三圖1所示:空白對照細(xì)胞之間有緊密聯(lián)系,具有上皮細(xì)胞特點(diǎn);隨著TPA濃度升高SW480細(xì)胞失去極性,排列松散,細(xì)胞間隙增寬,緊密聯(lián)接消失,細(xì)胞形態(tài)逐漸變成針尖狀,向類似間質(zhì)細(xì)胞的形態(tài)轉(zhuǎn)化。
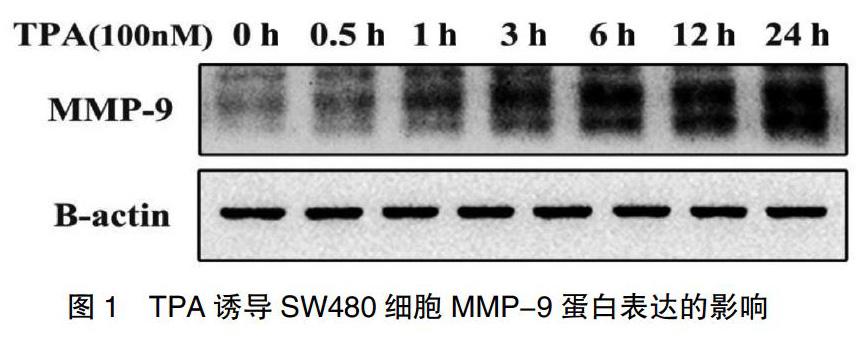
2.2 TPA對MMP-9蛋白表達(dá)水平的影響
為了觀察TPA對MMP-9蛋白表達(dá)水平的影響,利用Western Blot法檢測TPA處理0、0.5、1、3、6、12 h和24 h時(shí)SW480細(xì)胞中MMP-9蛋白表達(dá)的水平。如圖1所示,發(fā)現(xiàn)隨著TPA誘導(dǎo)時(shí)間的延長,MMP-9蛋白表達(dá)逐漸增高,呈時(shí)間依賴性,24 h時(shí)升高最明顯。
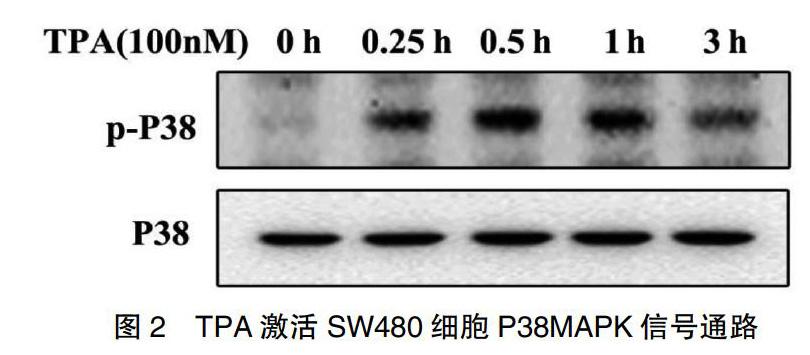
2.3 TPA對P38MAPK信號通路的影響
為了進(jìn)一步驗(yàn)證TPA誘導(dǎo)MMP-9的信號傳導(dǎo)通路,檢測TPA誘導(dǎo)0、0.25、0.5、1 h和3 h時(shí)P38 MAPK通路激活情況。P38的激活是通過其磷酸化為P-P38來實(shí)現(xiàn)的。如圖2所示,TPA誘導(dǎo)P-P38蛋白表達(dá)水平逐漸增高,0.5 h時(shí)P-P38水平升高最顯著,提示TPA誘導(dǎo)MMP-9過程中可激活P38MAPK通路。
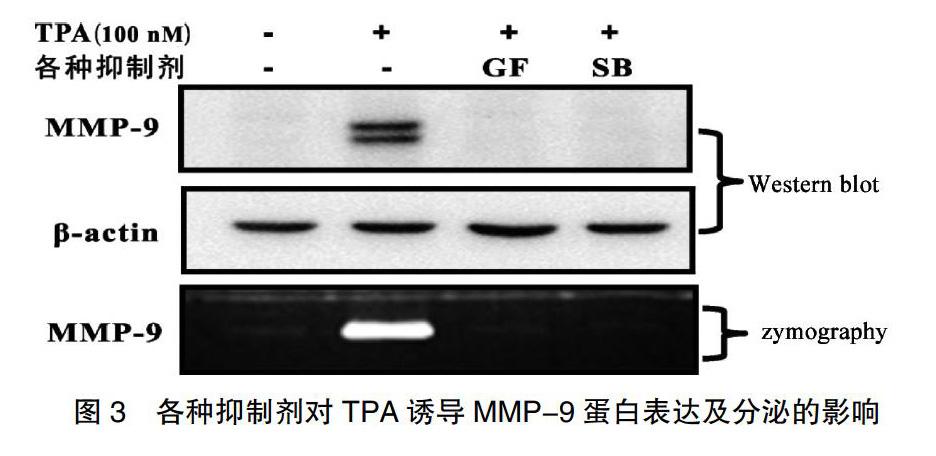
2.4 各種抑制劑對TPA誘導(dǎo)MMP-9蛋白表達(dá)及分泌的影響
利用Western Blot法檢測MMP-9蛋白表達(dá)情況;利用明膠酶譜法檢測MMP-9細(xì)胞外分泌情況,各實(shí)驗(yàn)組細(xì)胞MMP-9蛋白表達(dá)水平。如圖3所示,預(yù)處理PKC抑制劑GF109203X、P38抑制劑SB203580后,TPA誘導(dǎo)增加的MMP-9蛋白表達(dá)和分泌均被明顯抑制,提示TPA激活PKC-P38MAPK通路誘導(dǎo)MMP-9蛋白表達(dá)和分泌。
2.5 TPA對SW480細(xì)胞侵襲能力的影響
利用Transwell侵襲實(shí)驗(yàn)檢測TPA對SW480細(xì)胞侵襲能力的影響。如封三圖2所示,與空白對照組相比,單用TPA后穿過基底膜的細(xì)胞數(shù)量明顯增加,差異有統(tǒng)計(jì)學(xué)意義(P<0.01);與單用TPA組相比,TPA與PKC抑制劑GF109203X或P38抑制劑SB203580合用后,穿過基底膜的細(xì)胞數(shù)量明顯減少,差異有統(tǒng)計(jì)學(xué)意義(P<0.01),顯示TPA可明顯增強(qiáng)SW480細(xì)胞的侵襲能力,這種增強(qiáng)均可被PKC抑制劑GF109203X和P38抑制劑SB203580所抑制,再次證明TPA通過PKC-P38MAPK通路誘導(dǎo)SW480細(xì)胞MMP-9表達(dá)及細(xì)胞侵襲的作用。見表1、封三圖2。
3 討論
近年來研究顯示PKCs是一種轉(zhuǎn)化癌基因,PKC在腫瘤發(fā)生、發(fā)展及對抗瘤因子的反應(yīng)均起到重要作用,可介導(dǎo)腫瘤細(xì)胞黏附、運(yùn)動(dòng)、侵襲及轉(zhuǎn)移過程[9]。然而,PKC誘導(dǎo)細(xì)胞侵襲的機(jī)制仍然撲朔迷離。本研究結(jié)果顯示,TPA通過PKC下游分子P38MAPK信號通路誘導(dǎo)結(jié)直腸癌細(xì)胞MMP-9表達(dá)及細(xì)胞侵襲。這些結(jié)果顯示,在結(jié)直腸癌細(xì)胞中PKC-P38 MAPK通路參與了MMP-9表達(dá)及侵襲過程,為阻止腫瘤侵襲轉(zhuǎn)移提供了可行的理論依據(jù)。
惡性腫瘤的浸潤和轉(zhuǎn)移過程從降解細(xì)胞外基質(zhì)開始,MMPs通過降解基底膜、細(xì)胞外基質(zhì)等,向周圍浸潤,并侵襲血管和淋巴管向遠(yuǎn)處轉(zhuǎn)移,因此患者腫瘤組織中MMPs的含量和腫瘤的侵襲、轉(zhuǎn)移往往密切相關(guān)[10]。現(xiàn)已在多種人類腫瘤中檢測到MMPs的存在,在人類結(jié)腸癌中MMP-2、MMP-7和MMP-9均表達(dá)增高[11]。已有研究表明MMP-9與結(jié)直腸癌的發(fā)生有相關(guān)性,且作為結(jié)直腸癌的早發(fā)事件和影響預(yù)后的風(fēng)險(xiǎn)因子,MMP-9表達(dá)水平是評估結(jié)直腸癌患者復(fù)發(fā)風(fēng)險(xiǎn)的有效指標(biāo)[5]。
PKC是蛋白激酶家族中的一個(gè)重要成員,參與各種細(xì)胞功能的調(diào)節(jié),在細(xì)胞的增殖、分化、神經(jīng)遞質(zhì)的運(yùn)輸、釋放及腫瘤發(fā)生等起重要作用。早期的研究表明PKC能夠被具有促腫瘤增殖作用的佛波醇所激活,提示PKC在腫瘤的增殖過程中可能起重要作用,被認(rèn)為可能是腫瘤治療中的一個(gè)新靶點(diǎn)[9,12]。據(jù)報(bào)道激活的PKC能夠進(jìn)一步磷酸化P38 MAPK信號通路[13]。
促分裂原活化蛋白激酶(MAPK)是細(xì)胞內(nèi)一類絲氨酸/蘇氨酸蛋白激酶,是細(xì)胞內(nèi)主要信息傳遞途徑之一,其包括三大信號通路:P38MAPK信號通路、ERK細(xì)胞外信號調(diào)節(jié)蛋白激酶(ERK)通路及應(yīng)激活化蛋白激酶(SAPK)/c-Jun氨基末激酶(JNK)信號通路[14]。P38是MAPK家族中的重要成員,是介導(dǎo)細(xì)胞反應(yīng)的重要信號系統(tǒng)。P38信號通路是一種應(yīng)激反應(yīng)通路,它可被不同的外部與細(xì)胞內(nèi)刺激所激活,從細(xì)胞凋亡至細(xì)胞增殖周期,到誘導(dǎo)細(xì)胞基因的表達(dá)、分化中都有廣泛的參與及應(yīng)答。P38的激活是蘇氨酸和酪氨酸殘基的特定位置發(fā)生雙重磷酸化的過程[15-16]。
TPA是PKC的激活劑,作為促癌劑能促進(jìn)腫瘤的發(fā)展[9]。而在分子腫瘤研究中,TPA作為經(jīng)典促癌劑,其對細(xì)胞黏附的能力也有部分相關(guān)報(bào)道。有研究指出,TPA能在動(dòng)態(tài)和靜態(tài)環(huán)境中增加HT-29細(xì)胞的黏附能力[17]。TPA與PKC有高親和性,一方面TPA可以與PKC穩(wěn)定的結(jié)合,從而下調(diào)PKC活性,另一方面TPA可以充分激活PKC,促進(jìn)癌細(xì)胞的侵襲及轉(zhuǎn)移。PKC的激活與結(jié)直腸癌侵襲轉(zhuǎn)移高度相關(guān)[18]。
本研究結(jié)果顯示,PKC激動(dòng)劑TPA可以誘導(dǎo)SW480細(xì)胞向類似間質(zhì)細(xì)胞的形態(tài)轉(zhuǎn)化,為結(jié)直腸癌細(xì)胞侵襲提供啟動(dòng)因子。隨之,發(fā)現(xiàn)TPA時(shí)間依賴性誘導(dǎo)MMP-9蛋白表達(dá)增高,并且預(yù)處理PKC抑制劑可明顯阻滯TPA誘導(dǎo)的MMP-9表達(dá)及分泌,說明激活PKC可誘導(dǎo)結(jié)直腸癌細(xì)胞MMP-9蛋白的表達(dá)。進(jìn)一步檢測TPA對PKC下游信號P38MAPK的作用,發(fā)現(xiàn)TPA激活PKC可誘導(dǎo)下游P38被磷酸化,說明激活PKC可誘導(dǎo)下游P38信號通路的激活;為再次證明P38 MAPK信號通路對MMP-9的調(diào)控作用,利用P38抑制劑預(yù)處理,發(fā)現(xiàn)PKC激活誘導(dǎo)的MMP-9蛋白表達(dá)可被P38抑制劑所明顯抑制。發(fā)現(xiàn)激活PKC可誘導(dǎo)結(jié)直腸癌細(xì)胞的侵襲能力增強(qiáng),而這種增強(qiáng)可被PKC抑制劑和P38抑制劑所抑制,再一次證實(shí)了PKC誘導(dǎo)的結(jié)直腸癌細(xì)胞MMP-9表達(dá)及侵襲過程是介導(dǎo)P38MAPK通路來完成。
綜上所述,PKC可能是誘導(dǎo)結(jié)直腸癌侵襲的一個(gè)因子,初步探索了PKC誘導(dǎo)MMP-9蛋白表達(dá)的信號通路。PKC-P38-MMP-9可能是PKC誘導(dǎo)結(jié)直腸癌細(xì)胞侵襲的重要信號傳導(dǎo)通路之一,可能會(huì)為結(jié)直腸癌治療提供新的分子靶點(diǎn)。
[參考文獻(xiàn)]
[1] LGvdG,J LB,M K,et al. Nationwide trends in incidence,treatment and survival of colorectal cancer patients with synchronous metastases[J]. Clinical & Experimental Metastasis,2015,32(5):457-465.
[2] Wong SH,Yu J. Gut microbiota in colorectal cancer:Mechanisms of action and clinical applications[J]. Nat Rev Gastroenterol Hepatol,2019,16(11):690-704.
[3] Kapoor C,Vaidya S,Wadhwan V,et al. Seesaw of matrix metalloproteinases(MMPs)[J]. J Cancer Res Ther,2016, 12(1):28-35.
[4] SM,NA,SB,et al. Matrix metalloproteinase-9(MMP-9) and its inhibitors in cancer:A minireview[J]. European Journal of Medicinal Chemistry,2020,194:112260.
[5] Wang W,Li D,Xiang L,et al. TIMP-2 inhibits metastasis and predicts prognosis of colorectal cancer via regulating MMP-9[J]. Cell Adh Migr,2019,13(1):273-284.
[6] Islam SMA,Patel R,Bommareddy RR,et al. The modulation of actin dynamics via atypical protein kinase-C activated cofilin regulates metastasis of colorectal cancer cells[J]. Cell Adh Migr,2019,13(1):106-120.
[7] Qureshi-Baig K,Kuhn D,Viry E,et al. Hypoxia-induced autophagy drives colorectal cancer initiation and progression by activating the PRKC/PKC-EZR(ezrin) pathway[J]. Autophagy,2019,16(8):1-17.
[8] Jang HY,Hong OY,Youn HJ,et al. 15d-PGJ2 inhibits NF-κB and AP-1-mediated MMP-9 expression and invasion of breast cancer cell by means of a heme oxygenase-1-dependent mechanism[J]. BMB Rep,2020,53(4):212-217.
[9] Isakov N. Protein kinase C(PKC) isoforms in cancer,tumor promotion and tumor suppression[J]. Semin Cancer Biol,2018,48:36-52.
[10] Alaseem A,Alhazzani K,Dondapati P,et al. Matrix metalloproteinases:A challenging paradigm of cancer management[J]. Semin Cancer Biol,2019,56:100-115.
[11] Tao L,Zhu Y,Gu Y,et al. ARHGAP25: A negative regulator of colorectal cancer(CRC) metastasis via the Wnt/β-catenin pathway[J]. Eur J Pharmacol,2019,858:172476.
[12] Marquardt B,F(xiàn)rith D,Stabel S. Signalling from TPA to MAP kinase requires protein kinase C,raf and MEK:Reconstitution of the signalling pathway in vitro[J]. Oncogene,1994,9(11):3213-3218.
[13] Cardoso VG,Gonalves GL,Costa-Pessoa JM,et al. Angiotensin II-induced podocyte apoptosis is mediated by endoplasmic reticulum stress/PKC-δ/p38 MAPK pathway activation and trough increased Na(+)/H(+) exchanger isoform 1 activity[J]. BMC Nephrol,2018,19(1):179.
[14] Yue J,López JM. Understanding MAPK signaling pathways in apoptosis[J]. Int J Mol Sci,2020,21(7):2346.
[15] Ewendt F,F(xiàn)ller M. P38MAPK controls fibroblast growth factor 23(FGF23) synthesis in UMR106-osteoblast-like cells and in IDG-SW3 osteocytes[J]. J Endocrinol Invest,2019,42(12):1477-1483.
[16] Martínez-Limón A,Joaquin M,Caballero M,et al. The p38 pathway:From biology to cancer therapy[J]. Int J Mol Sci,2020,21(6):1913.
[17] Banskota S,Dahal S,Kwon E,et al. β-catenin gene promoter hypermethylation by reactive oxygen species correlates with the migratory and invasive potentials of colon cancer cells[J]. Cell Oncol(Dordr),2018,41(5):569-580.
[18] Shelton PM,Duran A,Nakanishi Y,et al. The secretion of miR-200s by a PKCζ/ADAR2 signaling axis promotes liver metastasis in colorectal cancer[J]. Cell Rep,2018,23(4):1178-1191.
(收稿日期:2020-06-12)

