調整葡萄糖轉運系統提高大腸桿菌L-蘇氨酸產量
朱麗飛 , 王小元
(1. 食品科學與技術國家重點實驗室 江南大學,江蘇 無錫 214122;2. 江南大學 食品安全國際聯合實驗室,江蘇無錫 214122;3. 江南大學 工業生物技術教育部重點實驗室,江蘇 無錫 214122)
關鍵字: 大腸桿菌;L-蘇氨酸;PTS 系統;galP;ptsH;ptsG
L-蘇氨酸是人體必需8 種氨基酸之一,廣泛應用于食品添加劑、飼料添加劑、化妝品、醫藥、水產養殖和保健品等多個領域,是一種非常重要的發酵工業產品[1-3]。 大腸桿菌(Escherichia coli)作為一種模式微生物,具有遺傳背景清晰、易改造、生長迅速、對發酵條件要求低等優點,最常用的是L-蘇氨酸生產菌株[4-7]。
磷酸烯醇式丙酮酸(PEP)依賴的磷酸酶轉移系統(PTS)是大腸桿菌中轉運葡萄糖的最主要方式,通過PEP 提供磷酸,把葡萄糖轉運到胞內的同時使其磷酸化成葡萄糖-6-磷酸 (G-6-P)[8-9],ptsH 基因編碼PTS 系統中磷酸組氨酸搬運蛋白HPr,ptsG 基因編碼膜透性酶EIICBGlc。 葡萄糖還可以通過galP基因編碼的半乳糖轉運蛋白GalP 進入胞內[10]。 G-6-P 由己糖磷酸異構酶PgI(pgi 基因編碼)催化生成6-磷酸果糖(F-6-P),再由磷酸果糖激酶PfkA(pfkA基因編碼)催化生成1,6-二磷酸果糖;由于這一步是糖酵解的關鍵限速步驟,pfkA 基因的表達水平一定程度上可以反映出糖酵解的強弱以及糖酵解中碳流到磷酸烯醇式丙酮酸的強弱[11-13]。 PEP 作為糖酵解的產物,由eno 基因編碼的烯醇化酶催化合成,PEP 可被pykA 基因編碼的丙酮酸激酶催化生成丙酮酸,丙酮酸脫氫生成乙酰輔酶A,再經gltA 基因編碼的檸檬酸合酶催化生成檸檬酸,進入檸檬酸循環生成草酰乙酸。 草酰乙酸經aspC 基因編碼的天冬氨酸轉氨酶AspC 催化生成天冬氨酸[14],再經thrA 基因編碼的天冬氨酸激酶、thrB 基因編碼的高絲氨酸激酶、thrC 基因編碼的蘇氨酸合成酶等關鍵酶催化生成L-蘇氨酸,見圖1。
作為 PTS 系統的關鍵基因,ptsH 和 ptsG 的缺失或者突變會使PTS 系統不能正常轉運葡萄糖,而只能利用GalP 系統等其他不消耗PEP 的方式轉運葡萄糖[8,15]。 作者在一株大腸桿菌L-蘇氨酸高產菌TWF001 中敲除了ptsH 和 ptsG 基因, 并且在 ptsH的敲除菌基因組上過表達galP 基因,發現改善葡萄糖轉運系統有利于大腸桿菌L-蘇氨酸的合成。
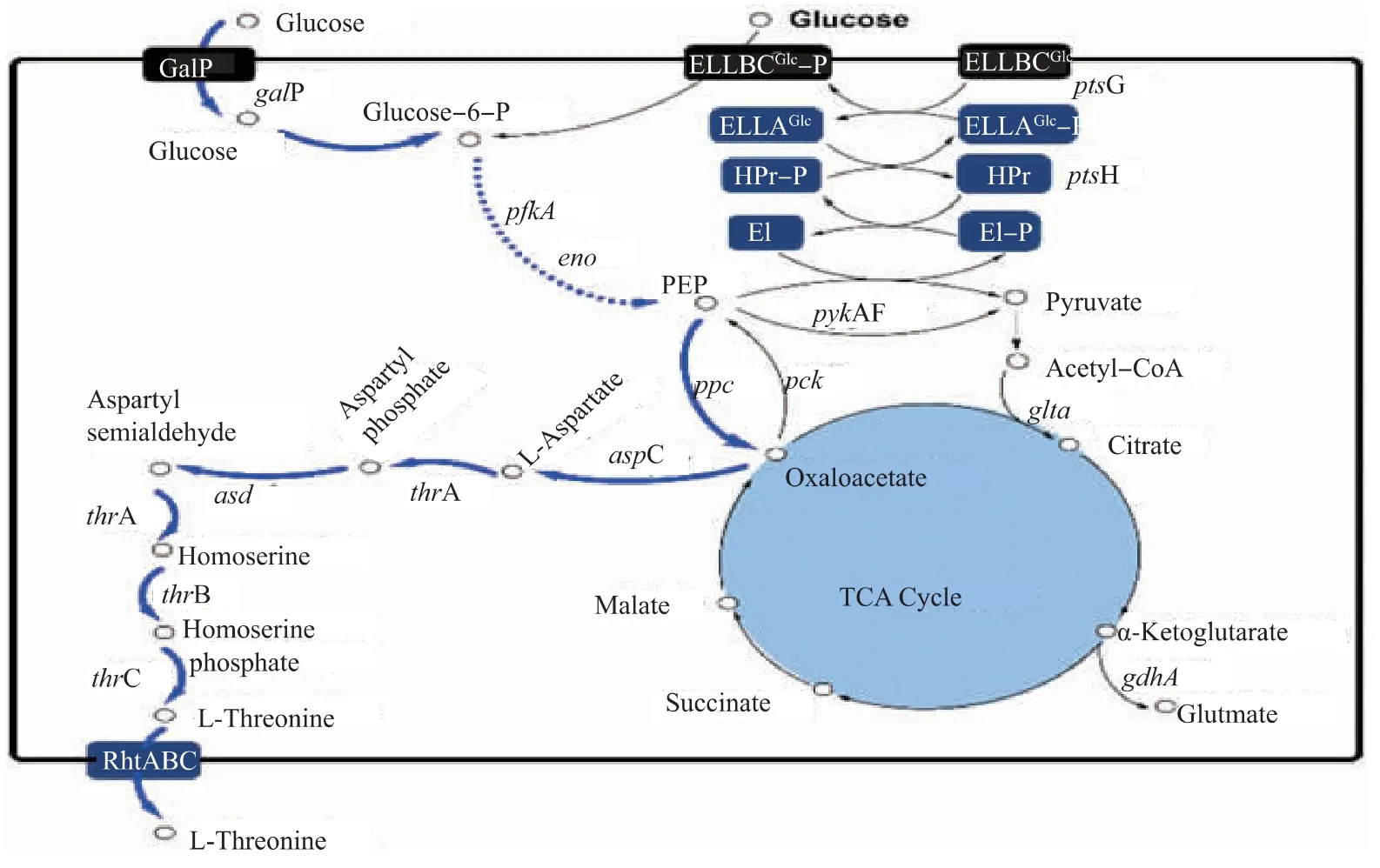
圖1 大腸桿菌中L-蘇氨酸合成代謝路程Fig. 1 Biosynthesis pathway of L-threonine in E. coli
1 材料與方法
1.1 材料與設備
本研究所有的菌株和質粒見表1, 所有的菌株都為大腸桿菌。 JM109 是用來構建質粒制作感受態用,發酵菌株TWF001 是作者所在實驗室篩到的一株 L-蘇氨酸高產菌, 保藏編號為 CCTCC no.M2017730[17]。 LB 培養基(g/L):蛋白胨 10,NaCl 10,酵母粉5, 固體需要添加質量分數為1.5%的瓊脂。發酵種子培養基(g/L):蛋白胨 10,NaCl 10,酵母粉5,蔗糖 10,121 ℃滅菌 20 min。搖瓶發酵培養基(g/L):葡萄糖(30、40、50、60,根據需要添加),(NH4)2SO425,酵母粉 2,檸檬酸 2,KH2PO47.46,MgSO4·7H2O2,FeSO4·7H2O5,MnSO4·4H2O5,CaCO320;pH 6.8(NaOH 調 pH),115 ℃滅菌 15 min。 酵母粉和蛋白胨:購自OXIOD 公司;氨基酸標準品:購自Sigma 公司;其他化學試劑:均購自國藥集團化學試劑有限公司;HPLC 級甲醇和乙腈: 購自蘇州科盛公司;2×Taq PCR MasterMix:購自南京博爾迪生物科技有限公司;QuickCut DpnI 酶、PrimerStar DNA 聚合酶:購自 TaKaRa 公司;T4 DNA 連接酶、 反轉錄 cDNA 試劑盒: 購自 Fermentas 公司;T4 多聚核苷酸激酶:購自紐英倫生物技術 (北京) 有限公司;ChamQTMUniversal SYBR qPCR Master Mix: 購自諾唯贊生物;Simply P 總 RNA 提取試劑盒: 購自 Bioflux 公司;質粒提取試劑盒、細菌基因組提取試劑盒:購自天根生物科技有限公司;SanPrep 柱式PCR 產物純化試劑盒、SanPrep 柱式DNA 膠回收試劑盒: 均購自生工生物工程股份有限公司。
1.2 實驗方法
本研究所有用來構建質粒和突變菌的引物信息見表 1, 敲除突變菌株所用引物設計參照MG1655 基因組。 基因組和質粒的提取根據基因組和質粒提取試劑盒的說明書進行; 基因組片段用PrimerStar DNA 聚合酶 PCR 獲得, 片段回收用SanPrep 柱式DNA 膠回收試劑盒,操作見說明書;菌落驗證用 2×Taq PCR MasterMix 進行 PCR 驗證。
以 MG1655 基因組為模板, 以引物 ptsHf1/ptsHr1 擴增出ptsH 基因上游片段ptsH-U, 以引物ptsHf2/ ptsHr2 擴增出ptsH 基因上游片段ptsH-D,再通過重疊PCR 把上下游片段重疊到一起得到ptsH 的敲除片段 ptsH-UD。 以 pTargetF 為模板,以引物 sgRNA-ptsH-F/T-sgRNA-R 擴增出構建pTargetF-ptsH 的片段, 片段經過 DpnI 酶消化,T4 Pnk 激酶磷酸化,T4 DNA 連接酶連接后化轉到JM109 感受態中,構建和擴增質粒,在含50 mg/L 壯觀霉素的LB 平板上生長10 h 后, 用引物Y-ptsHF/T-sgRNA-R 篩選正確的轉化子, 得到敲除質粒pTargetF-ptsH。 100 ng 敲除質粒 pTargetF-ptsH 和500 ng 敲除片段 ptsH-UD 同時電轉入 80 uL 的TWF001/pCas 電轉感受態中,在 30 ℃、100 r/min 慢搖復蘇2 h,涂在含50 mg/L 壯觀霉素和卡那霉素的LB 平板,30 ℃培養 48 h 后用引物 ptsHf1/ ptsHr2 驗證,得到正確敲除的轉化子,正確的轉化子轉接含50 mg/L 卡那霉素和0.5 mmol/L 異丙基硫代半乳糖苷(IPTG)的 LB 試管誘導培養去除pTargetF-ptsH質 粒 ,42 ℃過 夜 培 養 去 除 pCas 質 粒 , 去 除pTargetF-ptsH 和pCas 質粒后分別在含壯觀霉素和卡那霉素的LB 平板上進行反篩, 確定是否去除質粒成功,最后得到不含質粒的正確敲除ptsH 基因的突變菌TWF001ΔptsH。
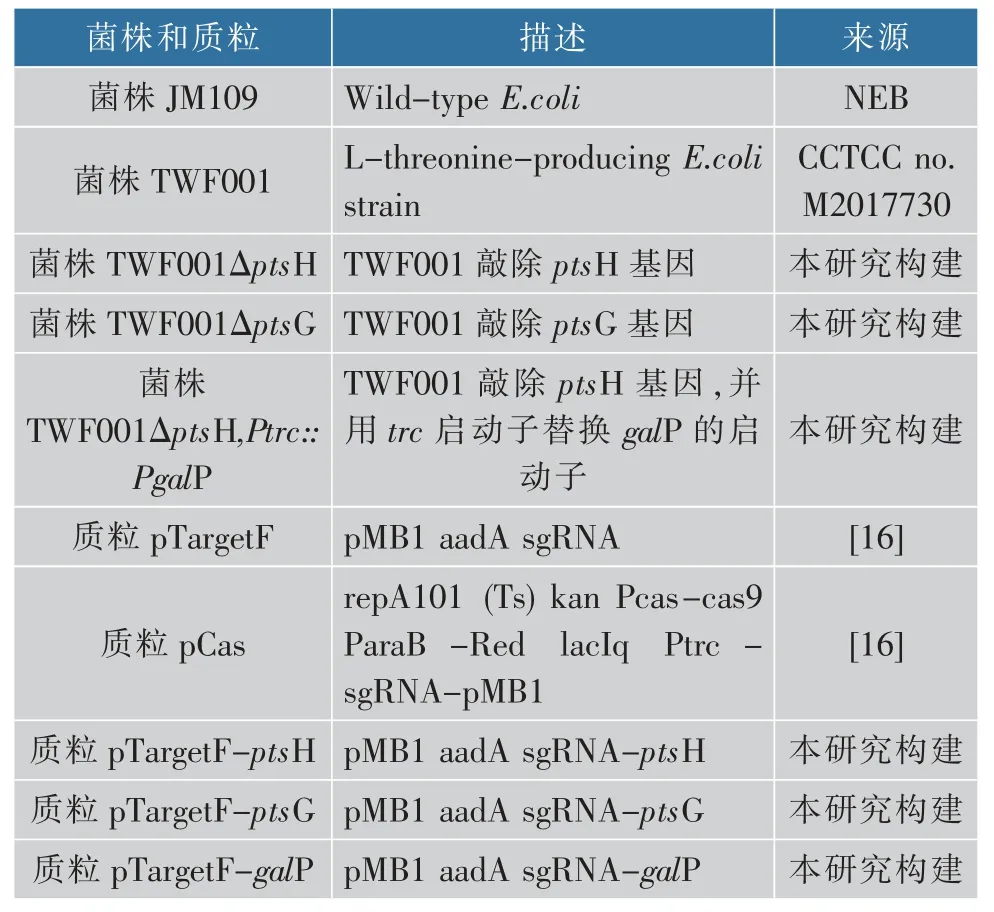
表1 本研究中所用到菌株和質粒Table 1 Strains and plasmids used in the study
TWF001ΔptsG 的 構 建 過 程 同 上 述TWF001ΔptsH 的構建, 所用引物參照表 2 中的ptsGf1/ptsGr1、ptsGf1/ptsGr1、sgRNA -ptsG -F/T -sgRNA-R、Y-ptsG-F/T-sgRNA-R。
TWF001ΔptsH,Ptrc::PgalP 的 構 建 是 以MG1655 基因組為模板, 以引物galPf1/galPr1 擴增出galP 基因上游片段galP-U,以引物galPf2/galPr2擴增出galP 基因上游片段galP-D, 引物Trc-F/Trc-R 95 ℃變性、4 ℃退火形成trc 啟動子片段,再通過重疊PCR 把上游、trc 啟動子和下游片段重疊到一起得到galP 的敲入片段trc-galP。以pTargetF 為模板,以引物sgRNA-galP-F/T-sgRNA-R 擴增出構建pTargetF-galP 的片段, 片段經過 DpnI 酶消化,T4 Pnk 激酶磷酸化,T4 DNA 連接酶連接后化轉到JM109 感受態中,構建和擴增質粒,在含50 mg/L 壯觀霉素的LB 平板上生長10 h 后,用引物Y-galP -F/T-sgRNA-R 篩選正確的轉化子, 得到敲除質粒pTargetF-galP。 100 ng 敲除質粒 pTargetF-galP 和500 ng 敲除片段 trc-galP 同時電轉入 80 uL 的TWF001ΔptsH/pCas 電轉感受態中,在 30 ℃、100 r/min慢搖復蘇2 h,涂在含50 mg/L 壯觀霉素和卡那霉素的 LB 平板,30 ℃培養 48 h 后用引物 Trc-F/galPr2驗證,得到正確敲入的轉化子,正確的轉化子轉接含50 mg/L 卡那霉素和0.5 mmol/L 異丙基硫代半乳糖苷(IPTG)的LB 試管誘導培養去除pTargetF-galP質 粒 ,42 ℃ 過 夜 培 養 去 除 pCas 質 粒 , 去 除pTargetF-galP 和pCas 質粒后分別在含壯觀霉素和卡那霉素的LB 平板上進行反篩, 確定是否去除質粒成功, 最后得到不含質粒的正確敲入trc-galP 基因的突變菌 TWF001ΔptsH,Ptrc::PgalP。

表2 本研究構建質粒和菌株所用引物Table 2 Primers usedused to construct plasmids andstrains in this study

表3 本研究RT-PCR 所用引物Table 3 Primers used for RT-PCR in this study
1.3 發酵過程參數測定
1.3.1 生物量的測定 生長在LB 培養基中的種子液的OD600的測定:取1 mL 菌液,再用去離子水稀釋相應的倍數充分混勻, 用紫外分光光度計測定600 nm 下的吸光度,再乘以相應倍數得到最后值。
生長在發酵培養基中的菌液的OD600的測定:取1 mL 菌液充分混勻,再用去1 mol/L 的稀鹽酸稀釋相應的倍數, 用紫外分光光度計測定在波長為600 nm 下的吸光度,再乘以相應倍數得到最后值。
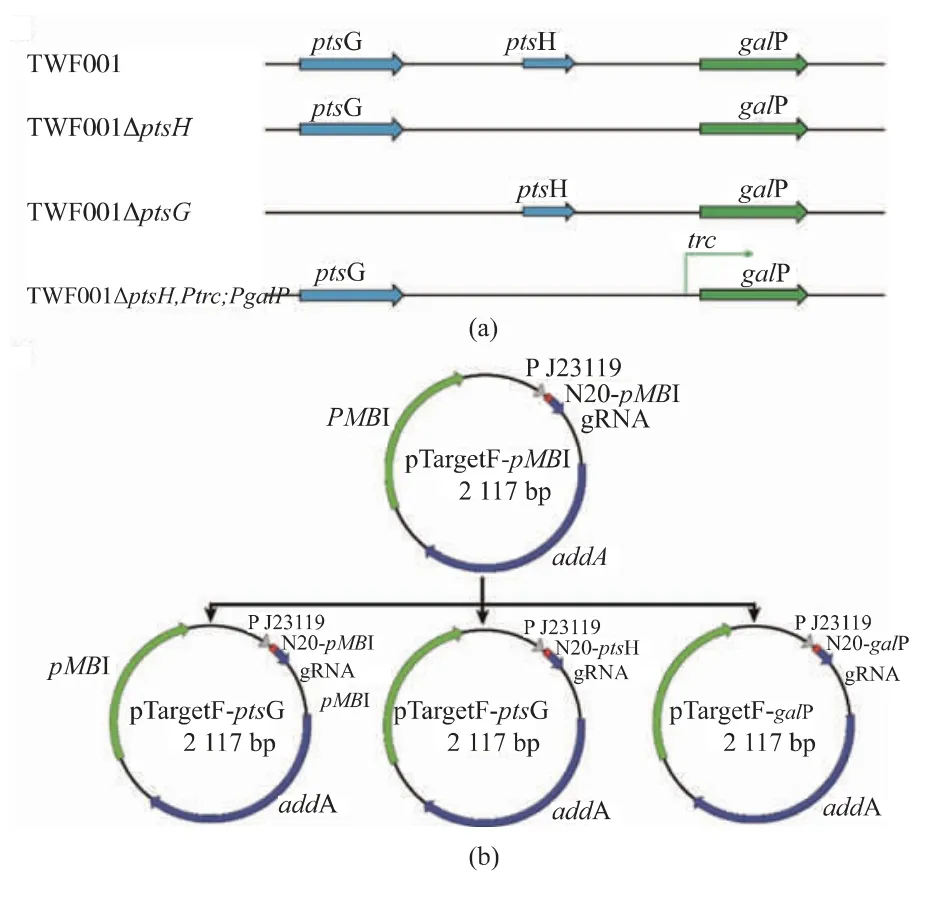
圖2 菌株構建流程和質粒圖Fig. 2 Construction process of mutant strains and the map of plasmids
1.3.2 葡萄糖質量濃度的測定 發酵液取樣,發酵液樣品 12 000 r/min 離心, 取上清液 10 μL 用去離子稀釋100 倍,用SBA40 還原糖測定儀測定葡萄糖的質量濃度。
1.3.3 氨基酸含量的測定
1) 樣品預處理 發酵液12 000 r/min 離心,取500 μL 上清液加入到 500 μL 的 10%的三氯乙酸溶液中,充分混勻,4 ℃靜置 4 h 以上。 12 000 r/min 離心15 min,用0.22 μm 的水相針式濾膜過濾上清液,上清液稀釋合適的倍數后用HPLC 測定氨基酸含量。
2) 高效液相色譜 采用鄰苯二甲醛柱前衍生法[18]。 儀器采用 Agilent 1200 超高效液相色譜儀,色譜柱為 Thermo ODS -2HYPERSIL C18 column(250 mm×4.0 mm,USA)。 流動相(水相):3.01 g 無水乙酸鈉溶解于超純水中,200 μL 三乙胺,5 mL 四氫呋喃,超純水定容到1 L,乙酸調至pH 7.2。 洗脫相(有機相):3.01 g 無水乙酸鈉溶解于200 mL 超純水中,用5%醋酸調至pH 7.2,再加400 mL 的HPLC級甲醇和400 mL 的HPLC 級乙腈。
1.4 實時熒光定量PCR 分析
相關基因轉錄水平通過StepOnePlus 實時熒光定量儀(美國Applied Biosystems 公司)檢測,所用引物見表2。發酵對數中期的發酵液,低速短暫離心取上清液去除發酵液中的CaCO3,12 000 r/min 離心收集菌體,RNA 的提取步驟、cDNA 的反轉錄合成以及RT-qPCR 的詳細步驟及參數分別按照Bioflux RNA 提取試劑盒說明書、Fermentas 公司反轉錄cDNA 試劑盒和諾唯贊生物ChamQTM Universal SYBR qPCR Master Mix 說明書,數據的分析參照文獻[19]。
2 結果與分析
2.1 突 變 菌 TWF001ΔptsH、TWF001ΔptsG 和TWF001ΔptsH,Ptrc::PgalP 的構建驗證
3 株突變菌構建的電泳驗證結果見圖3。 對照菌 TWF001 用引物 ptsHf1/ptsHr2 進行 PCR 驗證,擴增出1 500 bp 左右大小的條帶, 如1 泳道所示,大小正確;突變菌TWF001ΔptsH 用引物ptsHf1/ptsHr2擴增出了1 200 bp 左右大小的條帶, 如2 泳道所示,大小正確,電泳結果顯示敲除了正確大小的條帶,ptsH 基因敲除成功。
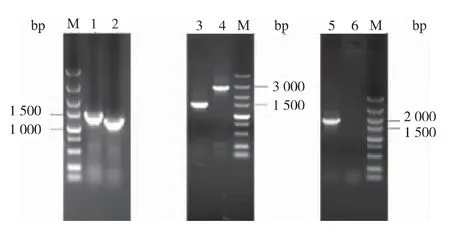
圖 3 TWF001ΔptsH、TWF001ΔptsG 和 TWF001ΔptsH,Ptrc::PgalP 構建驗證Fig. 3 Verification of TWF001ΔptsH,TWF001ΔptsG and TWF001ΔptsH,Ptrc::PgalP by PCR
突變菌 TWF001ΔptsG 用引物 ptsGf1/ptsGr2 PCR 驗證,擴增出1 500 bp 左右大小的條帶,如3泳道所示, 大小正確; 而對照菌TWF001 用引物ptsGf1/ptsGr22 擴增出的片段大小為 3 000 bp 左右,如4 泳道所示,大小正確。 電泳結果顯示敲除了正確大小的條帶,ptsG 基因敲除成功。
對照菌TWF001 經過基因組測序顯示沒有完整的galP 基因, 只存在galP 起始十幾個堿基的片段,且沒有其它同源性較高的序列。 要插入的片段包括一段galP 位置上的上游同源片段、trc 啟動子和galP 基因,大小為2 048 bp,突變菌TWF001ΔptsH,Ptrc::PgalP 用引物 galPf1/galPr2 PCR 驗證,擴增出2 000 bp 左右大小的條帶, 如 5 泳道所示, 大小正確; 而 TWF001ΔptsH 基因組上沒有引物 galPr2 結合位點, 所以擴增不出條帶, 如6 泳道所示。TWF001 基因結構特殊,galP 基因本身有1 395 bp,在基因組上插入trc 啟動子過表達galP 基因片段的難度較大。 PCR 驗證正確的轉化子,提取基因組,高保真酶擴增插入片段,對片段進行測序檢驗,完全正確插入片段并且沒有突變的就是最終正確突變株。
2.2 TWF001ΔptsH 在不同葡萄糖質量濃度培養基中的搖瓶發酵結果分析
為了進一步提高TWF001 的L-蘇氨酸含量,在TWF001 中 敲 除 ptsH 基 因 , 得 到 突 變 株TWF001ΔptsH。突變株在葡萄糖質量濃度為30 g/L[6]的培養基中進行搖瓶發酵,測定生長OD600、葡萄糖質量濃度和L-蘇氨酸的產量。 為了探究L-蘇氨酸產量和轉化率能否隨著葡萄糖質量濃度的升高進一步提升,又分別在含40、50、60 g/L 葡萄糖質量濃度的培養基中進行搖瓶發酵。
出發對照菌TWF001 和突變菌 TWF001ΔptsH在含 30、40、50、60 g/L 葡萄糖的培養基中的搖瓶發酵結果見圖4。
由圖 4(a)可知,TWF001ΔptsH 在各個葡萄糖質量濃度中的生長都要比TWF001 慢,生長受到明顯的抑制。 當葡萄糖質量濃度為30 g/L 時,TWF001的最大OD600為15.59,當葡萄質量濃度繼續升高到40、50 g/L 時,隨著葡萄糖質量濃度的升高,TWF001的生長越好,60 g/L 的葡萄糖就開始抑制菌體的生長。 TWF001ΔptsH 在 30 g/L 葡萄糖中的最大 OD600為12.03,隨著葡萄糖質量濃度升高到40、50、60 g/L時,雖然OD600變大了,但是發酵前期18 h 內,菌體生長非常緩慢,不利于發酵合成L-蘇氨酸。
如圖 4(b)所示,TWF001 在 30 g/L 葡萄糖質量濃度發酵時,發酵24 h 耗盡葡萄糖;隨著葡萄糖質量濃度的升高, 發酵36 h 最多能耗掉50 g/L 的葡萄糖。TWF001ΔptsH 在30 g/L 葡萄糖質量濃度發酵時,發酵30 h 耗盡葡萄糖,隨著葡萄糖質量濃度的升高,耗糖明顯被抑制,發酵36 h 最多能耗掉40 g/L的糖, 并且當葡萄糖質量濃度等于或者高于40 g/L時,發酵前18 小時幾乎不消耗葡萄糖,葡萄糖攝取被嚴重抑制,各個質量濃度中的耗糖速度都比對照菌慢。
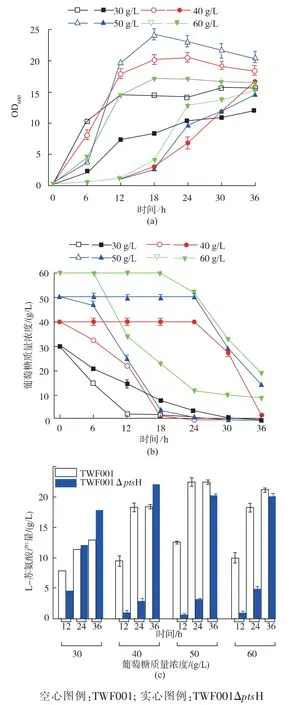
圖4 TWF001 和TWF001ΔptsH 在葡萄糖質量濃度為 30、40、50、60 g/L 的培養基中搖瓶發酵Fig. 4 Flask fermentation of TWF001 and TWF001ΔptsH in medium with 30,40,50,60 g/L glucose
如圖 4(c)所示,TWF001 在 30 g/L 葡萄糖質量濃度發酵時L-蘇氨酸產量為12.97 g/L, 糖酸轉化率為0.43 g/g; 隨著葡萄糖質量濃度升高到40 g/L時,L-蘇氨酸產量為18.41 g/L, 此時達到最大轉化率0.46 g/g;隨著葡萄糖質量濃度升高到50 g/L 時,L-蘇氨酸產量達到最大的22.56 g/L,轉化率下降到0.45 g/g;當葡萄糖質量濃度為60 g/L 時,蘇氨酸產量反而下降。TWF001ΔptsH 在30 g/L 葡萄糖發酵時L-蘇氨酸產量為17.90 g/L, 比對照 TWF001 提高38.01%,這時的轉化率為0.60 g/g;葡萄糖質量濃度升高到 40 g/L 時,L-蘇氨酸產量達到最大的22.16 g/L,但是轉化率下降到0.58 g/g,隨著葡萄糖質量濃度升高到50、60 g/L 時, 蘇氨酸產量反而下降,并且比對照菌要低。
ptsH 基因的敲除在30、40 g/L 葡萄糖質量濃度時能明顯地提高L-蘇氨酸的產量以及糖酸轉化率,但是生長和糖耗受到抑制,并且40 g/L 的葡萄糖就開始明顯抑制生長和糖耗,降低轉化率,只適合在30 g/L 的葡萄糖進行發酵。
2.3 TWF001ΔptsG 在不同葡萄糖質量濃度培養基中的搖瓶發酵結果分析
為了進一步提高TWF001 的L-蘇氨酸含量,在TWF001 中 敲 除 ptsG 基 因 , 得 到 突 變 株TWF001ΔptsG。 突變株在 30 g/L 葡萄糖的培養基中進行搖瓶發酵,測定生長OD600、葡萄糖質量濃度和L-蘇氨酸的產量。 為了探究L-蘇氨酸產量和轉化率能否隨著葡萄糖質量濃度的升高進一步提升,又分別在含40、50、60 g/L 葡萄糖的培養基中進行搖瓶發酵。
出發對照菌 TWF001 和突變菌TWF001ΔptsG在含 30、40、50、60 g/L 葡萄糖的培養基中的搖瓶發酵結果見圖5。
如圖 5(a)所示,TWF001ΔptsG 在各個葡萄糖質量濃度中的生長比TWF001 要慢一些,但生長沒有受到太大的抑制。 當葡萄糖質量濃度為30 g/L 時,TWF001ΔptsG 的最大 OD600為 11.61,當葡萄糖質量濃度繼續升高到40、50 g/L 時, 隨著葡萄糖質量濃度的升高,菌體生長的越好,60 g/L 的葡萄糖在發酵前18 小時抑制菌體的生長。
如圖 5(b)所示,TWF001ΔptsG 在 30 g/L 葡萄糖發酵時,發酵24 h 耗盡葡萄糖,與對照TWF001一致; 并且在40、50 g/L 的葡萄糖中的耗糖速度與對照菌十分接近,沒有明顯被抑制,當葡萄糖質量濃度升高到60 g/L 時,突變菌的葡萄糖攝取才表現出明顯被抑制。
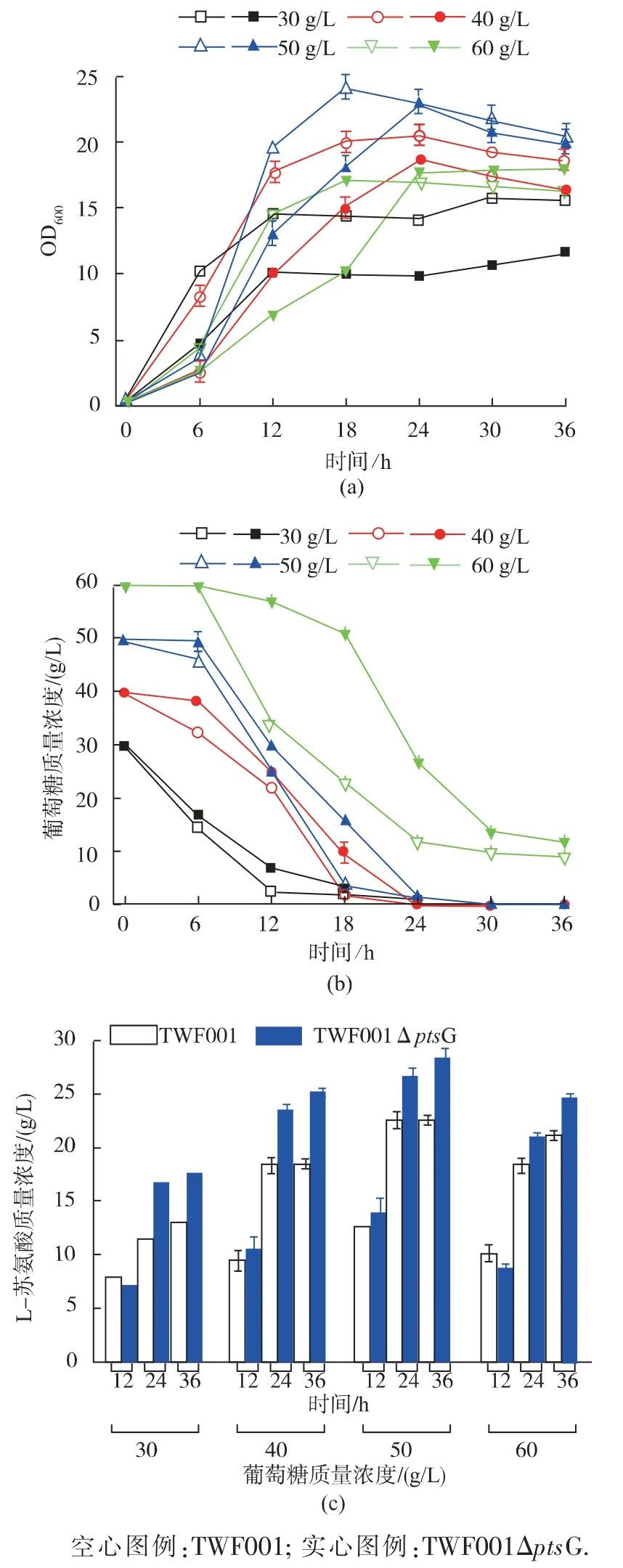
圖5 TWF001 和TWF001ΔptsG 在葡萄糖質量濃度為30、40、50、60 g/L 的培養基中搖瓶發酵Fig. 5 Flask fermentation of TWF001 and TWF001ΔptsG in medium with 30,40,50,60 g/L glucose
如圖 5(c)所示,TWF001ΔptsG 在 30 g/L 葡萄糖發酵時 L-蘇氨酸產量為 17.59 g/L, 比對照TWF001 提高了35.62%,這時的轉化率為0.59 g/g;當葡萄糖質量濃度升高到40 g/L 時,L-蘇氨酸產量為25.23 g/L,比對照TWF001 提高37.05%,為這個菌的最高幅度,此時的轉化率達到最大0.63 g/g;當葡萄糖質量濃度升高到50 g/L 時,L-蘇氨酸產量達到最大的28.39 g/L,只比對照提高了25.84%,轉化率也下降為0.57 g/g, 當葡萄糖質量濃度升高到60 g/L 時,蘇氨酸產量反而下降。
ptsG 基因的敲除既能能明顯提高L-蘇氨酸的產量和糖酸轉化率,40 g/L 葡萄糖時達到最大的轉化率和L-蘇氨酸產量提升幅度,是最適宜的葡萄糖質量濃度。
2.4 TWF001ΔptsH,Ptrc::PgalP 在不同葡萄糖質量濃度培養基中的搖瓶發酵結果分析
上述發酵結果顯示,在30 g/L 葡萄糖培養基中進行發酵,TWF001ΔptsH 的L-蘇氨酸產量為17.90 g/L,TWF001ΔptsG 的 L-蘇氨酸產量為 17.59 g/L。為了進一步提高L-蘇氨酸產量, 在TWF001ΔptsH的基因組上用trc 啟動子過表達galP 基因, 得到突變株 TWF001ΔptsH,Ptrc::PgalP。 對突變株在 30 g/L葡萄糖的培養基中進行搖瓶發酵,為了探究L-蘇氨酸產量和轉化率能否隨著葡萄糖質量濃度的升高進一步提升,又分別在含40、50、60 g/L 葡萄糖的培養基中進行搖瓶發酵。
出發對照菌TWF001 和突變菌TWF001ΔptsH,Ptrc::PgalP 在含 30、40、50、60 g/L 葡萄糖的培養基中的搖瓶發酵結果見圖6。
《太原縣志》中記載,明清時期風峪溝內水患嚴重,明洪武、嘉靖年間、清乾隆元年、十七年、三十三年、四十年均爆發過大規模的洪災,對人畜、建筑、交通要道有較大的損害。在清乾隆四十一年完成對沙堰的修建之后,“工竣,而城北等村可永免山水沖突之患矣”[11]。從現存周家莊古村建筑建造手法及建筑材料可以看出,村中建筑呈現由高向低,由東向西發展的趨勢,就是村民為防止水患危害,而采用的布局形式(圖2)。
如圖 6(a)所示,TWF001ΔptsH,Ptrc::PgalP 在30、50、60 g/L 葡萄糖中的生長比 TWF001 要慢一些,但生長沒有受到太大的抑制。 當葡萄糖質量濃度為 30 g/L 時,TWF001ΔptsH,Ptrc::PgalP 的最大OD600為12.32;當葡萄糖質量濃度繼續升高到40 g/L時,生長達到最好,并且比對照TWF001 略好。 升高到 50 g/L 時, 最大 OD600開始下降, 當繼續升高到60 g/L 時,生長開始受到較明顯的抑制。
如圖 6(b)所示,TWF001ΔptsH,Ptrc::PgalP 在30 g/L 的葡萄糖中的耗糖速度與對照菌幾乎一致,發酵18 h 耗盡30 g/L 的葡萄糖, 當葡萄糖質量濃度高于40 g/L 時,耗糖受到一定抑制,且質量濃度越高抑制越明顯,發酵36 h,最多能耗盡40 g/L 的葡萄糖。
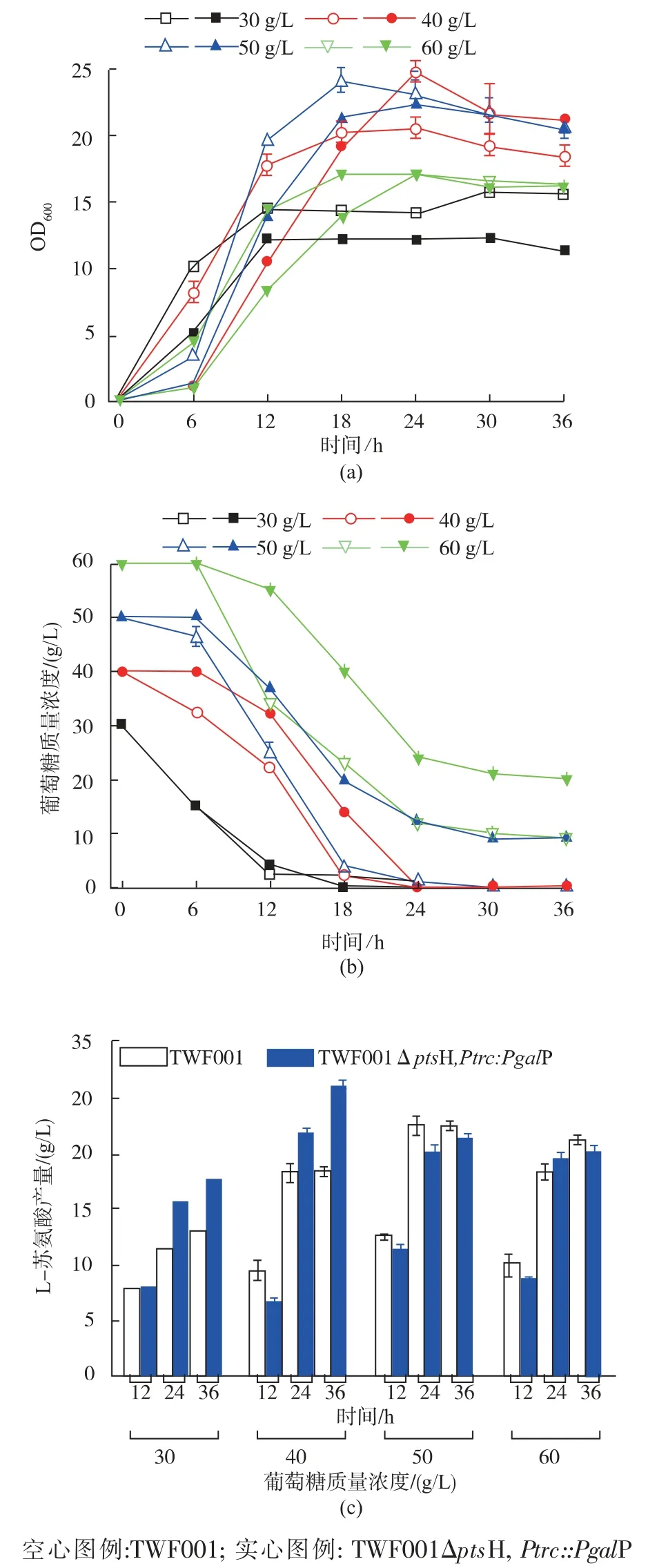
圖 6 TWF001 和 TWF001ΔptsH,Ptrc::PgalP 在葡萄糖質量濃度為30、40、50、60 g/L 的培養基中搖瓶發酵情況Fig. 6 Flask fermentation of TWF001 and TWF001ΔptsH,Ptrc::PgalP in medium with 30,40,50,60 g/L glucose
如圖 6(c)所示,TWF001ΔptsH,Ptrc::PgalP 在30 g/L 葡萄糖發酵時L-蘇氨酸產量為17.66 g/L,比對照TWF001 提高了36.16%, 這時的轉化率為0.60 g/g;當葡萄糖質量濃度升高到40 g/L 時,L-蘇氨酸產量為 26.16 g/L, 比對照 TWF001 提高了42.10%,為3 株突變菌的最高幅度,此時的轉化率達到最大的0.65 g/g,也是所有菌中最高的;當葡萄糖質量濃度升高到50、60 g/L 時,L-蘇氨酸產量分別下降到到21.43、20.16 g/L。
ptsH 基因的敲除能提高L-蘇氨酸的產量和糖酸轉化率, 但是ptsH 的生長和糖耗受到明顯的抑制,在敲除ptsH 突變菌的基礎上用trc 啟動子過表達galP 基因,不僅能改善生長和葡萄糖攝取[20],還能進一步提高L-蘇氨酸的產量和糖酸轉化率。
2.5 基因ptsH 和ptsG 的敲除以及galP 的過表達對L-蘇氨酸合成相關基因的轉錄水平的影響
為了探究造成這3 株突變菌L-蘇氨酸產量差異的原因,對大腸桿菌中影響L-蘇氨酸合成的相關基因 thrA、thrB、thrC、pfkA、eno、pykA、gltA、gdhA 和aspC 進行了實時熒光定量PCR 分析。 如圖7 所示,TWF001ΔptsH 中 thrA、thrB 和 thrC 的表達都有所提高,thrC 上升的最明顯, 這可能是蘇氨酸產量增加的主要原因之一;eno 基因明顯提高有利于合成更多的PEP[21],pykA 基因的上調雖然不利于積累PEP,但有利于糖酵解的順利進行合成丙酮酸,pfkA和gltA 基因是糖酵解和TCA 循環的關鍵限速步驟,它們的下調比較不利于生長[5],這可能是TWF001ΔptsH 生長和糖耗受到抑制的原因之一。TWF001ΔptsG 中 thrA 基因明顯上調, 使得蘇氨酸合成加強,pfkA 和eno 基因上調的比較明顯, 這表示糖酵解的碳流和流向PEP 的碳流的提高,這有利于糖酵解和合成更多的PEP[11-13],更多的PEP 供應于蘇氨酸的合成,pykA 基因的上調也使得生長更好,gdhA 基因的上調有利于合成更多谷氨酸, 而胞內氮源絕大部分來自谷氨酸[21],有利于L-蘇氨酸的合成,apsC 基因的上調有利于合成天冬氨酸, 天冬氨酸是重要的蘇氨酸前體物質。 在TWF001ΔptsH,Ptrc::PgalP 中,thrA、thrB、thrC、gdhA 和 aspC 這些基因都有明顯的上調,這些基因的上調都直接有利于L-蘇氨酸的合成, 這些可能是TWF001ΔptsH,Ptrc::PgalP 的L-蘇氨酸產量的提升幅度和糖酸轉化率最高的原因;eno 基因也明顯上調有助于PEP的合成,但是pfkA 和gltA 基因上調較弱,不利于糖酵解和TCA 循環。
TWF001、TWF001ΔptsH 和 TWF001ΔptsG 中沒有galP 基因,3 株菌中galP 的相對表達量相同,都為 1;TWF001ΔptsH,Ptrc::PgalP 中 galP 的相對表達量上升到16.2,提升幅度較大,表明插入基因組上的galP 基因得到表達。
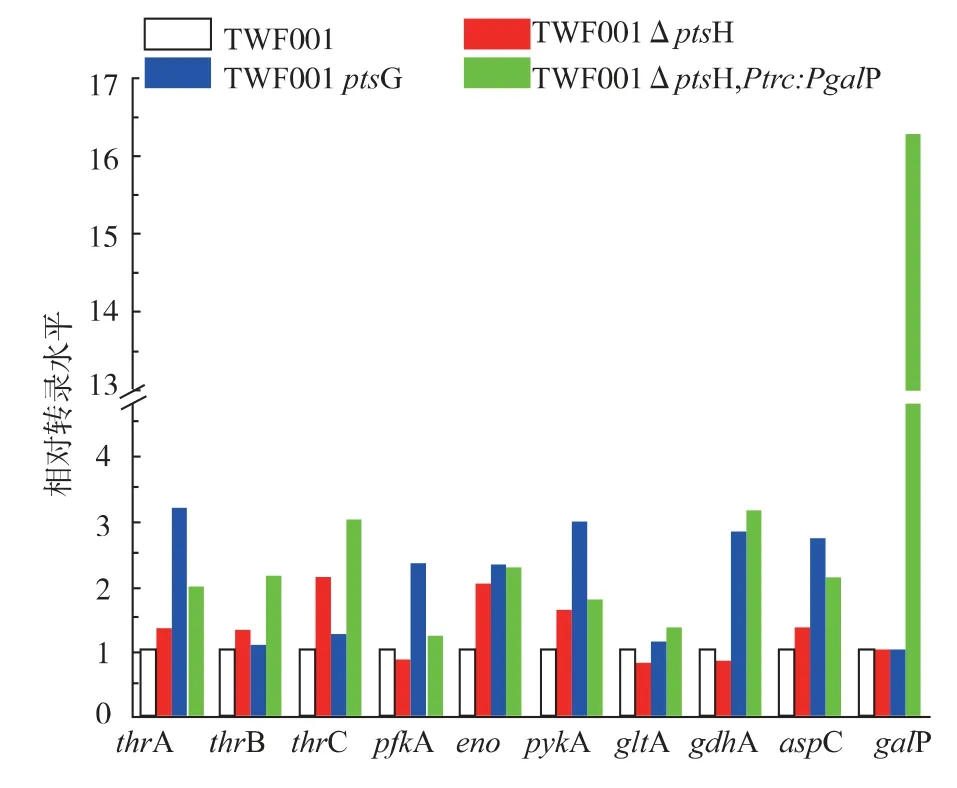
圖7 L-蘇氨酸合成相關基因的實時熒光定量PCR 分析Fig. 7 RT -qPCR analysis of genes involved in L -threonien synthesis
3 結 語
在一株高產L-蘇氨酸的大腸桿菌中分別單獨敲除ptsH 和ptsG 基因,并在ptsH 敲除菌的基礎上過表達galP 基因,進行搖瓶發酵,都能較大幅度提高L-蘇氨酸產量和提高糖酸轉化率,且菌株不攜帶任何表達質粒,有利于工業發酵。
ptsG 編碼PTS 系統中特異識別結合葡萄糖的膜結合蛋白EIICBGlc,ptsH 編碼PTS 中磷酸組氨酸搬運蛋白HPr,是轉運磷酸基團過程的一種蛋白質,但是它為PTS 系統轉運其他物質所共用。 敲除這兩個基因都能使PTS 系統轉運葡萄糖受阻,從而通過其他轉運蛋白質如GalP 和MglABC 轉運葡萄糖,能使用于PTS 系統轉運葡萄糖消耗的PEP 積累而用于代謝合成如L-蘇氨酸;RT-qPCR 也顯示這兩個基因的敲除能增加L-蘇氨酸合成相關基因的表達,從而促進蘇氨酸的合成。
對 TWF001、TWF001ΔptsH 和 TWF001ΔptsG進行搖瓶發酵, 此時葡萄糖質量濃度為30 g/L,TWF001ΔptsH 的生長和糖耗沒有受到非常明顯抑制, 此時它的L-蘇氨酸產量和糖酸轉化率是最高的, 為了進一步提高TWF001ΔptsH 的生長糖耗和L-蘇氨酸產量,在基因組上用trc 過表達galP 基因。GalP 蛋白轉運的葡萄糖只需要消耗一分子ATP,積累的PEP 可大部分用于合成代謝,而且能改善葡萄糖的攝取速度。 繼續提升培養基中葡萄糖質量濃度,并進行搖瓶發酵,研究結果顯示TWF001ΔptsH,Ptrc::PgalP 在40 g/L 的葡萄糖質量濃度時達到最大的L-蘇氨酸產量26.16 g/L,提高幅度為42.11%,轉化率能達到0.65 g/g。 先敲除PTS 系統中與轉運葡萄糖相關的編碼基因,使細菌不能以PTS 系統為主要的轉運葡萄糖的途徑,從而減少用于轉運葡萄糖所需要的PEP,這樣來自糖酵解的PEP 可大部分用于合成代謝, 再過表達GalP 這樣不需要消耗其他重要中間代謝物的葡萄糖轉運蛋白質,這樣在不嚴重影響生長和糖耗的同時能大幅度提高L-蘇氨酸產量和轉化率。
之前有文獻報道敲除ptsG 或者ptsH 基因可以用來生產其他物質[22-24],本試驗在一株高產L-蘇氨酸中只敲除ptsH、ptsG 以及過表達galP 就能較大幅度的提升產量和轉化率,效果是十分明顯的,這在工業應用上是比較有利的,但還可以進一步繼續改造,使得生長和糖耗進一步提升。
因為本出發菌基因組結構較MG1655 復雜,生長緩慢、單菌落非常小,構建較困難,可以繼續在本研究的基礎上,在突變菌TWF001ΔptsG 中用trc 過表達 galP 基因, 以及在 TWF001ΔptsH,Ptrc::PgalP中過表達glk 基因,探究生長和L-蘇氨酸產量情況并進行其他能提高蘇氨酸產量的代謝改造。

