應用凱氏定氮儀檢測杏脯中二氧化硫方法探討
李 靜 馬 磊 朱婧蓉 孫 濤 李 凱
(新疆農業科學院農業質量標準與檢測技術研究所,農業部農產品質量安全風險評估實驗室(烏魯木齊),新疆農產品質量安全實驗室,烏魯木齊 830091)
二氧化硫作為國內外允許使用的一種食品添加劑,通常以焦亞硫酸鉀、亞硫酸鈉、低亞硫酸鈉等多種形式的亞硫酸鹽添加于食品中,或采用燃燒硫磺、硫磺熏蒸等方法對食品進行處理,不但可以對食品進行干燥,同時可以防止褐變作用,最終食品成色有所提高,延長貯存期,進而達到干燥、漂白、防腐的目的[1,2]。二氧化硫在食品工業中作為添加劑發揮的護色、防腐、漂白和抗氧化作用,使一些生產商、攤點商販等違規添加二氧化硫[3]。添加劑一旦使用過量,后序的二氧化硫清除技術工作沒有保障,必然導致添加食品中二氧化硫殘留超標。二氧化硫殘留量超標,不僅會破壞食品的品質,人體攝入過量的亞硫酸鹽,不但會影響對鈣的吸收,同時還會破壞B族維生素,長期攝入則會對肝臟造成損害[4]。因為食品基質存在一定的差異性,并且檢測原理也各不相同,故二氧化硫殘留量的檢測需要采用不同的方法。目前,食品中二氧化硫常用的檢測方法有比色法、滴定法(如直接滴定、蒸餾-碘量、蒸餾-堿滴定)和色譜法(如氣相色譜、離子色譜)[5-7],以及其他的檢測方法(如化學發光法、電化學法及傳感器、酶光度分析法、半微量蒸餾—半導體制冷技術[8]、流動注射[9]、毛細管電泳等。目前,國標采用的傳統檢測方法,不僅操作過程耗時較長且中間環節不易控制;而目前在國內外科學研究中使用的比較前沿的分析方法,雖然具有很大的研究價值,但在實際檢測工作推廣使用往往需要較長的時間。
最新版國家標準GB 5009.34-2016將原有的國標中第一法刪除,原第二法蒸餾法改為滴定法。該國標是利用全玻璃蒸餾器進行蒸餾的滴定法,具體操作過程是利用手動開啟蒸餾瓶塞,添加試樣、迅速添加試劑,然后立刻蓋緊瓶塞,操作中不容易控制,中間環節較繁瑣,且耗時較長[10],不適宜用于批量樣品的檢測。本試驗選取杏脯試樣,利用凱氏定氮儀中蒸餾系統對杏脯中二氧化硫的檢測方法改進。
1 方法原理
在密閉容器中對樣品進行酸化、蒸餾,蒸餾物用乙酸鉛溶液吸收。吸收后的溶液用鹽酸酸化,碘標準溶液滴定,根據所消耗的碘標準溶液量計算出樣品中的二氧化硫含量[11]。
2 測定方法2.1 試劑
鹽酸溶液(1+1)、 硫酸溶液(1+9) 、淀粉指示劑(10 g/L)、乙酸鉛溶液(20g/L) ,具體配置方法參見《GB5009.34-2016 食品安全標準 食品中亞硫酸鹽的測定》。
2.2 標準品
2.3 標準溶液
重鉻酸鉀標準溶液[c(1/6K2Cr2O7)=0.1000mol/L]、硫代硫酸鈉標準溶液(0.1mol/L)、碘標準溶液[c(1/2I2)=0.10mol/L]、碘標準溶液[c(1/2 I2)=0.010 mol/L] (置于棕色瓶中,存放在暗處)、二氧化硫標準溶液(10 g/L)。具體配制方法參見《GB5009.34-2016 食品安全標準 食品中亞硫酸鹽的測定》。
2.4 儀器和設備
全玻璃蒸餾器(500mL);凱氏定氮儀(型號:福斯8100);蒸餾管;碘量瓶;酸式滴定管(10mL、25mL);剪切式粉碎機
2.5 測定步驟
2.5.1樣品制備
用四分法分取不同杏脯試樣,然后用剪刀將杏脯剪成小塊,再用剪切式粉碎機將試樣均勻剪碎,備用。
2.5.2蒸餾
準確稱取5.00 g經前期處理好的均勻樣品,置于250mL凱氏定氮蒸餾管中,在管中加入50mL左右蒸餾水對試樣進行浸泡,將凱氏定氮儀蒸餾系統中冷凝管下端,插入預先備有乙酸鉛吸收液(25mL)的碘量瓶的液面下。在經過充分浸泡的試樣蒸餾管中加入預先配置鹽酸(1+1)10 mL,隨后迅速將蒸餾管安裝在凱氏定氮儀上,使其完全密封,關閉安全門,選擇設定好的蒸餾程序,對試樣進行加熱蒸餾。當碘量瓶中乙酸鉛接收液含量約有150 m L時,停止蒸餾。在進行上述實驗操作的同時,進行空白試驗 。
2.5.3滴定
將蒸餾結束的碘量瓶取下,向其中依次加入濃鹽酸10 m L、淀粉指示液(10 g/L) 1 mL,充分搖勻,用碘標準溶液(0.010 mol/L)對接收液進行滴定,溶液變藍色且在30 s內不褪色為滴定終點,記錄滴定終點消耗碘標準滴定溶液體積。
釋意理論誕生于口譯實踐初期,解決的是尚不成熟的口譯實踐首先要面臨的最基礎也是最核心的問題:意義的理解與傳遞。彼時少量的口譯工作,僅需要少數在雙語/多語言環境中生活的譯員即可完成。隨著口譯實踐的豐富,人們對口譯效果的要求日益提高,需要更好地理解與傳遞意義,同時,對口譯量上的需求增加,又要求培養更多專業的口譯譯員,這兩方面需求都最終指向技術層面對語言形式的重視。
2.5.4結果計算
試樣中二氧化硫的含量按下式計算:
X=(V1-V0)×0.032×1000÷m
式中:X—試樣中的二氧化硫總含量,g/kg);
V1—滴定杏脯試樣所消耗碘標準溶液(0.010 mol /L)的體積毫升(m L)數;
V0—滴定試劑空白所消耗碘標準溶液(0.010 mol/L)的體積毫升(mL)數;
c—滴定時所消耗碘標準溶液的濃度,mol/L;m-杏脯試樣質量,g;
0.032~1 mL碘標準溶液[C(1/2I2)=1.0mol/L]相當于二氧化硫的質量,g;
3 結果與分析
3.1 優化確定凱氏定氮儀系統蒸餾接收液含量
采用全玻璃蒸餾器測定過程是首先在玻璃蒸餾瓶中加入200mL左右的水,再將酸加入蒸餾瓶中蓋上蓋進行加熱蒸餾,而運用凱氏定氮儀進行蒸餾,是先加入少量水將試樣浸泡,然后迅速在試樣中加入鹽酸,試樣不被大量的水稀釋,同時在充分浸泡后,反應更徹底、更迅速,結果更加準確、可靠。選擇250mL碘量瓶接收蒸餾液,當碘量瓶中乙酸鉛接收液約100 mL左右時,另取一個裝有10mL乙酸鉛(20 g/ L)的碘量瓶接收,接收液約50 mL時,停止蒸餾,并對這50mL蒸餾吸收液進行滴定,溶液滴定一滴后立刻變藍,證明試樣蒸餾管中已無二氧化硫存在。因此,將兩次蒸餾結束后蒸餾完全的接收液總體積確定為后期實驗蒸餾液接收液體積即150 mL左右,該體積適用于大部分試樣。
3.2 蒸餾時間的確定
稱取5.0g同一杏脯試樣進行測定,將蒸餾時間分別設定為2min、3min、4min、5min、6min、7min ,分別對試樣進行不同時間蒸餾,停止蒸餾后,用碘標準滴定溶液(0.010 mol / L)對不同時間蒸餾后試樣進行滴定,結果如表1所示。
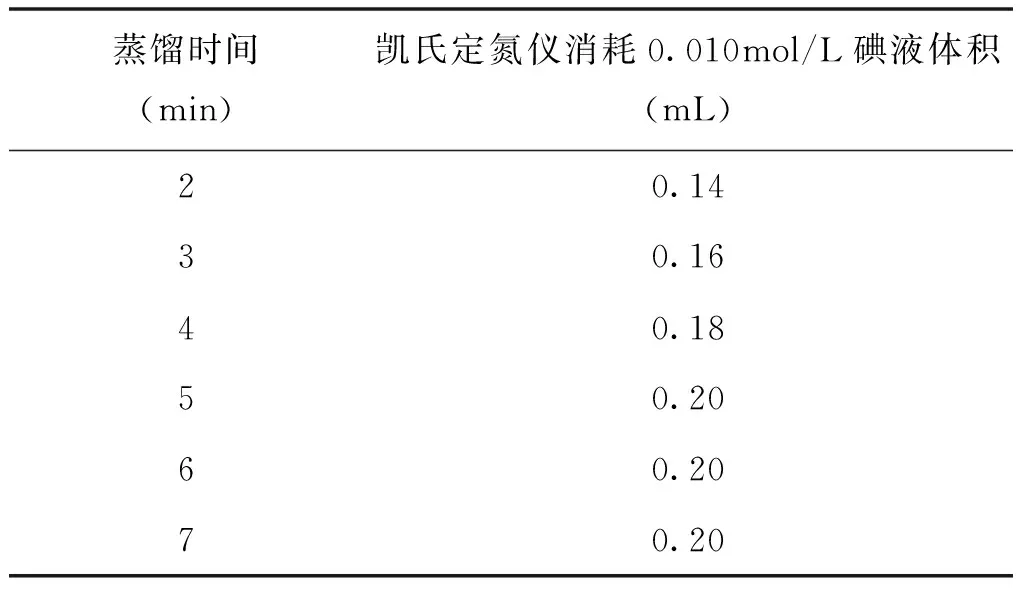
表1 不同蒸餾時間凱氏定氮儀消耗0.010mol/L碘液的體積(未扣除空白)
由表1可以看出,利用凱氏定氮儀對空白試驗進行蒸餾時間的確定,當蒸餾時間確定為2min時,由于蒸餾時間較短,滴定時所消耗碘標準溶液的體積較小,說明蒸餾不完全;當蒸餾時間超過5min,滴定所消耗碘標準溶液的體積保持不變。因此,將蒸餾時間設定在5min較好。
3.3 空白比對試驗
分別進行全玻璃蒸餾器和凱氏定氮儀進行空白比對試驗,各重復5次,同時選用用0.010 mol/ L碘標準滴定溶液對蒸餾后接收液進行滴定。具體實驗結果見表2。
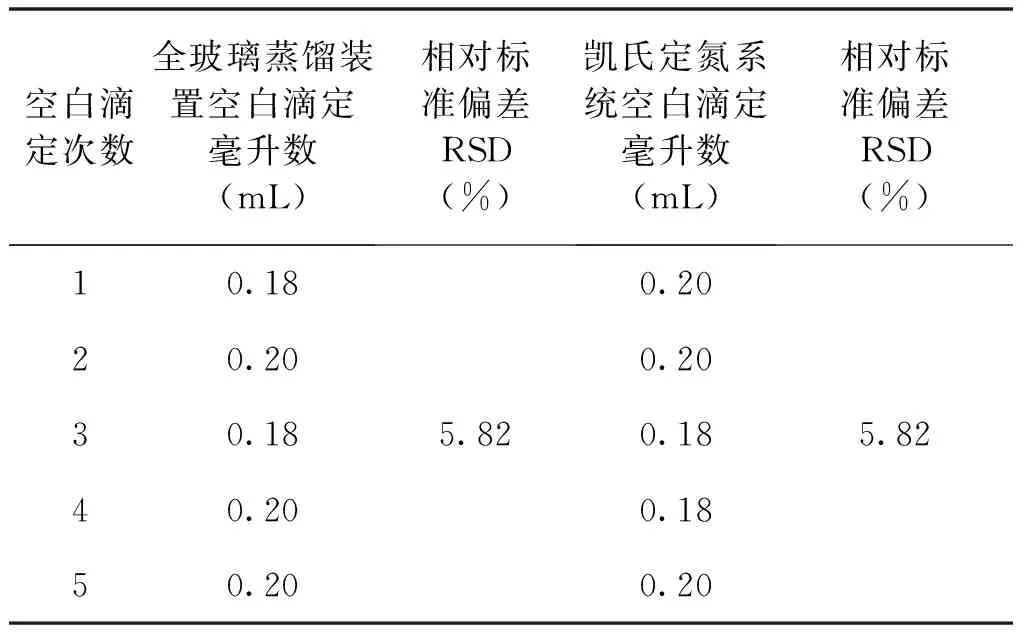
表2 空白試驗比對
從表2看出,5組重復實驗中,凱氏定氮儀的空白滴定體積與全玻璃蒸餾器空白滴定體積無差異,二者相對標準偏差無差異,說明在實驗分析過程中,利用凱氏定氮儀系統進行測定時,參與反應的試劑比較穩定,儀器分析系統對檢測過程沒有干擾,說明采用凱氏定氮儀的蒸餾系統可以對食品中二氧化硫殘留量進行檢測分析。
3.4 稱樣量的確定試驗
對3種試樣分別稱取0.50 g、1.00 g、5.00 g、10.00g的進行試驗,確定不同試樣中二氧化硫殘留量稱樣量的選擇,記錄滴定體積,結果見表3。
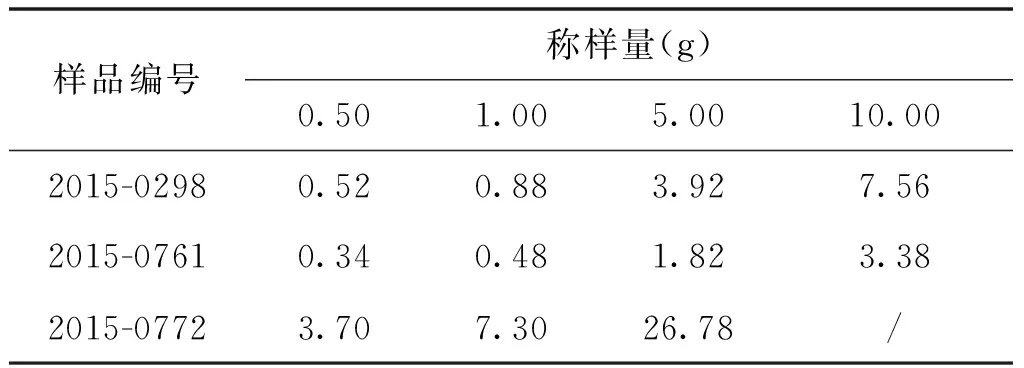
表3 不同稱樣量碘標準滴定溶液(0.010 mol/L)滴定體積(mL)
通過以上杏脯的試驗,分別稱取同一杏脯不同質量(0.5g、1.0g、5.0g、10.0g)進行檢測,試驗結果顯示:當試樣量較少時,消耗的碘標準溶液體積較小,由于取5g固體樣品時,方法的檢出限(LOD)為3.0mg/kg,定量限為10.0mg/kg,蒸餾結果較低,計算結果誤差較大;而當試樣量較大時,試樣會溶解不完全,極易導致蒸餾不完全,無法準確測定試樣中二氧化硫殘留量。因此,對不含二氧化硫添加劑或二氧化硫殘留量較少的杏脯試樣稱樣量確定在5.00~ 10.00 g范圍較適合;二氧化硫殘留量較高的的杏脯試樣稱樣量確定在0.50~ 1.00 g范圍內較適合。
3.5 滴定結果比對試驗
分別用全玻璃蒸餾器和凱氏定氮儀對試樣進行滴定試驗,各3次重復,用碘標準滴定溶液(0.010 mol/ L)進行滴定結果如表4。
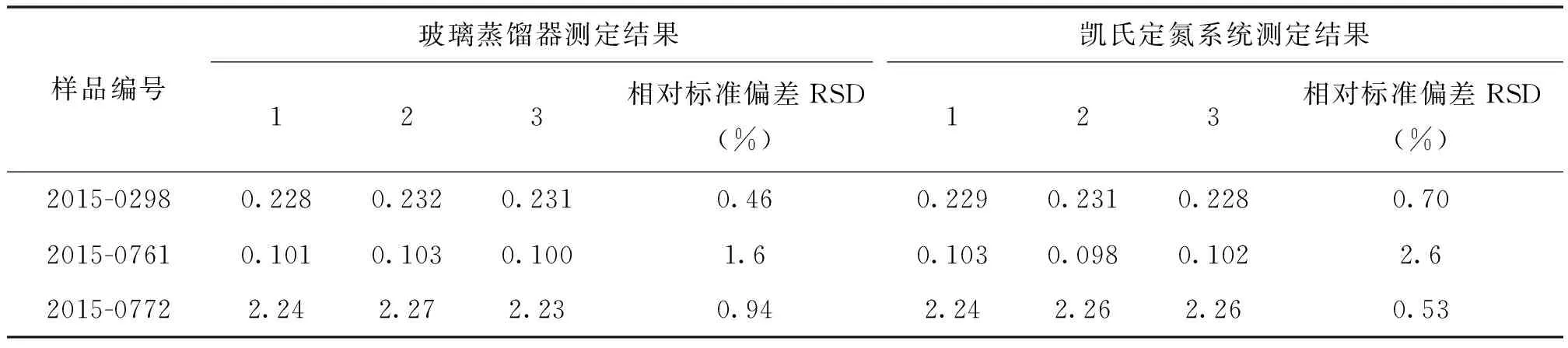
表4 二氧化硫的測定結果 g/kg
由表4可知,兩種測定方法對樣品中二氧化硫殘留量的測定結果無明顯差異,從標準偏差的結果來看,利用凱氏定氮儀測定的偏差結果與全玻璃蒸餾器的差異不大,說明凱氏定氮儀可以對二氧化硫殘留量進行測定,并且準確性、重復性也滿足測定要求。
3.6 凱氏定氮儀測定二氧化硫回收率試驗
稱取3份杏脯試樣2015-0298,,在其中均加入10 mL 10g/ L二氧化硫標準溶液(相當于添加二氧化硫0.100 g),用凱氏定氮儀對添加準確濃度的二氧化硫樣品進行加標回收實驗的蒸餾測定,結果見表5。

表5 加標測定二氧化硫的結果
通過添加濃度0.100 g二氧化硫標準實驗與樣品實驗結果進行回收率的計算,結果顯示,加標回收率是99.5%,符合凱氏定氮儀檢測回收率,證明此方法測定該指標可行。
4 結論
利用凱氏定氮儀對杏脯中的二氧化硫進行蒸餾測定,與傳統全玻璃蒸餾法測定幾乎無差異,而凱氏定氮儀與全玻璃蒸餾器相比,Kjeltec8100凱氏定氮儀是安全的、自動高效的蒸餾設備,蒸餾能力在~40mL/分鐘,重現性為1%的相對誤差,回收率>99.5%;該凱氏定氮系統有一系列以安全為目的的感應器,從試管在位、安全門、試管更換、蒸汽發生器過溫/過壓傳感器,最大程度的保證操作者的安全。該系統對餾出液直接進行溫度控制,可以保證結果準確可靠;冷凝水流量自調節功能可在分析時根據溫度自動調節水的流量,節約分析成本。因此,采用凱氏定氮系統對二氧化硫殘留量進行蒸餾測定,更具有快速便捷、智能化、易操作等優勢,同時可以減少人員操作、試劑添加、器皿等中間環節造成的誤差,結果更迅速、準確,更加適用于批量樣品的檢測。

