芍藥苷對氯化鈷誘導PC12 細胞氧化應激損傷的保護作用
雷 昌 黃 丹 向 韻張秀麗孟 盼鄒蔓姝王宇紅凌成利?
(1.湖南中醫藥大學, 湖南省中藥粉體與創新藥物省部共建國家重點實驗室培育基地, 湖南 長沙410208;2.湖南中醫藥大學科技創新中心, 湖南 長沙410208)
芍藥苷來源于毛莨科種屬,是從白芍和赤芍干燥根提取的主要活性成分,為一種單萜糖苷類化合物,具有抗氧化應激損傷、抗血栓、抗炎、抗高血壓、鎮痛、抗血小板聚集等作用[1?2]。有文獻表明芍藥苷對大鼠缺血性腦卒中引起的細胞氧化應激損傷有顯著療效,可通過Ca2+/CaMKⅡ/CREB 信號通路降低炎癥因子表達[3],同時也有文獻闡述了芍藥苷能降低血液黏度、抗血小板聚集、擴張血管、改善微循環、抗氧化、抗驚厥等多種作用效果[4?5],故芍藥苷在動物體內對不同病理條件誘導的神經細胞損傷有保護作用。溫新麗等[6]揭示了芍藥苷對過氧化氫誘導的SH?SY5Y 細胞氧化應激損傷有顯著保護效果,但具體機制不明。因此,本研究在PC12 細胞存活率基礎上,從活性氧自由基(ROS)、細胞凋亡、MMP 不同機制考察芍藥苷對CoCl2誘導高PC12 細胞氧化損傷的保護作用,為后續進一步研發作鋪墊。
1 材料
1.1 藥物與試劑 芍藥苷(純度≥98%,批號17041401)購自成都普飛德生物科技有限公司。氯化鈷(Cobalt chloride,CoCl2· 6H2O,批 號20180724)、ROS 試劑盒(DCFH?DA,編 號S0033)、細胞凋亡試劑盒(批號100918190307)、線粒體膜電位試劑盒(批號101118190416)均購自上海碧云天生物技術有限公司;二甲基亞砜(DMSO,批號20130417)購自湖南匯虹試劑有限公司;MTT [3?(4,5?二甲基噻唑?2)?2,5?二苯基四氮唑溴鹽,批號1015D0510]購自北京索萊寶科技有限公司;改良高糖細胞培養基(DMEM)和胎牛血清(FBS)均購自四季青生物工程材料有限公司(杭州);其他試劑均購自國藥集團化學試劑有限公司。
1.2 儀器 CO2培養箱(型號3131)、多功能酶標儀(型號3001?1758)均購自美國賽默飛世爾科技有限公司(上海);高內涵成像分析系統(型號operetta)購自美國珀金埃爾默股份有限公司。
2 方法
2.1 PC12 細胞培養 PC12 細胞購自中國科學院細胞庫,采用含10% 胎牛血清(FBS)的DMEM培養基,置于5% CO2、37 ℃培養箱中進行培養。以1 ∶2 或1 ∶3 比例進行細胞傳代,向培養皿中加入0.25% Trypsin?EDTA 1.5 mL,消化約1 min 后在顯微鏡下觀察,發現PC12 細胞回縮、類圓形,開始脫落,立即加入2 mL 培養基終止消化,選擇對數生長期細胞進行實驗。在藥物處理階段,各組(包括正常組)細胞均用不含FBS 的DMEM 培養基培養。
2.2 MTT 檢測
2.2.1 不同濃度CoCl2、芍藥苷對PC12 細胞存活率的影響 將對數生長的PC12 細胞以3×103/孔的濃度接種于96 孔板上,每孔0.1 mL,置于培養箱中培養12 h,待貼壁后分別采用CoCl2(0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0、3.0 mmol/L)和芍藥苷(10、100、200、300、400、500、600、700、800 μg/mL)孵育24 h,每孔加入0.5 mg/mL MTT 20 μL,37 ℃避光孵育4 h 后吸棄上清液,加200 μL DMSO,避光振搖10 min 使其充分溶解,在570 nm 波長處測定光密度(OD),細胞存活率= [(OD藥物組-OD空白組)/(OD正常組-OD空白組)]×100%,平行6 個復孔。
2.2.2 芍藥苷對CoCl2誘導的PC12 細胞存活率的影響 細胞分為正常組(正常PC12 細胞)、模型組(1.2 mmol/L CoCl2誘導PC12 細胞24 h)、芍藥苷組(不同濃度芍藥苷預先處理1 h,再加入1.2 mmol/L CoCl2共孵育24 h),按“2.2.1” 項下方法檢測各組細胞存活率。
2.3 ROS 檢測 根據ROS 試劑盒測定細胞內ROS水平,熒光探針DCFH?DA 按1 ∶1 000 比例用無血清培養基稀釋至終濃度為10 μmol/L。按“2.2.2”項下方法分組接種于96 孔板內,培養24 h 后,將培養液換成已稀釋好的DCFH?DA 探針溶液0.1 mL,37 ℃避光孵育30 min。PBS 洗滌2 次去除未進細胞內的熒光探針,采用高內涵成像分析系統檢測平均熒光強度(激發波長488 nm,發射波長525 nm),各組隨機選取6 個視野,平行3 個復孔。
2.4 細胞凋亡測定 利用Annexin V?FITC/PI 雙染色法凋亡試劑盒檢測PC12 細胞凋亡,按“2.2.2”項下方法分組接種于96 孔板內,以凋亡試劑盒操作步驟進行實驗,采用高內涵成像分析系統在488、525 nm 波長下檢測平均熒光強度。各組隨機選取6 個視野,計數細胞總數和凋亡細胞數,平行3 個復孔,計算凋亡率[(同一視野下凋亡細胞數/同一視野下總細胞數)×100%]。
2.5 MMP 測定 取對數生長期PC12 細胞,按“2.2.2” 項下方法分組,按MMP 試劑盒說明書進行操作。高內涵成像系統檢測細胞平均熒光強度(激發波長490 nm,發射波長530 nm),各組隨機選取6 個視野,平行3 個復孔。
2.6 統計學分析 通過Graphpad Prsim 軟件進行處理,數據以()表示,2 組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差。以P<0.05 為差異具有統計學意義。
3 結果
3.1 不同濃度CoCl2對PC12 細胞存活率的影響0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.5、2.0、3.0 mmol/L CoCl2對應細胞存活率分別為(92.9±5.7)%、(87.9±2.3)%、(82.1±4.5)%、(73.5±2.3)%、(66.3±4.8)%、(52.1±4.5)%、(47.3±5.0)%、(43.0±3.9)%、(40.1±4.6)%、(24.2±5.6)%。圖1A 表明,與正常組(100%±3.2)%相比,CoCl2(0.6~3.0 mmol/L)可降低PC12 細胞存活率,減少細胞活性,其濃度為1.2 mmol/L 時,細胞存活率接近50%(P<0.05),即為半數抑制濃度(IC50)。因此,采用1.2 mmol/L CoCl2誘導PC12 細胞24 h,作為PC12 細胞氧化應激損傷的最佳條件。

圖1 芍藥苷對CoCl2 誘導PC12 細胞存活率的影響Fig.1 Effect of paeoniflorin on the survival rate of CoCl2?induced PC12 cells
3.2 不同濃度芍藥苷對PC12 細胞存活率的影響由圖1B 可 知,10、100、200、300、400、500、600、700、800 μg/mL 芍藥苷處理PC12 細胞24 h,細胞存活率分別為(100.3±2.3)%、(99.7±3.6)%、(99.1±3.4)%、(97.9±2.8)%、(89.3±2.4)%、(83.5±3.5)%、(74.2±2.3)%、(59.6±2.6)%、(52.0±3.0)%,其濃度在600 μg/mL 以上時對PC12 細胞有強烈毒副作用,在400、500 μg/mL時可降低細胞存活率(P<0.05),有輕微毒性,故芍藥苷毒性濃度應在400 μg/mL 以下。
3.3 不同濃度芍藥苷對CoCl2誘導PC12 細胞存活率的影響 如圖1C 所示,與模型組比較,100、200、300 μg/mL 芍藥苷對CoCl2誘導的PC12 細胞存活率分別為(54.9±3.1)%、(63.0±2.7)%、(59.1±2.3)%,其濃度在10~500 μg/mL 范圍內未呈濃度依賴性,而在200 μg/mL 時可增加CoCl2誘導的PC12 細胞存活率(P<0.05)。由此表明,200 μg/mL芍藥苷對CoCl2誘導PC12 細胞所引起的氧化應激損傷有顯著保護作用。
3.4 芍藥苷對CoCl2誘導PC12 細胞內ROS 的影響 如圖2 所示,與正常組(11.0±2.0)比較,模型組PC12 細胞內平均熒光值增加(52.0±2.1,P<0.05),表明細胞內ROS 增加;與模型組比較,200 μg/mL 芍藥苷組PC12 細胞內平均熒光值降低(25.4±2.5,P<0.05),表明芍藥苷可明顯抑制CoCl2誘導PC12 細胞內ROS 的生成。
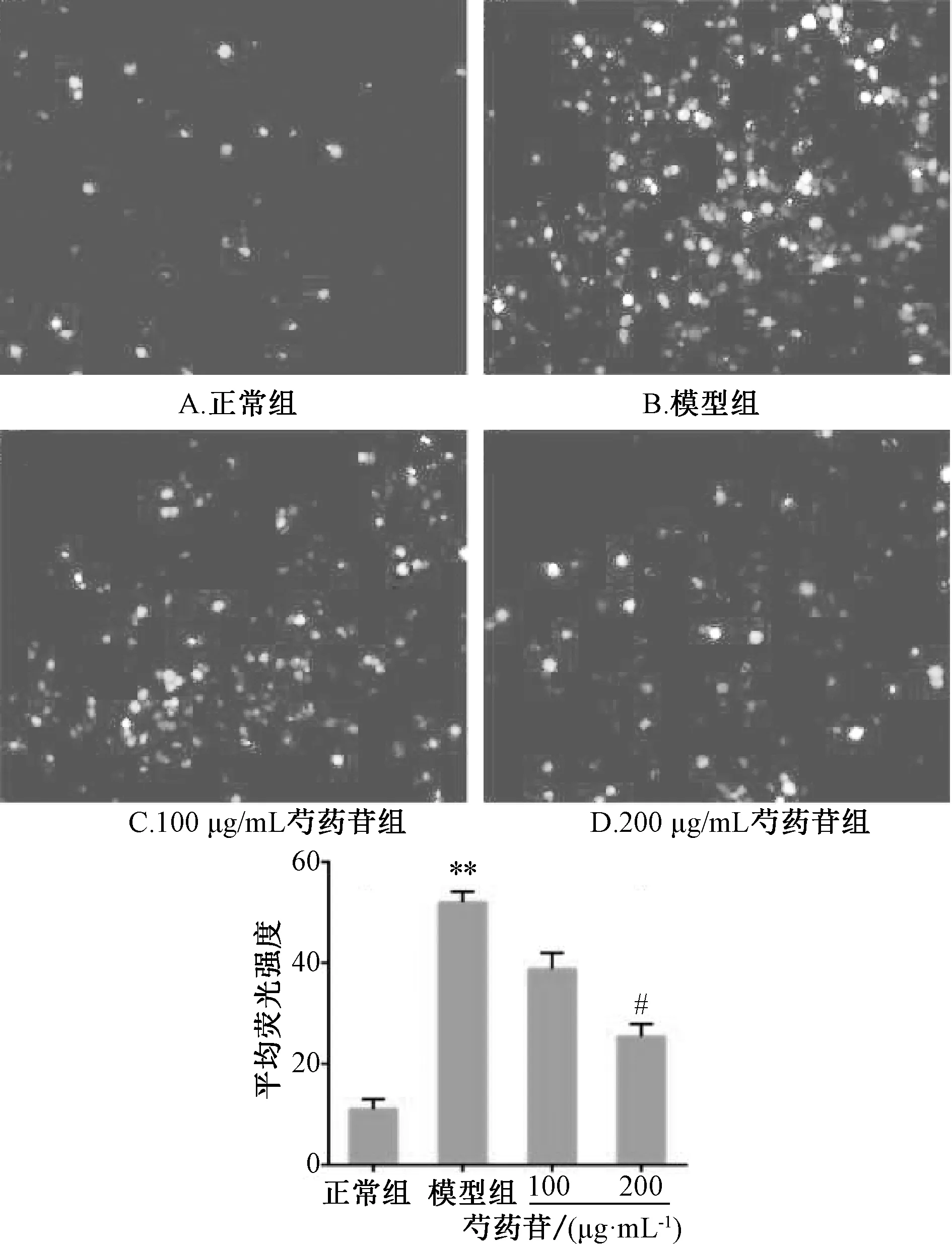
圖2 芍藥苷對CoCl2 誘導PC12 細胞生成ROS 的影響Fig.2 Effect of paeoniflorin on the ROS production of CoCl2?induced PC12 cells
3.5 芍藥苷對CoCl2誘導PC12 細胞凋亡的影響 如圖3 所示,正常組PC12 細胞早期和晚期凋亡分布有低強度綠色和紅色熒光(綠色熒光代表凋亡早期,紅色代表凋亡晚期和死亡細胞);經CoCl2誘導后,模型組出現高強度綠色和紅色熒光,且胞核變小,濃縮,呈細胞凋亡的形態特征;加入芍藥苷預處理后,綠色、紅色熒光強度降低,細胞核逐漸恢復正常形態。與正常組[活細胞比例(93.2±2.6)%,凋亡細胞比例(6.8±1.7)%]比較,模型組活細胞比例[(20.3±3.0)%]降低,細胞凋亡比例[(79.7±2.8)%]增加(P<0.05),其中200 μg/mL 芍藥苷組活細胞比例為(57.4±2.4)%,細胞凋亡比例為(42.6±3.3)%,與模型組比較差異具有統計學意義(P<0.05)。
3.6 芍藥苷對CoCl2所誘導PC12 細胞MMP 的影響 如圖4 所示,與正常組比較(平均熒光值為237.6±10.3),模型組PC12 細胞綠色平均熒光值為39.8±11.2,熒光強度降低(P<0.05),即線粒體膜電位下降。200 μg/mL 芍藥苷組PC12 細胞綠色平均熒光值為221.7±9.5,熒光強度升高(P<0.01),說明芍藥苷能提升MMP,保護PC12 細胞免受CoCl2誘導所致的損傷。
4 討論
腦缺血病理機制主要包括能量代謝障礙與梗死灶周圍缺氧去極化、興奮性氨基酸(EAA)毒性、氧化應激損傷、炎癥反應等[7],其中氧化應激損傷是其主要機制之一。氧化應激損傷(oxidative stress)是指有機體在遭受各種有害刺激或誘導時,細胞內產生的ROS 超過自身清除的ROS,導致ROS 細胞內蓄積及細胞凋亡與MMP 變化,細胞引發毒性損傷的過程[8]。目前大量研究認為,ROS、細胞凋亡及MMP 變化是氧化應激損傷的主要指標。
CoCl2是一種化學性氧化應激誘導模擬劑,可引起神經細胞氧化應激損傷和凋亡,其機制是鈷通過細胞內離子置換使亞鐵螯合酶失活,從而抑制細胞對氧的利用,最終達到常氧下誘導細胞缺氧導致氧化應激的效果[9],由于使用方便、理化性質穩定而成為誘導神經細胞氧化應激損傷的首選藥物,但在體外細胞上研究較少。課題組首次采用CoCl2誘導PC12 細胞模型模擬神經細胞氧化應激損傷而出現的腦缺血病理狀態,具有效果理想、可重復性好及操作簡便的優勢。

圖3 芍藥苷對CoCl2 誘導PC12 細胞凋亡的影響Fig.3 Effect of paeoniflorin on the apoptosis of CoCl2?induced PC12 cells
近年來,芍藥苷在細胞損傷方面的作用受到越來越多的關注。芍藥苷在白芍單萜類成分中含有量最高,也是最有效成分[10],具有抗神經細胞氧化、抗自由基損傷、抑制細胞內鈣超載,抗細胞凋亡、促進神經生長等作用[11]。有文獻研究發現,芍藥苷通過NO(硝普鈉)誘導PC12 細胞可直接發揮抗細胞凋亡作用[12]。理論上,芍藥苷具有抗細胞氧化應激損傷作用,本實驗結果表明,在CoCl2誘導PC12 細胞損傷模型中,100、200 μg/mL 芍藥苷可清除細胞內ROS 產生、減少細胞凋亡和提高MMP,但 200 μg/mL 的細胞 保護作 用大于100 μg/mL,其原因可能是促線粒體凋亡蛋白的表達程度不同。Wang 等[13]研究發現,神經細胞損傷與凋亡蛋白的表達有關,凋亡相關基因表達促進p38 MAPK 磷酸化程度,加劇細胞凋亡損傷。除了線粒體凋亡通路之外,核因子轉錄蛋白(NF?κB)信號通路和促分裂素原活化蛋白激酶(MAPK)信號通路也在腦缺血神經細胞損傷中發揮著重要的作用[14?15],是否參與了芍藥苷的神經保護機制有待于今后進一步的研究。

